Method Article
Drosophila의 배아들 중에서 - 생체내의 원심 분리
요약
우리 삶의 밀도에 의해 별도의 organelles하는 방법을 설명 Drosophila 배아. 배아는 한천에 포함된하고 centrifuged 있습니다. 이 기법은 앞쪽에 - 후부 배아 축을 따라 주요 organelles의 재현성 분리 산출. 이 방법은 생화 학적 분석 및 이식 실험에 대한 colocalization 실험 및 수율 organelle의 분수를 용이하게합니다.
초록
세포 organelles의 다른 유형의 정화 및 분리를위한 주요 전략은 낙관적인 밀도의 차이에 따라 서로에서 분리하는 것입니다. 그러나, 세포가 이전 원심 분리, 단백질이 아닌 모국어 환경에서 organelles을 방해하는 경우 종종 부적절하게 서로 붙어. 여기 우리는 그대로, 살아있는 Drosophila의 배아에서 밀도에 의해 별도의 organelles하는 방법을 설명합니다. cellularization 전에 초기 배아는 인구 케이지에서 수확하고, 자신의 외부 달걀 껍질은 50 % 표백제와 함께 치료에 의해 제거됩니다. 배아는 다음 한천의 작은 수직 구멍에 먼저 작은 한천 플레이트 및 삽입, 사후 최종으로 전송됩니다. 임베디드 배아가 포함된 플레이트는 3,000그램 30 분 centrifuged 있습니다. 한천은 배아를 지원하며 정의된 방향에서 그들을 유지합니다. 후에, 배아는 뭉툭한 바늘로 한천 밖으로 파고있다.
원심 분리는 밝은 - 필드 현미경으로 충화 쉽게 볼, 층이으로 주요 organelles를 분리합니다. 형광 마커의 숫자는 살아있는 배아의 성공 충화을 확인하실 수 있습니다. 특정 organelles와 연관된 단백질이 colocalization을 보여주는 특정 계층에 풍부한 것입니다. 개별 레이어는 기증자의 난자에 생화 학적 분석 또는 이식을위한 복구할 수 있습니다. 이 기술은 다양한 종류의 계란과 oocytes 등 다른 대형 세포에 organelle 분리에 대해 적용됩니다.
프로토콜
1) 한천 플레이트 준비
개요 :이 프로토콜은 두 개의 뚜렷한 용도에 한천 플레이트를 채용. 첫째, 한천 플레이트는 달걀 수집 표면 역할을하며, 한천에서 사과 주스는 달걀 누워을 자극. 접시가 centrifuged 때 둘째, 한천에 포함된 배아는 고정된 방향에서 개최되며 한천의 충분히 높은 농도는 원심 분리하는 동안 험악에서 접시를 방지하기 위해 필요합니다. 단순화하기 위해, 사과 주스 한천의 단일 유형은 두 용도로 고용됩니다.
자료
- 한천 (25g)
- 자당 (25g)
- 사과 주스 (250 ML)
- Nipagin M 재고 솔루션 (50 ML 에탄올에 5g 메틸 - P - 히드록시 벤조 산), 방부제 역할을
- 배양 접시 : 원심 분리 (60x15mm)과 계란 컬렉션 (60x15 mm 또는 100x15 mm, 2 단계에서 사용되는 파리 연습장에 따라 다름)에 대한
장비
- 핫 플레이트
- 두 Erlenmeyer flasks의
- Erlenmeyer 플라스크에 25g의 한천과 750 ML DH 2 O.을 결합 액체 사이클 50 분 압력솥. 그 동안, 사과 주스 솔루션 (단계 1.2) 준비합니다.
- 다른 Erlenmeyer 플라스크에 25g의 자당와 사과 주스 250 ML을 결합. 자당을 용해하기 위해 뜨거운 접시에 열 (55 ° C에 대해). 다음 15 ML Nipagin M 솔루션을 추가합니다. 그들이 Nipagin가 무너뜨리는 원인이되므로,보다 높은 온도를 피하십시오.
- 한천 솔루션 술병이 손으로 처리할 수 있습니다 충분히 냉각되면, 두 솔루션을 결합하고 철저히 섞는다. 균등하게 혼합하기 전까지 뜨거운 접시에 저어.
- 배양 접시 (~ 0.5 cm 높이)에 솔루션을 하거라. 솔루션 1 리터에 대한 작은 100 (60mm 직경) 40 대형 (100mm 직경) 요리 충분하다.
- 한천 플레이트는 실온에서 몇 시간이나 야간을위한 건조해야합니다, 그렇지 않으면 그들은 사용하기 위해 너무 무리 것입니다. 장기 저장을 위해, 4 (플라스틱 용기 또는 페트리 접시 슬리브에서) 그들이 포장 유지 ° C.
2) 수확 배아
개요 : 개발의 첫 3시간 동안은 (상온에서), Drosophila의 배아는 하나의 세포 (세균 라인 엽 성의 전구 물질, 뒤로있는 장대의 세포를 계산하지 않음)입니다. 이 단계의 배아가 제대로 중심 centrifuged 때, 계란의 긴 축을 따라 밀도에 의해 별도의 주요 organelles. cellularization 단계에서,이 큰 하나의 세포는 작은 수천개의 세포로 변환되며 고용 원심 분리 세력은 파열이 세포되지 않습니다. 주요 organelles의 성공적인 분리 들어, 아직 cellularization을 완료하지 않은 배아를 원심 분리기에 따라서 중요합니다.
자료
- 애플 쥬스 한천 플레이트
- 효모 붙여넣기 (건조 효모는 땅콩 버터 일관성에 물을 혼합)
장비
- 상용 (아래 참조) 또는 1 집에서 만든 : 새장을 플라이
- 성인 파리는 맨 아래에있는 사과 주스 한천 플레이트를 붙인 아르에 새장에 보관됩니다. 사용 새장에 적합한 배양 접시의 크기를 사용합니다.
- 달걀 컬렉션을 시작하려면, 신선한 사과 주스 한천 플레이트를 준비하고 효모 붙여있는 부분을 커버. 과일 파리는 누룩을 먹고, 특히, 효모가 계란 생산을위한 영양을 제공합니다. 한천의 효모와 사과 주스의 존재는 또한 달걀 누워을 유도.
- 새로운 한천 플레이트와 함께 기존의 교환을 원하시면, 즉시 케이지는 반전과 벤치 위에 몇 번 했지입니다. 파리는 아래로 떨어질 것이다 간략하게 혼동하고 있습니다. 그 신속 한 한천 플레이트를 제거하고 신선한 하나를 대체하는 당신에게 몇 초를 제공합니다. 교환은 어떤 연습이 필요하고, 세부 사항은 고용 케이지의 종류에 따라 달라집니다.
- 여자는 정자가 난자의 수정을 허용하기 위해 배포되는 내부 파우치에서 이전 matings (spermathecae)에서 저장 정자를 날아. 잘 품고 그대로하면, 암컷은 곧 수정 후 달걀을하다, 따라서 누워 계란의 시간 수정 및 개발의 시작 시간을 표시합니다. 조건이 최적화되어 있지 않습니다 때, 암컷은 누워 전에 변수 번 수정된 달걀을 개최. 같은 잘못 개최 배아의 수를 최소화하기 위해, 그것은 근무의 첫 번째 컬렉션 (30-60 분의 "사전 모음"충분합니다)를 삭제하는 것이 좋습니다. 신선한 효모의 존재이 개최 알을 낳기 위해 암컷을 유도하고, 후속 달걀 컬렉션 계란에 의해 지배되는 경향이 수정 직후에 입금.
- 배아 단계가 원하는 어떤 상황에 따라 최대 3 시간 동안 달걀을 수집합니다. 실내 온도 cellularization에서 ~ 3.5 시간 후 완료되기 때문에, 더 이상 수집 시간은 유용하지 않습니다. 대부분의 일관성을 겹겹이 너무 일상적인 실험을 위해 우리가 (1 시간을 단축 수집 시간을 찬성, 젊은 배아에서 얻을 수 있습니다이하).
- 가끔 파리가 누룩이나 한천 판의 표면에 달라 붙 는게 좀 그렇지. 핀셋으로 그들을 제거합니다.
3) 배아에서 알 껍질을 제거
개요 : predominately 왁스 만든 단백질과 내부 레이어로 만들어진 외부 계층 (chorion) (vitelline 막) : Drosophila의 배아 두 보호 레이어로 덮여 있습니다. 그들은 기계 모욕과 탈수에 대한 배아를 보호합니다. chorion는 독특한 구조로 쉽게 볼 수있는 두 확장 (계란 또는 필라멘트 등의 부속) 있습니다. 이 단계에서, 우리는 50 % 표백제에 계란을 몸으로하여 chorion을 제거합니다. chorion이 제거되면 배 (胚)는 원심 분리에 대한 특정 배아 단계의 선택을 허용, 전송 빛이 투명하게됩니다. chorion도 많은 후 원심 분리 절차 (예, 6 단계에서 고정)에 영향을 하듯이, chorion의 제거는 이제 신속하게 처리하기 수 있습니다.
50 % 표백 치료는 몇 분 이내에 chorion를 해산 것이며, 아직 그것은 배아를 손상하지 않습니다. vitelline 막 그 표백제 출력을 유지합니다. 계란 필라멘트가 더 이상 표시되지 않습니다 때까지 우리는 표백제 치료를 계속합니다. 이후, 우리는 작은 체 (와이어 메쉬로 만든 바구니)를 통해 배아 / 표백제 슬러리를 따르고하여 표백제에서 배아를 분리합니다. 이것은 표백제 노출 단계를 서두르지 않는 것이 중요합니다. 표백제가 성급하게 나중에 같이 씻어 경우 (예 : vitelline 막 다음 고정의 제거) 위험 수 있습니다.
자료 :
- 50 % 표백제와 함께 물총 병 (한 볼륨 상업용 표백제에 하나의 볼륨 DH 2 O)
- DH 2 O와 함께 분출 병
- 종이 타월
장비 :
- 홈메이드 와이어 바구니는 스테인레스 스틸 와이어 메쉬의 시트 밖으로했다. 바구니를 만들기 위해선, 플랫 시트 밖으로 ~ 2 X 2cm의 정사각형을 잘라 중간에 그들을 들여쓰기.
- 핀셋은 와이어 바구니를 잡아
- 해부 현미경 transillumination에 대한 설정
- 해부 현미경 한천 플레이트를 삽입하고 transillumination하여 배아를 관찰합니다. (그림 2A 참조) 계란 필라멘트를 식별할 수 있는지 확인하십시오.
- 한천 플레이트에 물총 50 % 표백제, 배아를 덮고. 표백제의 주위에 소용돌이 배아를 종종 한천 플레이트를 선동.
- 계란 섬유가 (일반적으로 3-5 분 후,하지만 시간이 다를 수 있습니다) 더 이상 볼 수 없습니다되면, chorion가 성공적으로 제거되었습니다.
- 다음 단계에서, 철망 바구니는 표백제에서 배아를 분리 체로 사용됩니다. 족집게로 와이어 바구니를 들고 한천 판의 거꾸로 커버를 통해 그것을 잡아. 표지는 와이어 메쉬를 통해 떨어지는 표백제를 잡는 저수지 역할을합니다.
- 와이어 메쉬를 통해 한천 플레이트에서 표백제 / 배아 슬러리 하거라.
- 배아의 상당수는 접시에 한천 플레이트, 애송이 DH 2 O에 남아와 와이어 메쉬를 통해 DH 2 O / 배아 슬러리를 부어있는 경우. 배아의 상당수는 저수지에 넘치다 경우, 와이어 메쉬를 통해 저수지의 내용을 부어.
- 초과 액체를 멀리 얼룩하기 위해 종이 타월에 와이어 메쉬의 하단을 터치. 다음 물총 DH 2 O는 철망에 남아있는 표백제를 씻어 수 있습니다. 위에서 설명한 바와 같이, 커버 플레이트가 실수로 씻어 어떤 배아를 복구하는 저수지로 사용할 수 있습니다. 당신은 철사 바구니의 경계를 따라 분출 병에서 물의 흐름을 가리키고하여 배아 손실 최소화할 수 있습니다. 자주 초과 액체를 얼룩.
- 모든 표백제가 제거된 때까지이 단계를 세탁 할 5-10 회 반복합니다. 철사 바구니 여전히 표백제의 냄새가있는 경우, 세탁 계속해야합니다.
한천 4) 장착 배아
개요 : Drosophila 달걀 더 이상 (~ 500 μm의) 폭 (~ 180 μm의)보다됩니다. 원심 분리하는 동안 organelles의 최대한의 일관성 분리를 얻으려면, 우리는 오리엔트 배아 같은 그 회전의 중심을 향해 자신의 앞쪽에 끝나는 지점 (그림 1, 3). 매우 조밀한 구조 (노른자 구성 요소)는 사후 끝 근처에 축적하면서 그 방법은 가벼운 세포 구조 (지질 방울)은 모든 태아의 앞쪽에 끝에 축적. 배아는 앞쪽에 종료가 붙어서, 사과 주스 한천의 작은 수직 구멍에 삽입됩니다. 한천은 원심 분리하는 동안 정해진 방향으로 배아를 유지합니다.
장비 :
- 니들 홀더
- 텅스텐 바늘, 바늘은 전형적인 방향에서 뒤로 홀더에 장착되고, 날이 끝이 밖으로 스틱과 배아를 조작 가능합니다 그래서
- P200 pipettor
- 해부 현미경 transilluminatio에 대한 설정N
- 플라이 브러시 (작은 페인트 브러쉬가 성인 Drosophila을 정렬하는 데 사용)
자료 :
- 트리톤 소금 솔루션 (TSS) : 4g NaCl, 0.3 ML 트리톤 X - 100 (10X 주식 솔루션으로 만들 수 있습니다) 1000 ML에 ddH 2 O로 기입
- TSS와 빈 페트리 접시에 철사 바구니의 배아를 씻으십시오. 태아가 아래로 침몰한다. 해부 범위에 TSS에있는 태아가 들어있는 페트리 접시를 전송하고 (배아는 그림 4에 묘사된 것과 유사합니다) transillumination하여 관찰합니다.
- P200 pipettor를 사용하면, 원하는 단계의 배아를 선택하고 작은 한천 플레이트에게 전송할 수 있습니다. 특정 단계를 쉽게 (; 더 자세히 들어, 1 참조 그림 4) 시각적으로 인식된다. 배아는 노화되고 TSS에서 (30 분 이상) 잠수 장기 개발에 영향을 미칠 수 있으므로 신속하게 작동합니다.
- 피펫과 Kimwipe 대부분의 TSS를 제거합니다. 한천의 표면은 쉽게 주위 배아를 밀어하게하는 약간 촉촉한해야합니다. 그러나 태아가 구멍 밖으로 슬라이드시킬 수 원심 분리하는 동안 초과 액체부터 접시 어디 남아있는 액체의 웅덩이가 없을 것입니다.
- 바늘을 사용하여 배아가있는 어디 근처에있는 한천에 수직 구멍을 찌르지. 그것은 당신이 동시에 현미경으로 볼 수 있도록 각도로 바늘을 잡고 있기 때문에 완벽하게 수직 아르 구멍을 찌를 어렵습니다. 배가 쉽게 따라하고 구멍에 슬라이드 수 있도록이 구멍 한쪽에 약간의 우울증 / 과수원을 생성하기 때문에 바늘의 사소한 경사 실제로 유리한 것입니다. 한천 한번 배아 부분적으로 그것이 손상없이 더욱에 강요 수있는 구멍에 삽입 충분히 부드러운 있기 때문에 그것은 찔린 한천의 표면에 충분합니다.
- 배아가 최대 앞쪽에 끝이 일반적으로 일관된 방향으로 구멍에 밀려해야대로, 태아의 앞쪽에 및 사후 종료를 인식했는지 확인하십시오. 앞쪽에 끝에 vitelline 막가 전문 구조가 특징이며, 정자가 수정하는 동안 입력되는 통해 micropyle (그림 2).
- 바늘의 뭉툭한 끝 사용하여 한천을 따라 그것을 이동하고 동양에 / 구멍 구멍을 향해 그 후부 엔드를 기동하기 위해 배아에 대해 밀어하실 수 있습니다. 다음 구멍으로 앞쪽에 끝에 대해 밀어. 이것은 쉽게 펑쳐링 동안 발생하는 약간의 우울증을 따라 구멍에 배아를 활강한다. 배아가 젖힌 때, 구멍 깊이 아래로 밀어.
- 완전히에서 밀고 때, 배아는 이미 일반적으로 매우 수직이다. 그렇지 않다면, 당신은 sidewise 그것에 밀고하여 더 많은 수직으로 삽입된 배아를 정렬할 수 있습니다. 구멍이 너무 큰되지 않으면 배아 위치는 안정 원심 분리를 통해 한천에서 개최됩니다.
- 연습, 그것은 접시마다 100-250 배아를 포함할 수 있습니다. 그것은 얼마나 많은가 필요한 특정 응용 프로그램에 따라 달라집니다 : 배아가 라이브 영상이나 이식 실험을위한 기증자로 사용하는 경우에만 몇 가지가 필요합니다. 배아는 고정하고 immunostained 수있다면, 소수가 후 원심 분리 처리하는 동안 손실, 그리고 하나는 높은 숫자로 시작한다됩니다. 배아는 좁은 개발 단계가 원하는 경우, 설치 요구 사항에 대한 전체 시간이 짧은 보관 너무 장착하는 동안 지속적으로 개발 점에 유의하십시오.
- 내장되지 않은 모든 배아의 나머지가있는 경우, moistened 플라이 브러시와 플레이트에서 제거합니다. 액체로 날아 브러시 (예 : 1xTSS) 수영, 신중하게 모든 남은 배아를 청소하기 위해 (해부 현미경으로 보면서) 접시 상단에 걸쳐 닦아, 다시 액체로 브러쉬 디핑하여 브러시의 배아를 씻으십시오.
5) 원심 분리 및 배아의 회복
개요 : 접시는 Sorvall RT7 플러스 원심 분리기의 스윙 양동이로 전송하고 ~ 3,000 G.에 해당하는 4,000 RPM에서 30 분 centrifuged 아르 원심 분리 후, 접시는 TSS 덮여있다. 바늘로, 배아는 한천에 구멍 파고 있으며 pipettor를 통해 해당 선박에 양도되었습니다.
장비 :
- 바늘로 니들 홀더 (이전과)
- Sorvall 플러스 RTH750 로터와 스윙 양동이와 RT7, 또는 동급 2
- 해부 현미경 transillumination에 대한 설정
- P200 pipettor
자료 :
- TSS
- 아래 원심 분리기, 한천 사이드의 스윙 양동이에 번호판을 전송합니다. 원심 분리기가 고르게 균형 있는지 확인하십시오.
- 원심 분리에 대한 설정 : 온도 = 40-10 ° C, RPM = 4000 시간 = 30 분.
- 다시 해부 현미경으로 원심 분리, 장소 한천 플레이트 후 TSS의 레이어로 접시를 커버.
- B를 사용하여바늘의 룬트 결국은 그들 구멍의 배아를 파다. 그들은 TSS의 부동되지만 잠수를 유지합니다.
- 배아는 앞쪽에 끝에 갈색 모자, 분명 중간 지역, 그리고 사후 끝에 어두운 회색 영역 (그림 2, 5A)로, 분명히 레이어가 나타납니다. 독특한 겹겹이 표시하지 배아를 폐기하십시오.
- P200 pipettor을 사용하여, 새로운 선박에 TSS에 잘 계층 배아를 전송, 응용 프로그램에 따라, 섬광의 약병 또는 microcentrifuge 관 예를 들어.
6) 또한 처리
응용 프로그램에 따라 배아는 이후 다양한 방법으로 취급됩니다.
- 밝은 - 필드 또는 epifluorescence 현미경으로 직접 관찰하기 위해, 배아는 유리 슬라이드에 버퍼에 전송되며, # 1 coverslips 스페이서로 18x18 mm와 22x22 mm # 1.5 coverslip에 따라 장착. 장기 관찰 들어, 할로 카본 오일 27로 버퍼를 교체해야 할 수도 있습니다.
- 배아는 수정해야하는 경우, 그들은 섬광 약병 단계 5.6에서 전송해야합니다. 그들은 다음 표준 고정 기술 1을 사용 해결할 수 있습니다. 이러한 기술은 일반적으로 vitelline 막을 제거하는 헵탄 - 메탄올의 감광 유제에 교반을 사용합니다. centrifuged 배아이 devitellinization 단계의 효율이 낮은합니다. 그것은 실용적인만큼 많은 배아로 시작하거나 수동으로 1 vitelline 막을 제거하는 것이 좋습니다.
- 배아가 이식 실험 (예를 들어, centrifuged 배아에서 특정 organelle 층을 제거하는)에서 사용되는 경우, 그들은 한천 플레이트로 전송되며 uncentrifuged 배아 3 표준 절차를 사용하여 coverslips에 장착. 원심 분리에 의해 유도된 겹겹이 분 수만 안정됩니다.
7) 대표 결과
원심 분리가 예상대로 일했다면, 주요 배아 organelles는 밀도가이에 의해 정렬됩니다. 예를 들어, 낮은 밀도 지질 방울은 앞쪽에 끝에 축적 것이다; 고밀도 노른자의 vesicles는 뒷부분 끝 (그림 1, 2)에 축적됩니다. 지질 방울과 노른자의 vesicles는 lipids과 단백질을위한 스토리지 organelles입니다.
밀도에 의존 충화의 확인은 해부 또는 복합 현미경 transillumination에 의해 살아있는 배아의 육안 검사를 통해 이루어진다. 배아는 그림 5A에서와 같이 나타납니다 : 지질 방울은 매우 앞쪽에 팁 ( "지질 모자")에서 단단한 갈색 레이어를 형성, 난황의 축적은 사후 끝에 어두운 회색 지대가 발생합니다. 이 두 어두운 레이어는 다른 organelles과 세포질을 나타내는 광범위한 명확한 영역으로 구분됩니다. 배아가 cellularization 후 centrifuged 경우 겹겹이은 (그림 5C)을 최소화합니다.
epifluorescence 현미경을 사용할 경우, 이러한 생활 centrifuged 배아는 자외선 여기 하에서 검사를하실 수 있습니다. 이러한 조건에서 노른자는 강렬한 블루 autofluorescence (그림 5B)를 표시합니다. 뒷부분 극에서 autofluorescent 재료의 소형 계층이 성공적으로 원심 분리를 표시하고 사후 엔드 마커 역할을합니다.
배아가 수정하는 경우 이러한 레이어의 모양이 크게 변경됩니다. 예를 들어, 배아가 표준 열 또는 포름 알데히드 고정하여 고정하는 경우 헵탄 - 메탄올의 devitellinization 1 다음, 지질 방울이 반투명이되고 지질 층은 다소 어두운 갈색 (그림 5D)보다 밝은 - 가벼운 현미경에 의해 약간 흰 솜털처럼 나타납니다. 난황 autofluorescence는 부분적으로 또는 완전히 훨씬 덜 강렬한 또는 감지되고, 고정에 의해 파괴됩니다.
인 - 생체내의 원심 분리 한 특정 organelle을 강조하기 위해 고용하는 경우, 그것은 라벨에 도움이되었는지 확인을위한 형광 마커로 organelle. 예를 들어, mitochondria를 타겟으로 YFP의 융합 단백질은 응급실이나 잠돌군 Zz 4 설명하고 있습니다. centrifuged 배아에서 이러한 표식은 앞쪽에 후부 축 (그림 1)를 따라 독특한 위치에 축적. 마지막으로, 특정 히스톤 융합 단백질은 지질 방울과 핵 2 모두 집중하고, 따라서 (레이블 핵의 숫자로) 배아의 무대를 모니터하려면 다음과 세포 구획 (그림 5 E, F)뿐만 아니라 표시하는 데 사용할 수 있습니다 . 이 단락에 언급된 마커를 표현 플라이 계통 블루밍턴 Drosophila 주식 센터 (http://flystocks.bio.indiana.edu/)에서 사용할 수 있습니다. 히스톤 H2Av 들면, GFP 및 mRFP 변종 5, 6 사용할 수 있습니다

그림 1. 원심 분리에 의해 organelles (2 이후에 수정된)을 분리. 뚜렷한 충화의 중심 배아 결과의 원심 분리(밝은 빛). , endoplasmic reticulum, 잠돌군 Zz 및 mitochondria (에 설명되어있는 YFP 표시를 통해 살아있는 배아에서 검색된 지질 방울 (나일 레드 얼룩에 의해 고정 배아에서 발견) : 후부 (아래) 축 - 주요 organelles는 앞쪽에 따라 특성 위치 (최대)의 축적 기본 텍스트), 난황 (autofluorescence에 의해 감지). 형광 이미지는 공촛점 현미경에 의해 인수되었다.

그림 2. 배아의 도식 묘사.
A. 계란 껍질 유명 계란 필라멘트 (지느러미 부속)와 계란. 계란 껍질은 반투명 아니므로, 난자가 균일하게 어두운 나타납니다.
chorion와 B. 에그가 삭제되었습니다. 앞쪽에 끝에 (왼쪽), micropyle가 표시됩니다. 개발 단계에 따라 vitelline 막 내부의 배아는 동일 짙은 갈색을 표시하거나 다양한 구조를 표시합니다. 예제 Figure4를 참조하십시오.
C. 여기서 설명한 프로토콜과 같은 방향, 배아를 Centrifuged. 지질 방울은 micropyle 끝에 갈색 "모자"로 축적, 노른자는 반대 끝에 가까운 회색 레이어를 형성합니다.
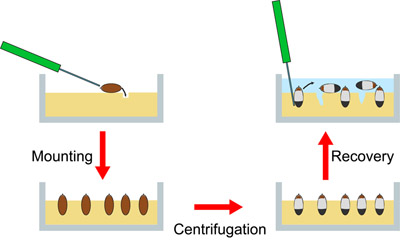
그림 3. 절차 도식 설명. 왼쪽 chorion없는 태아는 한천 플레이트의 상단에 위치하고 한천의 구멍에 바늘로 적용됩니다. 이것은 앞의와 모든 배아의 일관된 방향으로 결과를 장착 끝나 버리는 경우가 있습니다. 오른쪽 : 원심 분리 후, 배아는 층상 수 있습니다. 한천은 TSS (파란색)과 중첩되며, 태아가 바늘로 한천에서 회복됩니다. 일단 TSS에서 중지 배아는 pipettor로 데리러 수 있습니다.
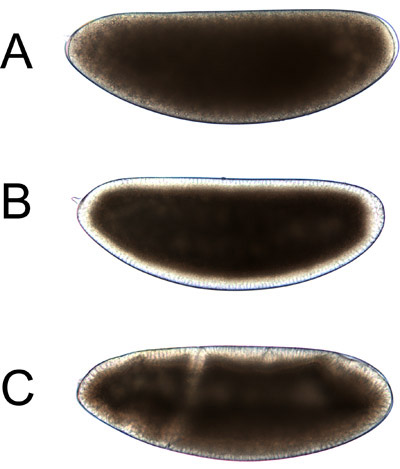
그들이 단계 4.1에 나타납니다 방식과 마찬가지로 생활 Drosophila의 배아 그림 4. 브라이트 - 빛의 이미지. 배아는 표준 방향으로 표시됩니다 : 아래 오른쪽 지느러미 측면까지, 그리고 복부쪽으로 왼쪽, 사후 종료 앞쪽에 종료합니다. 초기 embryogenesis의 시간 경과 영화는이 프로토콜을 함께 비디오의 일부로 사용할 수 있습니다.
A.의 절단 스테이지 배아가 균일하게 갈색 나타납니다. 이런 단계에서 - 생체내 원심 분리에 이상적입니다.
B.의 배반엽의 배아는 모든 측면에 유사하게 나타납니다 명확한 가장자리 있습니다. 이것은 분명 주변의 플라즈마 막에서 핵의 축적으로 인해 일부와 노른자의 vesicles 및 지질 방울 7 안으로 수송으로 인해 일부입니다. 이것은 분명 주변은 cellularization 1 끝 근처까지 확장됩니다. 배아는 아직 난황과 핵의 겹겹이은 절단 단계만큼 일관성이 아니지만, cellularization 8 월말까지 원심 분리에 의해 성공적으로 층상 수 있습니다.
지느러미와 복부 양쪽은 뚜렷한되고, 다양한 폴드 개발, cellularization 후 C., 배아는 비대칭 나타납니다. 표시된 배아 일찍 세균 밴드 확장에 있습니다. 이 단계에서 원심 분리는 주요 organelles을 stratifying에서 더 이상 유효하지 않습니다.
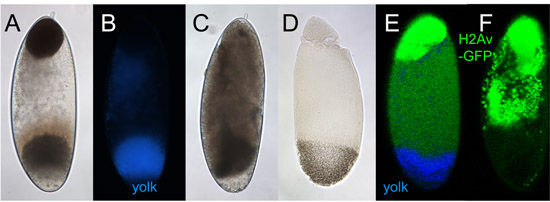
그림 5. Centrifuged 배아. 이 그림의 모든 태아들은 앞쪽에 엔드와 centrifuged했다 그 방향으로 표시됩니다.
성공적으로 centrifuged 배아의 A. 밝은 - 밝은 이미지. 맨 앞의 끝에 갈색 레이어 지질 - 비말의 축적에 의한 것입니다. 뒷부분 끝 근처에 광범위한 회색 레이어는 노른자의 vesicles 때문입니다. 원인 불명의 노른자 층 아래에 맑은 구역이 자주있다. 노란 영역은 노른자 레이어 위에 종종 분명이며 그것은 아마도 mitochondria 나타냅니다. 수용성 단백질은 지질 방울과 노른자 2 사이 명확한 계층을 통해 볼 수 있습니다.
UV 여기 아래 epifluorescence 현미경으로 볼에 B. 배아. 난황의 푸른 autofluorescence 특징은 뒷부분 끝을 식별하는 데 도움을줍니다.
C. 배아는 cellularization 후 세균 밴드 확장, 즉 동안 centrifuged. 난황은 여전히 사후 끝에 축적지만, 그렇지 않으면 겹겹이을 최소화합니다.
열 고정 후 D. 성공적으로 층상 배아. 지질 - 비말 계층은 다소 수정되지 않은 배아에서와 같이 어두운 갈색 (A)보다 흰색 솜털이 나타납니다.
공촛점 현미경 (2 이후에 수정된)에 의해 His2Av - GFP와 몇 군데를 표현 E. & F. 태아. E : 절단 단계에서 centrifuged, His2Av - GFP는 거의 핵이 시간에 의해 형성되므로 오직 지질 - 비말 계층을 표시가 나타납니다. 초점 평면에 따라 핵은 (여기에 표시되지 않음) 단지 비말 레이어 아래에 나타날 수 있습니다. F : 배반엽 단계에서 centrifuged, His2Av - GFP는 지질 - 비말 레이어 (상단)과 핵 (비말 층 아래에 광범위한 영역에서)를 모두 표시합니다.
토론
중요 단계
한천 농도가 충분히 높지되어 있는지 확인합니다. 너무 낮으면, 한천은 원심 분리하는 동안 분해되며, 태아가 파열하거나 임의로 지향합니다. 한천 농도 단지 약간 한천이 (단계 4.3에서 초과하는 TSS의 충분 건조 또는 불충 분한 제거) 젖었거나 너무 낮은 경우 경우 태아는 원심 분리하는 동안 그들의 구멍에서 부동과 부적 절한 중심이 될 것입니다. 한천 너무 얇게 부어있다면, 그것은 또한 축소 또는 원심 분리하는 동안 균열 것입니다.
organelles 개별 수천개의 세포 내에 분리된 될 것입니다 때문에 배아는 cellularization 단계 이상의 고급 않았는지 확인합니다. 그렇지 않으면, organelles의 분리 (그림 5C) 작동하지 않습니다. 한 세포 단계에서 젊은 배아에서 organelles 큰 거리를 마이 그 레이션하는 무료이며 자신의 특성 밀도에 따라 축적. 너무 오래 배아를 분석 방지하기 위해, 확실하게 (I)은 암컷은 오래된 달걀 (단계 2.4), (II) (단계 2.5) 3 시간 또는 더 적은을위한 배아를 수집, (III)를하다 수 있도록 미리 컬렉션을 포함 시각 한천에 삽입을위한 cellularization 단계 전에 배아를 선택합니다 (단계 4.2), (IV) cellularization (단계 4.6)의 끝 부분을 통해 개발을 방지하기 위해 짧은 시간을 포함 유지하고, (V) (단계 5.6) 정확하게 레이어 않았 배아를 폐기 .
원심 분리 시간에 날림으로하다하지 마십시오. 배아 중 일부는 심지어 원심 분리의 불과 10 분 후에 좋은 겹겹이 표시되지만, 분리는 배아로부터 배아에 일관성이있다. 30 분 놀이는 매우 일관성있는 결과를 제공합니다. 원심 분리가 끝난 후 또한, 더 이상 원심 분리 시간은 더 이상 레이어는 안정됩니다. 이것은 사용하기 전에 추가로 배아를 처리하는 데 시간이 걸립니다 어떤 이들 응용 프로그램에 중요합니다 (예를 들어, 그들은 이식 실험에 대한 처리 또는 공촛점 분석을 위해 장착해야하는 경우).
가능한 수정
에그 수집 및 chorion 제거 대부분의 다른 프로토콜은 2 단계와 3 단계 1, 3, 9 존재하고, 사용되는 배아는 어릴 같은 것들은 오랫동안 여기에 설명뿐만 아니라 작동합니다, 달걀 수율이 높다, 그리고 분수 잘못 개최 배아가 최소화됩니다.
앞쪽에 - 사후 정렬 프로토콜은 뒷부분 끝이 한천에 묻힌과 앞쪽에 끝이 접속 (그림 3)이다 그러한 모든 배아를 orients. 그것이 원심 분리 (그림 1, 5) 동안 지적 결국 랜드마크로 micropyle을 사용할 수 있습니다 있도록이 방향은 일관성을 위해 좋다. 그러나, 연습, 그것은 밝은 - 필드 현미경에 의한 지질 - 비말와 노른자 레이어의 독특한 외모로 centrifuged 태아의 방향을 선택하기 쉽습니다. 그런 다음 양쪽 끝에와 배아를 탑재 가능됩니다, 이러한 유연성은 설치 과정을 속도.
Unoriented 원심 분리 프로토콜의 가장 많은 시간과 기술적으로 도전적인 측면 한천의 배아 (4 단계)를 설치합니다. 그것은 (한 구멍에 삽입하고 한 번 원심 분리 후 복구)을 두 번 각각의 배아를 감동 필요합니다. 대안으로, 하나는 TSS 가득 microcentrifuge 튜브에 4.1 단계에서 배아를 전송할 수 있습니다. 이러한 튜브는 microcentrifuge (13,000 RPM, 10-30 분)에 centrifuged 때, 배아 것입니다 역시 일반적으로 계층 10-13. 이것은 유사 하나가 매우 빠르게 동시에 배아의 수백을 처리하실 수 있습니다. 그러나, 겹겹이은 일관성이 없다는 것입니다, 배아의 일부가 위의 프로토콜에 적용보다 훨씬 높은 원심 분리 세력 (~ 1만6천그램)에도 불구하고 서로 다른 레이어를 개발하지 않습니다. 더 많은 도전 태아의 방향이 변수이고, 하나는 주요 배아 축에 다양한 각도에서 분리를 볼 수있다는 사실입니다. 이 변화는 실험자가 특정 배아가 원심 튜브에 정렬 방식을 원심 분리 후에 정렬해야합니다. 그것이 안정적으로 그것을 할 많은 연습과 더 많은 판단을 필요로하지만 배아의 가장 밀도 부분 마커로 노른자의 autofluorescence의 사용과 함께, 이것은 종종 가능합니다. 샘플에 충분한 배아가있다면, 하나는 배아는 그림처럼 배열하는 일이있는 해당 인스턴스를 정렬하실 수 있습니다. 1.
자신의 알 껍질에서 배아의 원심 분리가 chorion 처음 2를 제거하지 않고 단계 4 한천의 배아를 포함시킬 수도 있습니다. 이 방법에서 수집 접시 배아는 할로 카본 오일 대신 단계 3.2 (할로 카본은 chorion의 투명한 세가)의 50 % 표백제 덮여있다. 해당 단계의 배아가 선택되고 핀셋을 사용하여 새 한천 플레이트로 전송되며, 핀셋, 손상만을 계란 필라멘트를 잡아서배아 적절한는 피할 수 있습니다. 배아는 앞쪽에 계란 필라멘트가 한천에있는 구멍까지 붙어서, 4.8을 통해 단계 4.4로 내장하고 있습니다. 배아가 centrifuged 및 단계 5.4에서와 같이 한천 밖으로 파고되고 난 후에 알 껍질은 50 % 표백 처리에 의해 제거됩니다. 계란 껍질의 존재에 원심 분리는 고정 후 devitellinization의 속도 (단계 6.2) 향상지만, 원심 분리에 대한 올바른 단계의 선택 (단계 4.2) 자세한 도전입니다.
애플 리케이션
특정 단백질이 특정 주요 organelle에 localizes 경우 colocalization 실험, 즉, 테스트를위한 배아의 원심 분리가 특히 유용합니다. 예를 들어, Klar 단백질이 초기 배아 지질 방울에 존재이며, 아직이 지방화는 그대로 태아에서 보여주는 도전이다. Klar puncta 및 지질 방울 모두 열심히 가짜 colocalization은 배제하고, 배아 주변 10 풍부하기 때문에 일부에서는이 있습니다. 그러나, 원심 분리는 별개의 레이어로 지질 방울을 집중하고, 따라서, Klar 신호 colocalization 10 명백한됩니다.
비슷한 분석 unambiguously 특정 histones 같은 놀라운 사례를 포함한 지질 방울 8, 13-15, 2와 단백질 ubiquitously 존재하는 경우에는 다른 단백질의 지방화를 보여주지만, 지질 방울 8 풍부했다. 배아가 발달 단계 (단계 4.2)에 의해 시각적으로 선택할 수 있듯이, 그것은 지질 방울 8, 15 단백질의 발달 규제 채용을 감지도 가능합니다. 지질 방울은 시각적으로 뚜렷한 "모자"에 축적 이후 지질 방울과 colocalization에 대한 테스트하는 것이 특히 쉽게, 아니 더 이상 마커 때문에 또는 얼룩이 레이어를 확인하기 위해 필요합니다. 사실, 때문에 간편하고 잠재적으로 눈에 띄는 시각적인 결과를 (그림 1, 그림 5. D, E), 우리의 실험실은 후보 단백질이 지질 방울로 지역화된 여부를 첫 번째 테스트로 지금은 정기적으로이 기술을 사용합니다. 원칙적으로 유사한 colocalization 연구 그림에 표시된 다른 organelles를 위해 작동합니다. 1, 그의 가능성 유통 centrifuged 배아에서 다른 (세포내 기생충 포함) 문서로 아직 가지고 있죠.
원심 분리가 꽉 밴드로 organelles을 집중하고 있기 때문에 이러한 organelles의 풍부한 소수의 고립을 용이하게합니다. 이 접근법은 이미 기증 배아 이식이에 대한 지질 방울을 복구하는 데 사용되었습니다. 또한 화학적으로 농축 분율 (예, 고정 15 일 이후에 배아에서 레이어를 절단하여) 분석하는 것이 가능해 질 수 있습니다.
원심 분리는 16 일 (개구리, nematodes, tunicates, annelids, 성게, mollusks, 그리고 Cnidarians 포함) 여러 종류의 달걀을 계충화하다하는 데 사용할 수있는 방법은 여기 Drosophila의 배아 이상의 응용 프로그램을 설명했다. 우리 자신의 연구실에서, 우리는 집파리 무스카 domestica 2의 태아에 대한 이상의 프로토콜을 사용하고 곰팡이 냇 Sciara coprophila 17 달팽이 Ilyanassa obsoleta 17 태아의 분석에 unoriented 원심 분리를 고용했습니다. 마지막으로,이 방법은 태아에 제한되지 않습니다 원심 분리 또한 oocytes (예 : Drosophila 2, 18 밀크 위드 버그 Oncopeltus fasciatus 17) 등 다른 대형 세포를 계충화하다에 유용할 수 있습니다. 다른 표본에 대한, 정확한 원심 분리 조건은 최적화할 필요가있다 : 예를 들어, 3,000g 10 분 효율적으로 무스카 domestica 2 배아를 계충화하다 충분한이며, 더 이상 centrifuged 경우, 태아는 고정 및 immunostaining 동안 떨어져 휴식하는 경향이있다.
공개
감사의 말
우리는 각각 Sciara coprophila 및 Ilyanassa obsoleta에 대한 인 - 생체내의 원심 분리를 테스트하는 자료를 공급 수잔 Gerbi, 하이디 스미스, 데이비드 램버트 감사드립니다. 우리는 기술과 원고에 대한 의견에 대한 Welte 실험실 구성원 감사합니다. 인 - 생체내 원심 분리 분석의 개발 및 개선을 모우에 NIGMS 부여 GM64687에 의해 지원되었다. 이미지가 그림에 표시됩니다. 1 그림. 5E, F는 이전에 다음 ID로 2를 출판 및 권한과 함께 reprinted 있습니다.
자료
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 60x15 mm Petri dishes | Becton Dickinson | #35-1007 | From Falcon | |
| Wire mesh | Small Parts | CX-0150 | stainless steel type 304; mesh size #150 x150, wire diameter: 0.0026 inches | |
| Tungsten needles | Fine Science Tools | 10130-10 | 0.25 mm | |
| Moria Nickel Plated Pin/Needle Holder | Fine Science Tools | 26016-12 | ||
| Fly Cages | Genesee Scientific | 59-100 or 59-101 | For 65 mm or 100 mm diameter Petri dishes, respectively | |
| Halocarbon Oil 27 | Sigma | H8773 |
참고문헌
- Wieschaus, E., Nüsslein-Volhard, C., Roberts, D. B. Looking at embryos. Drosophila: A Practical Approach. , 179-214 (1998).
- Cermelli, S., Guo, Y., Gross, S. P., Welte, M. A. The lipid droplet proteome reveals that droplets are a protein storage depot. Curr Biol. 16, 1783-1795 (2006).
- Kiehart, D. P., Crawford, J. M., Montague, R. A., Sullivan, W., Ashburner, M., Hawley, R. S. Quantitative microinjection of Drosophila embryos. Drosophila Protocols. , 345-359 (2000).
- LaJeunesse, D. R. Three new Drosophila markers of intracellular membranes. Biotechniques. 36 (784-788), 790-790 (2004).
- Schuh, M., Lehner, C. F., Heidmann, S. Incorporation of Drosophila CID/CENP-A and CENP-C into centromeres during early embryonic anaphase. Curr Biol. 17, 237-243 (2007).
- Clarkson, M., Saint, R. A His2AvDGFP fusion gene complements a lethal His2AvD mutant allele and provides an in vivo marker for Drosophila chromosome behavior. DNA Cell Biol. 18, 457-462 (1999).
- Welte, M. A., Gross, S. P., Postner, M., Block, S. M., Wieschaus, E. F. Developmental regulation of vesicle transport in Drosophila embryos: forces and kinetics. Cell. 92, 547-557 (1998).
- Tran, S. L., Welte, M. A. unpublished observations. , .
- Rothwell, W. F., Sullivan, W., Sullivan, W., Ashburner, M., Hawley, R. S. Fluorescent analysis of Drosophila embryos. Drosophila Protocols. , 141-157 (2000).
- Guo, Y., Jangi, S., Welte, M. A. Organelle-specific Control of Intracellular Transport: Distinctly Targeted Isoforms of the Regulator Klar. Mol Biol Cell. 16, 1406-1416 (2005).
- Meyer, W. J. Overlapping Functions of Argonaute Proteins in Patterning and Morphogenesis of Drosophila Embryos. PLoS Genet. 2, 1224-1239 (2006).
- Shubeita, G. T. Consequences of motor copy number on the intracellular transport of kinesin-1-driven lipid droplets. Cell. 135, 1098-1107 (2008).
- Welte, M. A. Regulation of lipid-droplet transport by the Perilipin homologue LSD2. Curr. Biol. 15, 1266-1275 (2005).
- Phadnis, N., Welte, M. A. Unpublished Observations. , .
- Phadnis, N., Welte, M. A. Unpublished Observations. , .
- Morgan, T. H. Chapter XXII: The redistribution of the visible materials of the egg by centrifuging. Experimental Embryology. , (1927).
- Welte, M. A. Unpublished Observations. , .
- Bownes, M. Abnormal oogenesis and embryogenesis resulting from centrifuging Drosophila melanogaster females. J Embryol Exp Morphol. 40, 65-81 (1977).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유