Titolazione di n-butillitio
Panoramica
Fonte: Vy M. Dong e Diane Le, Dipartimento di Chimica, Università della California, Irvine, CA
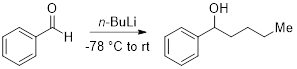
Questo esperimento dimostrerà una semplice tecnica per titolare e ottenere una concentrazione accurata del reagente organolitico, n-butillitio (n-BuLi). I reagenti organolitici sono estremamente sensibili all'aria e all'umidità e devono essere prestate la dovuta attenzione per mantenere la qualità del reagente in modo che possa essere utilizzato con successo in una reazione. Gli esperimenti di titolazione n-BuLidevono essere eseguiti regolarmente per ottenere concentrazioni accurate prima dell'uso in una reazione chimica. Successivamente, dimostreremo l'aggiunta del titolo n-BuLi alla benzaldeide.
Procedura
1. Preparazione del titolante
- In un matraccio a fondo tondo essiccato a fiamma munito di una barra di agitazione inferiore a N2, aggiungere acido difenilacetico (250 mg, 1,18 mmol) e THF anidro (5 ml).
2. Titolazione di n-BuLi
- Calcolare la quantità approssimativa di soluzione di n-BuLi (in esani) necessaria per consumare l'acido difenilacetico. Usando una siringa, aggiungere lentamenteuna soluzione di n-BuLi dropwise. La miscela d
Risultati
Risultati rappresentativi per la titolazione di n -BuLi per le procedure 1-3