Dispositivo di Dean Stark
Panoramica
Fonte: Vy M. Dong e Jan Riedel, Dipartimento di Chimica, Università della California, Irvine, CA
Una trappola Dean-Stark è un pezzo speciale di vetro, che consente la raccolta di acqua durante una reazione attraverso una distillazione azeotropica. Il desiderio di raccogliere acqua da una reazione può avere vari motivi. Può guidare gli equilibri nelle reazioni, dove l'acqua si forma come sottoprodotto. Secondo il principio di Le Chatelier, un cambiamento di temperatura, pressione, concentrazione o volume causerà un riaggiustamento di una reazione reversibile per stabilire un nuovo equilibrio. Una formazione acetale è una reazione reversibile, in cui l'acqua si forma come sottoprodotto. In questi casi, ottenere buone rese è possibile guidando l'equilibrio verso il lato del prodotto attraverso la rimozione dell'acqua. La trappola Dean-Stark consente anche la determinazione del contenuto di acqua o può essere utilizzata per rimuovere l'acqua da una miscela di solventi attraverso una distillazione azeotropica.
Principi
Un equilibrio di reazione può essere influenzato da un eccesso di reagente o dalla rimozione di un prodotto formato al fine di guidare l'equilibrio verso il lato del prodotto. Gli equilibri possono anche essere influenzati dalla temperatura o dalla pressione. Questo principio di base è chiamato principio di Le Chatelier e afferma che un cambiamento di temperatura, pressione, concentrazione o volume causerà un riaggiustamento della reazione per stabilire un nuovo equilibrio. Aggiungendo un eccesso di reagente, la concentrazione cambia e si stabilisce un nuovo equilibrio, favorendo il lato prodotto. Ad esempio, guidare l'equilibrio di un'idrolisi può essere facilmente raggiunto aggiungendo un eccesso di acqua.
Influenzare l'equilibrio di una reazione in cui l'acqua si forma come sottoprodotto, come un'esterificazione, non è semplice e richiede vetreria speciale. Questo speciale pezzo di vetro è chiamato trappola Dean-Stark e aiuta a rimuovere l'acqua formata dal mezzo di reazione (Figura 1). I solventi che formano un azeotropo con acqua, come il toluene, sono comunemente impiegati. Un azeotropo è un punto in una distillazione in cui la composizione della fase liquida è uguale alla composizione della fase gassosa. Un'ulteriore separazione attraverso una semplice distillazione oltre il punto azeotropico non è possibile. Questo è un vantaggio quando si utilizza la trappola Dean-Stark per influenzare gli equilibri, perché garantirà la rimozione continua dell'acqua. Dopo aver riscaldato la miscela di reazione, l'azeotropo toluene/acqua formato si distillerà, condenserà nel condensatore e fluirà nella trappola dean-stark. Il toluene e l'acqua formeranno due strati separati con il toluene come strato superiore e l'acqua come strato inferiore. Mentre il toluene può rifluire nel pallone di reazione, l'acqua viene intrappolata come strato inferiore e infine rimossa dall'equilibrio di reazione, guidando così la reazione verso il lato del prodotto.
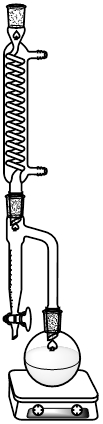
Figura 1. Apparato Dean-Stark
Procedura
1. Preparazione
- Prendi un pallone rotondo da 250 ml dotato di una barra magnetica.
- Posizionare un bagno d'olio sotto il pallone a fondo tondo su un agitatore magnetico.
- Riempire il matraccio a fondo tondo con 7,5 g (0,05 mol) m-Nitrobenzaldeide e aggiungere 75 ml di toluene.
- Aggiungere 3,1 ml (3,45 g, 0,055 mol) di glicole etilenico.
- Attacca la trappola Dean-Stark al pallone a fondo tondo.
- Attaccare un condensatore a riflusso sopra la trappola Dean-Stark.
2. Esecuzione della reazione
- Impostare la temperatura del bagno d'olio a 170 °C e riscaldare la miscela di reazione al reflusso.
- Monitora la reazione misurando la quantità d'acqua nella trappola Dean-Stark.
- La reazione viene eseguita quando nessun'altra acqua rimane intrappolata nel braccio laterale della trappola Dean-Stark.
- Dopo circa 2 ore, la quantità totale di acqua raccolta è di circa 0,8 ml.
3. Workup
- Rilasciare l'acqua e rimuovere il solvente organico combinato dalla miscela di reazione a pressione ridotta in un evaporatore rotante.
- Sciogliere il residuo giallo in 8 ml di etanolo sotto reflusso.
- Raffreddare la soluzione.
- L'acetale desiderato cristallizzerà.
- Filtrare il solido e asciugarlo a pressione ridotta.
Risultati
L'acqua si formerà e rimarrà intrappolata nel corso della reazione. La quantità teorica di acqua formata alla completa conversione può essere calcolata e confrontata con la quantità misurata dell'acqua intrappolata per determinare l'avanzamento della reazione.
Applicazione e Riepilogo
Questo esperimento dimostra vividamente il principio di Le Chatelier e come può guidare un equilibrio.
Le trappole Dean-Stark sono comunemente usate per rimuovere l'acqua da una miscela di solventi in varie circostanze. Ad esempio, la rimozione dell'acqua attraverso una semplice distillazione quando l'acqua non forma un azeotropo con l'altro solvente, è possibile con una trappola Dean-Stark basata sul suo design. Nel caso di una distillazione azeotropica, è necessaria l'aggiunta di un entrainer. Un entrainer è un solvente organico, che formerà un azeotropo con acqua ma non si mescola con l'acqua nella fase liquida. L'aggiunta di un entrainer assicura la rimozione continua dell'acqua, che rimane intrappolata nel braccio laterale della trappola Dean-Stark. A differenza della trappola Dean-Stark, un normale apparato di distillazione richiede l'aggiunta continua di un entrainer poiché l'entrainer distillato non può tornare alla miscela di solventi.
La trappola Dean-Stark può anche essere utilizzata per guidare gli equilibri delle reazioni, dove l'acqua si forma come sottoprodotto, come in una formazione di estere o acetale. Attraverso una distillazione azeotropica dove il solvente è anche l'entrainer, l'acqua viene rimossa dalla reazione e quindi dall'equilibrio.
Infine, una distillazione azeotropica con una trappola Dean-Stark può anche essere utilizzata per determinare il contenuto di acqua di solventi o miscele di solventi. Non solo l'acqua può essere rimossa con una trappola Dean-Stark, ma anche alcoli volatili posizionando setacci molecolari 5-Å nella trappola.
Vai a...
Video da questa raccolta:

Now Playing
Dispositivo di Dean Stark
Organic Chemistry II
100.6K Visualizzazioni

Pulizia della vetreria
Organic Chemistry II
123.9K Visualizzazioni

Sostituzione nucleofila
Organic Chemistry II
99.6K Visualizzazioni

Agenti riducenti
Organic Chemistry II
43.2K Visualizzazioni

Reazione di Grignard
Organic Chemistry II
149.2K Visualizzazioni

Titolazione di n-butillitio
Organic Chemistry II
48.1K Visualizzazioni

Ozonolisi degli alcheni
Organic Chemistry II
67.1K Visualizzazioni

Organocatalisi
Organic Chemistry II
16.9K Visualizzazioni

Reazione di accoppiamento catalizzata da palladio
Organic Chemistry II
34.6K Visualizzazioni

Sintesi in fase solida
Organic Chemistry II
41.2K Visualizzazioni

Idrogenazione
Organic Chemistry II
49.7K Visualizzazioni

Polimerizzazione
Organic Chemistry II
94.6K Visualizzazioni

Punto di fusione
Organic Chemistry II
150.0K Visualizzazioni

Spettroscopia infrarossa
Organic Chemistry II
215.9K Visualizzazioni

Polarimetro
Organic Chemistry II
100.2K Visualizzazioni