このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスES胚細胞の単離と導出
要約
開発の初期段階で始原生殖細胞に分化する胚性生殖細胞の能力は、がんと不妊についての我々の仮説に対応するために最適なモデルです。このプロトコルは、10.5から11.5日後に交尾のマウス胚での開発生殖腺から始原生殖細胞を単離する方法を示しています。
要約
初期の発達段階の間に後で配偶子への始原生殖細胞(始原生殖細胞)に分化し、胚性生殖細胞の能力(EG)は、がんと不妊についての我々の仮説に対応するために最適なモデルです。このプロトコルは、10.5から11.5日後に交尾(DPC)のマウス胚での開発生殖腺から始原生殖細胞を単離する方法を示しています。マウス胚から生殖腺隆起(C57BL6J)を開発してから以前に分裂ノックアウト媒体の存在下でマイトマイシンCで不活化し、白血病阻害剤を添加したマウス胚線維芽細胞のフィーダー層(MEF - CF1)に播種、コラゲナーゼと機械的な破砕により解離させた因子(LIF)、塩基性線維芽細胞増殖因子(bFGF)、および幹細胞因子(SCF)。培養条件のPCG識別、分離、および確立のためにこれらの最適化されたメソッドを使用すると、40日以上用EG細胞の長期培養を可能にします。胚性生殖細胞系は、多能性の状態の一般的な使用されるマーカーの胚の表現型と発現を示した。単離および培養中の胚細胞の派生は、in vitroでその開発を理解し、酸化ストレスへの曝露後の遺伝的およびエピジェネティックなレベルでの累積損傷を監視する機会を提供するツールを提供しています。
プロトコル
パート1:妊娠中のマウスの開腹
- 頸椎脱臼を使用して、10.5から11.5 DPCで妊娠C57BL6J雌マウスを安楽死させる。
- その後抗菌石鹸で腹部をきれいに、そして、それを剃る。
- シェービング後は、生理食塩水で腹部を洗う。
- その後、滅菌ガーゼで腹部を乾かします。
- 新しい滅菌フィールドでマウスをカバー。
- 鉗子と解剖鋏を使用して腹側切開を行います。
- 腹腔からの全体の子宮を識別し、削除。マウスの胚は子宮内部に表示されます。
- D - PBSで満たしたシャーレに子宮を転送し、それを氷上で保管してください。
- 滅菌メスや鉗子を用いて、胎盤及び各胚の余分な胚組織を削除します。
- D - PBSで満たされた新鮮なシャーレに胚を移す。
- マウス胚の長さを測定します。我々は、サイズが胚の年齢に応じて異なることがわかった。例8.5のDPCは、16mmの平均で測定さ11mmの12.5 DPCの平均で測定さ6mmの10.5 DPCの平均で測定。
- その後、DNA抽出のための彼らの尾を取り除く。
パート2:生殖隆起の解剖
実体顕微鏡と光源ショットFostec下
- シャーレにろ紙を置きます。その後、胚を乾燥させ、解剖のために固定するために、ろ紙の上にマウス胚を置きます。
- 滅菌メスを用いて、臍帯の起源上記のマウス胚の横カットを行います。
- 実体顕微鏡下で、無菌細かい鉗子と滅菌細かいからかいの針を使用して、泌尿器系が表示されるように腸や肝臓を取り除く。
腎臓は、腹腔内の横方向に配置され、そして膀胱は腎臓に比べて内側と尾側に位置しています。生殖腺の隆起が膀胱の両側に配置されているので、胚が雄として識別することができます。女性では、生殖腺の尾根はしっかりと腎臓の尾外側端に接続されている。 - その背後にある針をスライドさせて生殖隆起ピール。生殖隆起は、それを支える組織を離れて切断することによって除去される。
- 新鮮なD - PBSで満たされた新しいペトリ皿に生殖腺隆起を転送する。
顕微鏡的に、男性の生殖隆起は、形状が大きく、楕円形、ストリップする必要があります。対照的に、女性の生殖隆起を発見する必要がある、細長い形状を有し、雄の生殖隆起と比較して小さくなる。
パート3:生殖隆起の消化
実体顕微鏡の下で:
- 中腎の解剖:中腎と罰金とシャープな針を使用して尾根から生殖腺を区切ります。
- それはPGCの導出過程で生い茂るれる体細胞組織であるため、生殖隆起から中腎を削除することが重要です。
- 生殖隆起の消化:新鮮なD - PBSの0.5ulドロップできれいな生殖腺隆起を収集。コラゲナーゼ/ディスパーゼ溶液20ml(1mg/ml時の最終濃度)を追加します。
- 胚は、個別に処理されるべきです。それぞれの胚は、独自の個別およびラベル付けペトリ皿を持っている必要があります。
- 生殖腺のリッジは、ミンシング:滅菌針および滅菌細かい鉗子4号を使用して小片に生殖隆起をカット。
- インキュベーション:ペトリ皿を37℃インキュベーターに転送されます℃で15分間。
- インキュベーション時間は、組織間で異なる可能性があります。
- ピペッティング:15分後、組織は、ピペッティングにより解離させることができる。 40〜100 mmの間で直径と引っ張らガラスキャピラリーピペットを使用すると上下にピペッティングでピースを分割。これは、小さな塊を形成します。最後の洗浄のための事前暖めD - PBSのドロップの0.5ミリリットルに塊を転送する。
- 洗浄後、エッペンドルフチューブに塊を転送する。
- 上のコラゲナーゼに組織を公開しないでください。
- 単一の細胞懸濁液を作成しないでください。これはコロニー形成のために重要です。それは単一の細胞懸濁液の場合は、始原生殖細胞は分化し、移行する傾向がある。
- このプロセスは20分以内にする必要があります、またはあなたの細胞は、生存能力を失うことになる。
- 室温で5分間2000rpmで遠心する。
- 遠心後、上清を除去し、メディアから補足ノック(37℃で予め温めておいた)0.5 mlにペレットを再懸濁します。
パート4:始原胚細胞の培養
"あなたは分離し、導出のため始原生殖細胞の生存を維持するためにすぐに次の手順を実行する必要があります。
- 24時間このプロセスの前に、張J.ら、2008年からプロトコルを以下の有糸分裂的不活化MEF - CF1フィーダー層を準備する必要があります。
- oneプレグナで20皿を準備するNT雌性マウス(6-8胚)。
- MEFには5-6継代後(成長を促進し、差別化を防ぐ)フィーダー層となる能力を失う。
- 48時間以上経過したMEFを使用しないでください。
- すぐにメッキの始原生殖細胞の前に、MEFの培地は、徐々にMEFフィーダー層から削除する必要があります。
- その後、MEFフィーダー層上に予め温めておいた補充ノックアウト培地0.5ml /ウェルを追加。
- MEFのメディアは、始原生殖細胞の分化を誘導するウシ胎児血清が含まれています。
- グロー因子の活性を確保するために使用する前にノックアウト媒体は、直ちに正貨特定の成長因子を補充する必要があります。
- MEFフィーダー層上に対称的な分布、プレートの始原生殖細胞を使用する。
- これらの作品が近すぎる場合は、集約する傾向があり、不十分な添付または分化を開始高密度コロニーを作る。
- 培養皿は、胚胚細胞株名、継代数、および日付で標識されている必要があります。
- 慎重に、37℃、5%CO 2インキュベーターに培養皿を転送する。
- 細胞を24時間ごとに監視します。
- 48時間後、コロニーの付着を妨げることを避けるために文化の非常に上からメディア250mlのを削除します。その後、新鮮なノックアウト添加培地(37℃で予め温めておいた℃)250 mlを加える。
- 手順7の後に、別の48時間待機してから、完全にすべてのメディアを取り出し、新鮮なノックアウト添加培地(37℃で予め温めておいた)に交換してください。 PGCコロニー形成されるまで8-10日のためにこの2日おきください。
パート5:胚胚細胞
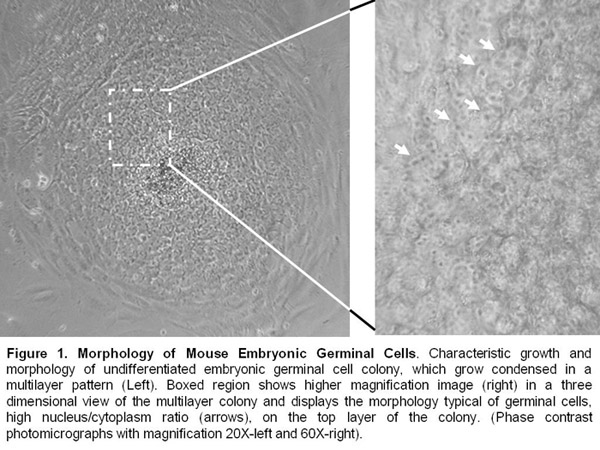
- PGCの分離の10日後、胚性生殖細胞のコロニーが形成されています。
- 胚性生殖細胞系は、マニュアルの文章ごとに8-10日で生き続けています。彼らは未分化な形態を提示し、そのようなalkalyneホスファターゼ、OCT - 4、SSEA - 1、およびSOX - 2のような多分化能マーカーを発現し続ける
ノート
- 無菌/滅菌条件は、培養室で不可欠です。
- 導出と文化のために、始原生殖細胞は、浄水器クラスIIバイオセーフティキャビネット内で処理されます。
- インキュベーションは、加湿37℃、5%CO 2インキュベーターです。
- すべての培地および試薬は4℃で保存されている0.2ミクロンフィルター、° Cで使用する前に濾過し、使用前に37℃で事前に暖めています。
- 解剖の手順中に、すべての胚や組織は氷上で保存する必要があります。
- すべての試薬のフラスコは、キャビネット内に配置する前にエタノールで除染されています。
- 手袋、白衣、看護師のキャップの使用は必須です。
結論
私達は分離する方法を示していますビデオ、派生、および10.5から11.5 DPCのマウス胚の生殖腺尾根から文化胚性生殖細胞を提供している。再現性の分離および胚生殖細胞株の長期的な文化は、男性と女性の胚で配偶子形成の発達過程で、遺伝的およびエピジェネティックな胚のパターン、生殖腺形成、周囲の臓器の環境への影響を初期胚発生の研究のための重要な基盤を提供します。とがんと不妊につながる経路の決定。
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
;博士ルーシーセンター、博士ブリジットウィルフォードとMSU ALAC認定マウスの施設での研修や動物のケアと支援のためのマイクBasett、博士ドウェインワイズ博士ニールまず、原稿編集のためKourtneyウィルキンソン:著者はの非常に貴重な助けに感謝セザールモンロイ、ハンナスウォープ、およびMSUのビデオ制作とその支援のためのボビーハドルストン、顕微鏡と画像キャプチャと彼の支援のための。この研究は、インスティテューショナルリサーチとミシシッピ州立大学で生物科学科のオフィスによって資金を供給された。
Access restricted. Please log in or start a trial to view this content.
資料
鉗子14号、15、メス35ミリメートル、解剖ハサミ、外科分野、抗菌石鹸、生理食塩水0.9%、ガーゼ、氷の泡コンテナ、カミソリの刃、メス35ミリメートル、微細な鉗子第4と5、罰金からかい針ハンドル、ろ紙シート、およびガラスピペットを引っ張った。
設備:解剖顕微鏡、光源ショットFostec、倒立顕微鏡、マイクロピペット10、200ul、遠心分離、バイオセーフティキャビネット。
参考文献
- DeFelici, M. Cell Biology: A laboratory Handbook. 1, Second Edition, 73-85 (1998).
- Donovan, P. J., De Miguel, M. P. Turning Germ Cells into Stem Cells. Current Opinion in Genetics and Development. 13, 463-471 (2003).
- Labosky, P. A., Hogan, B. L. M. Part 12: Mouse Primordial Germ Cells: isolation and in vitro culture. Molecular embryology: methods and protocols. Sharp, P. T., Mason, I. 97, Humana Press. Totowa, NJ. (1999).
- Mc Laren, A., Southee, D. Entry of Mouse Embryonic Germ Cells into Meiosis. Developmental Biology. 187, 107-113 (1997).
- Yoshimizu, T., Obinata, M., Matsui, Y. Stage-specific tissue and cell interactions play key roles in mouse germ cell specification. Development. 128, 481-490 (2001).
- Zhang, J., Hhvorostov, I., Teitell, M. From MEFs to Matrigel I: Passaging hESCs in the Presence of MEFs. J Vis Exp. , (2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved