Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Embriyonik Germinal Hücreleri İzolasyon ve türetilmesi
Özet
Ilkel germinal hücrelerin ayırt etmek için erken geliştirme aşamasında, embriyonik germinal hücreler, kanser ve kısırlık hakkındaki hipotezi adresine yeteneği mükemmel bir model. Bu protokol, 10,5-11,5 gün coitum fare embriyoları, gelişmekte olan gonadlar ilkel germinal hücreleri izole etmek için nasıl gösterir.
Özet
Embriyonik germinal hücrelerin yeteneği (EG), kanser ve kısırlık hakkındaki hipotezi adresi için mükemmel bir model, erken gelişim aşamalarında, ilkel germinal hücreleri (PGCs) içine ve daha sonra gamet içine ayırt etmek için. Bu protokol, 10,5-11,5 gün coitum (DPC) fare embriyoları, gelişmekte olan gonadlar ilkel germinal hücreleri izole etmek için nasıl gösterir. Fare embriyoları gonadal sırtlar Geliştirme (C57BL6J) sonra daha önce mitotik nakavt medya huzurunda mitomisin C ile inaktive edilmiş ve Lösemi İnhibitörü ile desteklenmiş bir fare embriyo fibroblast besleyici tabaka (MEF-CF1) kaplama kollajenaz ile mekanik parçalanması, ayrışmış edildi Faktörü (LIF), temel Fibroblast Büyüme Faktörü (bFGF) ve Kök Hücre Faktörü (SCF). PCG kimlik, kültür koşulları, izolasyon, ve kurulması için optimize edilmiş, bu yöntemleri kullanarak, en fazla 40 gün için EG hücreleri uzun vadeli kültürleri izin verir. Embriyonik germinal hücre hatları, pluripotent devletin yaygın olarak kullanılan belirteçlerin embriyonik fenotip ve ifade gösterdi. İzolasyon ve kültür germinal hücrelerin türetme gelişimini anlamak ve in vitro genetik ve epigenetik düzeyde oksidatif strese maruz kaldıktan sonra birikimli hasar izlemek için bir fırsat sunmak için bir araç sağlar.
Protokol
Bölüm 1: Hamile Fare Laparotomi
- Servikal dislokasyon kullanarak, 10,5-11,5 DPC, hamile bir C57BL6J kadın fare euthanize.
- Karın antimikrobiyal sabun ile temizleyin ve sonra, tıraş.
- Tıraştan sonra karın, bir tuzlu su çözeltisi ile yıkayın.
- Sonra steril bir gazlı bez ile karın kurulayın.
- Yeni bir steril alan fare ile kaplayın.
- Forseps ve diseksiyon makas kullanarak ventral kesi olun.
- Belirlenmesi ve karın boşluğuna kadar tüm rahim kaldırmak. Fare embriyoları rahim içinde görünür olacaktır.
- D-PBS ile dolu bir petri içine rahim transferi ve buz üzerinde tutmak.
- Steril bir bisturi ve forseps kullanarak, plasenta ve her embriyo ekstra embriyonik dokularda çıkarın.
- D-PBS ile dolu yeni bir petri içine embriyo transferine.
- Fare embriyo uzunluğunu ölçün. Biz boyutları embriyonun yaşına göre farklılık bulundu. 6mm ortalama ölçülen DPC örneğin 8.5, 10.5 DPC 11mm ortalama ölçülen ve 16 mm ortalama 12.5 DPC ölçülür.
- Daha sonra, DNA ekstraksiyonu için kuyrukları kaldırmak.
Bölüm 2: Gonadal Ridge Diseksiyon
Stereomikroskopta ve Işık kaynağı Schott Fostec altında
- Petri kabındaki bir filtre kağıdı yerleştirin. Sonra, embriyo kuru ve diseksiyon için hareketsiz fare embriyo filtre kağıdının üstüne koyun.
- Steril bir bistüri kullanarak, fare embriyo göbek kordonu kökeni üzerinde enine kesilmiş olun.
- Stereomikroskop altında, steril ince forseps ve steril bir ince alay iğne kullanarak, üriner sistem görünür olduğunu bu nedenle bağırsak ve karaciğer kaldırmak.
Böbrekler yanal karın boşluğunda bulunan ve mesane, böbrekler göre medial ve kaudal bulunmaktadır. Gonadal sırtlar mesane iki tarafında bulunması nedeniyle embriyonun erkek olarak tespit edilebilir. Kadın, gonadal sırtlar böbrekler kaudal lateral sonuna kadar sıkıca bağlıdırlar. - Arkasında bir iğne kaydırarak gonadal sırt dışarı Peel. Gonadal sırtı destekleyen dokuların kesim tarafından kaldırılır.
- Gonadal sırtlar taze D-PBS ile dolu yeni bir petri kabına aktarın.
Mikroskopik, erkek gonadal sırt, büyük ve oval soyulmuş olmalıdır. Buna karşılık, dişi gonadal sırt fark olmalıdır, uzatılmış şekli ve erkek gonadal sırt kıyasla daha küçük olabilir.
Bölüm 3: Ridge Sindirim Gonadal
Altında stereomikroskopta:
- Mesonephros Diseksiyon: ince ve keskin bir iğne kullanılarak mesonephros ve sırt gonad ayırın.
- PGC türetme süreç içinde büyümek bir somatik doku olması nedeniyle gonadal sırt mesonephros kaldırmak için önemlidir.
- Gonadal Ridge Sindirim: taze D-PBS 0.5ul açılan temiz gonadal sırtlar toplayın. Kollajenaz / Dispase Çözüm 20 ml (1mg/ml Final konsantrasyon) ekleyin.
- Embriyolar ayrı ayrı işleme tabi tutulmalıdır. Her embriyo kendi ayrı ve etiketli petri olmalıdır.
- Gonadal Ridge kıyma: gonadal sırt, steril bir iğne ve steril ince forseps No 4 kullanarak küçük parçalar halinde kesin.
- Kuluçka: Petri kapları 37 bir kuluçka aktarılır ° C de 15 dakika boyunca.
- Inkübasyon süresi dokular arasında değişebilir.
- Pipetleme: 15 dakika sonra, doku pipetleme ayrışmış olabilir. 40 -100 mm çapları arasında çekilmiş cam kapiller pipetler kullanarak, yukarı ve aşağı pipetleme tarafından parçaları kadar Break. Bu küçük öbekler şeklinde olacaktır. Nihai bir yıkama için bir ön ısındı D-PBS damla 0.5 ml yığınları aktarın.
- Yıkadıktan sonra yığınları, Eppendorf tüplerine transfer.
- Doku üzerinde kollajenaz maruz bırakmayın.
- Tek bir hücre süspansiyonu yapmayın. Bu koloni oluşumu için önemlidir. Tek bir hücre süspansiyonu ise, PGCs farklılaştırmak ve göç eğilimindedir.
- Bu işlemi 20 dakika daha uzun olmamalı, ya da hücreler canlılığını kaybedecektir.
- Oda sıcaklığında 5 dakika 2000 rpm'de santrifüjleyin.
- Santrifüj sonra, süpernatant kaldırmak ve medya dışında ilave vuruş (37 ° C'de Önceden ısıtılmış) 0.5 ml pelet tekrar süspansiyon.
Bölüm 4: İlkel Germinal Hücreler Kültür
"Sen, izolasyon ve derivasyon PGCs canlılığını korumak için hızla bir sonraki adımları gerçekleştirmeniz gerekir.
- Bu süreç 24 saat önce Zhang, J. ve ark 2008 protokolü takip mitotik olarak inaktive MEF-CF1 besleyici tabaka hazırlamalıdır.
- Bir pregna 20 yemekleri hazırlayınnt dişi fare (6-8 embriyoların).
- MEFS 5-6 pasajlar sonra (büyümeyi teşvik etmek ve önlemek farklılaşma) besleyici tabaka yeteneğini kaybedersiniz.
- 48 saatten daha büyük MEFS kullanmayın.
- Kaplama PGCs hemen önce, MEF orta yavaş yavaş MEF besleyici tabaka kaldırılmış olmalıdır.
- Daha sonra, MEF besleyici tabaka üzerine, önceden ısıtılmış takviye nakavt orta / iyi 0,5 ml ekleyin.
- MEF medya PGCs, farklılaşma indükler fetal sığır serumu içerir.
- Nakavt orta specie özel büyüme faktörleri ile takviye edilmelidir hemen önce büyümeye faktörünün etkinliği sağlamak için kullanmak.
- MEF besleyici tabaka üzerinde simetrik dağılımı, plaka PGCs kullanma.
- Bu parçaları çok yakın iseler, agrega ve kötü eklemek veya ayırt başlamak yoğun koloniler yapmak eğilimindedir.
- Kültür yemekler Embriyonik Germinal hücre hattı adı, geçiş numarası ve tarih ile etiketlenmiş olmalıdır.
- Dikkatlice bir inkübatör içine 37 ° C ve% 5 CO 2 kültür kaplarına aktarın.
- Hücreler her 24 saatte bir izleyin.
- 48 saat sonra, koloni eki rahatsız etmemek için 250 ml medya kültürünün en üst çıkarın. Daha sonra, 250 ml taze takviye knock-out medya (37 ° C'de önceden ısıtılmış) ekleyin.
- 7 adım sonra, başka bir 48 saat bekleyin ve sonra, tamamen kaldırmak ve tüm medya taze knock-out takviye medya (37 ° C'de önceden ısıtılmış) ile değiştirin. PGC koloni oluştururlar kadar 8-10 gün boyunca bu 2 günde yapın.
Bölüm 5: Embriyonik Germinal Hücreler
- PGC izolasyon 10 gün sonra, embriyonik germinal hücre kolonileri oluşur.
- Embriyonik germinal hücre hatları manuel geçişleri her 8-10 gün canlı tutulur. Farklılaşmamış bir morfoloji sunmak ve pluripotency belirteçlerinin alkalyne fosfataz, Ekim-4, SSEA-1, ve SOX-2 gibi ifade etmeye devam
Notlar
- Steril / aseptik koşullarda kültür odası gereklidir.
- Türetme ve kültür için, PGCs Arıtma Sınıf II Bio Güvenlik Kabinesi işlenir.
- Inkübatörü nemlendirilmiş bir 37 ° C ve% 5 CO 2 inkübatör.
- Tüm medya ve reaktifler 4 kayıtlı 0,2 um filtre ° C kullanmak için önce filtre ve kullanmadan önce 37 ° C önceden ısıtılmış.
- Diseksiyonu adımları sırasında, tüm embriyolar ve dokuların buz üzerinde tutulmalıdır.
- Tüm reaktif şişeler, bir kabin içine yerleştirmeden önce etanol ile dekontamine.
- Eldiven, laboratuvar önlüğü ve hemşire kapaklar kullanılması zorunludur.
Sonuç
Biz izole etmek için nasıl bir video türetmek ve gonadal sırtlar 10,5-11,5 DPC fare embriyo kültür embriyonik germinal hücrelerin sağladı. Embriyonik germinal hücre hatları tekrarlanabilir izolasyon ve uzun vadeli kültürü, erken embriyonik gelişim, genetik ve epigenetik germinal desenleri, gonad oluşumu çalışma için kritik bir temel sağlar, erkek ve dişi embriyolarda gametogenezis gelişim sürecinde organları çevreleyen çevresel etkileri, ve kanser ve kısırlığa neden yollarının belirlenmesi.
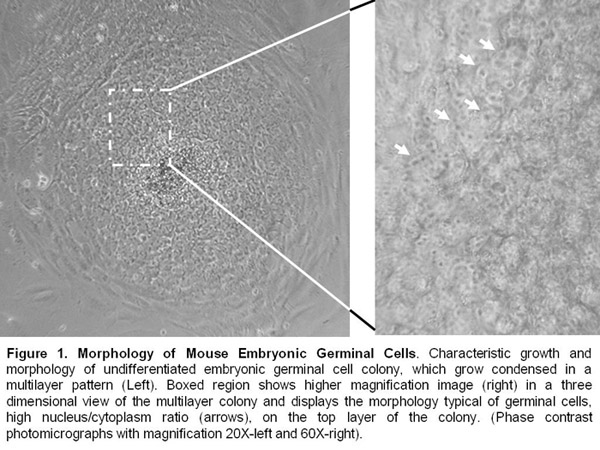
Açıklamalar
Teşekkürler
Dr Lucy Senter, Dr. Brigit Willeford ve MSU ALAC akredite fare tesisi, eğitim ve hayvan bakımı ile ilgili yardım için Mike Basett; Dr. Dwayne Wise Dr Neal Birinci ve yazının düzenleme için Kourtney Wilkinson: Yazarlar, paha biçilmez bir yardım kabul etmek istiyorum Cesar Monroy Hannah Swoope ve Bobbie Huddleston MSU video üretimi ile yardım için mikroskopi ve görüntü yakalama ile yaptığı yardım için. Bu araştırma, Mississippi State Üniversitesi Kurumsal Araştırma ve Biyolojik Bilimler Bölümü Ofisi tarafından finanse edildi.
Malzemeler
Forseps No 14 ve 15, neşter 35 mm, diseksiyon makas, cerrahi alanlar, antimikrobiyal sabun, tuzlu solüsyon% 0.9, gazlı bez, buz köpüğü konteyner, jilet, bistüri 35 mm, ince forseps 4 ve 5 sayılı, ince alay iğne ile kağıt yaprak sapı, filtre ve cam pipetler çekti.
Ekipman: diseksiyon stereomikroskopta, ışık kaynağı Schott Fostec, inverted mikroskop, 10 mikropipet ve 200ul, santrifüj, biyo güvenlik Dolabı.
Referanslar
- DeFelici, M. . Cell Biology: A laboratory Handbook. 1, 73-85 (1998).
- Donovan, P. J., De Miguel, M. P. Turning Germ Cells into Stem Cells. Current Opinion in Genetics and Development. 13, 463-471 (2003).
- Labosky, P. A., Hogan, B. L. M., Sharp, P. T., Mason, I. Part 12: Mouse Primordial Germ Cells: isolation and in vitro culture. Molecular embryology: methods and protocols. 97, (1999).
- Mc Laren, A., Southee, D. Entry of Mouse Embryonic Germ Cells into Meiosis. Developmental Biology. 187, 107-113 (1997).
- Yoshimizu, T., Obinata, M., Matsui, Y. Stage-specific tissue and cell interactions play key roles in mouse germ cell specification. Development. 128, 481-490 (2001).
- Zhang, J., Hhvorostov, I., Teitell, M. From MEFs to Matrigel I: Passaging hESCs in the Presence of MEFs. J Vis Exp. , (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır