Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение и Вывод мышиных эмбриональных зародышевых клеток
В этой статье
Резюме
Способность эмбриональных зародышевых клеток дифференцироваться в первичных зародышевых клеток на ранних стадиях развития является идеальной моделью для решения нашу гипотезу о раке и бесплодие. Этот протокол показывает, как изолировать первичный зародышевых клеток из развивающихся гонад в 10.5-11.5 дней после эмбрионов coitum мыши.
Аннотация
Способность эмбриональных зародышевых клеток (EG) дифференцироваться в первичных зародышевых клеток (PGCs), а затем в гаметы во время ранних стадиях развития является идеальной моделью для решения нашу гипотезу о раке и бесплодие. Этот протокол показывает, как изолировать первичный зародышевых клеток из развивающихся гонад в 10.5-11.5 дней после coitum (ЦОД) эмбрионов мыши. Разработка половых хребты из мышиных эмбрионов (C57BL6J) были диссоциированы механическое разрушение с коллагеназа, а затем помещают в фибробласты эмбриона мыши фидерного слоя (MEF-CF1), который был ранее митотически инактивированные митомицином С в присутствии средств массовой информации нокаутом и дополнены лейкемии Ингибитор фактор (LIF), основной фактор роста фибробластов (bFGF), и фактор стволовых клеток (SCF). Используя эти методы оптимизированы для PCG выявление, изоляцию, а также создание условий культивирования позволяет долгосрочных культурах Е. клетки в течение более 40 дней. Эмбриональных зародышевых линий эмбриональных клеток показали, фенотип и выражение общих использовать маркеры плюрипотентных государства. Выделение и вывод зародышевых клеток в культуре предоставить инструмент, чтобы понять их развитие в лабораторных и предлагают возможность контролировать совокупный ущерб на генетические и эпигенетические уровни после воздействия окислительного стресса.
протокол
Часть 1: Беременные Лапаротомия мышь
- Использование шейки дислокации, эвтаназии беременных женщин C57BL6J мыши на 10.5-11.5 DPC.
- Чистая живота с антимикробным мылом, а затем, побрить его.
- После бритья, мыть живот с физиологическим раствором.
- Затем, сухой живот стерильной марлей.
- Обложка мышь с новой стерильной области.
- Сделать вентральный вырез использованием щипцов и рассечение ножницами.
- Выявить и устранить все матки из брюшной полости. Мышь эмбрионы будут видны внутри матки.
- Передача матки в чашку Петри заполнены D-PBS, и держать его на льду.
- Используя стерильный скальпель и пинцет, удалите плаценты и эмбриональных тканей дополнительные каждого эмбриона.
- Трансфер эмбрионов в свежем чашке Петри заполнены D-PBS.
- Измерьте длину эмбрионов мыши. Мы обнаружили, что размеры отличаются в зависимости от возраста эмбриона. Например 8,5 DPC измеряется в среднем на 6 мм, 10.5 DPC измеряется в среднем на 11 мм и 12,5 DPC измеряется в среднем 16 мм.
- Затем удалите их хвосты выделения ДНК.
Часть 2: гонад Dissection Ридж
Под стереомикроскопа и источник света Schott Fostec
- Место фильтровальную бумагу в чашке Петри. Затем поместите эмбриона мыши в верхней части фильтровальной бумаге высохнуть эмбриона и парализовать для вскрытия.
- Используя стерильный скальпель, сделать поперечный срез эмбриона мыши над происхождения пуповины.
- Под стереомикроскопа, с помощью стерильного пинцета и тонкой стерильной тонкой иглой дразнить, удалить кишечник и печень, так что мочевыделительной системы видна.
Почки расположены горизонтально в брюшной полости, и мочевого пузыря находится медиальной и хвостового по сравнению с почками. Эмбриона могут быть определены как мужские, так как половая хребты расположены по обе стороны мочевого пузыря. У женщин, половая хребты прочно прикреплены к боковым хвостового конца почки. - Пил из половых хребта, сдвинув иглу за ним. Половых хребта удален убирания тканей, которые поддерживают его.
- Передача половых хребтов на новую чашку Петри заполнены свежими D-PBS.
Микроскопически мужской половых хребте должны быть удалены, большие и овальной формы. В отличие от женщины половых хребта должно быть заметили, имеют удлиненную форму и быть меньше, по сравнению с мужской половых хребта.
Часть 3: гонад Пищеварение Ридж
Под стереомикроскопа:
- Мезонефрос Препарирование: Отдельная гонады от мезонефрос и конька с помощью тонкой и острой иглой.
- Важно, чтобы удалить мезонефрос от половых хребта, потому что это ткань соматических которые перерастают в процессе вывода PGC.
- Гонад Пищеварение Ридж: Соберите чистых половых хребтов 0.5ul капля свежей D-PBS. Добавьте 20 мл коллагеназы / Dispase Решение (конечная концентрация в 1mg/ml).
- Эмбрионы должны быть обработаны по отдельности. Каждый эмбрион должен иметь свой собственный отдельный и маркированы Петри.
- Гонад Ридж Минцинг: Cut половых хребта на мелкие части, используя стерильные иглы и стерильной тонкой щипцы № 4.
- Инкубация: чашки Петри передаются в инкубаторе при температуре 37 ° С в течение 15 минут.
- Инкубационный период может варьироваться между тканями.
- Пипетирование: После 15 минут, ткани могут быть отделены с помощью пипетки. Использование вытащил стеклянный капилляр пипетки с диаметром от 40 мм -100 Разбейте произведения пипетирования вверх и вниз. Это образуют небольшие скопления. Передача сгустки в 0,5 мл предварительно нагревается D-PBS капли для последней промывки.
- После мытья, передача сгустки в Эппендорф труб.
- Не более чем подвергать ткани коллагеназы.
- Не делайте суспензии отдельных клеток. Это важно для образования колоний. Если это суспензии отдельных клеток, PGCs, как правило, дифференцироваться и мигрировать.
- Этот процесс не должен быть длиннее 20 минут, или ваши клетки теряют жизнеспособность.
- Центрифуга при 2000 оборотов в минуту в течение 5 минут при комнатной температуре.
- После центрифугирования, удалить супернатант, и ресуспендируют осадок в 0,5 мл дополнен выбить средства массовой информации (Pre-нагревают при 37 ° С).
Часть 4: Изначальная Жерминаль культуры клеток
"Вы должны выполнить следующие шаги быстро сохранить жизнеспособность PGCs для изоляции и словообразования.
- 24 часа до начала этого процесса необходимо подготовить митотически инактивированных MEF-CF1 фидерного слоя следующий протокол от Чжан Дж. и др. 2008 год.
- Подготовка 20 блюд для одного pregnaNT женский мыши (6-8 эмбрионов).
- MEFs теряют способность быть фидерного слоя (стимулирования роста и предотвращения дифференциации) через 5-6 пассажей.
- Не используйте MEFs старше 48 часов.
- Непосредственно перед покрытием PGCs, средний MEF должны быть постепенно удалены из слоя фидерных MEF.
- Затем добавьте 0,5 мл / лунку подогретого дополнен нокаутом среды на уровень подачи MEF.
- MEF носитель содержит эмбриональной телячьей сыворотки, которая индуцирует дифференциацию PGCs.
- Нокаут среда должна быть дополнена породы специфических факторов роста непосредственно перед употреблением для обеспечения деятельности растут фактор.
- Использование симметричного распределения пластины PGCs по слою фидерные MEF.
- Если эти части находятся слишком близко, они склонны к агрегации и сделать густые заросли, которые крепятся плохо или начать дифференциации.
- Культура блюда должны быть помечены Эмбриональные Жерминаль название линии клеток, прохождение номер и дату.
- Осторожно, передача культуры блюда в инкубаторе при температуре 37 ° С и 5% СО 2.
- Монитор клетки каждые 24 часа.
- Через 48 часов, удалите 250 мл СМИ из самой вершине культуры не мешать привязанности колонии. Затем добавьте 250 мл свежей дополнен нокаут средств массовой информации (предварительно нагревают при 37 ° С).
- После шага 7, ждать еще 48 часов, а затем полностью удалить все средства массовой информации и заменить его на свежий дополнен нокаут средств массовой информации (предварительно нагревают при 37 ° С). Делайте это раз в 2 дня в течение 8-10 дней, пока форма PGC колоний.
Часть 5: Эмбриональные зародышевых клеток
- После 10 дней изоляции PGC, эмбриональных зародышевых колонии образуются ячейки.
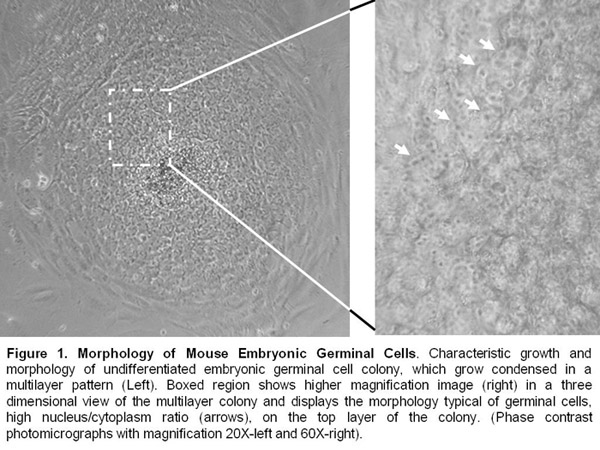
- Эмбриональные зародышевые линии клеток поддерживается по сей день руководство проходов каждые 8-10 дней. Они по-прежнему представляют недифференцированной морфологией и выразить плюрипотентности маркеров, таких как alkalyne фосфатазы, Oct-4, SSEA-1, и SOX-2
Примечания
- Стерильные / асептических условиях играют важную роль в культуре комнате.
- Для вывода и культуры, PGCs обрабатываются в очиститель Класс II кабинета безопасности Bio.
- Инкубацию находятся в увлажненном 37 ° С и 5% СО 2 инкубатора.
- Все средства массовой информации и реагентов фильтруются перед использованием в 0,2 мкм фильтр, хранить при температуре 4 ° С, и предварительно нагревают при 37 ° С до использования.
- Во время вскрытия шаги, все эмбрионы и ткани должны храниться на льду.
- Все реагенты колбы обеззаражены с этанолом до размещения в шкафу.
- Использование перчатки, халат, и медсестра шапки, являются обязательными.
Заключение
Мы предоставили видео, которое показывает, как изолировать, получать и культуры эмбриональных зародышевых клетках половых хребтов 10.5-11.5 эмбрионов DPC мыши. Воспроизводимые изоляции и долгое культуры термин эмбриональных зародышевых линиях клеток представляет собой важнейшую основу для изучения раннего эмбрионального развития, генетических и эпигенетических зародышевых узоры, гонад формирования, экологические последствия окружающие органы во время процесса развития гаметогенеза в мужские и женские эмбрионы, и определение путей, что приводит к раку и бесплодию.
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Авторы хотели бы отметить неоценимую помощь: д-р Нил Первый и Кортни Уилкинсон для редактирования рукописей, д-р Люси Senter, доктор Бриджит Willeford и Майк Basett за помощь в подготовке и ухода за животными в МГУ ALAC аккредитованных объекта мышь; доктор Дуэйн Мудрого за помощь в микроскопии и захват изображения; Сезар Монрой, Ханна Свуп, и Бобби Хаддлстон за их помощь в видео-продукции в МГУ. Это исследование было профинансировано Управлением институциональных исследований и Отделение биологических наук Университета штата Миссисипи.
Access restricted. Please log in or start a trial to view this content.
Материалы
Пинцет № 14 и 15, скальпель 35 мм, рассечение ножницами, области хирургии, антимикробное мыло, солевой раствор 0,9%, марля, контейнер льда пеной, бритва, скальпель 35 мм, тонкие щипцы № 4 и 5, тонкая игла с дразнить ручки, листы фильтровальной бумаги, и вытащил стекло пипетки.
Оборудование: рассекает стереомикроскопа, источник света Schott Fostec, инвертированный микроскоп, микропипетки 10 и 200ul, центрифуги, био-безопасности, Кабинетом министров.
Ссылки
- DeFelici, M. Cell Biology: A laboratory Handbook. 1, Second Edition, 73-85 (1998).
- Donovan, P. J., De Miguel, M. P. Turning Germ Cells into Stem Cells. Current Opinion in Genetics and Development. 13, 463-471 (2003).
- Labosky, P. A., Hogan, B. L. M. Part 12: Mouse Primordial Germ Cells: isolation and in vitro culture. Molecular embryology: methods and protocols. Sharp, P. T., Mason, I. 97, Humana Press. Totowa, NJ. (1999).
- Mc Laren, A., Southee, D. Entry of Mouse Embryonic Germ Cells into Meiosis. Developmental Biology. 187, 107-113 (1997).
- Yoshimizu, T., Obinata, M., Matsui, Y. Stage-specific tissue and cell interactions play key roles in mouse germ cell specification. Development. 128, 481-490 (2001).
- Zhang, J., Hhvorostov, I., Teitell, M. From MEFs to Matrigel I: Passaging hESCs in the Presence of MEFs. J Vis Exp. , (2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены