Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'isolement et la dérivation de cellules germinales embryonnaires de souris
Dans cet article
Résumé
La capacité des cellules embryonnaires germinales à se différencier en cellules germinales primordiales durant les stades de développement précoce est un modèle parfait pour répondre à nos hypothèses sur le cancer et l'infertilité. Ce protocole montre comment isoler des cellules germinales primordiales gonades en développement en 10/05 à 11/05 jours post coïtum embryons de souris.
Résumé
La capacité des cellules embryonnaires germinales (EG) de se différencier en cellules germinales primordiales (PGC) et plus tard en gamètes premiers stades de développement est un modèle parfait pour répondre à nos hypothèses sur le cancer et l'infertilité. Ce protocole montre comment isoler des cellules germinales primordiales gonades en développement dans les embryons 10/05 au 11/05 jours post-coïtum souris (DPC). Développer les crêtes gonadiques d'embryons de souris (C57BL6J) ont été dissociées par une rupture mécanique avec de la collagénase, puis étalées en une couche de fibroblastes d'embryon de souris d'alimentation (MEF-CF1) qui était auparavant mitotiquement inactivé par la mitomycine C, en présence des médias à élimination directe et complétée par un inhibiteur de la leucémie Cell Factor Factor (LIF), facteur de croissance basique des fibroblastes (bFGF), et souches (SCF). L'utilisation de ces méthodes optimisées pour l'identification PCG, l'isolement, et l'établissement de conditions de culture permet les cultures à long terme des cellules EG depuis plus de 40 jours. Les lignes de cellules embryonnaires germinales montré phénotype embryonnaire et l'expression des marqueurs utilisés commune de l'état pluripotent. L'isolement et la dérivation de cellules germinales dans la culture de fournir un outil pour comprendre leur développement in vitro et offrent la possibilité de surveiller les dommages cumulatifs aux niveaux génétiques et épigénétiques après l'exposition au stress oxydatif.
Protocole
Partie 1: Laparotomie souris enceintes
- Par dislocation cervicale, euthanasier une souris C57BL6J enceinte femelle à 10/05 au 11/05 DPC.
- Nettoyer l'abdomen avec un savon antimicrobien, et puis, il raser.
- Après le rasage, lavage de l'abdomen avec une solution saline.
- Ensuite, séchez l'abdomen avec une gaze stérile.
- Couvrir la souris avec un nouveau champ stérile.
- Faire une incision ventrale aide de pinces et de ciseaux de dissection.
- Identifier et éliminer tout l'utérus de la cavité abdominale. Embryons de souris sera visible à l'intérieur de l'utérus.
- Transfert de l'utérus dans une boîte de Pétri remplie de D-PBS, et le garder sur la glace.
- L'utilisation d'un scalpel stérile et pince, retirer le placenta et les tissus embryonnaires supplémentaires de chaque embryon.
- Transfert des embryons dans un plat frais de Pétri remplie de D-PBS.
- Mesurer la longueur de l'embryon de souris. Nous avons constaté que les tailles diffèrent en fonction de l'âge de l'embryon. Par exemple 8,5 dpc mesurée à une moyenne de 6 mm, 10,5 jpc mesurée à une moyenne de 11mm, et 12,5 jpc mesurée à une moyenne de 16 mm.
- Ensuite, retirer leurs queues pour l'extraction de l'ADN.
Partie 2: Dissection Ridge gonadique
Sous stéréomicroscope et Lumière de source Schott Fostec
- Placez un papier filtre dans une boîte de Pétri. Ensuite, placer l'embryon de souris au-dessus du papier filtre pour sécher l'embryon et immobiliser pour la dissection.
- L'utilisation d'un scalpel stérile, faire une coupe transversale de l'embryon de souris au-dessus de l'origine du cordon ombilical.
- Sous un microscope stéréoscopique, en utilisant une pince fine stérile et une aiguille stériles moqueries fines, enlever les intestins et le foie de sorte que le système urinaire est visible.
Les reins sont situés latéralement dans la cavité abdominale et la vessie se situe médiale et caudale par rapport aux reins. L'embryon peut être identifiée comme masculine, car les crêtes gonadiques sont situés de chaque côté de la vessie. Chez la femelle, les crêtes gonadiques sont fermement attachés à l'extrémité caudale latérale du rein. - Peler les crêtes génitales à en glissant une aiguille derrière elle. La crête gonadique est enlevé en coupant les tissus qui la soutiennent.
- Transférer les crêtes gonadiques d'un nouveau plat de Pétri remplie de fraîcheur D-PBS.
Au microscope, la crête gonadique masculine devrait être dépouillé, grandes et de forme ovale. En revanche, la crête gonadiques chez la femme doivent être repérés, ont forme allongée et plus petite en comparaison de la crête gonadique masculine.
Partie 3: Digestion Ridge gonadique
Sous stéréomicroscope:
- Dissection mésonéphros: Séparez les gonades à partir du mésonéphros et dorsale à l'aide d'une aiguille fine et pointue.
- Il est important de retirer le mésonéphros de la crête gonadique car c'est un tissu somatique qui va proliférer dans le processus de dérivation PGC.
- Digestion Ridge gonadiques: Recueillir potable crêtes gonadiques par une baisse des frais 0.5ul D-PBS. Ajouter 20 ml de collagénase / dispase solution (concentration finale à 1mg/ml).
- Les embryons doivent être traités individuellement. Chaque embryon doit avoir son propre plat à part et étiquetés de Pétri.
- Gonadique Ridge Mincing: Couper la crête gonadique en petits morceaux à l'aide d'une aiguille stérile et stérile pinces fines n ° 4.
- Incubation: boîtes de Pétri sont transférés à l'étuve à 37 ° C pendant 15 minutes.
- Le temps d'incubation peut varier entre les tissus.
- Pipetage: Après 15 minutes, le tissu peut être dissocié par pipetage. En utilisant des pipettes en verre tiré capillaire avec un diamètre compris entre 40 mm -100 Break up les morceaux par aspiration et refoulement. Ce sera sous forme de petites touffes. Transférer les touffes d'0.5ml d'une pré réchauffé D-PBS baisse pour un lavage final.
- Après lavage, transférer les touffes de tubes Eppendorf.
- Ne pas surexposer le tissu à la collagénase.
- Ne pas faire une suspension cellulaire unique. Ceci est important pour la formation de colonies. Si c'est une suspension cellulaire unique, PGC ont tendance à se différencier et migrer.
- Ce processus ne devrait pas être plus long que 20 minutes, ou vos cellules vont perdre leur viabilité.
- Centrifuger à 2000 rpm pendant 5 minutes à température ambiante.
- Après centrifugation, éliminer le surnageant et resuspendre le culot dans 0,5 ml de knock complétées par les médias (préchauffé à 37 ° C).
Partie 4: Primordial Culture Germinal Cellules
«Vous devriez effectuer les étapes suivantes rapidement pour préserver la viabilité des PGC pour l'isolement et la dérivation.
- 24 heures avant ce processus, vous devriez préparer un mitotiquement inactivé MEF-CF1 alimentation couche suivant le protocole de Zhang J. et al 2008.
- Préparer 20 plats pour un prégnant des femmes de la souris (6-8 embryons).
- FAE perdre la capacité d'être une couche nourricière (promouvoir la croissance et empêcher la différenciation) après 5-6 passages.
- Ne pas utiliser plus de 48 heures FAE.
- Immédiatement avant PGC plaquage, le milieu MEF doit être lentement retirée de la couche nourricière MEF.
- Ensuite, ajoutez 0,5 ml / puits de pré-chauffé moyennes KO complété sur la couche d'alimentation du MEF.
- MEF support contient sérum fœtal bovin qui induit la différenciation des PGC.
- Knockout moyennes doivent être complétées par des facteurs de croissance spécifiques specie immédiatement avant usage afin d'assurer l'activité du facteur de croissance.
- En utilisant la distribution symétrique, PGC plaque sur la couche d'alimentation du MEF.
- Si ces pièces sont trop proches, ils ont tendance à s'agréger et de faire des colonies denses qui s'attachent mal ou commencer différencier.
- Des boîtes de culture doivent être étiquetés avec le nom de lignée cellulaire embryonnaire Germinal, le nombre de passages, et la date.
- Soigneusement, le transfert des boîtes de culture dans un incubateur à 37 ° C et 5% de CO 2.
- Surveiller les cellules toutes les 24 heures.
- Après 48 heures, retirer 250 ml de milieux de la haute hiérarchie de la culture pour éviter de perturber l'attachement de la colonie. Ensuite, ajoutez 250 ml de frais complété knock-out des médias (préchauffé à 37 ° C).
- Après l'étape 7, attendre encore 48 heures, et ensuite, enlever complètement tous les médias et le remplacer par Fresh Media complétée knock-out (préchauffé à 37 ° C). Pour ce faire, deux tous les jours pendant 8-10 jours jusqu'à ce PGC forment des colonies.
Partie 5: cellules embryonnaires Germinal
- Après 10 jours d'isolement PGC, embryonnaires colonies cellule germinale sont formées.
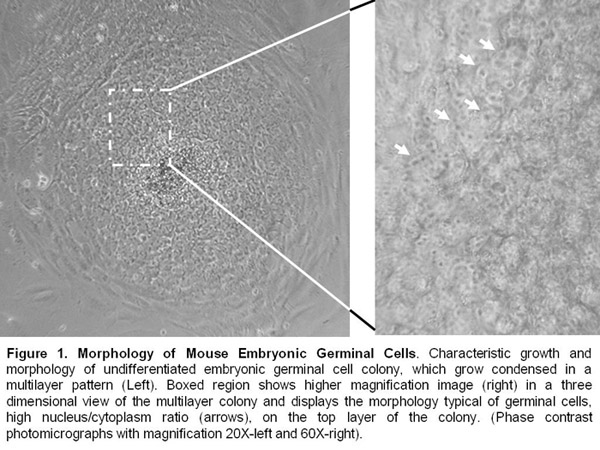
- Lignées cellulaires embryonnaires germinales sont maintenues en vie par des passages manuels tous les 8-10 jours. Ils continuent de présenter une morphologie indifférenciée et expriment des marqueurs tels que la pluripotence alkalyne phosphatase, Oct-4, SSEA-1, et SOX-2
Remarques
- Des conditions stériles / aseptique sont essentiels dans la salle de culture.
- Pour l'élaboration et à la culture, PGC sont traitées dans un cabinet Purificateur classe II de sécurité Bio.
- Les incubations sont dans un 37 humidifié ° C et 5% de CO 2 incubateur.
- Tous les médias et les réactifs sont filtrés avant utilisation dans un filtre de 0,2 um, conservés à 4 ° C, et pré-chauffé à 37 ° C avant utilisation.
- Pendant les étapes de la dissection, tous les embryons et les tissus doivent être conservés sur glace.
- Tous les flacons de réactifs sont décontaminés avec de l'éthanol avant de placer dans une armoire.
- Utilisez des gants, des blouses de laboratoire, une infirmière et casquettes sont obligatoires.
Conclusion
Nous avons fourni une vidéo qui vous montre comment isoler, dégager, et la culture des cellules embryonnaires germinales à partir de 10.05 à 11.05 crêtes gonadiques embryons de souris DPC. L'isolement et la culture reproductibles à long terme de lignées cellulaires embryonnaires germinales fournit un fondement essentiel pour l'étude du développement embryonnaire précoce, les modèles génétiques et épigénétiques germinales, la formation des gonades, les effets environnementaux des organes environnants pendant le processus de développement de la gamétogenèse chez les embryons mâles et femelles, et la détermination des voies qui mène au cancer et l'infertilité.
Déclarations de divulgation
Remerciements
Les auteurs tiennent à souligner l'aide inestimable de: Dr Neal First et Kourtney Wilkinson pour le manuscrit d'édition, le Dr Lucy Senter, le Dr Brigitte Willeford et Mike Basett de l'aide pour les soins de formation et d'animaux à l'installation MSU ALAC souris accrédités; Dr Dwayne Wise pour son aide à la microscopie et la capture d'image; Cesar Monroy, Hannah Swoope, et Bobbie Huddleston pour leur aide à la production vidéo à la MSU. Cette recherche a été financée par l'Office de la recherche institutionnelle et le Département des sciences biologiques à la Mississippi State University.
matériels
Pince n ° 14 et 15, 35 mm bistouri, des ciseaux de dissection, champs chirurgicaux, savon antiseptique, une solution saline à 0,9%, de la gaze, contenant en mousse de glace, lame de rasoir, scalpel 35 mm, une pince fine n ° 4 et 5, l'aiguille fine taquiner avec poignée, filtre à feuilles de papier, et a tiré des pipettes en verre.
Équipement: stéréomicroscope à dissection, source de lumière Schott Fostec, microscope inversé, micropipette 10 et 200ul, centrifugeuse, le Cabinet de sécurité biologique.
Références
- DeFelici, M. . Cell Biology: A laboratory Handbook. 1, 73-85 (1998).
- Donovan, P. J., De Miguel, M. P. Turning Germ Cells into Stem Cells. Current Opinion in Genetics and Development. 13, 463-471 (2003).
- Labosky, P. A., Hogan, B. L. M., Sharp, P. T., Mason, I. Part 12: Mouse Primordial Germ Cells: isolation and in vitro culture. Molecular embryology: methods and protocols. 97, (1999).
- Mc Laren, A., Southee, D. Entry of Mouse Embryonic Germ Cells into Meiosis. Developmental Biology. 187, 107-113 (1997).
- Yoshimizu, T., Obinata, M., Matsui, Y. Stage-specific tissue and cell interactions play key roles in mouse germ cell specification. Development. 128, 481-490 (2001).
- Zhang, J., Hhvorostov, I., Teitell, M. From MEFs to Matrigel I: Passaging hESCs in the Presence of MEFs. J Vis Exp. , (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon