È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'isolamento e la derivazione di cellule embrionali del mouse Germinal
In questo articolo
Riepilogo
La capacità di cellule germinali embrionali di differenziarsi in cellule germinali primordiali durante le prime fasi di sviluppo è un modello perfetto per affrontare la nostra ipotesi sul cancro e la sterilità. Questo protocollo mostra come isolare le cellule germinali primordiali di gonadi in via di sviluppo 10,5-11,5 embrioni giorni post coitum mouse.
Abstract
La capacità di cellule embrionali germinali (EG) a differenziarsi in cellule germinali primordiali (PGC) e più tardi in gameti durante le prime fasi di sviluppo è un modello perfetto per affrontare la nostra ipotesi sul cancro e la sterilità. Questo protocollo mostra come isolare le cellule germinali primordiali di gonadi in via di sviluppo 10,5-11,5 giorni post coitum (DPC), embrioni di topo. Lo sviluppo di creste delle gonadi da embrioni di topo (C57BL6J) erano dissociate dalla rottura meccanica con collagenasi, poi placcato in uno strato di fibroblasti di topo alimentatore embrione (MEF-CF1) che precedentemente era mitoticamente inattivati con mitomicina C in presenza di mezzi di comunicazione ad eliminazione diretta e integrata con Inibitore leucemia Factor (LIF), fondamentale fattore di crescita dei fibroblasti (bFGF), e Stem Cell Factor (SCF). L'utilizzo di questi metodi di ottimizzazione per l'identificazione PCG, l'isolamento, e la creazione di condizioni di coltura permette di culture a lungo termine delle cellule EG per più di 40 giorni. Le linee sulle cellule germinali hanno mostrato fenotipo embrionale ed espressione di marcatori comuni usati dello stato pluripotente. L'isolamento e la derivazione di cellule germinali in coltura fornire uno strumento per comprendere il loro sviluppo in vitro e offrono la possibilità di monitorare i danni cumulativi a livelli genetici ed epigenetici dopo l'esposizione allo stress ossidativo.
Protocollo
Parte 1: Laparotomia mouse in gravidanza
- Utilizzando dislocazione cervicale, l'eutanasia un topo gravide C57BL6J femminile a 10,5-11,5 dpc.
- Pulire l'addome con sapone antimicrobico, e poi, radersi.
- Dopo la rasatura, lavare l'addome con una soluzione salina.
- Poi, a secco l'addome con una garza sterile.
- Coprire il mouse con un nuovo campo sterile.
- Effettuare una incisione ventrale con pinze e forbici dissezione.
- Identificare e rimuovere l'utero intero dalla cavità addominale. Embrioni di topo saranno visibili all'interno dell'utero.
- Trasferire l'utero in una scatola Petri riempite con D-PBS, e tenerlo in ghiaccio.
- Usando un bisturi sterile e pinzette, rimuovere la placenta ed extra tessuti embrionali di ogni embrione.
- Trasferire gli embrioni in un piatto fresco Petri riempite con D-PBS.
- Misurare la lunghezza della embrioni di topo. Abbiamo scoperto che le dimensioni differiscono in base all'età dell'embrione. Per esempio 8,5 dpc misurata a una media di 6 millimetri, 10.5 dpc misurata a una media di 11mm, e 12,5 dpc misurato ad una media di 16 mm.
- Quindi, rimuovere la coda per l'estrazione del DNA.
Parte 2: dissezione Ridge gonadica
Sotto stereomicroscopio e Sorgente Schott Fostec
- Inserire una carta da filtro in una capsula di Petri. Poi, posto l'embrione del mouse sulla parte superiore del filtro di carta per asciugare l'embrione e immobilizzare per la dissezione.
- Usando un bisturi sterile, praticare un taglio trasversale dell'embrione mouse sopra l'origine del cordone ombelicale.
- Sotto uno stereomicroscopio, utilizzando una pinza sottile sterile e un ago sterile presa in giro fine, rimuovere l'intestino ed il fegato in modo che il sistema urinario è visibile.
I reni sono situati lateralmente nella cavità addominale, e la vescica si trova mediale e caudale rispetto ai reni. L'embrione può essere identificato come maschio, perché le creste delle gonadi sono situate su entrambi i lati della vescica. Nella femmina, le creste delle gonadi sono saldamente attaccati alla fine caudale laterale dei reni. - Sbucciate la cresta gonadica fuori facendo scorrere un ago dietro. La cresta gonadica viene rimosso tagliando via i tessuti che lo supportano.
- Trasferire le creste delle gonadi di un nuovo piatto di Petri riempite con nuove D-PBS.
Microscopicamente, la cresta delle gonadi maschili dovrebbero essere spogliati, di grandi dimensioni e di forma ovale. Al contrario, la cresta delle gonadi femminili devono essere individuati, hanno forma allungata ed essere più piccole rispetto alla cresta delle gonadi maschili.
Parte 3: Digestione Ridge gonadica
Sotto stereomicroscopio:
- Mesonefro Dissection: Separare i gonade dal mesonefro e la cresta con un ago sottile e tagliente.
- E 'importante rimuovere il mesonefro dalla cresta gonadica, perché è un tessuto somatico che invadere nel processo di derivazione PGC.
- Digestione Ridge gonadica: Raccogliere pulito creste gonadico in una goccia di fresca 0.5ul D-PBS. Aggiungere 20 ml di Collagenasi / dispasi soluzione (concentrazione finale a 1mg/ml).
- Gli embrioni devono essere trattati singolarmente. Ogni embrione deve avere il proprio piatto a parte ed etichettato Petri.
- Gonadica Ridge tritare: Tagliare la cresta gonadica in piccoli pezzi con un ago sterile e sterile una pinza sottile No. 4.
- Incubazione: piastre di Petri sono trasferiti in un incubatore a 37 ° C per 15 minuti.
- Il tempo di incubazione può variare tra i tessuti.
- Pipettaggio: Dopo 15 minuti, il tessuto può essere dissociato da pipettaggio. Con pipette in vetro tirato capillari con diametri tra 40 mm -100 Rompere i pezzi pipettando su e giù. Questo formerà grumi di piccole dimensioni. Trasferire le macchie di 0,5 ml di un pre riscaldato D-PBS goccia per un lavaggio finale.
- Dopo il lavaggio, trasferire i grumi di tubi eppendorf.
- Non più di esporre il tessuto di collagenasi.
- Non fare una sospensione singola cellula. Questo è importante per la formazione di colonie. Se si tratta di una sospensione di cellule singole, PGC tendono a differenziare e migrazione.
- Questo processo non dovrebbe essere più di 20 minuti, o le cellule perdono vitalità.
- Centrifugare a 2000 rpm per 5 minuti a temperatura ambiente.
- Dopo centrifugazione, rimuovere il supernatante e risospendere il pellet in 0,5 ml di bussare integrato fuori media (pre-riscaldata a 37 ° C).
Parte 4: Primordiale Cultura Germinal Cellule
"È necessario effettuare i seguenti passi in fretta per conservare la vitalità di PGC per l'isolamento e la derivazione.
- 24 ore prima di questo processo si dovrebbe preparare un mitoticamente inattivato MEF-CF1 alimentatore strato seguendo il protocollo di J. Zhang et al 2008.
- Preparare 20 piatti per uno pregnant femminile del mouse (6-8 embrioni).
- MEF perdono la capacità di essere uno strato alimentatore (promuovere la crescita e prevenire differenziazione) dopo 5-6 passaggi.
- Non utilizzare più di 48 ore MEF.
- Immediatamente prima PGC placcatura, il mezzo MEF deve essere lentamente dallo strato alimentatore MEF.
- Quindi, aggiungere 0,5 ml / pozzetto di pre-riscaldato medio knockout integrata sullo strato alimentatore MEF.
- MEF supporto contiene siero fetale bovino, che induce la differenziazione di PGC.
- Medio knockout deve essere integrato con specifici fattori di crescita specie immediatamente prima dell'uso per assicurare l'attività del fattore di crescita.
- Utilizzando distribuzione simmetrica, PGC piatto sopra lo strato alimentatore MEF.
- Se questi pezzi sono troppo vicini, tendono ad aggregarsi e fare dense colonie che si attaccano male o iniziare differenziazione.
- Piatti di cultura devono essere etichettati con nome embrionali Germinal linea cellulare, il numero di passaggio, e la data.
- Cura, il trasferimento i piatti della cultura in un incubatore a 37 ° C e 5% di CO 2.
- Monitorare le cellule ogni 24 ore.
- Dopo 48 ore, togliere 250 ml di mezzi di comunicazione dalla cima della cultura per non disturbare l'attaccamento della colonia. Quindi, aggiungere 250 ml di fresca integrato knock-out dei media (pre-riscaldato a 37 ° C).
- Dopo il punto 7, attendere altre 48 ore, e poi, rimuovere completamente tutti i media e sostituirlo con fresca dei media integrato knock-out (pre-riscaldato a 37 ° C). Fate questo ogni 2 giorni per 8-10 giorni fino a formare PGC colonie.
Parte 5: cellule germinali embrionali
- Dopo 10 giorni di isolamento PGC, colonie cellula germinale embrionale si formano.
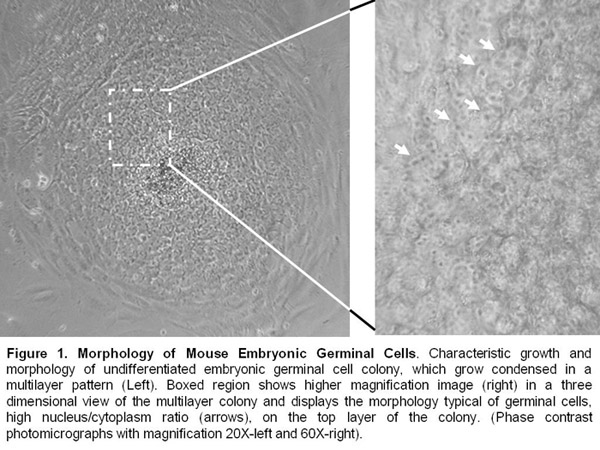
- Linee di cellule embrionali germinali sono tenuti in vita da passaggi manuali ogni 8-10 giorni. Essi continuano a presentare una morfologia indifferenziata ed esprimere marcatori pluripotenza come alcalino fosfatasi, Oct-4, SSE-1, e SOX-2
Note
- Condizioni di sterilità / asettiche sono essenziali nella sala della cultura.
- Per la derivazione e la cultura, PGC sono trattati in classe di sicurezza II purificatore Cabinet Bio.
- Incubazioni sono in un umidificata 37 ° C e 5% CO 2 incubatore.
- Tutti i media ei reagenti vengono filtrati prima di utilizzare in un filtro di 0,2 um, conservato a 4 ° C, e pre-riscaldato a 37 ° C prima dell'uso.
- Durante le fasi di dissezione, tutti gli embrioni e tessuti deve essere tenuta in ghiaccio.
- Tutti i flaconi dei reagenti sono decontaminati con etanolo prima di mettere in un armadio.
- Uso di guanti, camice da laboratorio, e tappi infermiere sono obbligatori.
Conclusione
Abbiamo fornito un video che mostra come isolare, derivano, e la cultura cellule embrionali germinali da creste delle gonadi di embrioni di topo 10,5-11,5 dpc. L'isolamento riproducibile e la cultura a lungo termine di linee di cellule embrionali germinali fornisce una base fondamentale per lo studio dello sviluppo embrionale precoce, i modelli germinali genetiche ed epigenetiche, la formazione delle gonadi, gli effetti ambientali di organi circostanti durante il processo di sviluppo della gametogenesi negli embrioni maschili e femminili, e la determinazione di percorsi che porta al cancro e la sterilità.
Divulgazioni
Riconoscimenti
Gli autori desiderano ringraziare per la preziosa collaborazione di: Dott. Neal First e Kourtney Wilkinson per il manoscritto di editing; Dr. Lucy Senter, il Dr. Brigit Willeford e Mike Basett per l'assistenza con cura la formazione e animali presso la struttura del mouse ALAC MSU accreditati; Dr. Dwayne Wise per la sua assistenza con la microscopia e la cattura dell'immagine; Cesar Monroy, Hannah Swoope, e Bobbie Huddleston per la loro assistenza con la produzione video a MSU. Questa ricerca è stata finanziata dall'Ufficio di ricerca istituzionale e il Dipartimento di Scienze Biologiche presso Mississippi State University.
Materiali
Pinze n. 14 e 15, bisturi 35 mm, forbici dissezione, campi chirurgici, sapone antisettico, soluzione salina 0,9%, garza, schiuma contenitore di ghiaccio, lama di rasoio, bisturi 35 mm, pinza sottile n ° 4 e 5, con ago sottile presa in giro con maniglia, filtro fogli di carta, e tirò pipette di vetro.
Equipaggiamento: stereomicroscopio da dissezione, sorgente luminosa Schott Fostec, microscopio invertito, micropipetta 10 e 200ul, centrifuga, cappa di sicurezza biologica.
Riferimenti
- DeFelici, M. . Cell Biology: A laboratory Handbook. 1, 73-85 (1998).
- Donovan, P. J., De Miguel, M. P. Turning Germ Cells into Stem Cells. Current Opinion in Genetics and Development. 13, 463-471 (2003).
- Labosky, P. A., Hogan, B. L. M., Sharp, P. T., Mason, I. Part 12: Mouse Primordial Germ Cells: isolation and in vitro culture. Molecular embryology: methods and protocols. 97, (1999).
- Mc Laren, A., Southee, D. Entry of Mouse Embryonic Germ Cells into Meiosis. Developmental Biology. 187, 107-113 (1997).
- Yoshimizu, T., Obinata, M., Matsui, Y. Stage-specific tissue and cell interactions play key roles in mouse germ cell specification. Development. 128, 481-490 (2001).
- Zhang, J., Hhvorostov, I., Teitell, M. From MEFs to Matrigel I: Passaging hESCs in the Presence of MEFs. J Vis Exp. , (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon