Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolation und Ableitung von embryonalen Maus-Keimzellen
In diesem Artikel
Zusammenfassung
Die Fähigkeit von embryonalen Keimzellen in primordialen Keimzellen während der frühen Entwicklungsstadien zu unterscheiden, ist eine perfekte Modell, um unsere Hypothese über Krebs und Unfruchtbarkeit Adresse. Dieses Protokoll zeigt, wie Ur-Keimzellen aus Entwicklungsländern Gonaden in 10,5-11,5 Tage nach coitum Maus-Embryonen zu isolieren.
Zusammenfassung
Die Fähigkeit von embryonalen Keimzellen (EG) in primordialen Keimzellen (PGC) und später in Keimzellen während der frühen Entwicklungsstadien zu unterscheiden, ist eine perfekte Modell, um unsere Hypothese über Krebs und Unfruchtbarkeit Adresse. Dieses Protokoll zeigt, wie Ur-Keimzellen aus Entwicklungsländern Gonaden in 10,5-11,5 Tage nach coitum (DPC) Maus-Embryonen zu isolieren. Die Entwicklung der Gonaden Kämme aus Maus-Embryonen (C57BL6J) wurden durch mechanische Störungen mit Kollagenase, dann in einem Maus-Embryo-Fibroblasten-Feeder-Schicht (MEF-CF1), die zuvor mitotisch mit Mitomycin C wurde in Anwesenheit von Knockout-Medien inaktiviert und ergänzt mit Leukämie Inhibitor vernickelt dissoziiert Factor (LIF), basischen Fibroblasten-Wachstumsfaktor (bFGF) und Stem Cell Factor (SCF). Mit diesen optimierten Methoden für PCG Identifikation, Isolierung und Etablierung der Kulturbedingungen ermöglicht langfristig Kulturen von EG-Zellen für mehr als 40 Tage. Die embryonalen Keimzelle Linien zeigten embryonalen Phänotyp und die Expression von häufig verwendeten Marker der pluripotenten Zustand. Isolation und Ableitung von Keimzellen in der Kultur ein Instrument, um ihre Entwicklung in vitro zu verstehen und bieten die Möglichkeit, kumulative Schäden an genetischen und epigenetischen zu überwachen nach der Exposition gegenüber oxidativem Stress.
Protokoll
Teil 1: Schwangere Maus Laparotomie
- Mit Genickbruch, euthanize eine schwangere C57BL6J weiblichen Maus bei 10,5-11,5 dpc.
- Reinigen Sie den Bauch mit antimikrobieller Seife, und dann rasieren sie.
- Nach der Rasur, waschen den Bauch mit einer Kochsalzlösung.
- Dann trocknen die Bauchhöhle mit einer sterilen Gaze.
- Decken Sie die Maus mit einem neuen sterilen Bereich.
- Machen Sie eine ventrale Inzision mit einer Pinzette und Schere Dissektion.
- Und entfernen Sie die gesamte Gebärmutter aus der Bauchhöhle. Maus-Embryonen wird sichtbar in der Gebärmutter.
- Übertragen Sie die Gebärmutter in eine Petrischale mit D-PBS gefüllt, und bewahren Sie sie auf Eis.
- Mit einem sterilen Skalpell und Pinzette, entfernen Sie die Plazenta und zusätzliche embryonale Gewebe eines jeden Embryos.
- Transfer-Embryonen in eine frische Petrischale mit D-PBS gefüllt.
- Messen Sie die Länge der Maus-Embryonen. Wir fanden, dass die Größen nach dem Embryo das Alter unterschieden. Beispielsweise 8,5 DPC bei einem Durchschnitt von 6 mm gemessen, gemessen 10,5 dpc bei einem Durchschnitt von 11mm und 12,5 dpc bei einem Durchschnitt von 16 mm gemessen.
- Dann entfernen Sie ihre Schwänze zur DNA-Extraktion.
Teil 2: Gonadenmissbildungen Ridge Dissection
Unter Stereomikroskop und Lichtquelle Schott Fostec
- Legen Sie ein Filterpapier in einer Petrischale. Legen Sie dann die Maus-Embryo auf dem Filterpapier in den Embryo trocken und unbeweglich für die Präparation.
- Mit einem sterilen Skalpell, einen Schnitt quer durch die Maus-Embryo über den Ursprung der Nabelschnur.
- Unter einem Stereomikroskop, mit einer sterilen feinen Pinzette und einer sterilen feinen Hänseleien Nadel, entfernen Sie den Darm und Leber, so dass die Harnwege sichtbar ist.
Die Nieren sind seitlich in der Bauchhöhle befindet, und die Blase befindet sich medial und kaudal im Vergleich zu den Nieren. Der Embryo kann als männlich identifiziert werden, da die Gonaden Rippen auf beiden Seiten der Blase befinden. In der weiblichen, sind die Gonaden Grate fest an der Schwanzflosse seitlichen Ende der Nieren angebracht. - Schälen Sie die Gonaden Grat aus, indem Sie eine Nadel dahinter. Die Gonaden Grat ist durch Wegschneiden der Gewebe, die es unterstützen entfernt.
- Übertragen Sie die Gonaden Grate, um eine neue Petrischale mit frischem D-PBS gefüllt.
Mikroskopisch, sollte die männlichen Keimdrüsen Grat werden abgestreift, groß und oval. Im Gegensatz dazu die weiblichen Keimdrüsen Grat gesichtet werden sollte, haben längliche Form und kleiner im Vergleich zu den männlichen Keimdrüsen Kamm.
Teil 3: Gonadenmissbildungen Ridge Verdauung
Unter Stereomikroskop:
- Mesonephros Dissection: Trennen Sie die Gonade aus dem Mesonephros und Rücken mit einem feinen und spitzen Nadel.
- Es ist wichtig, die Urniere aus der Gonaden Grat zu entfernen, weil es sich um eine somatische Gewebe, das in der PGC Ableitung Prozess überwuchern Wille ist.
- Gonaden Ridge Verdauung: Collect sauber Gonaden Bergrücken in einer 0.5ul Tropfen frischen D-PBS. 20 ml Collagenase / Dispase-Lösung (Endkonzentration an 1mg/ml).
- Embryonen sollten einzeln bearbeitet werden. Jeder Embryo sollte über eine eigene getrennte und beschriftet Petrischale.
- Gonaden Ridge Mincing: Schneiden Sie die Gonaden Grat in kleine Stücke mit einer sterilen Nadel und sterilen feinen Pinzette Nr. 4.
- Inkubation: Petrischalen werden in einen Inkubator bei 37 übertragen ° C für 15 Minuten.
- Die Inkubationszeit kann zwischen Geweben variieren.
- Pipettieren: Nach 15 Minuten kann das Gewebe werden durch Pipettieren dissoziiert. Mit gezapftes Kapillarpipetten mit Durchmessern zwischen 40 -100 mm Break up die Stücke durch Auf-und Abpipettieren. Dies bildet kleine Klumpen. Übertragen Sie die Klumpen zu 0,5 ml einer vorher erwärmt D-PBS Drop für eine endgültige waschen.
- Nach dem Waschen, übertragen Sie die Klumpen auf Eppendorf-Röhrchen.
- Nicht zu entlarven das Gewebe Kollagenase.
- Machen Sie nicht einen einzigen Zellsuspension. Dies ist für die Kolonie-Bildung wichtig. Wenn es eine einzige Zellsuspension wird, neigen PGCs zu differenzieren und zu migrieren.
- Dieser Vorgang sollte nicht länger als 20 Minuten, oder Ihre Zellen Lebensfähigkeit verlieren.
- Zentrifugation bei 2000 rpm für 5 Minuten bei Raumtemperatur.
- Nach der Zentrifugation den Überstand und das Pellet in 0,5 ml ergänzt knock out Medien (bei 37 ° C vorgewärmt).
Teil 4: Primordial Keimzellen Kultur
"Sie sollten die nächsten Schritte rasch durchzuführen, um die Lebensfähigkeit der PGCs für die Isolierung und die Ableitung zu erhalten.
- 24 Stunden vor diesem Prozess sollten Sie bereiten mitotisch inaktivierten MEF-CF1 Feeder-Schicht nach dem Protokoll von Zhang J. et al 2008.
- Es werden 20 Gerichte für eine pregnant weiblichen Maus (6-8 Embryonen).
- MEFs verlieren die Fähigkeit, eine Feeder-Schicht werden (Förderung von Wachstum und Differenzierung zu verhindern) nach 5-6 Passagen.
- Verwenden Sie keine MEFs älter als 48 Stunden.
- Unmittelbar vor dem Ausplattieren PGCs, muss der MEF Medium langsam aus dem MEF Feeder-Schicht entfernt werden.
- Dann fügen Sie 0,5 ml / well vorgewärmtes ergänzt Knockout Mediums auf die MEF Feeder-Schicht.
- MEF Medium enthält Rinderfötenserum dass eine Differenzierung der PGCs induziert.
- Knockout Medium muss mit specie spezifischen Wachstumsfaktoren ergänzt werden unmittelbar vor Gebrauch, um die Aktivität der wachsen-Faktor sorgen.
- Mit symmetrische Verteilung, Platte PGCs über die MEF Feeder-Schicht.
- Wenn diese Stücke zu nahe sind, neigen sie zu aggregieren und bilden dichte Kolonien, die schlecht anbringen oder beginnen differenzieren.
- Kulturschalen muss mit embryonalen Germinal Zelllinie Namen, Durchgang Nummer und Datum beschriftet werden.
- Vorsichtig, überweisen Sie den Kulturschalen in einem Brutschrank bei 37 ° C und 5% CO 2.
- Überwachen Sie die Zellen alle 24 Stunden.
- Nach 48 Stunden zu entfernen 250 ml von Medien aus der Spitze der Kultur nicht zu stören der Kolonie Anhang. Dann fügen Sie 250 ml frischem ergänzt Knock-out-Medien (bei 37 ° C vorgewärmt).
- Nach Schritt 7, warten weitere 48 Stunden, und dann vollständig zu entfernen alle Medien und ersetzen Sie es mit frischen ergänzt Knock-out-Medien (bei 37 ° C vorgewärmt). Tun Sie dies alle 2 Tage für 8-10 Tage, bis PGC Kolonien zu bilden.
Teil 5: Embryonale Keimzellen
- Nach 10 Tagen PGC Isolation, sind embryonale Keimzelle Kolonien gebildet.
- Embryonale Keimzelle Linien sind am Leben gehalten durch manuelle Passagen alle 8-10 Tage. Sie fahren fort, eine undifferenzierte Morphologie präsentieren und ausdrücken Pluripotenz Marker wie alkalyne Phosphatase, Oct-4, SSEA-1 und SOX-2
Hinweise
- Sterile / aseptischen Bedingungen sind unerlässlich in der Kultur Raum.
- Für die Ableitung und Kultur, sind PGCs in einem Luftreiniger Class II Bio Sicherheit Kabinett verarbeitet.
- Inkubationen werden in einem befeuchteten 37 ° C und 5% CO 2-Inkubator.
- Alle Medien und Reagenzien sind vor in einer 0,2 um Filter, Lagerung bei 4 ° C verwenden, filtriert und bei 37 vorgewärmten ° C vor dem Gebrauch.
- Während der Dissektion Schritte müssen alle Embryonen und Gewebe auf Eis gehalten werden.
- Alle Reagenzien Flaschen werden mit Ethanol, bevor sie in einem Schrank dekontaminiert.
- Verwendung von Handschuhen, Kittel und Krankenschwester caps sind Pflichtfelder.
Abschluss
Wir haben ein Video, das Ihnen zeigt, wie zu isolieren, zu leiten und Kultur embryonalen Keimzellen von Gonaden Grate 10,5-11,5 dpc Maus-Embryonen zur Verfügung gestellt. Die reproduzierbare Isolierung und langfristig Kultur der embryonalen Keimzelle Linien bietet eine entscheidende Grundlage für das Studium der frühen Embryonalentwicklung, genetischen und epigenetischen germinal Muster, Gonade Bildung, Umwelt-Auswirkungen der umliegenden Organe während des Entwicklungsprozesses der Gametogenese in der männlichen und weiblichen Embryonen, und Bestimmung der Wege, die zu Krebs und Unfruchtbarkeit führt.
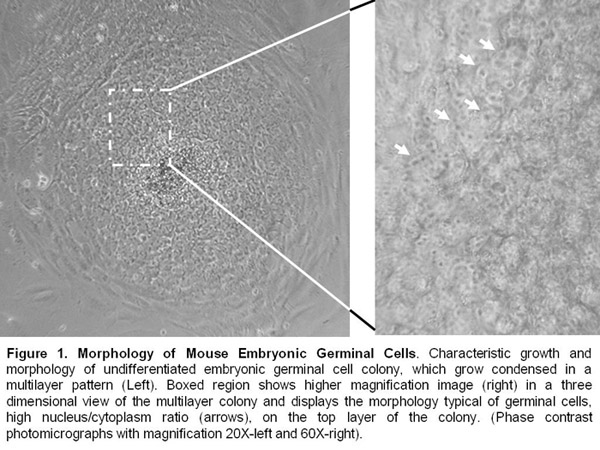
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Die Autoren möchten die unschätzbare Hilfe zu bestätigen: Dr. Neal First und Kourtney Wilkinson für Manuskript-Bearbeitung; Dr. Lucy Senter, Dr. Brigit Willeford und Mike Basett für die Unterstützung bei Ausbildung und Pflege der Tiere an der MSU ALAC akkreditierten Maus-Anlage, Dr. Dwayne Wise für seine Unterstützung bei der Mikroskopie und Bilderfassung; Cesar Monroy, Hannah Swoope und Bobbie Huddleston für ihre Unterstützung mit Video-Produktion an der MSU. Diese Arbeit wurde vom Office of Institutional Research und dem Department of Biological Sciences an der Mississippi State University gefördert.
Access restricted. Please log in or start a trial to view this content.
Materialien
Zange Nr. 14 und 15, Skalpell 35 mm, Dissektion Scheren, chirurgischen Bereichen, antimikrobielle Seife, Kochsalzlösung 0,9%, Gaze, Eis-Schaum-Behälter, Rasierklinge, Skalpell 35 mm, feinen Pinzette Nr. 4 und 5, feine Hänseleien Nadel mit Griff-, Filter-Papierbögen, und zog Glaspipetten.
Equipment: Sezieren Stereomikroskop Lichtquelle Schott Fostec, inverse Mikroskop Mikropipette 10 und 200 &mgr; l, Zentrifuge, bio Sicherheit Kabinett.
Referenzen
- DeFelici, M. Cell Biology: A laboratory Handbook. 1, Second Edition, 73-85 (1998).
- Donovan, P. J., De Miguel, M. P. Turning Germ Cells into Stem Cells. Current Opinion in Genetics and Development. 13, 463-471 (2003).
- Labosky, P. A., Hogan, B. L. M. Part 12: Mouse Primordial Germ Cells: isolation and in vitro culture. Molecular embryology: methods and protocols. Sharp, P. T., Mason, I. 97, Humana Press. Totowa, NJ. (1999).
- Mc Laren, A., Southee, D. Entry of Mouse Embryonic Germ Cells into Meiosis. Developmental Biology. 187, 107-113 (1997).
- Yoshimizu, T., Obinata, M., Matsui, Y. Stage-specific tissue and cell interactions play key roles in mouse germ cell specification. Development. 128, 481-490 (2001).
- Zhang, J., Hhvorostov, I., Teitell, M. From MEFs to Matrigel I: Passaging hESCs in the Presence of MEFs. J Vis Exp. , (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten