Method Article
細胞溶解物からの多タンパク質複合体の解析のための青いネイティブポリアクリルアミドゲル電気泳動(BN - PAGE)
要約
このビデオでは、我々は青いネイティブポリアクリルアミドゲル電気泳動(BN - PAGE)により、多タンパク質複合体(MPCは)の特性について説明します。最初の次元では、透析の細胞溶解物を、個々のMPCを識別するために、BN - PAGEによって分離される。二次元目SDS - PAGEにおいては、関心のMPCは、さらに免疫ブロッティングにより、その成分を分析するために細分化されています。
要約
ほとんどのタンパク質が他のタンパク質と機能的または規制上の複合体(サリ、Glaeser ら、2003)で見つけることができるので、多タンパク質複合体(MPCは)、細胞シグナル伝達において重要な役割を果たしている。従って、タンパク質 - タンパク質相互作用ネットワークの研究は、タンパク質の機能や制御の統合的な理解を得るためのMPCの詳細な特性評価が必要になります。識別と分析のために、MPCは、ネイティブ条件下で区切る必要があります。このビデオでは、我々は青いネイティブポリアクリルアミドゲル電気泳動(BN - PAGE)でのMPCの分析について説明します。 BN - PAGE、ゲル濾過やショ糖密度遠心分離によって提供されるよりも高い解像度で本来のコンフォメーションでのMPCの分離を可能にする技術であり、そしてMPCのサイズ、組成、および相対量(SchäggerとフォンJagow 1991)を決定するために有用です。 ;(Schägger、クラマーら1994。)。この方法によって、タンパク質は、ポリアクリルアミドのマトリックスで、その流体力学的サイズと形状に応じて分離されています。ここで、我々は、ライセート透析は、BN - PAGEこれらの生物学的試料に適用するために重要なステップであることを指摘し、全細胞溶解液ののMPCの分析を示しています。最初の次元BN -および二次元目SDS - PAGEの組み合わせを使用して、我々は、BN - PAGEによって分離MPCは、さらにSDS - PAGEによって彼らの個々の成分に分割することができることを示している。ゲルの分離時にMPCのコンポーネントの可視化は、標準的な免疫ブロッティングにより実行されます。 BN - PAGEによるMPCの解析の例として、我々は十分に特徴付け真核生物の19S、20S、および26Sプロテアソームを選んだ。
プロトコル
多タンパク質複合体の同定と解析のためのブルーネイティブポリアクリルアミドゲル電気泳動(BN - PAGE):**このビデオプロトコルは、関連する出版物1に基づいています 。 Mahimaスワミー、ガブリエルM. Siegers、スサーナMinguet、ベルントWollscheid、とウォルフガングWA Schamel。科学のSTKE 2006(345):PL2年7月25、2006、[DOI:10.1126/stke.3892006pl4]。 この文書を見るにはここをクリックしてください 。
1。透析細胞ライセートの調製
- 4℃で5分間350グラムで、遠心分離により収穫10 × 10 6個の細胞とペレット℃の
- 氷冷PBS(レシピ1)、ステップ1.1のように遠心分離機1mLで細胞ペレット3回洗浄する。
- 再懸濁し、氷冷BN -溶解バッファー(レシピ2)の250μLのペレットとは、15分間氷上でインキュベートする。
- 4時15分° C不溶性物質を除去するため、13,000 gで遠心。
- パスツールピペットの加熱された大径側を使用して、1.5 mlのマイクロチューブのキャップに穴を溶融し、4℃に冷却するためにチューブを氷上に置く
- キャップの穴とチルドチューブにステップ1.4から上清を移す。
- 近くにオープンしたチューブの上部に、キャップ上にピンセットで透析膜(10 kDの分子量カットオフ)を配置、および突出過剰透析膜を切り取ります。
- パラフィルムで慎重に側にキャップをしっかり閉めます。
- チューブを逆さにして4℃で10秒のための細胞培養の遠心機で50 - mLコニカルチューブに可能な限り最低の速度で逆さま遠心℃をチューブ右側を上げて避けるために、ピンセットを用いて遠心から反転チューブを取り外します。
- コールドBN -透析バッファー(レシピ3)と撹拌プレートで100 mLのビーカーを用意します。 100μLのサンプルあたりBN -透析緩衝液の少なくとも10 mLを使用してください。
- 貼付逆さまのビーカー内のテープとチューブ、そして曲げたパスツールピペットを用いてキャップの下の穴から気泡を取り除く。
- 場所の磁石のスターラーの上にビーカー、スターラーのスイッチと寒い部屋で6時間または一晩放置する。攪拌は、透析膜に気泡を作成されていないことを保証するために時々確認してください。
- 新しい冷却したマイクロ遠心チューブ中で透析細胞ライセートを収集する。
2。 BN -ゲルを注ぐ
- 注ぐ勾配ゲルは、勾配のミキサーを用いて室温で行われる。ポリアクリルアミドが非常に神経毒性であるので、手袋を着用する必要があります。 SDSとの接触を避ける。
- 攪拌プレート上に勾配のミキサーを配置し、フレキシブルチューブの部分に取り付けます。バルブを使用してチャネルを閉じ、クランプでチューブを閉じます。チューブに接続されて"ハイ"シリンダーの中にマグネチックスターラー15%を置きます。
- peristaliticポンプにフレキシブルチューブを通し、その端にシリンジの針を取り付けます。その後、ゲル装置の2枚のガラス板との間に針を置く。
- 4%(レシピ5)及び15%(レシピ6)、ゲルソリューションを分離するAPSを追加し、使用直前にTEMEDを準備します。組み合わせたボリュームは、分離ゲルの体積に等しいはずです。
- 勾配のミキサー("低"に4%、"高い"シリンダーに15%)の対応するシリンダー内にこれらのゲル溶液を注ぐ。
- バルブを開いて、親指で左のシリンダーを介して押して、2つのゲルリザーバーを接続し、チャネル内の空気の泡を強制的に。
- マグネチックスターラーのスイッチを、クランプを取り外し、1分あたり5 mlにperistaliticポンプに切り替える。ゲルがゆっくりとガラス板の間に流れるようになります。針が液体の上に常にであることを確認してください。
- すべての液体がゲル装置を入力することができますし、イソプロパノールで軽く重ねます。ゲルは室温で少なくとも30分間重合することができます。
- のdH 2 O(洗剤を使用しない)とすぐに注ぐ装置を清掃してください。
- イソプロパノールを除去する、のdH 2 Oで洗浄し、ワットマン濾紙でのdH 2 Oを削除する。
- 、3.2%スタッキングゲル(レシピ7)準備APSを追加し、使用直前にTEMED。
- 分離ゲルの上にスタッキングゲルを注ぎ、泡を避け、ガラスプレートの間に櫛をご紹介。スタッキングゲルが重合した後、4℃でゲルをクールダウン
- すぐにサンプルをロードする前に、ゲルの平面への角度でそれを引き出して、ゆっくりとコームを抜き取る。これは、井戸の品質を向上させる急速にポケットを、入力する空気が可能です。
3。 BN - PAGEによる透析細胞溶解液の分離
- 4で乾燥した井戸で透析ライセート1〜40μLとマーカーミックス10〜20μlの(レシピ10)を読み込む℃に冷陰極バッファー(レシピ8)を各ウェルにサンプルを重ねます。
- 冷たい猫と内側のチャンバーを埋めるコールド陽極バッファ付きHODEバッファと下側/外側のチャンバー(レシピ9)。
- サンプルが分離ゲルを入力するまで、ミニゲルまたは大ゲルに150Vに100 Vを適用します。 4でゲルを実行℃に
- 180 V(ミニゲル)または400 V(大ゲル)に電圧を増加し、色素フロントがゲルの端に達するまで実行する。ランは、大型ゲル用ミニ、および18〜24時間3〜4時間かかります。
4。二次元目SDS - PAGE
- 最初の次元BN - PAGEの車線、分子量マーカー用の定期的な車線、と持っている透析ライセートの分注し用の定期的な車線のための単一の大規模な車線で、標準の10%SDS -ゲル(レシピ12-15)の準備SDSサンプルバッファー(レシピ11)と混合し、95℃で5分間煮沸されて厚さSDSゲル上にBN - PAGEゲルスライスのローディングを簡素化するためにセロハンテープの二層で増加したスペーサーを使用してください。
- 電気泳動装置からプレートにBN - PAGEゲルを外し、ゆっくりと一つのプレートを取り出します。
- スタッキングゲルを取り出して、目的のタンパク質を含むBN - PAGEゲルのレーンを切り取る。
- 室温で10分間、2 × SDSサンプルバッファーとインキュベートのBN - PAGEゲルスライスを置きます。
- 電子レンジでのBN - PAGEゲルスライスを短く(以上20秒)煮る。
- 室温でさらに15分間、ホットSDSサンプルバッファーでのBN - PAGEゲルスライスをインキュベートする。
- SDS - PAGEゲル回避気泡、およびオーバーレイSDSサンプルバッファーとスライスのスタッキングゲルを優に超える大型のBN - PAGEゲルスライスをロードする。マーカーとライセートコントロールをロードする。
- 標準プロトコルにしたがって電気泳動を行います。
5。イムノブロッティングによってMPCのサブユニットの検出
- 転送の場合は、SDS -ゲルの大きさに6ワットマンの論文やPVDF膜のフィッティングを準備。
- 30秒、100%メタノールにPVDF膜をインキュベートし、転送バッファ(レシピ16)にワットマンのペーパーを浸す。
- 場所再び3ワットマンの論文、PVDF膜、SDS -ゲル(ゲルをスタッキング削除)、および半乾きの転送細胞にサンドイッチのような構造三ワットマンの論文。
- 25分間20 Vを適用します。
- 標準免疫ブロットプロトコールにしたがってタンパク質を検出します。
6。代表的な結果
我々は2次元BN / SDS - PAGE(図1A)でMPCの特性評価のための例のような真核19S、20S、および26Sプロテアソームの分析を提示する。 HEK293細胞は、膜を破壊し、膜タンパク質複合体を可溶化する界面活性剤として0.1%のTriton X - 100を含むバッファーで溶解した。これらの溶解物を、塩と小さな代謝物を削除するにはBN -透析緩衝液に対して透析した。その後、MPCはは、二次元目SDS - PAGEに続いて4〜15パーセントの勾配BN - PAGEにより分離した。タンパク質は20Sプロテアソームのサブユニットβ2とMcp21に対する抗体を用いたイムノブロッティングにより可視化した。
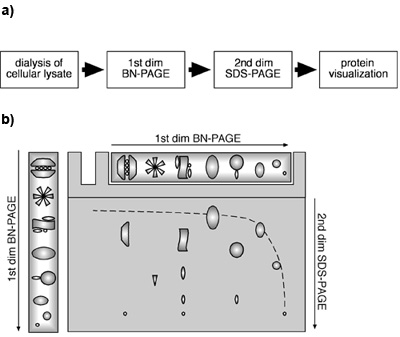
図1。細胞溶解物を使用して2次元BN-PAGE/SDS-PAGEのアプローチ。()細胞溶解物から2D BN-PAGE/SDS-PAGEのアプローチのフロー図。 2D BN-PAGE/SDS-PAGEの(B)の模式スキーム。タンパク質とMPCは、最初の次元のBN - PAGEによる未変性条件下で分離されている。二次元の場合は、タンパク質および/またはMPCは、BN - PAGEによる分離後にゲルストリップをSDSで変性し、その後、SDS - PAGEに供した。単量体タンパク質は、最初の勾配ゲルと2番目の次元の線形ゲルによる双曲線角に移行します。 1つの具体的MPCのコンポーネントは、垂直線上にある、対角線の下に検索されます。
それは最初の次元BN -および二次元目SDS - PAGEの組み合わせによって、単量体タンパク質は二次元目(最初のと線形ゲルの濃度勾配ゲルによる双曲線角内に移行することが示されている(カマチョ-カルバハル、Wollscheid らら 2004)、 図 1B)。 MPCはのコンポーネントは、この対角線の下にあります。水平線の同じタンパク質のいくつかのスポットがいくつかの別個のMPC内のタンパク質の存在を示すのに対し、同じMPCのサブユニットを表すタンパク質は、2番目の次元の垂直方向に1行で見つけることができます。我々の実験ではβ2とMcp21に対するイムノブロット図2に示すようにこれらのプロテアソームサブユニットを含む特定のタンパク質複合体の存在が明らかになった。両タンパク質は、β2とMcp21はいくつかの異なるのMPCの構成要素を表すことを示す、水平線に配置された個々のスポットとして検出された。これらのMPCは、はっきりと調節サブユニットPA28と一緒に20Sプロテアソーム、(20Sプラス19Sキャップ)26Sプロテアソームと同定、および20Sはその大きさと組成に基づいて、単独でプロテアソームすることができます。一緒に、これらのresuLTSは、内因性のMPCは、細胞溶解物を用いて二次元BN-PAGE/SDS-PAGEのアプローチによって識別し、特徴付けることができることを示している。このメソッドは、サイズ、組成、とMPCの相対量を決定するために適用可能です。

図2。二次元BN-PAGE/SDS-PAGE後に免疫ブロット法による真核生物のプロテアソームの異なる形式の検出は。真核生物のプロテアソームの同定および解析には、HEK293細胞を0.1%トリトンX - 100で溶解した。携帯溶解物を透析し、その後別のMPCにBN - PAGE(4-15%)を行った。その後、二次元目SDS - PAGE(10%)は個々のサブコンポーネントのサイズ分離のために実行されました。イムノブロットは、20Sのコア複合体のMcp21とβ2サブユニットを認識する特異的抗体、および調節サブユニットPA28を行った。
特定の試薬のI.表(アルファベット順):
| 試薬 | 会社 | コメント |
| 6 - アミノヘキサン酸 (ε-アミノカプロン酸) | Sigma - Aldrich社、Taufkirchen、ドイツ | この化学物質は刺激性であり、手袋で処理する必要があります。 |
| アクリルアミド-ビスアクリルアミド溶液(40%)、ミックス32:1 | Applichem、ダルムシュタット、ドイツ | このソリューションは、神経毒であり、手袋で処理する必要があります。 |
| ビス - トリス | ロス、カールスルーエ、ゲルマ- NY | |
| のBrij 96 | Sigma - Aldrich社、Taufkirchen、ドイツ | |
| クマシーブルーG250 | Serva、ハイデルベルク、ドイツ - 多くの | このようなクマシーブルーR250またはコロイドCOO -マシーブルースとしてクマシー色素の他のタイプを代用しないでください。 |
| ジギトニン | Sigma - Aldrich社、Taufkirchen、ドイツ | ジギトニンは有毒です。この決定 - ゲントを含むバッファーやサンプルを取り扱う際は手袋を着用してください。 |
| Dodecylmaltoside | Applichem、ダルムシュタット、ドイツ | |
| トリトンX - 100 | ロス、カールスルーエ、ゲルマ- NY | トリトンX - 100は毒性があります。この洗剤を含む緩衝液または検体を取り扱う際は手袋を着用してください。 |
II。特定の材料および機器の表:
| 機器 | 会社 |
| 透析膜(10〜50 kDの分子量のオフカット) | ロス、カールスルーエ、ドイツ |
| ゲル電気泳動システム | Bio - Rad社、ミュンヘン、ドイツから例えば |
| 勾配ミキサー | 自己作らまたはBio - Rad社、ミュンヘン、ドイツから市販されている |
| 蠕動ポンプ | アマシャムファルマシアバイオテク、フライブルク、ドイツ |
| ポリフッ化ビニリデン(PVDF)膜 | イモビロン- P、ミリポア、エシュボルン、ドイツ |
| セミドライトランスファー装置 | Bio - Rad社、ミュンヘン、ドイツから例えば |
| シリコンチューブ(3〜5 mm径、1mの長さ) | NeoLab、ハイデルベルク、ドイツ |
III。レシピの表:
| いいえ | バッファとソリューション | コンテンツ | コメント |
| 1 | リン酸緩衝食塩水(PBS) | のNa 2 HPO 4 8.1 mMKH 2 PO 4 1.5mMの NaClを138 mMの KClを2.7 mMの | 適切に、事前に、比べ、解は、pH7.4にする必要があります。 |
| 2 | BN -溶解バッファー | ベースのバッファ ビス - トリス20mMの ε-アミノカプロン酸500mMの 塩化ナトリウム20mMの EDTA、pH8.0の2mMの グリセリン10パーセント HClでpHを7.0に調整する。 4℃で保存します。 洗剤 1.0%ジギトニン0.5 またはのBrij 96 0.1〜0.5パーセント またはトリトンX - 100 0.1〜0.5パーセント またはDodecylmaltoside 0.1から0.5パーセント プロテアーゼ及びホスファターゼ阻害剤 アプロチニン10μg/ mLの ロイペプチン10μg/ mLの PMSF、1mMの フッ化ナトリウム0.5mMの オルトバナジウム酸ナトリウム0.5mMの | 適切な洗剤を経験的に決定する必要がありますし、他の溶解バッファーのレシピに使用されるものと同じである必要があります。 ジギトニンはちょうどのdH 2 O(-20〜5 mlのアリコート° Cで店舗)の2%のストック溶液から使用の前に追加する必要があります。 プロテアーゼ及びフォスファターゼ阻害し、ORSは、使用の直前に追加する必要があります。 ナトリウムorthova - nadateを添加すると、バッファは色で黄色になります。 |
| 3 | BN -透析バッファ | ベースのバッファ ビス - トリス20mMの ε-アミノカプロン酸500mMの 塩化ナトリウム20mMの EDTA、pH8.0の2mMの グリセリン10パーセント HClでpHを7.0に調整する。 4℃で保存します。 洗剤 ジギトニン0.3から0.5パーセント またはTriton X - 100を0.1パーセント またはのBrij 96 0.1パーセント またはDodecylmaltoside 0.1パーセント プロテアーゼ及びホスファターゼ阻害剤 PMSF、1mMの オルトバナジウム酸ナトリウム0.5mMの | 適切な洗剤を経験的に決定する必要がありますし、他の溶解バッファーで使用されているものと同じである必要がありますが、指示された低濃度tionsで。 洗剤は、ゲル電気泳動のスタッキングステップでプリベントアグリゲーションに追加する必要があります。 プロテアーゼ及びフォスファターゼ阻害し、ORSは、使用の直前に追加する必要があります。 |
| 4 | 3X BN -ゲルバッファー | ビス - トリス150mMの ε-アミノカプロン酸200mMの HClでpHを7.0に調整する。 4℃で保存します。 | |
| 5 | 4%ゲルを分離 | 3X BN -ゲルバッファー(レシピ4)5.00 mLを アクリルアミド/ビスアクリルアミド1.50 mLの のdH 2 O 8.50 mLの APS、のdH 2 O 54μLの10% 5.4μLTEMED | これらの試薬は重合を促進するとして、immedia - telyゲルを注ぐ前にAPSとTEMEDを追加。 このレシピは、30 mlゲルをキャストするのに十分です。注がれているゲルの数とサイズのボリュームを調整します。 |
| 6 | 15%がゲルの分離 | 3X BN -ゲルバッファー(レシピ4)5.00 mLを アクリルアミド/ビスアクリルアミド5.63 mLの グリセリン70パーセント4.38 mLの APS、のdH 2 O 42μLの10% TEMED 4.2μL | これらの試薬は重合を促進するとして、immedia - telyゲルを注ぐ前にAPSとTEMEDを追加。 このレシピは、30 mlゲルをキャストするのに十分です。注がれているゲルの数とサイズのボリュームを調整します。 アクリルアミド-ビスアクリルアミドの濃度は、10から18%に必要に応じて変えることができる。 |
| 7 | 3.2%ゲルをスタッキング | 3X BN -ゲルバッファー(レシピ4)3.00 mLを アクリルアミド/ビスアクリルアミド0.72 mLの のdH 2 O 5.28 mLの APS、のdH 2 O 120μLの10% TEMED 12μlの | これらの試薬は重合を促進するとして、immedia - telyゲルを注ぐ前にAPSとTEMEDを追加。 このレシピは、30 mlゲルをキャストするのに十分です。注がれているゲルの数とサイズのボリュームを調整します。 |
| 8 | 陰極バッファー | ビス - トリス15mMの トリシン50mMの クマシーブルーG250 0.02パーセント 10xのストックとして1リットルを準備し、4℃でHClでpHを7.0に調整し、店舗℃に 使用前のdH 2 Oで1:10に希釈する。 | このようなクマシーブルーR250またはコロイドクマのブルースのようなクマシー色素の他のタイプを代用しないでください。 |
| 9 | 陽極バッファー | ビス - トリス50mMの 10xのストックとして1リットルを準備し、4℃でHClでpHを7.0に調整し、店舗℃に 使用前のdH 2 Oで1:10に希釈する。 | |
| 10 | マーカーミックス | アルドラーゼ(158 kD)の10 mg / mlの カタラーゼ(232 kD)の10 mg / mlの フェリチン(440および880 kDの)10 mg / mLの サイログロブリン(670 kD)の10 mg / mlの BSA(66および132 kDの)10 mg / mLの ビス - トリス20mMの 塩化ナトリウム20mMの グリセリン10パーセント HClでpHを7.0に調整する。 4℃で保存します。 | 分子量マーカーは、体外- genまたはファルマシアを含む複数のソースからも市販されている。 |
| 11 | SDSサンプルバッファー | トリス12.5 mmを SDS 4パーセント グリセリン20パーセント ブロモフェノールブルー0.02パーセント 6.8にpHを調整する。ジスルフィド結合を減らすために、9 mLのβ-メルカプトエタノールを加える。 | 粉体とβ- MER - captoethanolとしてSDSは毒性があります。そのため、手袋を使用し、ボンネットの下に働く。 |
| 12 | 4倍速より低いバッファ | トリス、1.5M SDS 0.4パーセント 8.8にpHを調整する。 | 粉末としてSDSは毒性があります。そのため、手袋を使用し、ボンネットの下に働く。 |
| 13 | 4倍の上部バッファー | トリス、0.5M SDS 0.4パーセント 6.8にpHを調整する。 | 粉末としてSDSは毒性があります。そのため、手袋を使用し、ボンネットの下に働く。 |
| 14 | 10%がゲルの分離 | アクリルアミド(30%)2.0 mLを 4倍速より低いバッファー1.5 mLの のdH 2 O 2.454 mLの APS、のdH 2 O 40μLの10% 6μLTEMED | これらの試薬は重合を促進するとして、immedia - telyゲルを注ぐ前にAPSとTEMEDを追加。 このレシピは、30 mlゲルをキャストするのに十分です。注がれているゲルの数とサイズのボリュームを調整します。 |
| 15 | 4.8%ゲルをスタッキング | アシルアミド(30%)320μL 4xの上部バッファー500μL のdH 2 O 1.16 mLの APS、のdH 2 Oで10%20μL TEMED 2μL | これらの試薬は重合を促進するとして、immedia - telyゲルを注ぐ前にAPSとTEMEDを追加。 このレシピは、30 mlゲルをキャストするのに十分です。注がれているゲルの数とサイズのボリュームを調整します。 |
| 16 | セミドライトランスファーバッファー | トリスさ48 mm グリシン39 mMの メタノール20パーセント 0.1%SDS のdH 2 Oで1リットルにボリュームを調整室温で保管してください。 | 粉やメタノールなどのSDSは毒性があります。そのため、手袋を使用し、ボンネットの下に働く。 |
ディスカッション
本研究では、BN - PAGEによるMPCの分析について説明します。 2D的なアプローチは、ネイティブ条件下でまず個別のMPCに使用され、その後、さらに二次元目SDS - PAGEによって彼らの個々のコンポーネントにそれらを再分割する。
サンプルは、細胞ライセートから調製されています。多くのMPCの可溶化のために、適切な洗剤は、タンパク質複合体の構造は保存されますが、必要とされる。ここでは、0.1%トリトンX - 100を使用してください。しかし、最適な洗剤とその適切な濃度は、すべてのMPCのために経験的に決定する必要があります。トリトンX - 100の場合には、例えば、それは低い界面活性剤濃度は、F 1 F 0 - ATPaseの複合体(アーノルド、ファイファーら 1998)の二量体形態の識別を可能にすることが報告されている。高いトリトンX - 100濃度は、しかし、二量体の解離と単量体F 1 F 0 - ATPaseの複合体の対応する増加につながる。高濃度のまたは別の洗剤の使用量がINジギトニンの結果を呼ばれるのに対し、これは私たちのかつての研究の一つの線の上に、我々は、のBrij 96の低濃度で抽出するときに多価のT細胞受容体複合体(TCR)が保持されることを示していた単量体のTCRの抽出(Schamel、Arechaga ら、2005)。テストすることができる一般的に使用される洗剤は、ジギトニン(0.5〜1%)、トリトンX - 100(0.1〜0.5%)、のBrij 96(0.1〜0.5%)、またはdodecylmaltosideを(0.1〜0.5%)含まれています。これらの試薬は、MPCの安定のために最良になりがちな非イオン性界面活性剤、です。 SDSやその他の強力な洗剤との接触は(カマチョ-カルバハル、Wollscheid ら 2004)は避けるべきであることに注意してください。
溶解液の透析は、BN -ゲル(。カマチョ-カルバハル、Wollscheid ら 2004)でMPCの分離を達成するために必要とされ、(ハイス、Junkes ら、2005。)。それは、塩濃度または低分子量不純物の除去の調整は、高解像度のために重要であると思われる。また、免疫精製し、後で抗体から溶出されている膜調製物とMPCは、、(スワミー、Siegers ら 2006)BN - PAGEに適していることは注目に値する。どちらの場合も、サンプルは膜の溶解または溶出がBN -溶解緩衝液中で実施されている場合、BN - PAGEの分離のために透析する必要はありません。
BN - PAGEによるタンパク質の分離のために、色素クーマシーブルーは、タンパク質に非特異的に結合し、負電荷でそれらをカバーする、必要とされる。これにより、クマシーブルーでは、中性pH(SchäggerとフォンJagow 1991)で、陰極に向かって、タンパク質の電気泳動移動度を可能にします;(Schägger、クラマーら1994。)。さらに、クマシーブルーでは電気泳動中にスタッキングゲルにタンパク質の凝集を防ぎます。 BN - PAGEの場合は、クマシーG250は、クマシーブルーR250またはコロイドクマシーブルースの代わりに使用する必要があります。
BN -ゲルを実行する前に、それはゲルの割合は、関心のMPCの予想サイズに収まるようにするために必要です。さまざまなグラデーションと、適切なバッファを持つBN -ゲルはインビトロジェン(NativePAGE NOVEXビス - トリスゲルシステム)から市販されているプレキャスト。しかし、BN -ゲルはまたpersistalticポンプと一緒に勾配のミキサーを用いて調製することができる。無傷の勾配を保証するために、液体が注ぐ中に絶えず流れる必要があり、気泡は避けてください。オーバーロードは、電気泳動プロセス中にタンパク質沈殿する可能性があるため私たちは、ゲル上の異なるサンプルの希釈のロードをお勧めします。さらに、BN -ゲルは4℃で実行する必要があります° Cは、タンパク質の分解を防止するとMPCがそのまま保持する。
MPCはのBN - PAGE、可視化は、クマシーブリリアントブルー染色、銀染色やイムノブロッティングによって達成することができます後。タンパク質バンドはクーマシーまたは銀染色により可視化質量分析法(カマチョ-カルバハル、Wollscheid ら 2004)によるさらなる分析に適しています。イムノブロットの場合には、関心のMPCのための最適な転送条件は、経験的に決定する必要があります。クマシーブルーでもBN -ゲルからブロッティング中に転送されていることに注意してください。したがって、ゲル、膜は青色を発揮するのに対し、転送が成功すると無色になります。さらに、SDS - PAGE後の検出のために働くしないすべての一次抗体は、、BN - PAGEによりイムノブロットに適用可能であることを言及することが重要です。それは彼らのエピトープは、タンパク質の天然構造に隠されているため、抗体は興味のMPCを認識しないことが起こり得ます。この問題を克服するために、それは1x SDSサンプルバッファーでまもなくゲルを煮沸することにより前の転送へのBN -ゲル内のタンパク質を変性させることが可能です。
この例では、我々は、タンパク質バンドの検出に直接BN -ゲルを衝撃はなかった。その代わりに、我々は、第2 dimensiによってBN - PAGEで区切られたライセートを分けるSDS - PAGE上で。二次元SDS -ゲルでは、単量体蛋白質は第1および第2の次元(カマチョ-カルバハル、Wollscheid ら 2004)の線形ゲルの濃度勾配ゲルによる双曲線角内に移行する。彼らはこの双曲線対角線の下にローカライズされているので、これは、MPCのを簡単に識別することができます。 1つの異なるMPCのサブコンポーネントは、二次元SDS - PAGEの縦線で区切られています。いくつかのdinstinctのMPCはの構成要素であるコンポーネントは、MPCの大きさに応じて水平線を識別することができます。しかし、それを垂直方向に1行に現れるいくつかのタンパク質のスポットがまたBN - PAGEで同じ位置に移行する独立した複合体の一部であることを考慮する必要があります。彼らは同じMPC内に存在すること、最終的な証拠は抗体ベースのゲルシフトアッセイによって得ることができます。このアッセイでは、細胞溶解物は、前のBN - PAGEに同定されたスポットの一つで表されるタンパク質に対する抗体とともにインキュベートされる。最初の次元の高い分子量の方にこのタンパク質を含むすべてのMPCのシフトでこの結果。また、これらのMPCの一部である他のタンパク質は、この複雑な固有のシフトを受けるため、二次元目SDS -ゲルで簡単に識別できるでしょう。
MPCはの組成はBN - PAGEで分析だけでなく、それらの化学量論の決定が可能です(SchamelとReth 2000)することができるだけではなく、(Schamel 2001)、(スワミー、Minguet ら2007)。この目的のために、NAMOSアッセイ(ネイティブ抗体ベースの移動度シフトアッセイ)を行うことができます。抗体ベースのゲルシフトアッセイと同様に、細胞溶解物は、モノクローナルサブユニット特異的抗体とインキュベートされています。これは、MPCは化学量論にシフトの程度から推論を可能にするBN -ゲルで電気泳動immunoshiftsの誘導につながる
conlusionでは、BN - PAGEは、MPCはの同定とそれらのサイズ、組成だけでなく、相対的な豊かさの測定に適しています。 NAMOSアッセイとして実行、それはまた、特定のMPCの化学量論を決定する可能性を提供しています。その一般的な適用を考えると、このテクニックは、MPCはの特性評価(。デッカー、ミュラーら 1996)は非常に有益なツールです、(ウィッティッヒとSchagger 2008);(ワーグナー、Rehling ら2009。)、(ウィッティッヒとSchägger 2009) 。
開示事項
謝辞
我々は科学的なサポートのためにマイケルReth、ヘルマンSchägger、とマルガリータカマチョ-カルバハルに感謝する。この作品は、ドイツ学術振興協会(DFG)からのBIOSではによって、Bundesministerium福二BildungとForschung(BMBF)からFORSYSによって賄われ、ドイツ連邦政府と州政府のエクセレンスイニシアチブによって部分的にサポートされていました(GSC - 4、シュペーマン大学院)。
参考文献
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved