Method Article
Blaue Native Polyacrylamid-Gelelektrophorese (BN-PAGE) zur Analyse von Multiproteinkomplexen aus Zelllysaten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In diesem Video, beschreiben wir die Charakterisierung von Multiproteinkomplexen (MPL) durch blaue nativen Polyacrylamidgelelektrophorese (BN-PAGE). In einer ersten Dimension sind dialysiert Zelllysaten durch BN-PAGE getrennt an die einzelnen MPL zu identifizieren. In einer zweiten Dimension SDS-PAGE, werden MPC von Interesse weiter unterteilt, um ihre Wähler durch Immunoblot analysieren.
Zusammenfassung
Multiproteinkomplexen (MPL) spielen eine entscheidende Rolle für die Zellkommunikation, da die meisten Proteine in funktioneller oder regulatorische Komplexe mit anderen Proteinen (Sali, Glaeser et al. 2003) gefunden werden kann. So erfordert die Untersuchung von Protein-Protein-Interaktions-Netzwerke die detaillierte Charakterisierung der Mittelmeer-Partnerländer, um ein integratives Verständnis der Funktion von Proteinen und Regulierung zu gewinnen. Zur Identifizierung und Analyse muss MPCs unter nativen Bedingungen getrennt werden. In diesem Video, beschreiben wir die Analyse der Mittelmeer-Partnerländer durch blaue nativen Polyacrylamidgelelektrophorese (BN-PAGE). BN-PAGE ist eine Technik, die Trennung von MPC ermöglicht in einer nativen Konformation mit einer höheren Auflösung als durch Gelfiltration oder Saccharose-Dichtegradienten-Ultrazentrifugation angeboten und ist daher sinnvoll, MPC Größe, Zusammensetzung und relative Häufigkeit (Schägger und von Jagow 1991) bestimmen ; (Schägger, Cramer et al 1994).. Mit dieser Methode werden Proteine nach ihrer hydrodynamischen Größe und Form in einem Polyacrylamid-Matrix getrennt. Hier zeigen wir die Analyse der Mittelmeer-Partnerländer der gesamten zellulären Lysaten und wies darauf hin, dass Lysat Dialyse den entscheidenden Schritt zu machen BN-PAGE für diese biologischen Proben ist. Mit einer Kombination aus der ersten Dimension BN-und die zweite Dimension SDS-PAGE zeigen wir, dass PLM nach BN-PAGE getrennt weiter in ihre einzelnen Bestandteile werden durch SDS-PAGE unterteilt. Visualisierung der MPC-Komponenten auf Gel-Trennung wird durch Standard-Immunblot durchgeführt. Als Beispiel für MPC Analyse von BN-PAGE, wählten wir die gut charakterisierten eukaryotischen 19S, 20S und 26S Proteasomen.
Protokoll
Blaue Native Polyacrylamid-Gelelektrophorese (BN-PAGE) für die Identifizierung und Analyse von Multiproteinkomplexen: ** Dieses Video-Protokoll basiert auf einem zugehörigen Publikation 1. Mahima Swamy, Gabrielle M. Siegers, Susana Minguet, Bernd Wollscheid, und Wolfgang WA Schamel. Science STKE 2006 (345): pl2, 25. Juli 2006, [DOI: 10.1126/stke.3892006pl4]. Bitte klicken Sie hier, um diese Publikation zu sehen .
1. Vorbereitung der dialysiert Zelllysat
- Ernte 10x10 6 Zellen und Pellet durch Zentrifugation bei 350g für 5 min bei 4 ° C.
- Waschen Sie die Zellpellet dreimal mit 1 ml eiskaltem PBS (Rezept 1), in Schritt 1.1 Zentrifuge.
- Pellet in 250 ul eiskaltem BN-Lysis Buffer (Rezept 2) und auf Eis inkubieren für 15 min.
- Zentrifuge bei 13.000 g für 15 min bei 4 ° C zu entfernen unlösliches Material.
- Melt ein Loch in den Deckel eines 1,5-ml-Mikrozentrifugenröhrchen mit der beheizten großen Durchmessers Seite einer Pasteurpipette dann die Röhrchen auf Eis abkühlen auf 4 ° C.
- Überstand aus Schritt 1.4 in den gekühlten Rohr mit dem Loch in der Kappe.
- Legen Sie eine Dialysemembran (molecular weight cut-off von 10 kD) mit einer Pinzette auf der Oberseite des geöffneten Röhre, in der Nähe der Kappe, und schneiden Sie das überschüssige Dialysemembran, die aus Stöcken.
- Seal die Kappe auf der Seite sorgfältig mit Parafilm.
- Kehren Sie die Rohre und Zentrifuge Upside-Down zu den niedrigsten möglichen Geschwindigkeit in einer 50-ml konische Röhrchen in einer Zellkultur Zentrifuge für 10 sec bei 4 ° C. Entfernen Sie den invertierten Rohr aus der Zentrifuge mit einer Pinzette zu vermeiden, drehen die Röhre wieder richtig herum.
- Bereiten Sie eine 100-ml-Becher mit kaltem BN-Dialyse-Puffer (Rezept 3) und einer Rührplatte. Verwenden Sie mindestens 10 ml BN-Dialyse-Puffer pro 100-ul-Probe.
- Befestigen Sie das Rohr mit Klebeband auf den Kopf in den Becher, und entfernen Sie Luftblasen aus dem Loch unter der Kappe mit einem gebogenen Pasteurpipette.
- Legen Sie Becherglas auf einem Magnetrührer auf der Rührer-Schalter und lassen Sie es für 6 Stunden oder über Nacht im Kühlraum. Überprüfen Sie gelegentlich, um sicherzustellen, dass das Rühren nicht schaffen Luftblasen an der Dialysemembran.
- Sammeln Sie die dialysiert Zelllysat in ein neues gekühltes Reaktionsgefäß.
2. Gießen von BN-Gelen
- Gradient Gel gegossen wird bei Raumtemperatur mit einem Gradienten-Mischer erfolgen. Handschuhe müssen getragen, weil Polyacrylamid ist ein starkes Nervengift werden. Vermeiden Sie jeden Kontakt mit SDS.
- Legen Sie die Gradientenmischer auf einer Rührplatte und hängen Sie es an einem Stück Schlauch. Schließen Sie den Kanal mit dem Ventil und schließen Sie den Schlauch mit einer Schelle. Legen Sie einen Magnetrührer 15% in den "high" Zylinder verbunden, um den Schlauch.
- Thema der flexiblen in eine peristalitic Pumpe und befestigen Sie eine Kanüle bis zu seinem Ende. Dann setzen Sie die Nadel zwischen den beiden Glasplatten der Gel-Apparatur.
- Bereiten Sie 4% (Rezept 5) und 15% (Rezept 6) Trenngel-Lösungen, indem APS und TEMED erst unmittelbar vor Gebrauch. Das kombinierte Volumen gleich sein sollten, um die Lautstärke des Trenngels.
- Gießen Sie diese Gel-Lösungen in die entsprechenden Zylinder des Gradientenmischer (4% in den "low" und 15% in den "high" Zylinder).
- Öffnen Sie das Ventil und Kraft aus der Luftblase im Inneren des Kanals zwischen den beiden Stauseen Gel, indem Sie über die linke Zylinder mit dem Daumen.
- Schalten Sie den Magnetrührer, entfernen Sie die Klemme, und schalten Sie die Pumpe peristalitic bis 5 ml pro Minute. Lassen Sie das Gel langsam zwischen den Glasplatten fließen. Stellen Sie sicher, dass die Nadel immer oberhalb der Flüssigkeit.
- Lassen Sie alle flüssigen in den Gel-Apparatur geben, und dann sanft Überlagerung mit Isopropanol. Lassen Sie das Gel für mindestens 30 min bei Raumtemperatur polymerisieren.
- Reinigen Sie das Gießen Apparat sofort mit dH 2 O (Verwenden Sie keine Reinigungsmittel).
- Entfernen Sie die Isopropanol, mit dH 2 O gewaschen, und entfernen Sie die dH 2 O mit einem Whatman-Papier.
- Bereiten Sie eine 3,2% Sammelgel (Rezept 7) und fügte hinzu, APS und TEMED erst unmittelbar vor Gebrauch.
- Gießen Sie die Stacking-Gel auf dem Trenngel und stellen Sie den Kamm zwischen den Glasplatten, blasenfrei. Nach dem Stapeln Gel polymerisiert, kühlen das Gel bis zu 4 ° C.
- Unmittelbar vor der Probenaufgabe, entfernen Sie den Kamm langsam und zog sie in einem Winkel zur Ebene des Gels. Dadurch kann Luft in die Taschen schnell, was die Qualität des Brunnen verbessert geben.
3. Trennung von dialysiert Zelllysat durch BN-PAGE
- Laden von 1 bis 40 ul der dialysiert Lysat und 10 bis 20 ul der Marker-Mix (Rezept 10) in den trockenen Brunnen bei 4 ° C. Overlay die Proben in jede Vertiefung mit Kaltkathoden-Buffer (Rezept 8).
- Füllen Sie den Innenraum mit kaltem Cathode Buffer und der äußeren / unteren Kammer mit kaltem Anode Buffer (Rezept 9).
- Apply 100 V eine Minigel oder 150V zu einer großen Gel, bis die Proben das Trenngel eingegeben haben. Führen Sie das Gel bei 4 ° C.
- Erhöhen Sie die Spannung auf 180 V (Minigel) oder 400 V (large-Gel) und führen bis der Farbstoff vor Erreichen des Endes des Gels. Der Lauf dauert 3 bis 4 Stunden für ein Mini-und 18 bis 24 Stunden für ein großes Gel.
4. Zweite Dimension SDS-PAGE
- Bereiten Sie eine Standard-10% SDS-Gel (Rezepte 12-15) mit einer einzigen großen Spur für die erste Dimension BN-PAGE Spur, eine reguläre Fahrspur für den Molekulargewichtsmarker, und eine regelmäßige Spur für eine Teilmenge der dialysierten Lysat, dass hat wurden mit SDS-Probenpuffer (Rezept 11) gemischt und für 5 min gekocht bei 95 ° C. Verwenden Sie Abstandshalter, deren Dicke wurde durch zwei Lagen Klebeband erhöht werden, um Belastung der BN-PAGE-Gel Scheibe auf das SDS-Gel zu vereinfachen.
- Entfernen Sie die BN-PAGE-Gel in die Platten aus dem Elektrophorese-Vorrichtung und hebeln bis eine Platte.
- Entfernen Sie die Stacking-Gel und schneiden Sie die Spur der BN-PAGE-Gel mit den Proteinen von Interesse.
- Legen Sie die BN-PAGE-Gel Scheibe in 2x SDS-Probenpuffer und Inkubation für 10 min bei Raumtemperatur.
- Kochen Sie die BN-PAGE-Gel Scheibe kurz (nicht mehr als 20 sec) in eine Mikrowelle.
- Inkubieren Sie die BN-PAGE-Gel Scheibe in die heiße SDS Probenpuffer für weitere 15 min bei Raumtemperatur.
- Laden Sie die BN-PAGE-Gel Scheibe in den großen, gut über die Stacking-Gel der SDS-PAGE-Gel luftblasenfrei und überziehe die Scheibe mit SDS-Probenpuffer. Legen Sie Marker und Lysat zu kontrollieren.
- Führen Elektrophorese nach Standardprotokollen.
5. Erkennung von MPC-Untereinheiten durch Immunoblots
- Für die Übertragung, Bereiten Sie sechs Whatman Papiere und eine PVDF-Membran Anpassung an die Größe des SDS-Gels.
- Inkubieren Sie die PVDF-Membran in 100% Methanol für 30 s und genießen die Whatman Papiere in Transfer-Puffer (Rezept 16).
- Platzieren Sie drei Whatman Papiere, die PVDF-Membran, das SDS-Gel (entfernen Stacking-Gel), und wieder drei Whatman Papiere in einer Sandwich-Struktur in eine halbtrockenen Transfer Zelle.
- Übernehmen 20 V für 25 min.
- Detect Proteine gemäß der Norm Immunoblot-Protokolle.
6. Repräsentative Ergebnisse
Wir präsentieren die Analyse der eukaryotischen 19S, 20S und 26S Proteasomen als Beispiel für MPC Charakterisierung durch 2D BN / SDS-PAGE (Abbildung 1A). HEK293 Zellen wurden mit einem Puffer mit 0,1% lysiert Triton X-100 als Detergens um die Membranen zu stören und zu lösen Membranprotein-Komplexen. Diese Lysate wurden gegen BN-Dialyse-Puffer dialysiert, um Salze und kleinen Metaboliten zu entfernen. Dann wurden PLM nach 4-15% Steigung BN-PAGE durch eine zweite Dimension SDS-PAGE, gefolgt getrennt. Die Proteine wurden durch Immunblot mit Antikörpern gegen die Untereinheiten β2 und Mcp21 des 20S Proteasom.
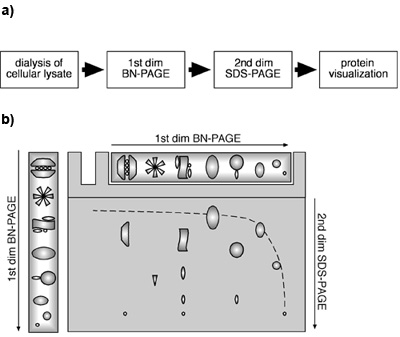
Abbildung 1. Ein zweidimensionales BN-PAGE/SDS-PAGE Ansatz mit Zelllysaten. (A) Flow-Diagramm eines 2D BN-PAGE/SDS-PAGE Ansatz von Zelllysaten. (B) Schematische Schema einer 2D BN-PAGE/SDS-PAGE. Proteine und MPC sind unter nativen Bedingungen durch BN-PAGE in einer ersten Dimension getrennt. Für die zweite Dimension, sind Proteine und / oder MPCs denaturiert SDS im Gel Streifen nach der Trennung von BN-PAGE und anschließend einer SDS-PAGE unterzogen. Monomeren Proteinen wird in einem hyperbolischen diagonal durch die Gradienten-Gel in der ersten und eine lineare Gel in die zweite Dimension migriert. Komponenten eines konkreten MPC wird unterhalb der Diagonalen, auf einer vertikalen Linie befinden gefunden werden.
Es hat sich gezeigt, dass durch die Kombination der ersten Dimension BN-und die zweite Dimension SDS-PAGE, monomere Proteine innerhalb einer hyperbolischen diagonal durch die Gradienten-Gel wandern in der ersten und der linear-Gel in der zweiten Dimension ((Camacho-Carvajal, Wollscheid et al 2004);. Abbildung 1B). Komponenten der Mittelmeer-Partnerländer sind unterhalb der Diagonale liegt. Proteine, die Untereinheiten des gleichen MPC darstellen kann in einer vertikalen Linie in der zweiten Dimension zu finden, während mehreren Stellen des gleichen Proteins in eine horizontale Linie das Vorhandensein des Proteins in mehrere verschiedene MPCs anzuzeigen. Abbildung 2 zeigt, dass in unserem Experiment Immunoblot gegen β2 und Mcp21 zeigte die Anwesenheit von spezifischen Protein-Komplexen mit diesen proteasomalen Untereinheiten. Beide Proteine wurden als einzelne Punkte in einer horizontalen Linie angeordnet nachweisbar, was darauf hinweist, dass β2 und Mcp21 Bestandteile von mehreren verschiedenen MPC vertreten. Diese MPCs konnte eindeutig als das 26S Proteasom (20S und 19S-Cap), das 20S-Proteasom zusammen mit der regulatorischen Untereinheit PA28 identifiziert werden, und die 20S Proteasomen allein auf der Grundlage ihrer Größe und Zusammensetzung. Zusammengenommen sind diese results zeigen, dass endogene MPCs identifiziert werden können und durch eine zweidimensionale BN-PAGE/SDS-PAGE Ansatz mit Zelllysat charakterisiert werden. Dieses Verfahren ist anwendbar für die Bestimmung der Größe, Zusammensetzung und relative Häufigkeit von PLM.

Abbildung 2. Erkennung von verschiedenen Formen der eukaryotischen Proteasom durch Immunoblot nach zweidimensionaler BN-PAGE/SDS-PAGE. Zur Identifizierung und Analyse von eukaryotischen Proteasom, wurden HEK293-Zellen mit 0,1% Triton X-100 lysiert. Zelllysaten wurden dialysiert und anschließend auf BN-PAGE (4-15%) zu trennen MPCs unterzogen. Danach wurde eine zweite Dimension SDS-PAGE (10%) für die Größe Trennung der einzelnen Subkomponenten laufen. Immunoblotting wurde mit spezifischen Antikörpern, die Mcp21 und β2-Untereinheit des 20S Core-Komplex und der regulatorischen Untereinheit PA28 durchgeführt.
I. Tabelle der spezifischen Reagenzien (alphabetische Reihenfolge):
| Reagens | Firma | Kommentare |
| 6-Aminohexansäure (Ε-Aminocapronsäure) | Sigma-Aldrich, Taufkirchen, Deutschland | Diese Chemikalie ist reizend und sollte mit Handschuhen angefasst werden. |
| Acrylamid-Bisacrylamid-Lösung (40%), Mix 32:1 | Applichem, Darmstadt, Deutschland | Diese Lösung ist neurotoxisch und sollten mit Handschuhen angefasst werden. |
| Bis-Tris | Roth, Karlsruhe, Germa-ny | |
| Brij 96 | Sigma-Aldrich, Taufkirchen, Deutschland | |
| Coomassie-Blau G250 | Serva, Heidelberg, Deutsch-land | Verwenden Sie keine anderen Arten von Coomassie Farbstoff wie Coomassie Blau R250 oder kolloidalen Coo-Massie Blues. |
| Digitonin | Sigma-Aldrich, Taufkirchen, Deutschland | Digitonin ist giftig. Die Handschuhe sollten bei der Handhabung Puffer oder Proben mit diesem abschrecken-gent werden. |
| Dodecylmaltosid | Applichem, Darmstadt, Deutschland | |
| Triton X-100 | Roth, Karlsruhe, Germa-ny | Triton X-100 ist giftig. Die Handschuhe sollten bei der Handhabung Puffer oder Proben mit diesem Reinigungsmittel gereinigt werden. |
II. Tabelle der spezifischen Material und Ausrüstung:
| Ausstattung | Firma |
| Dialysemembranen (molecular weight cut-off von 10 bis 50 kD) | Roth, Karlsruhe, Deutschland |
| Gel-Elektrophorese-System | Zum Beispiel von Bio-Rad, München, Deutschland |
| Gradientenmischer | Self-made oder im Handel von Bio-Rad, München, Deutschland |
| Schlauchpumpe | Amersham Pharmacia Biotech, Freiburg, Deutschland |
| Polyvinylidenfluorid (PVDF)-Membran | Immobilon-P, Millipore, Eschborn, Deutschland |
| Semi-dry-Transfer- | Zum Beispiel von Bio-Rad, München, Deutschland |
| Silicon-Schlauch (3 bis 5 mm Durchmesser, 1 m Länge) | NeoLab, Heidelberg, Deutschland |
III. Tabelle der Rezepte:
| Nein. | Puffer und Lösungen | Inhalt | Kommentare |
| 1 | Phosphate-Buffered Saline (PBS) | Na 2 HPO 4 8.1 MMKH 2 PO 4 1,5 mM NaCl 138 mM KCl 2,7 mM | Lösung sollte pH 7,4 sein, wenn vorbereitet richtig. |
| 2 | BN-Lysispuffer | Basis-Puffer Bis-Tris 20 mM ε-Aminocapronsäure 500 mM NaCl 20 mM EDTA, pH 8,0 2 mM Glycerin 10% Der pH-Wert auf 7,0 mit HCl. Lagerung bei 4 ° C. Reinigungsmittel Digitonin 0,5 bis 1,0% oder Brij 96 von 0,1 bis 0,5% oder Triton X-100 von 0,1 bis 0,5% oder Dodecylmaltosid 0,1 bis 0,5% Protease-und Phosphatase-Inhibitoren Aprotinin 10 pg / mL Leupeptin 10 pg / mL PMSF 1 mM Natriumfluorid 0,5 mM Natriumorthovanadat 0,5 mM | Die entsprechenden Reinigungsmittel müssen empirisch ermittelt werden und sollte die gleiche wie die in den anderen Lysepuffer Rezepte verwendet werden. Digitonin muss unmittelbar vor Gebrauch aus einer 2%-Stammlösung in dH 2 O (store in 5-ml-Portionen bei -20 ° C) hinzugefügt werden. Protease und Phosphatase hemmen-ors sollte unmittelbar vor Gebrauch hinzugefügt werden. Nach Zugabe von Natrium-orthova-nadate, wird der Puffer zu gelblich. |
| 3 | BN-Dialysepuffer | Basis-Puffer Bis-Tris 20 mM ε-Aminocapronsäure 500 mM NaCl 20 mM EDTA, pH 8,0 2 mM Glycerin 10% Der pH-Wert auf 7,0 mit HCl. Lagerung bei 4 ° C. Reinigungsmittel Digitonin 0,3 bis 0,5% oder Triton X-100 0,1% oder Brij 96 0,1% oder Dodecylmaltosid 0,1% Protease-und Phosphatase-Inhibitoren PMSF 1 mM Natriumorthovanadat 0,5 mM | Die entsprechenden Reinigungsmittel müssen empirisch ermittelt werden und sollte die gleiche wie die in den anderen Lysepuffer verwendet werden, aber an der angegebenen unteren Konzentrationen. Waschmittel muss zu ver-hindern Aggregation auf Stapeln Schritt Gelelektrophorese hinzugefügt werden. Protease und Phosphatase hemmen-ors sollte unmittelbar vor Gebrauch hinzugefügt werden. |
| 4 | 3x BN-Gel-Puffer | Bis-Tris 150 mM ε-Aminocapronsäure 200 mM Der pH-Wert auf 7,0 mit HCl. Lagerung bei 4 ° C. | |
| 5 | 4% Trenngel | 3x BN-Gel-Puffer (Rezept 4) 5,00 ml Acrylamid / Bisacrylamid 1.50 mL dH 2 O 8,50 mL APS, 10% in dH 2 O 54 ul TEMED 5,4 ul | Add APS und TEMED unver-züglich vor dem Gießen-Gel, da diese Reagenzien zu fördern Polymerisation. Dieses Rezept ist ausreichend, um einen 30-ml-Gel gegossen. Lautstärkeanpassung für die Anzahl und Größe der Gele gegossen. |
| 6 | 15% Trenngel | 3x BN-Gel-Puffer (Rezept 4) 5,00 ml Acrylamid / Bisacrylamid 5,63 mL Glycerol 70% 4,38 mL APS, 10% in dH 2 O 42 ul TEMED 4,2 ul | Add APS und TEMED unver-züglich vor dem Gießen-Gel, da diese Reagenzien zu fördern Polymerisation. Dieses Rezept ist ausreichend, um einen 30-ml-Gel gegossen. Lautstärkeanpassung für die Anzahl und Größe der Gele gegossen. Die Konzentration von Acrylamid-Bisacrylamid kann auch als notwendig, von 10 bis 18% variiert werden. |
| 7 | 3,2% Stacking Gel | 3x BN-Gel-Puffer (Rezept 4) 3.00 mL Acrylamid / Bisacrylamid 0,72 ml dH 2 O 5,28 mL APS, 10% in dH 2 O 120 ul TEMED 12 ul | Add APS und TEMED unver-züglich vor dem Gießen-Gel, da diese Reagenzien zu fördern Polymerisation. Dieses Rezept ist ausreichend, um einen 30-ml-Gel gegossen. Lautstärkeanpassung für die Anzahl und Größe der Gele gegossen. |
| 8 | Cathode Buffer | Bis-Tris 15 mM Tricine 50 mM Coomassie-Blau G250 0,02% Bereiten Sie 1 Liter als 10fach, pH-Wert auf 7,0 mit HCl, und lagern bei 4 ° C. Verdünnen 1:10 mit dH 2 O vor dem Gebrauch. | Verwenden Sie keine anderen Arten von Coomassie Farbstoff wie Coomassie Blau R250 oder kolloidale Coomassie Blau. |
| 9 | Anodenpuffer | Bis-Tris 50 mM Bereiten Sie 1 Liter als 10fach, pH-Wert auf 7,0 mit HCl, und lagern bei 4 ° C. Verdünnen 1:10 mit dH 2 O vor dem Gebrauch. | |
| 10 | Marker Mix | Aldolase (158 kD) 10 mg / mL Catalase (232 kD) 10 mg / mL Ferritin (440 und 880 kD) 10 mg / mL Thyreoglobulin (670 kD) 10 mg / mL BSA (66 und 132 kD) 10 mg / mL Bis-Tris 20 mM NaCl 20 mM Glycerin 10% Der pH-Wert auf 7,0 mit HCl. Lagerung bei 4 ° C. | Molekulargewichtsmarker sind auch kommerziell erhältlich von verschiedenen Quellen, einschließlich Invitro-gen oder Pharmacia. |
| 11 | SDS-Probenpuffer | Tris 12,5 mM SDS 4% Glycerin 20% Bromphenolblau 0,02% Der pH-Wert auf 6,8. Zur Reduzierung der Disulfidbrücken, fügen 9 mL β-Mercaptoethanol. | SDS als Pulver und β-mer-captoethanol sind giftig. Verwenden Sie daher Handschuhe und arbeiten unter einer Haube. |
| 12 | 4x unteren Puffer | Tris 1,5 M SDS 0,4% Der pH-Wert auf 8,8. | SDS als Pulver ist giftig. Verwenden Sie daher Handschuhe und arbeiten unter einer Haube. |
| 13 | 4x oberen Puffer | Tris 0,5 M SDS 0,4% Der pH-Wert auf 6,8. | SDS als Pulver ist giftig. Verwenden Sie daher Handschuhe und arbeiten unter einer Haube. |
| 14 | 10% Trenngel | Acrylamid (30%) 2,0 mL 4x unteren Puffer 1,5 ml dH 2 O 2,454 mL APS, 10% in dH 2 O 40 ul TEMED 6 ul | Add APS und TEMED unver-züglich vor dem Gießen-Gel, da diese Reagenzien zu fördern Polymerisation. Dieses Rezept ist ausreichend, um einen 30-ml-Gel gegossen. Lautstärkeanpassung für die Anzahl und Größe der Gele gegossen. |
| 15 | 4,8% Stacking Gel | Acrylamid (30%) 320 ul 4x oberen Puffer 500 ul dH 2 O 1,16 ml APS, 10% in dH 2 O 20 ul TEMED 2 ul | Add APS und TEMED unver-züglich vor dem Gießen-Gel, da diese Reagenzien zu fördern Polymerisation. Dieses Rezept ist ausreichend, um einen 30-ml-Gel gegossen. Lautstärkeanpassung für die Anzahl und Größe der Gele gegossen. |
| 16 | Semidry Transfer-Buffer | Tris 48 mm Glycine 39 mM Methanol 20% SDS 0,1% Anpassen der Lautstärke auf 1 Liter mit dH 2 O. Lagerung bei Raumtemperatur. | SDS als Pulver und Methanol sind giftig. Verwenden Sie daher Handschuhe und arbeiten unter einer Haube. |
Diskussion
In dieser Studie beschreiben wir die Analyse der PLM nach BN-PAGE. Ein 2D-Ansatz ist die erste eigenständige MPC unter nativen Bedingungen verwendet werden, und dann weiter zu unterteilen sie in ihre einzelnen Komponenten durch eine zweite Dimension SDS-PAGE.
Die Proben werden aus Zelllysaten vorbereitet. Für die Solubilisierung von vielen Mittelmeer-Partnerländer, ist ein geeignetes Reinigungsmittel benötigt, die bewahrt die Struktur des Protein-Komplexen. Hier verwenden wir 0,1% Triton X-100. Allerdings haben die optimale Reinigungs-und ihrer geeigneten Konzentration empirisch für jeden MPC bestimmt werden. Im Falle von Triton X-100 zum Beispiel wurde berichtet, dass niedrige Detergenzkonzentrationen die Identifizierung einer dimeren Form des F 1 ermöglichen F 0-ATPase-Komplex (Arnold, Pfeiffer et al. 1998). Höhere Triton X-100-Konzentrationen, jedoch auf die Dissoziation des Dimers und zu einer entsprechenden Erhöhung der monomeren F 1 F 0-ATPase-Komplexes führen. Dies steht im Einklang mit einem unserer früheren Studien konnten wir zeigen, dass die multivalente T-Zell-Rezeptor-Komplex (TCR) erhalten bleibt, wenn sie mit geringen Konzentrationen von Brij 96 extrahiert, während die Verwendung von höheren Konzentrationen oder eines anderen Waschmittel genannt Digitonin Ergebnisse in die Gewinnung von monomerem TCR (Schamel, Arechaga et al. 2005). Häufig verwendete Reinigungsmittel, die getestet werden können, gehören Digitonin (0,5 bis 1%), Triton X-100 (0,1 bis 0,5%), Brij 96 (0,1 bis 0,5%), oder Dodecylmaltosid (0,1 bis 0,5%). Diese Reagenzien sind ionische Detergenzien, die am besten für MPC Stabilität neigen. Seien Sie sich bewusst, dass der Kontakt mit SDS und andere scharfe Reinigungsmittel sollten vermieden (Camacho-Carvajal, Wollscheid et al. 2004).
Dialyse der Lysate wird benötigt, um MPC Trennung in einem BN-Gel (Camacho-Carvajal, Wollscheid et al 2004). Erzielen; (Heiss, Junkes et al 2005).. Es scheint, dass die Einstellung der Salzkonzentration oder die Entfernung von Verunreinigungen mit niedrigem Molekulargewicht entscheidend für eine hohe Auflösung. Es ist bemerkenswert, dass auch Membran-Präparationen und MPC, die seit immunopurified haben und später aus dem Antikörper eluiert, geeignet für BN-PAGE werden (Swamy, Siegers et al. 2006). In beiden Fällen müssen die Proben nicht für BN-PAGE Trennung dialysiert werden, wenn Membran Lyse oder Elution erfolgt in BN-Lysepuffer durchgeführt.
Für Protein Trennung durch BN-PAGE, wird der Farbstoff Coomassie-Blau benötigt, was bindet unspezifisch an Proteine und bedeckt sie mit negativen Ladungen. Dadurch ermöglicht die Coomassie-Blau der elektrophoretischen Mobilität von Proteinen in Richtung der Kathode bei neutralem pH (Schägger und von Jagow 1991); (Schägger, Cramer et al 1994).. Darüber hinaus verhindert Coomassieblau Proteinaggregation in den Stapeln Gel während der Elektrophorese. Für BN-PAGE wurde Coomassie G250, um anstelle von Coomassie Blau R250 oder kolloidale Coomassie Blau verwendet werden.
Bevor Sie eine BN-Gel, ist es notwendig, um sicherzustellen, dass der Anteil des Gels auf die erwartete Größe des MPC von Interesse passt. Vorgefertigte BN-Gele mit unterschiedlichen Steigungen und geeignete Puffer sind im Handel erhältlich von Invitrogen (NativePAGE Novex Bis-Tris Gel System). Aber BN-Gele können auch unter Verwendung eines Gradientenmischer zusammen mit einem persistaltic pumpen. Um zu gewährleisten, eine intakte Gradienten, sollte die Flüssigkeit fließen ständig während des Gießens und Blasen zu vermeiden. Wir empfehlen das Laden von verschiedenen Probenverdünnungen auf das Gel weil Überlastung kann zu Proteinfällung während der Elektrophorese-Verfahren führen. Darüber hinaus sollten BN-Gels bei 4 laufen ° C bis Proteinabbau zu verhindern und zu halten, den Mittelmeer-Partnerländern intakt.
Nach BN-PAGE, Visualisierung der Mittelmeer-Partnerländer durch Coomassie Brilliant Blue-Färbung, Silberfärbung oder Immunoblotting erreicht werden. Proteinbanden sichtbar gemacht durch Coomassie-oder Silberfärbung sind für die weitere Analyse geeignet durch Massenspektrometrie (Camacho-Carvajal, Wollscheid et al. 2004). Im Falle von Immunoblot, haben die optimale Übertragung Bedingungen für die Mittelmeer-Partnerländer von Interesse sind empirisch ermittelt werden. Seien Sie sich bewusst, dass Coomassie-Blau auch während Blotting einer BN-Gel übertragen. Daher wird das Gel nach dem erfolgreichen Transfer farblos, während die Membran eine blaue Farbe ausüben wird. Darüber hinaus ist es wichtig zu erwähnen, dass nicht jeder primärer Antikörper, die für den Nachweis nach SDS-PAGE arbeitet, für Immunoblot auf BN-PAGE ist. Es kann vorkommen, dass Antikörper erkennen nicht die MPC von Interesse, weil ihre Epitop in die native Konformation der Proteine verborgen ist. Um dieses Problem zu überwinden, ist es möglich, die Proteine innerhalb der BN-Gel vor der Übertragung durch Kochen denaturiert das Gel kurz in 1x SDS-Probenpuffer.
In unserem Beispiel haben wir nicht unter dem BN-Gel direkt auf die Erfassung Proteinbanden. Stattdessen haben wir weiter unterteilt die BN-PAGE getrennt Lysat durch eine zweite dimensiauf SDS-PAGE. In der zweiten Dimension SDS-Gel, monomere Proteine innerhalb einer hyperbolischen diagonal durch die Gradienten-Gel in der ersten und der linear-Gel in der zweiten Dimension (Camacho-Carvajal, Wollscheid et al. 2004) zu migrieren. Dies ermöglicht die einfache Identifizierung der Mittelmeer-Partnerländer, da sie unterhalb dieser hyperbolischen Diagonale lokalisiert sind. Unterkomponenten einer deutlichen MPC sind in einer vertikalen Linie in der zweiten Dimension SDS-PAGE getrennt. Komponenten, die Bestandteile von mehreren dinstinct MPCs sind, können auf einer horizontalen Linie nach der Größe der MPC identifiziert werden. Es ist jedoch zu berücksichtigen, dass mehrere Proteinspots erscheinen in einer vertikalen Linie könnte auch ein Teil der getrennten Komplexen, die an der gleichen Position in BN-PAGE wandern werden. Der endgültige Beweis, dass sie in der gleichen MPC sind, können durch einen Antikörper-basierte Gel-Shift-Assay erhalten. In diesem Assay wird Zelllysat mit einem Antikörper gegen ein Protein, das von einem der identifizierten Spots vor der BN-PAGE vertreten inkubiert. Dies führt zu einer Verschiebung aller MPCs, dass dieses Protein enthalten, zu einem höheren Molekulargewicht in der ersten Dimension. Andere Proteine, die auch ein Teil dieser MPCs wird durchlaufen diese komplexe spezifische Schicht und sind deshalb leicht in die zweite Dimension SDS-Gel zu identifizieren.
Nicht nur die Zusammensetzung der Mittelmeer-Partnerländer durch BN-PAGE analysiert werden, sondern auch die Bestimmung ihrer Stöchiometrie ist möglich (Schamel und Reth 2000); (Schamel 2001), (Swamy, Minguet et al 2007).. Zu diesem Zweck kann ein NAMOS Assay (native Antikörper-basierte Mobility-Shift-Assay) durchgeführt werden. Wie in der Antikörper-basierte Gel-Shift-Assay werden die zellulären Lysaten mit monoklonalen Untereinheit-spezifischen Antikörper inkubiert. Dies führt zur Induktion der elektrophoretischen immunoshifts in der BN-Gele, die den Schluss erlauben aus dem Ausmaß der Verschiebung von der Stöchiometrie der MPC
In SCHLUSSKOMMENTAR ist BN-PAGE geeignet für die Identifizierung von MPL und die Bestimmung ihrer Größe, Zusammensetzung, sowie relative Häufigkeit. Aufgeführt als NAMOS Assay, es bietet auch die Möglichkeit, die Stöchiometrie einer bestimmten MPC bestimmen. Aufgrund seiner allgemeinen Anwendbarkeit, ist diese Technik ein sehr nützliches Werkzeug für die Charakterisierung von PLM (Dekker, Müller et al 1996.); (Wittig und Schagger 2008); (Wagner, Rehling et al 2009.); (Wittig und Schägger 2009) .
Offenlegungen
Danksagungen
Wir danken Michael Reth, Hermann Schägger und Margarita Camacho-Carvajal für die wissenschaftliche Unterstützung. Diese Arbeit wurde von FORSYS vom Bundesministerium fuer Bildung und Forschung (BMBF) gefördert, durch BIOSS von der Deutschen Forschungsgemeinschaft (DFG), und unterstützt zum Teil durch die Exzellenzinitiative der deutschen Bundesregierung und der Länder (GSC-4, Spemann Graduiertenschule ).
Referenzen
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten