Method Article
Синий Родные электрофореза в полиакриламидном геле (BN-PAGE) для анализа Multiprotein Комплексы из ячеистого Лизаты
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом видео мы описываем характеристики multiprotein комплексов (ПДК) синим родной электрофореза в полиакриламидном геле (БН-PAGE). В первом измерении, диализовали сотовой лизатов разделены БН-PAGE для идентификации отдельных ПДК. В втором измерении SDS-PAGE, ПДК интерес в свою очередь подразделяются для анализа своих избирателей с помощью метода иммуноблоттинга.
Аннотация
Multiprotein комплексов (ПДК) играют важную роль в клеточной сигнализации, так как большинство белков может быть найден в функциональном или нормативных комплексов с другими белками (Сали, Glaeser и соавт. 2003). Таким образом, исследования белок-белковых взаимодействий сетей требует детальной характеристики ПДК, чтобы получить понимание интегративной функции белка и регулирования. Для идентификации и анализа, ПДК должны быть разделены по родной условиях. В этом видео мы описываем анализ ПДК синим родной электрофореза в полиакриламидном геле (БН-PAGE). БН-страница представляет собой метод, который позволяет разделение ПДК в нативной конформации с высоким разрешением, чем предлагаемые гель-фильтрации или центрифугирования плотности сахарозы, и поэтому полезен для определения ПДК размер, состав и относительное изобилие (Schägger и фон Jagow 1991) ; (Schägger, Крамер и др., 1994.). С помощью этого метода, белки разделяются в зависимости от их гидродинамические размеры и форму в полиакриламидном матрицы. Здесь мы демонстрируем анализ ПДК от общего числа сотовых лизатов, указывая, что лизат диализ решающий шаг, чтобы сделать БН-СТРАНИЦА, применимых к этим биологическим образцам. Используя комбинацию первого измерения БН-и второе измерение SDS-PAGE, мы покажем, что ПДК, разделенных БН-страница может быть далее подразделены на их отдельных компонентов на SDS-PAGE. Визуализация компонентов ПДК на гель разделение осуществляется стандартным иммуноблоттинга. В качестве примера для MPC анализа БН-страницу, мы выбрали хорошо известных эукариотических 19S, 20S, 26S и протеасом.
протокол
** Это видео протокол основан на связанный публикации 1: Голубые Родные электрофореза в полиакриламидном геле (BN-PAGE) для идентификации и анализа Multiprotein комплексов. Махима Свами, Габриэль М. Siegers, Susana Minguet, Бернд Wollscheid и Вольфганг WA Schamel. STKE Науки 2006 (345): pl2 25 июля 2006 года [DOI: 10.1126/stke.3892006pl4]. Пожалуйста, нажмите здесь, чтобы посмотреть эту публикацию .
1. Подготовка диализу лизат ячейки
- Урожай 10х10 6 клеток и гранул центрифугированием при 350g в течение 5 мин при 4 ° C.
- Промыть осадок клеток в три раза с 1 мл ледяной PBS (рецепт 1), центрифуги, как в пункте 1.1.
- Ресуспендируют осадок в 250 мкл ледяной БН-лизирующего буфера (рецепт 2) и инкубировать на льду в течение 15 мин.
- Центрифуга при 13000 г в течение 15 мин при 4 ° С для удаления нерастворимого материала.
- Растопить отверстие в крышке 1,5-мл микроцентрифужных трубки использованием подогревом большой стороны диаметр пипетки Пастера, затем поместите трубку на лед для охлаждения до 4 ° C.
- Передача супернатант с шага в 1,4 охлажденной трубки с отверстием в крышке.
- Место диализных мембран (молекулярная масса отсечки 10 кДа) щипцами сверху открыл трубу, закройте крышку, и отсек избыток мембран диализа, что торчит.
- Уплотнение крышки на стороне тщательно парафильмом.
- Обратить труб и центрифуги вверх дном на минимальной скорости возможно в 50-мл конические пробирки в центрифугу культуре клеток в течение 10 сек при 4 ° C. Удалить перевернутая трубка из центрифуги с помощью пинцета, чтобы избежать превращения стороне трубки право.
- Подготовка 100-мл стакан с холодной диализа БН-буфера (рецепт 3) и мешалки. Используйте как минимум 10 мл БН-диализа Буфер на 100-мкл образца.
- Прикрепите трубку с лентой вверх-вниз внутри стакана, и удалить пузырьки воздуха из отверстия под крышкой использованием изогнутых пипетки Пастера.
- Место стакан поверх магнит мешалки, включите мешалку и оставить на 6 часов или на ночь в холодной комнате. Проверьте иногда, чтобы обеспечить перемешивание не создавая воздушных пузырей на диализе мембраны.
- Сбор диализу лизат ячейки в новой охлажденной трубки микроцентрифужных.
2. Заливка БН-гели
- Градиент заливки геля происходит при комнатной температуре с градиентом смесителя. Перчатки необходимо надевать, потому полиакриламидном очень нейротоксическое. Избегайте контактов с SDS.
- Место градиент миксером на мешалки и приложите его к кусок гибкого шланга. Закрыть канал с помощью клапана и закройте трубки с зажимом. Место магнитной мешалкой 15% в "высокий" цилиндр связан с трубкой.
- Тема гибкий шланг в peristalitic насоса и присоединить иглу шприца до конца. Затем поместите иглу между двумя стеклянными пластинами гель аппарата.
- Подготовка 4% (рецепт 5) и 15% (рецепт 6) разделения гель решения, добавив, APS и TEMED непосредственно перед употреблением. Комбинированный объемов должен быть равен объему разделения гель.
- Залить этим гелем решения в соответствующие цилиндры градиент микшера (4% в "низкий" и 15% в "высокий" цилиндр).
- Откройте клапан и вытеснить пузырьки воздуха внутри канала, соединяющего два водохранилища гель, нажав на левую цилиндр с большим пальцем.
- Включите магнитной мешалкой, снимите зажим, и включить насос peristalitic по 5 мл в минуту. Разрешить гель медленно потока между стеклянными пластинами. Убедитесь, что игла всегда выше жидкости.
- Разрешить все жидкости ввести гель аппарата, а затем наложение осторожно изопропанола. Разрешить гель для полимеризации, по крайней мере 30 мин при комнатной температуре.
- Чистая проливным аппарата сразу с дН 2 O (не используйте моющие средства).
- Удалить изопропанол, промыть дН 2 O, и удалить дН 2 O с ватмане.
- Подготовка 3,2% концентрирующий гель (рецепт 7), добавив, APS и TEMED непосредственно перед употреблением.
- Налейте концентрирующий гель на вершине разделения гель и ввести гребень между стеклянными пластинами, избегая пузырей. После укладки гель полимеризуется, прохладный гель до 4 ° C.
- Непосредственно перед загрузкой образца, удалите гребень медленно, потянув ее под углом к плоскости геля. Это позволяет воздуху поступать в карманы быстро, что улучшает качество скважин.
3. Разделение диализу лизат ячейки БН-СТРАНИЦА
- Нагрузка от 1 до 40 мкл лизата диализу и от 10 до 20 мкл Маркер Mix (рецепт 10) в сухих скважин при температуре 4 ° C. Наложение образцов в каждую лунку с холодным катодом буфера (рецепт 8).
- Заполните внутренней камеры с холодной Cathode буфера и наружный / нижняя палата с холодной буфера Анодные (рецепт 9).
- Применить от 100 В до 150 В или minigel в значительной гель, пока образцы ввели разделение геля. Выполнить гель при температуре 4 ° C.
- Повышение напряжения до 180 В (minigel) или 400 В (большие гель) и продлится до красителя перед достигает конца геля. Запустить занимает от 3 до 4 часов для мини-и от 18 до 24 часов для большого геля.
4. Второе измерение SDS-PAGE
- Подготовка стандартных 10% SDS-гель (рецепты 12-15) с одной большой полосы для первого измерения БН-PAGE переулок, одну очередную полосу движения для маркер молекулярного веса, и одну очередную полосу движения для Аликвоту диализовали лизат, которая смешивают с SDS образца буфера (рецепт 11) и кипятят в течение 5 мин при 95 ° C. Используйте прокладки, толщина которых была увеличена на два слоя скотча для упрощения загрузки БН-ПААГ геля на SDS гель.
- Удалить БН-PAGE гель в плиты из аппарата электрофореза и аккуратно приподнимите одну пластину.
- Удалить концентрирующий гель и вырезать полосу БН-PAGE гель, содержащий белки, представляющих интерес.
- Место БН-ПААГ геля в 2 раза SDS буфера выборки и инкубировать в течение 10 мин при комнатной температуре.
- Отварите БН-PAGE геля кратко (не более 20 сек) в микроволновой печи.
- Инкубируйте БН-PAGE геля в горячей Пример SDS буфера в течение еще 15 минут при комнатной температуре.
- Нагрузка БН-ПААГ геля в больших свыше укладки гель SDS-PAGE гель избегая пузырьков воздуха, и наложения ломтик буфером Пример SDS. Нагрузка маркер и лизат контроля.
- Выполните электрофореза в соответствии со стандартными протоколами.
5. Обнаружение подразделения ПДК иммуноблоттинга
- Для передачи, подготовить шесть Ватман бумаг и мембраны PVDF установки на размер SDS-гель.
- Инкубируйте мембраны PVDF в 100% метаноле в течение 30 с и понежиться Ватман статей в буфер передачи (рецепт 16).
- Поместите три ватмана бумаг, мембраны PVDF, SDS-гель (снять концентрирующий гель), и снова три ватмана статей в сэндвич-подобные структуры в полусухого переноса.
- Применяют 20 В в течение 25 мин.
- Обнаружение белков в соответствии со стандартными протоколами иммуноблоттинга.
6. Представитель Результаты
Мы представляем анализ эукариотической 19S, 20S, 26S и протеасом в качестве примера для характеристики ПДК в 2D-BN / SDS-PAGE (рис. 1А). НЕК293 лизировали с буфером, содержащим 0,1% Тритон Х-100, как моющее средство сорвать мембран и растворить комплексов мембранных белков. Эти лизаты диализу против БН-диализа буфера для удаления солей и малых метаболитов. Затем, ПДК были разделены 4-15% градиент БН-PAGE затем второе измерение SDS-PAGE. Белки были визуализированы с помощью метода иммуноблоттинга с антителами против субъединиц β2 и Mcp21 из 20S протеасомы.
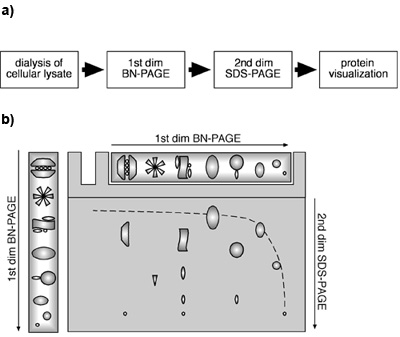
Рисунок 1. Двумерных BN-PAGE/SDS-PAGE подход с использованием сотовой лизатов. () Принципиальная схема 2D подход BN-PAGE/SDS-PAGE из ячеистого лизатов. (В) Схема схема 2D BN-PAGE/SDS-PAGE. Белки и ПДК разделены под родной условий БН-PAGE в первом измерении. Для второго измерения, белков и / или ПДК денатурированного с помощью ДСН в геле полоса после отделения БН-PAGE и затем подвергают SDS-PAGE. Мономерные белки будут мигрировать в гиперболической диагональные связи с градиентом геля в первом и линейного геля во втором измерении. Компоненты одного конкретного MPC будет найден ниже диагонали, расположенные на вертикальной линии.
Было показано, что сочетание первого измерения БН-и второе измерение SDS-PAGE, мономерные белки мигрировать в гиперболической диагональные связи с градиентом геля в первом и линейного геля во втором измерении ((Камачо Карвахаль, Wollscheid и др. др. 2004);. рис. 1b). Компоненты ПДК расположены ниже этой диагонали. Белки, которые представляют подразделения одного и того же MPC можно найти в одной вертикальной линии во втором измерении, в то время нескольких местах одного и того же белка в горизонтальной линии указывает на наличие белка в нескольких различных ПДК. Рисунок 2 показывает, что в нашем эксперименте иммуноблоттинга против β2 и Mcp21 показал наличие специфических белковых комплексов, содержащих эти протеасомной субъединицы. Оба белка были обнаружены в виде отдельных пятен, расположенных в горизонтальной линией, указывая, что β2 и Mcp21 представляют компоненты нескольких различных ПДК. Эти ПДК можно четко определить как 26S протеасом (20S 19S плюс крышка), 20S протеасомы вместе с регуляторной субъединицы PA28 и 20S протеасом только на основании их размера и состава. Взятые вместе, эти resuLTS продемонстрировать, что эндогенные ПДК могут быть идентифицированы и характеризуется двумерным BN-PAGE/SDS-PAGE подход с использованием сотовой лизат. Этот метод применим для определения размера, состава и относительного содержания ПДК.

Рисунок 2. Обнаружение различных форм эукариот протеасом путем иммуноблоттинга после двумерного BN-PAGE/SDS-PAGE. Для выявления и анализа эукариот протеасом, HEK293 лизировали с 0,1% Тритон Х-100. Сотовая лизаты диализуют и затем подвергают БН-PAGE (4-15%), чтобы отделить ПДК. Впоследствии, второе измерение SDS-PAGE (10%) был запущен на размер разделения отдельных компонентов. Иммуноблоттинг была выполнена со специфическими антителами признании Mcp21 и β2 субъединицы комплекса ядро 20С, а регуляторная субъединица PA28.
I. Таблица специфических реагентов (в алфавитном порядке):
| Реагент | Компания | Комментарии |
| 6-aminohexanoic кислоты (Ε-аминокапроновая кислота) | Sigma-Aldrich, Тауфкирхен, Германия | Это химическое вещество раздражающего и должны быть обработаны с перчатками. |
| Акриламид-bisacrylamide решение (40%), Mix 32:1 | AppliChem, Дармштадт, Германия | Это решение является нейротоксическое и должны быть обработаны с перчатками. |
| Бис-трис | Рот, Карлсруэ, Герма-Нью-Йорк | |
| Бридж 96 | Sigma-Aldrich, Тауфкирхен, Германия | |
| Кумасси синий G250 | Служанка, Гейдельберг, Германия многих | Не заменять другими видами Кумасси красителей, таких как Кумасси синий R250 или коллоидной Ку-Масси блюз. |
| Дигитонин | Sigma-Aldrich, Тауфкирхен, Германия | Дигитонин является токсичным. Перчатки должны быть надеты при обработке буферов или образцов, содержащих это моющим средством. |
| Dodecylmaltoside | AppliChem, Дармштадт, Германия | |
| Тритон Х-100 | Рот, Карлсруэ, Герма-Нью-Йорк | Тритон Х-100 является токсичным. Перчатки должны быть надеты при обработке буферов или образцов, содержащих это моющее средство. |
II. Таблица конкретных материалов и оборудования:
| Оборудование | Компания |
| Диализ мембраны (молекулярный вес отсечки 10 до 50 кДа) | Рот, Карлсруэ, Германия |
| Система Гель-электрофорез | Например, из Bio-Rad, Мюнхен, Германия |
| Градиент смесителя | Самодельные или коммерчески доступны от Bio-Rad, Мюнхен, Германия |
| Перистальтический насос | Amersham Pharmacia Biotech, Фрайбург, Германия |
| Поливинилиденфторид дифторида (PVDF) мембраны | Immobilon-P, Millipore, Эшборн, Германия |
| Полусухой передачи оборудования | Например, из Bio-Rad, Мюнхен, Германия |
| Силиконовая трубка (от 3 до 5 мм в диаметре, 1 м длины) | NeoLab, Гейдельберг, Германия |
III. Таблица рецептов:
| Нет. | Буферы и решения | Содержание | Комментарии |
| 1 | Фосфатно-солевом буфере (PBS) | Na 2 HPO 4 8,1 mMKH 2 PO 4 1,5 мМ NaCl 138 мм 2,7 мМ KCl | Решение должно быть рН 7,4, если подготовлено должным образом. |
| 2 | БН-лизирующего буфера | База буфер Бис-20 мМ трис ε-аминокапроновой кислоты 500 мМ NaCl 20 мМ ЭДТА, рН 8,0, 2 мМ Глицерин 10% Отрегулируйте рН до 7,0 с помощью соляной кислоты. Хранить при температуре 4 ° С. Моющее средство Дигитонин 0,5 до 1,0% или Brij 96 от 0,1 до 0,5% или Тритон Х-100 от 0,1 до 0,5% или Dodecylmaltoside 0,1 до 0,5% Протеаз и ингибиторов фосфатазы Апротинин 10 мкг / мл Leupeptin 10 мкг / мл PMSF 1 мМ Фторид натрия 0,5 мМ Натрий ортованадата 0,5 мМ | Соответствующих моющих средств должны быть определены эмпирически и должна быть такой же, что и в других рецептов буфера для лизиса. Дигитонин должны быть добавлены непосредственно перед употреблением из 2% маточного раствора в дН 2 O (магазин в 5-мл аликвоты при -20 ° С). Протеазы и phophatase ингибируют-ORS следует добавить непосредственно перед употреблением. При добавлении натрия orthova-nadate, буфер станет желтоватого цвета. |
| 3 | БН-диализа буфера | База буфер Бис-20 мМ трис ε-аминокапроновой кислоты 500 мМ NaCl 20 мМ ЭДТА, рН 8,0, 2 мМ Глицерин 10% Отрегулируйте рН до 7,0 с помощью соляной кислоты. Хранить при температуре 4 ° С. Моющее средство Дигитонин 0,3 до 0,5% или Тритон Х-100 0,1% или Brij 96 0,1% или Dodecylmaltoside 0,1% Протеаз и ингибиторов фосфатазы PMSF 1 мМ Натрий ортованадата 0,5 мМ | Соответствующих моющих средств должны быть определены эмпирически и должна быть такой же, что и в других буферах лизис, но в указанных ниже концентрациях. Моющие средства должны быть добавлены, чтобы предотвратить агрегирование на шаг укладки гель-электрофореза. Протеазы и phophatase ингибируют-ORS следует добавить непосредственно перед употреблением. |
| 4 | 3x БН-гель буфера | Бис-150 мМ трис ε-аминокапроновой кислоты 200 мМ Отрегулируйте рН до 7,0 с помощью соляной кислоты. Хранить при температуре 4 ° С. | |
| 5 | 4% Разделение Гель | 3x БН-гель буфера (рецепт 4) 5,00 мл Акриламид / Bisacrylamide 1,50 мл дН 2 O 8,50 мл APS, 10% в дН 2 O 54 мкл TEMED 5,4 мкл | Добавить APS и TEMED immedia-tely перед заливкой геля, так как эти реагенты способствующих полимеризации. Этот рецепт достаточно, чтобы бросить 30-мл геля. Отрегулируйте объемы количество и размер гели льется. |
| 6 | 15% Разделение Гель | 3x БН-гель буфера (рецепт 4) 5,00 мл Акриламид / Bisacrylamide 5,63 мл Глицерин 70% 4,38 мл APS, 10% в дН 2 O 42 мкл TEMED 4,2 мкл | Добавить APS и TEMED immedia-tely перед заливкой геля, так как эти реагенты способствующих полимеризации. Этот рецепт достаточно, чтобы бросить 30-мл геля. Отрегулируйте объемы количество и размер гели льется. Концентрация акриламида bisacrylamide также может быть изменена по мере необходимости с 10 до 18%. |
| 7 | 3,2% Укладка Гель | 3x БН-гель буфера (рецепт 4) 3,00 мл Акриламид / Bisacrylamide 0,72 мл дН 2 O 5,28 мл APS, 10% в дН 2 O 120 мкл TEMED 12 мкл | Добавить APS и TEMED immedia-tely перед заливкой геля, так как эти реагенты способствующих полимеризации. Этот рецепт достаточно, чтобы бросить 30-мл геля. Отрегулируйте объемы количество и размер гели льется. |
| 8 | Катод буфера | Бис-15 мМ трис Tricine 50 мМ Кумасси синий G250 0,02% Подготовка 1 литр, как 10-кратный запас, отрегулировать рН до 7,0 с помощью соляной кислоты, и хранить при температуре 4 ° C. Развести 1:10 с дН 2 O перед использованием. | Не заменять другими видами Кумасси красителей, таких как Кумасси синий R250 или коллоидной блюз Кумасси. |
| 9 | Анодный буфер | Бис-50 мМ трис Подготовка 1 литр, как 10-кратный запас, отрегулировать рН до 7,0 с помощью соляной кислоты, и хранить при температуре 4 ° C. Развести 1:10 с дН 2 O перед использованием. | |
| 10 | Маркер Mix | Альдолазы (158 кДа) 10 мг / мл Каталазы (232 кДа) 10 мг / мл Ферритин (440 и 880 кДа) 10 мг / мл Тиреоглобулина (670 кДа) 10 мг / мл BSA (66 и 132 кДа) 10 мг / мл Бис-20 мМ трис NaCl 20 мМ Глицерин 10% Отрегулируйте рН до 7,0 с помощью соляной кислоты. Хранить при температуре 4 ° С. | Молекулярные маркеры вес также коммерчески доступны из нескольких источников, в том числе Инвитро поколения или Pharmacia. |
| 11 | SDS Пример буфера | Трис 12,5 мм SDS 4% Глицерин 20% Бромфенола синий 0,02% Отрегулируйте рН до 6,8. Чтобы уменьшить дисульфидных связей, добавить 9 мл β-меркаптоэтанола. | SDS в виде порошка и β-Мер-captoethanol являются токсичными. Поэтому используйте перчатки и работать под капотом. |
| 12 | 4x нижнего буфера | 1,5 М Трис SDS 0,4% Отрегулируйте рН до 8,8. | SDS в виде порошка является токсичным. Поэтому используйте перчатки и работать под капотом. |
| 13 | 4-кратный верхний буфер | Трис 0,5 M SDS 0,4% Отрегулируйте рН до 6,8. | SDS в виде порошка является токсичным. Поэтому используйте перчатки и работать под капотом. |
| 14 | 10% Разделение Гель | Акриламид (30%) 2,0 мл 4x ниже 1,5 мл буфера дН 2 O 2,454 мл APS, 10% в дН 2 O 40 мкл TEMED 6 мкл | Добавить APS и TEMED immedia-tely перед заливкой геля, так как эти реагенты способствующих полимеризации. Этот рецепт достаточно, чтобы бросить 30-мл геля. Отрегулируйте объемы количество и размер гели льется. |
| 15 | 4,8% Укладка Гель | Acylamide (30%) 320 мкл 4-кратный верхний буфером 500 мкл дН 2 O 1,16 мл APS, 10% в дН 2 O 20 мкл TEMED 2 мкл | Добавить APS и TEMED immedia-tely перед заливкой геля, так как эти реагенты способствующих полимеризации. Этот рецепт достаточно, чтобы бросить 30-мл геля. Отрегулируйте объемы количество и размер гели льется. |
| 16 | Полусухое передача буфера | Трис 48 мМ Глицин 39 мм Метанол 20% SDS 0,1% Регулировка громкости до 1 литра дН 2 O. Хранить при комнатной температуре. | SDS в виде порошка и метанола являются токсичными. Поэтому используйте перчатки и работать под капотом. |
Обсуждение
В этом исследовании мы опишем анализ ПДК по БН-PAGE. 2D подход используется для первого отдельного ПДК в нативных условиях, а затем в дальнейшем разделить их на отдельные компоненты, второе измерение SDS-PAGE.
Образцы готовят из клеточных лизатов. Для растворения многих ПДК, соответствующих моющих средств необходимо, который сохраняет структуру белковых комплексов. Здесь мы используем 0,1% Тритон Х-100. Однако, оптимальное моющее средство и его подходящей концентрации должны быть определены эмпирически для каждого ПДК. В случае Тритон Х-100, например, было сообщено, что низкие концентрации моющего средства позволяют выявлять димерных форм F 1 F 0-АТФазы комплекса (Арнольд, Пфайфер и соавт. 1998). Высшее Тритон Х-100 концентрациях, однако, привести к диссоциации димера и соответствующее увеличение мономерных F 1 F 0-АТФазы комплекса. Это согласуется с одним из наших бывших исследования, были мы покажем, что поливалентные Т-клеточного рецептора комплекса (TCR) сохраняется после извлечения с низкой концентрацией Brij 96, в то время как использование более высокой концентрации или другого моющего средства называются дигитонин результаты в извлечение мономерных TCR (Schamel, Аречаги и соавт. 2005). Часто используемые моющие средства, которые могут быть проверены включают дигитонин (от 0,5 до 1%), Тритон Х-100 (от 0,1 до 0,5%), Бридж 96 (от 0,1 до 0,5%), или dodecylmaltoside (от 0,1 до 0,5%). Эти реагенты неионогенные моющие средства, которые имеют тенденцию быть лучше для стабильности ПДК. Имейте в виду, что контакт с СДС и другие сильные моющие средства следует избегать (Камачо Карвахаль, Wollscheid и соавт. 2004).
Диализ лизатов является необходимой для достижения ПДК разделения в БН-гель (Камачо Карвахаль, Wollscheid и др. 2004 год.); (Хайс, Junkes и др. 2005).. Кажется, что корректировка концентрации соли или удаления низкомолекулярных примесей вес имеет решающее значение для высокого разрешения. Стоит отметить, что также мембранные препараты и ПДК, которые были immunopurified а позже вымывают из антител, пригодных для БН-PAGE (Свами, Siegers и соавт. 2006). В обоих случаях образцы не должны быть диализу для БН-PAGE разделения, если лизис мембраны или элюирования осуществляется в БН-лизис буфера.
Для разделения белков по БН-PAGE, краситель синий Кумасси необходима, который связывается с белками неспецифичным и покрывает их с отрицательными зарядами. Таким образом, Кумасси синим позволяет электрофоретической подвижности белков к катоду при нейтральном рН (Schägger и фон Jagow 1991); (Schägger, Крамер и др., 1994.). Кроме того, Кумасси синий препятствует агрегации белков в концентрирующий гель во время электрофореза. Для БН-PAGE, Кумасси G250 должен быть использован вместо Кумасси синий R250 или коллоидной блюз Кумасси.
Перед запуском БН-гель, необходимо, чтобы процент гель подходит для ожидаемого размера ПДК интерес. Сборный БН-гели с различными градиентами и подходящих буферов являются коммерчески доступными из Invitrogen (NativePAGE Novex Bis-Tris Гель System). Но БН-гели могут быть также получены с использованием градиента смеситель вместе с persistaltic насоса. Чтобы гарантировать нетронутыми градиент, жидкость должна поступать постоянно при разливке и пузыри следует избегать. Мы рекомендуем загрузку различных разведений образца на гель потому что перегрузка может привести к осаждения белка во время электрофореза процесса. Кроме того, БН-гели должны быть запущены при 4 ° С для предотвращения деградации белка и держать ПДК нетронутыми.
После БН-PAGE, визуализация ПДК может быть достигнуто путем Кумасси бриллиантовый синий окрашивания, окрашивания серебром или иммуноблоттинга. Белки полосы визуализировали окрашиванием Кумасси или серебро являются подходящими для дальнейшего анализа методом масс-спектрометрии (Камачо Карвахаль, Wollscheid и соавт. 2004). В случае иммуноблоттинга, оптимальные условия для передачи ПДК интереса должны быть определены опытным путем. Помните, что Кумасси синий также передается во время блоттинга БН-гель. Таким образом, гель будет бесцветным после успешной передачи, в то время как мембрана будет оказывать синего цвета. Кроме того, важно отметить, что не каждое первичное антитело, которое работает для обнаружения после SDS-PAGE, применимо к иммуноблоттинга на БН-PAGE. Это может случиться, что антитела не признают ПДК интерес, потому что их эпитопа скрыт в родной конформации белков. Чтобы преодолеть эту проблему, можно для денатурации белков в БН-гель до передачи в кипящей геля в скором времени в 1х буфере образец SDS.
В нашем примере, мы не предмет БН-гель непосредственно на обнаружение белка полосы. Вместо этого, мы разделены БН-PAGE разделенных лизат вторым dimensiна SDS-PAGE. Во втором измерении SDS-гель, мономерные белки мигрировать в гиперболической диагональные связи с градиентом геля в первом и линейного геля во втором измерении (Камачо Карвахаль, Wollscheid и соавт. 2004). Это позволяет легко идентифицировать ПДК, так как они локализованы ниже этой гиперболической диагонали. Подкомпоненты одно определенное MPC разделяются в вертикальную линию во втором измерении SDS-PAGE. Компоненты, которые входят в состав нескольких ПДК dinstinct может быть идентифицирован по горизонтальной линии в соответствии с размером ПДК. Тем не менее, он должен учитывать, что несколько мест белков, входящих в одной вертикальной линии может также быть частью отдельных комплексов, которые мигрируют на той же позиции в БН-PAGE. Окончательное доказательство того, что они находятся в том же MPC может быть получена на основе антител методом сдвига геля. В данном анализе сотовой лизат инкубировали с антителами против белка представлен одним из выявленных пятна до БН-PAGE. Это приводит к сдвигу всех ПДК, которые содержат этот белок в направлении более высокой молекулярной массы в первом измерении. Другие белки, которые также являются частью этих ПДК будет проходить этот комплекс конкретных сдвига и, следовательно, легко определить, во втором измерении SDS-гель.
Не только состав ПДК могут быть проанализированы БН-страницы, но также определение их стехиометрии можно (и Schamel Reth 2000); (Schamel 2001), (Свами, Minguet и др. 2007 год.). Для этого анализа Namos (родной основе антител мобильности сдвига анализ) может быть выполнена. Как и в основе антител методом сдвига геля, сотовые лизатов инкубировали с моноклональными субъединицы-специфических антител. Это приводит к индукции электрофоретического immunoshifts в БН-гели, которые позволяют вывод из степени переложить на стехиометрии ПДК
В conlusion, БН-страница предназначена для определения ПДК и определение их размера, состава, а также относительное изобилие. Исполняется как анализ Namos, он также предлагает возможность определения стехиометрии определенных ПДК. С учетом его общего применения, этот метод является очень полезным инструментом для характеристики ПДК (Деккер, Мюллер и др., 1996.); (Виттиг и Schagger 2008); (Вагнер, Rehling и др. 2009 год.); (Виттиг и Schägger 2009) .
Раскрытие информации
Благодарности
Мы благодарим Майкла Reth, Герман Schägger, и Маргарита Камачо Карвахаль для научной поддержки. Эта работа финансировалась из FORSYS Bundesministerium Fuer Bildung и Forschung (BMBF), по БИОСС из Deutsche Forschungsgemeinschaft (DFG), а также при частичной поддержке совершенства Инициатива немецкого федерального правительства и правительств (ГСК-4, Спеманн Высшая школа ).
Ссылки
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены