Method Article
Eletroforese em Gel de Poliacrilamida azul Nativo (BN-PAGE) para Análise de Complexos Multiproteicos de Lisados Celular
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Neste vídeo, descrevemos a caracterização de complexos multiprotein (PPM) por eletroforese em gel de poliacrilamida nativo azul (BN-PAGE). Em uma primeira dimensão, dialisadas lisados celulares são separados por BN-PAGE para identificar PPM individual. Em uma segunda dimensão SDS-PAGE, PPM de interesse são subdivididos para analisar os seus constituintes por immunoblotting.
Resumo
Complexos multiprotein (PPM) desempenham um papel crucial na sinalização celular, já que a maioria das proteínas podem ser encontradas em complexos funcionais ou de regulamentação com outras proteínas (Sali, Glaeser et al. 2003). Assim, o estudo das redes de interação proteína-proteína requer a caracterização detalhada do PPM para ganhar uma compreensão integrativa da função da proteína e regulação. Para a identificação e análise, PPM devem ser separados em condições nativas. Neste vídeo, descrevemos a análise do PPM por eletroforese em gel de poliacrilamida nativo azul (BN-PAGE). BN-PAGE é uma técnica que permite a separação de PPM em uma conformação nativa com uma resolução maior que o oferecido por filtração em gel ou ultracentrifugação de densidade de sacarose, e é, portanto, útil para determinar MPC tamanho, composição e abundância relativa (Schägger e von Jagow 1991) ; (Schägger, Cramer et al 1994).. Por este método, as proteínas são separadas de acordo com seu tamanho e forma hidrodinâmica em uma matriz de poliacrilamida. Aqui, demonstramos a análise do PPM do total lisados celulares, apontando que a diálise lisado é o passo crucial para fazer BN-PAGE aplicável a estas amostras biológicas. Usando uma combinação de primeira dimensão BN e segunda dimensão SDS-PAGE, mostramos que PPM separados por BN-PAGE pode ser subdividida em seus componentes individuais por SDS-PAGE. Visualização dos componentes MPC sobre separação gel é realizada por immunoblotting padrão. Como um exemplo para MPC análise por BN-PAGE, que escolheu o 19S bem caracterizados eucarióticas, 20S, 26S e proteasomas.
Protocolo
** Este protocolo de vídeo é baseado em uma publicação associada 1: Eletroforese em Gel Azul nativos de poliacrilamida (PAGE-BN) para a Identificação e Análise de Complexos Multiproteicos. Mahima Swamy, Gabrielle M. Siegers, Susana Minguet, Bernd Wollscheid, e Wolfgang WA Schamel. STKE da ciência 2006 (345): PL2, 25 de julho de 2006, [DOI: 10.1126/stke.3892006pl4]. Clique aqui para ver esta publicação .
1. Preparação do lisado celular dialisadas
- Colheita 10x10 6 células e pellet por centrifugação a 350g por 5 min a 4 ° C.
- Lave o pellet celular três vezes com 1 mL de PBS gelado (receita 1), centrífuga como no passo 1.1.
- Ressuspender pellet em 250 mL de tampão gelada BN-Lise (receita 2) e incubar no gelo por 15 min.
- Centrifugar a 13.000 g por 15 min a 4 ° C para remover o material insolúvel.
- Derreta um furo na tampa de um tubo de microcentrífuga de 1,5 mL usando o lado diâmetro aquecida grande de uma pipeta Pasteur, em seguida, coloque o tubo no gelo para resfriar a 4 ° C.
- Transfira o sobrenadante do passo 1,4 para dentro do tubo refrigerado com o furo na tampa.
- Coloque uma membrana de diálise (peso molecular de corte de 10 kD) com uma pinça na parte superior do tubo aberto, feche a tampa e corte o excesso membrana de diálise que fura para fora.
- Vedação da tampa do lado cuidadosamente com Parafilm.
- Inverter os tubos e centrifugar de cabeça para baixo na velocidade mais baixa possível em um tubo cônico de 50 mL em uma centrífuga de cultura de células por 10 segundos a 4 ° C. Remova o tubo invertido da centrífuga, usando uma pinça para evitar transformar o lado direito do tubo para cima.
- Prepare um copo de 100 mL com tampão de diálise BN-frio (receita 3) e uma placa de agitação. Use pelo menos 10 mL de Diálise BN-Buffer por 100 mL-amostra.
- Apor o tubo com fita de cabeça para baixo dentro do copo, e remover as bolhas de ar do buraco por baixo da tampa usando uma inclinação Pasteur pipeta.
- Copo coloque em cima de um agitador magnético, ligar o agitador e deixá-la por 6 horas ou durante a noite na sala fria. Verifique ocasionalmente para garantir que agitação não é a criação de bolhas de ar na membrana de diálise.
- Recolher o lisado celular dialisadas em um novo tubo de microcentrífuga refrigerada.
2. Derramamento de BN-gel
- Gel gradiente derramando é feito à temperatura ambiente com um misturador de gradiente. As luvas devem ser usadas porque poliacrilamida é altamente neurotóxico. Evitar qualquer contacto com SDS.
- Coloque a mistura em uma placa de gradiente de agitar e anexá-la a um pedaço de tubo flexível. Fechar o canal usando a válvula e fechar o tubo com uma pinça. Coloque um agitador magnético de 15% para o cilindro "alto" conectado à tubulação.
- Passe o tubo flexível em uma bomba peristalitic e anexar uma agulha da seringa até o fim. Em seguida, coloque a agulha entre as duas placas de vidro do aparelho gel.
- Prepare 4% (receita 5) e 15% (receita 6) que separam soluções gel, acrescentando APS e Temed imediatamente antes da utilização. Os volumes combinados deve ser igual ao volume do gel de separação.
- Despeje essas soluções gel para dentro dos cilindros correspondentes do misturador de gradiente (4% no "baixo" e 15% para o cilindro "alto").
- Abrir a válvula e forçar a saída da bolha de ar dentro do canal que liga os dois reservatórios de gel pressionando sobre o cilindro esquerdo com o polegar.
- Ligue o agitador magnético, remova o grampo, e ligar a bomba peristalitic a 5 ml por minuto. Permita que o gel lentamente fluxo entre as placas de vidro. Assegurar que a agulha está sempre acima do líquido.
- Permitir que todo o líquido para entrar no aparelho de gel, e depois overlay suavemente com isopropanol. Permitir que o gel polimerizar por pelo menos 30 min em temperatura ambiente.
- Limpar o aparelho despejando imediatamente com dH 2 O (não use detergente).
- Remover o isopropanol, lave com dH 2 O, e remover o dH 2 O com um papel Whatman.
- Prepare um gel de empilhamento 3,2% (receita 7), acrescentando APS e Temed imediatamente antes da utilização.
- Despeje o gel de empilhamento no topo do gel de separação e introduzir o pente entre as placas de vidro, evitando bolhas. Depois que o gel de empilhamento foi polimerizado, resfriar o gel até 4 ° C.
- Imediatamente antes do carregamento da amostra, remova o pente devagar, puxando-o em um ângulo para o plano do gel. Isto permite que o ar entre os bolsos rapidamente, o que melhora a qualidade dos poços.
3. Separação de lisado celular dialisadas por BN-PAGE
- Carga 1-40 mL de lisado dialisadas e 10 a 20 l da mistura de Marker (receita 10) nos poços secos a 4 ° C. Sobreposição das amostras em cada poço com tampão de cátodo frio (receita 8).
- Encha a câmara interna com Cat friohode tampão ea câmara externa / inferior com tampão de Ânodo frio (receita 9).
- Aplicar 100 V para uma minigel ou 150V para um gel de grande porte, até que as amostras tenham entrado no gel de separação. Executar o gel a 4 ° C.
- Aumentar a tensão para 180 V (minigel) ou 400 V (gel de grande porte) e correr até a frente de corante atinge o final do gel. A corrida leva de 3 a 4 horas para um mini-, e 18 a 24 horas de um gel de grande porte.
4. Segunda dimensão SDS-PAGE
- Preparar um padrão de 10% SDS-gel (receitas 12-15) com uma única pista para o primeiro grande dimensão lane BN-PAGE, uma pista regular para o marcador de peso molecular, e uma pista regular para uma alíquota do lisado dialisado que tem foi misturada com tampão de amostra SDS (receita 11) e fervido por 5 min a 95 ° C. Use espaçadores cuja espessura foi aumentada em duas camadas de fita adesiva para simplificar o carregamento da fatia de gel BN-PAGE em gel de SDS.
- Remova o gel BN-PAGE nas placas do aparelho de eletroforese e gentilmente levante uma placa.
- Remova o gel de empilhamento e cortar a pista do gel BN-PAGE contendo as proteínas de interesse.
- Coloque a fatia de gel BN-PAGE em tampão de amostra 2x SDS e incubar por 10 min em temperatura ambiente.
- Ferva o BN-PAGE brevemente fatia gel (não mais de 20 seg) no microondas.
- Incubar a fatia gel BN-PAGE no tampão de amostra SDS quente por mais 15 minutos em temperatura ambiente.
- Carregar a fatia gel BN-PAGE na grande e bem sobre o gel de empilhamento do SDS-PAGE gel evitando bolhas de ar, e sobrepor a fatia com tampão de amostra SDS. Carga marcador e controle lisado.
- Realizar eletroforese de acordo com protocolos padrão.
5. Detecção de subunidades MPC por immunoblotting
- Para a transferência, prepare seis artigos Whatman e uma membrana PVDF adequado para o tamanho da SDS-gel.
- Incubar a membrana PVDF em metanol 100% por 30 s e absorver os papéis Whatman em tampão de transferência (receita 16).
- Coloque três papéis Whatman, a membrana PVDF, a SDS-gel (gel de empilhamento remover), e novamente três trabalhos Whatman em uma estrutura sanduíche-como em uma célula de transferência de semi-secos.
- Aplicar 20 V por 25 min.
- Detectar proteínas de acordo com protocolos padrão immunoblotting.
6. Resultados representante
Apresentamos a análise do 19S eucarióticas, 20S, 26S e proteasomas como um exemplo para a caracterização MPC pela BN 2D / SDS-PAGE (Figura 1A). HEK293 células foram lisadas com tampão contendo 0,1% Triton X-100 como um detergente para romper as membranas e solubilizar complexos de proteína de membrana. Estes lisados foram dialisadas contra BN Diálise-buffer para remover sais e metabolitos de pequeno porte. Então, PPM foram separadas por PAGE 4-15% BN-gradiente seguido por uma segunda dimensão SDS-PAGE. Proteínas foram visualizadas por immunoblotting com anticorpos contra as subunidades β2 e Mcp21 do proteassoma 20S.
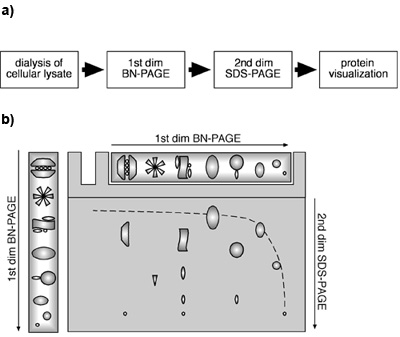
Figura 1. Uma abordagem BN-PAGE/SDS-PAGE bidimensional usando lisados celulares. (A) Diagrama de uma abordagem BN-PAGE/SDS-PAGE 2D a partir de lisados celulares. (B) Esquema de um esquema de BN-PAGE/SDS-PAGE 2D. Proteínas e PPM são separados em condições nativas por BN-PAGE em uma primeira dimensão. Para a segunda dimensão, as proteínas e / ou PPM são desnaturadas pela SDS na faixa gel após a separação por BN-PAGE e, posteriormente, submetidas a SDS-PAGE. Proteínas monoméricas vai migrar de uma função hiperbólica diagonal para o gel de gradiente no primeiro e um gel linear na segunda dimensão. Componentes de uma concreta MPC será encontrado abaixo da diagonal, localizado em uma linha vertical.
Tem sido demonstrado que, por combinação de primeira dimensão BN e segunda dimensão SDS-PAGE, proteínas monoméricas migrar dentro de uma diagonal hiperbólica devido ao gradiente de gel no primeiro e no gel linear na segunda dimensão ((Camacho-Carvajal, Wollscheid et al 2004);. Figura 1B). Componentes do PPM estão localizados abaixo dessa diagonal. Proteínas que representam subunidades do MPC mesmo pode ser encontrado em uma linha vertical na segunda dimensão, ao passo que vários pontos da mesma proteína em uma linha horizontal indicam a presença da proteína em vários PPM distintas. A Figura 2 mostra que em nosso experimento immunoblotting contra a β2 e Mcp21 revelou a presença de complexos de proteínas específicas que contêm estas subunidades proteosomal. Ambas as proteínas foram detectadas como pontos individuais dispostos em uma linha horizontal, indicando que β2 e Mcp21 representam constituintes de várias PPM distintas. Estes PPM pode ser claramente identificado como o proteassoma 26S (20S 19S mais cap), o proteassoma 20S em conjunto com a subunidade reguladora PA28, eo 20S proteasomas sozinho, com base em seu tamanho e composição. Juntos, esses results demonstrar que PPM endógenos podem ser identificados e caracterizados por uma abordagem BN-PAGE/SDS-PAGE bidimensional usando lisado celular. Este método é aplicável para a determinação do tamanho, composição e abundância relativa de PPM.

Figura 2. Detecção de formas diferentes do proteassoma eucarióticas por immunoblotting depois de dois-dimensional BN-PAGE/SDS-PAGE. Para identificação e análise de proteasomas eucarióticas, HEK293 células foram lisadas com 0,1% Triton X-100. Lisados celulares foram dialisadas e, posteriormente, submetidos a BN-PAGE (4-15%) para PPM separado. Depois, uma segunda dimensão SDS-PAGE (10%) foi executado para a separação de tamanho de subcomponentes individuais. Immunoblotting foi realizada com anticorpos específicos reconhecendo a Mcp21 e β2 subunidade do complexo núcleo 20S e da subunidade reguladora PA28.
I. Tabela de reagentes específicos (ordem alfabética):
| Reagente | Companhia | Comentários |
| 6-aminohexanoic ácido (Ε-aminocapróico) | Sigma-Aldrich, Taufkirchen, Alemanha | Este produto químico é um irritante e deve ser manuseado com luvas. |
| Acrilamida bisacrylamide solução (40%), Mix 32:1 | Applichem, Darmstadt, Alemanha | Esta solução é neurotóxica e deve ser manuseado com luvas. |
| Bis-tris | Roth, Karlsruhe, Germa-ny | |
| Brij 96 | Sigma-Aldrich, Taufkirchen, Alemanha | |
| Coomassie blue G250 | Serva, Heidelberg, Ale-manha | Não substitua os outros tipos de corante Coomassie como Coomassie blue R250 ou coloidal Coo-Massie blues. |
| Digitonina | Sigma-Aldrich, Taufkirchen, Alemanha | Digitonina é tóxico. Devem ser usadas luvas ao manusear buffers ou amostras contendo este deter gent. |
| Dodecylmaltoside | Applichem, Darmstadt, Alemanha | |
| Triton X-100 | Roth, Karlsruhe, Germa-ny | Triton X-100 é tóxico. Devem ser usadas luvas ao manusear buffers ou amostras contendo este detergente. |
II. Tabela de materiais e equipamentos específicos:
| Equipamento | Companhia |
| Membranas de diálise (peso molecular de corte 10-50 kD) | Roth, Karlsruhe, Alemanha |
| Sistema de eletroforese em gel | Por exemplo, de Bio-Rad, Munique, Alemanha |
| Misturador de gradiente | Self-made ou comercialmente disponível a partir de Bio-Rad, Munique, Alemanha |
| Bomba peristáltica | Amersham Pharmacia Biotech, Freiburg, Alemanha |
| Polivinilideno difluoreto de membrana (PVDF) | Immobilon-P, Millipore, Eschborn, Alemanha |
| Semi-seco equipamentos de transferência | Por exemplo, de Bio-Rad, Munique, Alemanha |
| Silicon tubulação (3 a 5 mm de diâmetro, 1 m de comprimento) | Neolab, Heidelberg, Alemanha |
III. Tabela de receitas:
| Não. | Buffers e soluções | Conteúdo | Comentários |
| 1 | Tampão fosfato (PBS) | Na 2 HPO 4 8,1 mMKH 2 PO 4 1,5 mM NaCl 138 mM KCl 2,7 mM | Solução deve ser pH 7,4, se preparadas adequadamente. |
| 2 | BN Lise-Buffer | Tampão de base Bis-tris 20 mM ε-aminocapróico 500 mM NaCl 20 mM EDTA, pH 8.0 2 mM Glicerol 10% Ajustar o pH para 7,0 com HCl. Armazenar a 4 ° C. Detergente Digitonina 0,5 a 1,0% Brij 96 ou 0,1 a 0,5% ou Triton X-100 0,1 a 0,5% ou Dodecylmaltoside 0,1 a 0,5% Inibidores da protease e fosfatase Aprotinina 10 mcg / mL Leupeptin 10 mcg / mL PMSF 1 mM Fluoreto de sódio 0,5 mM Ortovanadato de sódio a 0,5 mM | O detergente apropriado deve ser determinado empiricamente e deve ser a mesma que a utilizada nas receitas tampão de lise outros. Digitonina deve ser adicionado imediatamente antes da utilização de uma solução estoque de 2% em dH 2 O (loja na 5 ml alíquotas a -20 ° C). Protease e fosfatase inibir-ors deve ser adicionado imediatamente antes da utilização. Após a adição de sódio orthova-nadate, o buffer ficará de cor amarelada. |
| 3 | BN Diálise-Buffer | Tampão de base Bis-tris 20 mM ε-aminocapróico 500 mM NaCl 20 mM EDTA, pH 8.0 2 mM Glicerol 10% Ajustar o pH para 7,0 com HCl. Armazenar a 4 ° C. Detergente Digitonina 0,3 a 0,5% ou Triton X-100 0,1% Brij 96 ou 0,1% ou Dodecylmaltoside 0,1% Inibidores da protease e fosfatase PMSF 1 mM Ortovanadato de sódio a 0,5 mM | O detergente apropriado deve ser determinado empiricamente e deve ser a mesma que a utilizada na lise outros buffers, mas ao indicado menor concen-trações. Detergente deve ser adicionado ao pré-vent de agregação na etapa de empilhamento de eletroforese em gel. Protease e fosfatase inibir-ors deve ser adicionado imediatamente antes da utilização. |
| 4 | Tampão BN Gel-3x | Bis-tris 150 mM ε-aminocapróico 200 mM Ajustar o pH para 7,0 com HCl. Armazenar a 4 ° C. | |
| 5 | Separar 4% Gel | Tampão BN Gel-3x (receita 4) 5,00 mL Acrilamida / Bisacrylamide 1,50 mL dH 2 O 8,50 mL APS, 10% em dH 2 O 54 mL Temed 5,4 mL | Adicionar APS e ime-diatamente Temed antes de coloca-gel, como estes reagentes promover a polimerização. Esta receita é suficiente para lançar um gel de 30 ml. Ajustar volumes para o número e tamanho dos géis que está sendo derramado. |
| 6 | 15% Separar Gel | Tampão BN Gel-3x (receita 4) 5,00 mL Acrilamida / Bisacrylamide 5,63 mL Glicerol 70% 4,38 mL APS, 10% em dH 2 O 42 mL Temed 4,2 mL | Adicionar APS e ime-diatamente Temed antes de coloca-gel, como estes reagentes promover a polimerização. Esta receita é suficiente para lançar um gel de 30 ml. Ajustar volumes para o número e tamanho dos géis que está sendo derramado. A concentração de acrilamida bisacrylamide também pode ser variada conforme necessário 10-18%. |
| 7 | 3,2% Stacking Gel | Tampão BN gel-3x (receita 4) 3,00 mL Acrilamida / Bisacrylamide 0,72 mL dH 2 O 5,28 mL APS, 10% em dH 2 O 120 mL Temed 12 mL | Adicionar APS e ime-diatamente Temed antes de coloca-gel, como estes reagentes promover a polimerização. Esta receita é suficiente para lançar um gel de 30 ml. Ajustar volumes para o número e tamanho dos géis que está sendo derramado. |
| 8 | Tampão de cátodo | Bis-tris 15 mM Tricine 50 mM Coomassie blue G250 0,02% Prepare um litro como um estoque de 10x, ajustar o pH para 7,0 com HCl, e armazenar a 4 ° C. Diluir 1:10 com dH 2 O antes de usar. | Não substitua os outros tipos de corante Coomassie como Coomassie blue R250 ou blues Coomassie coloidal. |
| 9 | Tampão do ânodo | Bis-tris 50 mM Prepare um litro como um estoque de 10x, ajustar o pH para 7,0 com HCl, e armazenar a 4 ° C. Diluir 1:10 com dH 2 O antes de usar. | |
| 10 | Mix marcador | Aldolase (158 kD) 10 mg / mL Catalase (232 kD) 10 mg / mL Ferritina (440 e 880 kD) 10 mg / mL Tireoglobulina (670 kD) 10 mg / mL BSA (66 e 132 kD) 10 mg / mL Bis-tris 20 mM NaCl 20 mM Glicerol 10% Ajustar o pH para 7,0 com HCl. Armazenar a 4 ° C. | Marcadores de peso molecular também são disponíveis comercialmente a partir de diversas fontes, incluindo Invitro-gen ou Pharmacia. |
| 11 | Tampão de amostra SDS | Tris 12,5 mM SDS 4% Glicerol 20% Azul de bromofenol 0,02% Ajustar o pH para 6,8. Para reduzir pontes dissulfeto, adicionar 9 mL β-mercaptoetanol. | SDS como um pó e β-mer-captoethanol são tóxicos. Portanto, use luvas e trabalhar sob um capuz. |
| 12 | Menor tampão 4x | Tris 1,5 M SDS 0,4% Ajustar o pH para 8,8. | SDS como um pó é tóxico. Portanto, use luvas e trabalhar sob um capuz. |
| 13 | Tampão superior 4x | Tris 0,5 M SDS 0,4% Ajustar o pH para 6,8. | SDS como um pó é tóxico. Portanto, use luvas e trabalhar sob um capuz. |
| 14 | 10% Separar Gel | Acrilamida (30%) 2,0 mL 4x menor buffer de 1,5 mL dH 2 O 2,454 mL APS, 10% em dH 2 O 40 mL Temed mL 6 | Adicionar APS e ime-diatamente Temed antes de coloca-gel, como estes reagentes promover a polimerização. Esta receita é suficiente para lançar um gel de 30 ml. Ajustar volumes para o número e tamanho dos géis que está sendo derramado. |
| 15 | 4,8% Stacking Gel | Acylamide (30%) 320 mL 4x superior buffer de 500 mL dH 2 O 1,16 mL APS, 10% em dH 2 O 20 mL Temed 2 mL | Adicionar APS e ime-diatamente Temed antes de coloca-gel, como estes reagentes promover a polimerização. Esta receita é suficiente para lançar um gel de 30 ml. Ajustar volumes para o número e tamanho dos géis que está sendo derramado. |
| 16 | Semi-secos do buffer de transferência | Tris 48 mM Glicina 39 mM Metanol 20% SDS 0,1% Ajustar o volume para 1 litro com dH 2 O. Conservar à temperatura ambiente. | SDS como um pó e metanol são tóxicos. Portanto, use luvas e trabalhar sob um capuz. |
Discussão
Neste estudo, descrevemos a análise do PPM pelo BN-PAGE. Uma abordagem 2D é usada para separar primeiro PPM em condições nativas e, depois, subdividir-los em seus componentes individuais, uma segunda dimensão SDS-PAGE.
As amostras são preparadas a partir de lisados celulares. Para a solubilização do PPM muitos, um detergente apropriado é necessário, que preserva a estrutura dos complexos de proteína. Aqui, usamos 0,1% Triton X-100. No entanto, o detergente ideal e adequada a sua concentração tem que ser determinado empiricamente para cada MPC. Em caso de Triton X-100, por exemplo, foi relatado que as concentrações de detergente permitir a identificação de uma forma dimérica da F 1 F 0-ATPase complexos (Arnold, Pfeiffer et al. 1998). Maior Triton X-100 concentrações, no entanto, levam à dissociação do dímero e um aumento correspondente do monomérica F 1 F 0-ATPase complexo. Isto está de acordo com um dos nossos estudos anteriores, nós mostramos que foram o complexo receptor de células T multivalentes (TCR) é preservada quando extraído com baixas concentrações de Brij 96, enquanto que o uso de maior concentração ou de outro detergente chamado resultados digitonina em a extração de monomérica TCR (Schamel, Aréchaga et al. 2005). Detergentes comumente usados que podem ser testados incluem digitonina (0,5 a 1%), Triton X-100 (0,1 a 0,5%), Brij 96 (0,1 a 0,5%), ou dodecylmaltoside (0,1 a 0,5%). Estes reagentes são os detergentes não-iônico, que tendem a ser melhor para a estabilidade MPC. Esteja ciente de que o contato com SDS e outros detergentes fortes devem ser evitados (Camacho-Carvajal, Wollscheid et al. 2004).
Diálise do lisados é necessário para alcançar MPC separação em um BN-gel (Camacho-Carvajal, Wollscheid et al 2004).; (Heiss, Junkes et al 2005).. Parece que o ajuste da concentração de sal ou a remoção de impurezas de baixo peso molecular é crucial em alta resolução. Vale ressaltar que também preparações de membrana e PPM, que têm sido immunopurified e, posteriormente, eluída da anticorpos, são adequados para BN-PAGE (Swamy, Siegers et al. 2006). Em ambos os casos, as amostras não precisam ser dialisado para BN-PAGE separação, se lise de membranas ou de eluição é realizada em BN lise-buffer.
Para a separação de proteínas por BN-PAGE, o corante Coomassie blue é necessário, que se liga a proteínas não específica e cobre-os com cargas negativas. Assim, Coomassie blue permite a mobilidade eletroforética de proteínas para o catodo de pH neutro (Schägger e von Jagow 1991); (Schägger, Cramer et al 1994).. Além disso, Coomassie blue previne a agregação de proteínas no gel de empilhamento durante a eletroforese. Para BN-PAGE, Coomassie G250 tem que ser usado em vez de azul Coomassie R250 ou blues Coomassie coloidal.
Antes de executar um BN-gel, é necessário para garantir que a percentagem de gel se adapta ao tamanho esperado do MPC de interesse. Pré-moldado BN-géis com gradientes diferentes e buffers adequados estão disponíveis comercialmente a partir Invitrogen (NativePAGE Novex Bis-Tris Sistema Gel). Mas BN-gel também pode ser preparado usando um misturador de gradiente, juntamente com uma bomba persistaltic. Para garantir um gradiente intactos, o líquido deve fluir constantemente durante o vazamento e bolhas devem ser evitadas. Recomendamos o carregamento de diferentes diluições de amostras no gel, pois a sobrecarga pode levar à precipitação de proteínas durante o processo de eletroforese. Além disso, BN-gel deve ser executado a 4 ° C para prevenir a degradação de proteínas e para manter o PPM intacta.
Depois BN-PAGE visualização, de PPM pode ser alcançado por Coomassie coloração azul brilhante, coloração pela prata ou immunoblotting. Bandas de proteínas visualizados através da coloração Coomassie ou prata são adequados para posterior análise por espectrometria de massa (Camacho-Carvajal, Wollscheid et al. 2004). Em caso de immunoblotting, as condições de transferência ideal para o PPM de juros têm de ser determinadas empiricamente. Estar ciente de que Coomassie azul também é transferida durante blotting de um BN-gel. Portanto, o gel vai ser incolor após a transferência bem-sucedida, ao passo que a membrana irá exercer uma cor azul. Além disso, é importante mencionar que não todos os anticorpos primários, que trabalha para detecção após SDS-PAGE, é aplicável a immunoblotting sobre BN-PAGE. Pode acontecer que os anticorpos não reconhecem o MPC de interesse porque o seu epítopo está escondido na conformação nativa das proteínas. Para ultrapassar este problema, é possível para desnaturar as proteínas dentro da BN-gel antes da transferência fervendo o gel em breve no 1x tampão de amostra SDS.
No nosso exemplo, não submeta o BN-gel diretamente para a detecção de bandas de proteínas. Em vez disso, nós ainda dividiu o BN-PAGE-lisado separados por um segundo dimensiem SDS-PAGE. Na segunda dimensão SDS-gel, as proteínas monoméricas migrar dentro de uma diagonal hiperbólica devido ao gradiente de gel no primeiro e no gel linear na segunda dimensão (Camacho-Carvajal, Wollscheid et al. 2004). Isto permite a fácil identificação de PPM, uma vez que estão localizados abaixo dessa diagonal hiperbólica. Subcomponentes de um MPC distintos são separados em uma linha vertical na segunda dimensão SDS-PAGE. Componentes que são constituintes do PPM dinstinct vários podem ser identificados em uma linha horizontal de acordo com o tamanho do MPC. No entanto, ele tem que se considerar que vários spots de proteínas que aparecem em uma linha vertical também poderia ser parte de complexos separados que migram na mesma posição em BN-PAGE. A prova final de que eles estão presentes no MPC mesmo pode ser obtido por um ensaio de alteração baseados em anticorpos gel. Neste ensaio, lisado celular é incubada com um anticorpo contra uma proteína representado por um dos pontos identificados antes da BN-PAGE. Isso resulta em uma mudança de todos os PPM que contêm essa proteína para uma maior massa molecular na primeira dimensão. Outras proteínas que são também uma parte destes PPM vai sofrer essa mudança complexos específicos e por isso são fáceis de identificar na segunda dimensão SDS-gel.
Não só a composição do PPM podem ser analisados por BN-PAGE, mas também a determinação de sua estequiometria é possível (e Schamel Reth 2000); (Schamel 2001), (Swamy, Minguet et al 2007).. Para este fim, um ensaio Namos (nativo baseadas em anticorpos, ensaio de mobilidade shift) pode ser realizada. Como no ensaio de mudança baseadas em anticorpos, gel, os lisados celulares são incubados com anticorpos monoclonais subunidade anticorpos específicos. Isto leva à indução de immunoshifts eletroforética em gel-BN, que permitem a inferência da extensão da mudança na estequiometria do PPM
Em conlusion, BN-PAGE é adequado para a identificação de PPM ea determinação de sua composição, tamanho, bem como abundância relativa. Realizada como um ensaio Namos, ela também oferece a possibilidade de determinar a estequiometria de uma MPC certos. Dada a sua aplicabilidade geral, esta técnica é uma ferramenta muito útil para a caracterização de PPM (Dekker, Müller et al 1996).; (Wittig e Schagger 2008); (Wagner, Rehling et al 2009.); (Wittig e Schägger 2009) .
Divulgações
Agradecimentos
Agradecemos a Michael Reth, Hermann Schägger, e Margarita Camacho-Carvajal ao apoio científico. Este trabalho foi financiado pela Forsys do fuer Bundesministerium Bildung e Forschung (BMBF), pela BIOS do Deutsche Forschungsgemeinschaft (DFG), e apoiado em parte pela Iniciativa de Excelência dos Governos Federal e Estadual alemães (GSC-4, Spemann Graduate School ).
Referências
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados