Method Article
Bleu d'électrophorèse sur gel de polyacrylamide natif (BN-PAGE) pour l'analyse des complexes multiprotéiques de lysats cellulaires
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans cette vidéo, nous décrivons la caractérisation de complexes multiprotéiques (PPM) en bleu électrophorèse en gel de polyacrylamide natif (BN-PAGE). Dans une première dimension, dialysées lysats cellulaires sont séparés par BN-PAGE pour identifier les PPM individuelle. Dans une deuxième dimension SDS-PAGE, PPM d'intérêt sont subdivisées afin d'analyser leurs électeurs par immunoblot.
Résumé
Complexes multiprotéiques (PPM) jouent un rôle crucial dans la signalisation cellulaire, puisque la plupart des protéines peuvent être trouvés dans des complexes fonctionnels ou réglementaires avec d'autres protéines (Sali, Glaeser et al. 2003). Ainsi, l'étude des réseaux d'interactions protéine-protéine requiert la caractérisation détaillée des PPM d'acquérir une compréhension intégrative des fonctions des protéines et la réglementation. Pour l'identification et l'analyse, les PPM doivent être séparés dans des conditions natives. Dans cette vidéo, nous décrivons l'analyse des PPM par le bleu électrophorèse en gel de polyacrylamide natif (BN-PAGE). BN-PAGE est une technique qui permet la séparation des PPM dans une conformation native avec une résolution supérieure à celle offerte par filtration sur gel ou d'ultracentrifugation de densité de sucrose, et est donc utile pour déterminer la taille MPC, la composition et l'abondance relative (Schagger et Jagow 1991) ; (Schagger, Cramer et al, 1994).. Par cette méthode, les protéines sont séparées selon leur taille et la forme hydrodynamique dans une matrice de polyacrylamide. Ici, nous démontrons l'analyse des PPM du total des lysats cellulaires, soulignant que la dialyse lysat est l'étape cruciale pour faire BN-PAGE applicables à ces prélèvements biologiques. En utilisant une combinaison de la dimension et la dimension BN-première seconde SDS-PAGE, nous montrons que les PPM séparés par BN-PAGE peut être subdivisée en leurs constituants individuels par SDS-PAGE. Visualisation des composants MPC en cas de séparation du gel est réalisée par immunoblot standard. À titre d'exemple pour l'analyse des PPM par BN-PAGE, nous avons choisi le 19S bien caractérisés eucaryotes, 20S, 26S et de protéasomes.
Protocole
** Ce protocole vidéo est basée sur une publication associée 1: Bleu d'électrophorèse sur gel de polyacrylamide natif (BN-PAGE) pour l'identification et l'analyse de complexes multiprotéiques. Mahima Swamy, Gabrielle M. Siegers, Susana Minguet, Bernd Wollscheid, et Wolfgang WA Schamel. STKE Science 2006 (345): PL2, Juillet 25, 2006, [DOI: 10.1126/stke.3892006pl4]. S'il vous plaît cliquer ici pour voir cette publication .
1. Préparation du lysat cellulaire dialysé
- Récolte 10x10 6 cellules et de culot par centrifugation à 350g pendant 5 min à 4 ° C.
- Laver le culot cellulaire à trois reprises avec 1 ml de PBS glacé (recette 1), centrifuger comme à l'étape 1.1.
- Resuspendre le culot dans 250 l de glace à froid BN-Lysis Buffer (recette 2) et incuber sur de la glace pendant 15 min.
- Centrifuger à 13000 g pendant 15 min à 4 ° C pour éliminer les matières insolubles.
- Faire fondre un trou dans le bouchon d'un tube à centrifuger de 1,5 ml en utilisant le côté de diamètre chauffée grande d'une pipette Pasteur, puis placer le tube sur la glace pour refroidir à 4 ° C.
- Transférer le surnageant de l'étape 1.4 dans le tube refroidi avec le trou dans le capuchon.
- Placez une membrane de dialyse (poids moléculaire de coupure de 10 kD) avec une pince sur le dessus du tube ouvert, fermer le bouchon, et de couper membrane de dialyse en excès qui dépasse.
- Sceller le bouchon sur le côté soigneusement avec du parafilm.
- Inverser les tubes et centrifuger à l'envers à la vitesse la plus basse possible dans un tube conique de 50 ml dans une centrifugeuse culture cellulaire pendant 10 sec à 4 ° C. Retirer le tube inversé de la centrifugeuse à l'aide des pincettes pour éviter de transformer le côté droit du tube en place.
- Préparer un bécher de 100 mL de froid BN-dialyse Tampon (recette 3) et une plaque d'agitation. Utiliser au moins 10 mL de tampon de dialyse BN-100-uL d'échantillon.
- Fixez le tube avec du ruban adhésif à l'envers dans le bécher, et éliminer les bulles d'air du trou sous le bouchon en utilisant une pipette Pasteur plié.
- Bécher placer sur le dessus d'un agitateur magnétique, commutateur sur l'agitateur et le laisser pendant 6 heures ou toute la nuit dans la chambre froide. Vérifiez occasionnellement pour s'assurer que l'agitation n'est pas de créer des bulles d'air à la membrane de dialyse.
- Recueillir le lysat cellulaire dialysée dans un microtube réfrigérée nouvelle.
2. Coulage du BN-gels
- Gel de gradient coulage est effectué à température ambiante avec un mélangeur de gradient. Les gants doivent être portés à cause de polyacrylamide est hautement neurotoxique. Eviter tout contact avec le SDS.
- Placer le mélangeur de gradient sur une plaque d'agitation et de l'attacher à un morceau de tuyau flexible. Fermez le canal à l'aide de la vanne et fermer le tube avec une pince. Placer un agitateur magnétique à 15% dans le "haut" cylindre relié à la tubulure.
- Enfiler le tube flexible dans une pompe peristalitic et fixer une aiguille de seringue à sa fin. Ensuite, placez l'aiguille entre les deux plaques de verre de l'appareil de gel.
- Préparer 4% (recette 5) et 15% (recette 6) séparant les solutions gel, ajoutant APS et TEMED immédiatement avant utilisation. Les volumes combinés devrait être égal au volume du gel de séparation.
- Verser ces solutions de gel dans les cylindres correspondants du mélangeur de gradient (4% dans le «faible» et 15% dans le «haut» du cylindre).
- Ouvrez la vanne et la force à la bulle d'air à l'intérieur du canal reliant les deux réservoirs de gel en appuyant sur le cylindre gauche avec votre pouce.
- Mettre l'agitateur magnétique, enlevez la pince, et l'interrupteur sur la pompe peristalitic à 5 ml par minute. Laisser le gel lentement couler entre les plaques de verre. Assurez-vous que l'aiguille est toujours au-dessus du liquide.
- Permettre à tous les liquides de pénétrer l'appareil de gel, puis superposer délicatement avec de l'isopropanol. Laisser le gel se polymériser pendant au moins 30 min à température ambiante.
- Nettoyez l'appareil verser immédiatement avec dH 2 O (ne pas utiliser de détergent).
- Retirez l'isopropanol, laver avec dH 2 O, et de supprimer le DH 2 O avec un papier Whatman.
- Préparer un gel de 3,2% d'empilage (recette 7), ajoutant APS et TEMED immédiatement avant utilisation.
- Verser le gel de concentration sur le dessus du gel de séparation et d'introduire le peigne entre les plaques de verre, en évitant les bulles. Après le gel de concentration a polymérisé, refroidir le gel jusqu'à 4 ° C.
- Juste avant le chargement des échantillons, enlever le peigne lentement, en le tirant avec un angle par rapport au plan du gel. Cela permet à l'air de pénétrer les poches rapidement, ce qui améliore la qualité des puits.
3. Séparation de lysat cellulaire dialysées par BN-PAGE
- Charge de 1 à 40 de lysat dialysés et de 10 à 20 pi de Mix Marker (recette 10) dans les puits à sec à 4 ° C. Superposition des échantillons dans chaque puits avec du tampon de cathode froide (recette 8).
- Remplir la chambre intérieure avec Cat froideTampon Hode et la chambre extérieure / bas avec le tampon anode froide (recette 9).
- Appliquer de 100 V à 150V ou à une minigel à un gel important, jusqu'à ce que les échantillons sont entrés dans le gel de séparation. Exécutez le gel à 4 ° C.
- Augmenter la tension à 180 V (minigel) ou 400 V (gel de grande taille) et se poursuivront jusqu'à ce que le front atteint la fin du gel. La course prend de 3 à 4 heures pour un mini-, et de 18 à 24 heures pour un gel important.
4. Deuxième dimension SDS-PAGE
- Établir une norme de 10% SDS-gel (recettes 12-15) avec une seule voie importante pour la dimension BN-PAGE première voie, une voie régulière pour le marqueur de poids moléculaire, et une voie régulière pour une aliquote du lysat dialysées qui a été mélangé avec un tampon d'échantillon SDS (recette 11) et faire bouillir pendant 5 min à 95 ° C. Utiliser des cales dont l'épaisseur a été augmentée par deux couches de ruban adhésif pour simplifier le chargement de la tranche de gel BN-PAGE sur le gel SDS.
- Retirer le gel BN-PAGE dans les plaques de l'appareil d'électrophorèse et tirez jusqu'à une plaque.
- Retirer le gel d'empilement et couper la voie du gel BN-PAGE contenant les protéines d'intérêt.
- Placez la tranche de gel BN-PAGE de tampon 2x échantillon SDS et incuber pendant 10 min à température ambiante.
- Faire bouillir brièvement BN-PAGE sur gel tranche (pas plus de 20 sec) dans un micro-ondes.
- Incuber la tranche de gel BN-page dans le tampon SDS échantillon chaud pendant 15 min à température ambiante.
- Chargez la tranche de gel BN-PAGE dans les grandes et bien sur le gel d'empilement des bulles gel SDS-PAGE de l'air en évitant, et la superposition de la tranche avec tampon d'échantillon SDS. Charge de marqueur et de contrôle lysat.
- Effectuer l'électrophorèse selon des protocoles standard.
5. La détection des sous-unités MPC par immunoblot
- Pour le transfert, de préparer six documents Whatman et une membrane PVDF à la taille de la SDD-gel.
- Incuber la membrane de PVDF dans du méthanol à 100% pendant 30 s et tremper les papiers Whatman dans un tampon de transfert (recette de 16).
- Placez trois papiers Whatman, la membrane de PVDF, le SDS-gel (gel de supprimer les empiler), et encore trois papiers Whatman dans une structure sandwich dans une cellule de transfert semi-sec.
- Appliquer 20 V pendant 25 min.
- Détecter les protéines en fonction de protocoles standard immunoblot.
6. Les résultats représentatifs
Nous présentons l'analyse de la 19S eucaryotes, 20S, 26S et de protéasomes comme un exemple pour la caractérisation des PPM par BN 2D / SDS-PAGE (figure 1A). Cellules HEK293 ont été lysées avec un tampon contenant 0,1% de Triton X-100 comme un détergent pour perturber les membranes et solubiliser les complexes de protéines membranaires. Ces lysats ont été dialysées contre BN-dialyse de tampon pour éliminer les sels et des métabolites de petite taille. Ensuite, les PPM ont été séparés par gradient de 4-15% BN-PAGE suivie d'une deuxième dimension SDS-PAGE. Les protéines ont été visualisées par immunoblot avec des anticorps contre les sous-unités β2 et Mcp21 du protéasome 20S.
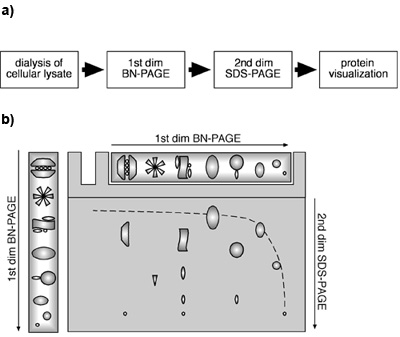
Figure 1. Une approche BN-PAGE/SDS-PAGE deux dimensions en utilisant des lysats cellulaires. Schéma (A) d'une approche BN-PAGE/SDS-PAGE 2D à partir de lysats cellulaires. Schéma schéma (B) d'un BN-PAGE/SDS-PAGE 2D. Protéines et PPM sont séparés dans des conditions natives par BN-PAGE dans une première dimension. Pour la deuxième dimension, les protéines et / ou PPM sont dénaturés par le SDS dans la bande de gel après la séparation par BN-PAGE et ensuite soumis à une SDS-PAGE. Protéines monomères vont migrer dans une cause hyperboliques en diagonale sur le gel de gradient dans le premier et un gel linéaire dans la deuxième dimension. Composants d'un béton MPC sera trouvée en dessous de la diagonale, située sur une ligne verticale.
Il a été démontré que par la combinaison de la première dimension de BN et deuxième dimension SDS-PAGE, les protéines monomériques migrer à l'intérieur d'une diagonale hyperboliques due au gel de gradient dans le premier et le gel linéaire dans la deuxième dimension ((Camacho-Carvajal, et Wollscheid al 2004);. figure 1B). Composantes du PPM sont situés en dessous de cette diagonale. Les protéines qui représentent des sous-unités de la même MPC peut être trouvé dans une ligne verticale dans la deuxième dimension, alors que plusieurs endroits de la même protéine dans une ligne horizontale indique la présence de la protéine dans plusieurs PPM distinctes. La figure 2 montre que dans notre expérience immunoblot contre la β2 et Mcp21 révélé la présence de complexes protéiques spécifiques contenant ces sous-unités du protéasome. Les deux protéines sont détectables comme des taches individuelles disposées en une ligne horizontale, ce qui indique que β2 et de représenter les électeurs Mcp21 de plusieurs PPM distinctes. Ces PPM pourrait être clairement identifié comme le protéasome 26S (20S 19S, plus de la PAC), le protéasome 20S avec la sous-unité régulatrice PA28, et le 20S protéasome seul, sur la base de leur taille et leur composition. Pris ensemble, ces resuLTS démontrer que PPM endogène peut être identifié et caractérisé par une approche BN-PAGE/SDS-PAGE deux dimensions en utilisant lysat cellulaire. Cette méthode est applicable pour la détermination de la taille, la composition et l'abondance relative des PPM.

Figure 2. La détection des différentes formes du protéasome eucaryote par immunoblot après deux dimensions BN-PAGE/SDS-PAGE. Pour l'identification et l'analyse des protéasomes eucaryotes, les cellules HEK293 ont été lysées avec 0,1% de Triton X-100. Lysats cellulaires ont été dialysées et ensuite soumis à BN-PAGE (4-15%) à PPM séparé. Ensuite, une deuxième dimension SDS-PAGE (10%) a été exécuté pour la séparation de taille des sous-composants individuels. Immunoblot a été réalisé avec des anticorps spécifiques reconnaissant la sous-unité β2 Mcp21 et du complexe 20S fondamentales, et la sous-unité régulatrice PA28.
I. Table des réactifs spécifiques (par ordre alphabétique):
| Réactifs | Société | Commentaires |
| 6-aminohexanoïque (Ε-aminocaproïque) | Sigma-Aldrich, Taufkirchen, Allemagne | Ce produit chimique est un irritant et doit être manipulé avec des gants. |
| L'acrylamide-bisacrylamide solution (40%), Mix 32:1 | Applichem, Darmstadt, Allemagne | Cette solution est neurotoxique et doivent être manipulés avec des gants. |
| Bis-tris | Roth, Karlsruhe, Germa-ny | |
| Brij 96 | Sigma-Aldrich, Taufkirchen, Allemagne | |
| Bleu de Coomassie G250 | Serva, Heidelberg, Alle-magne | Ne pas remplacer d'autres types de Coomassie colorant tel que le bleu de Coomassie R250 ou colloïdale Coo-Massie blues. |
| Digitonine | Sigma-Aldrich, Taufkirchen, Allemagne | Digitonine est toxique. Les gants doivent être portés lors de la manipulation des tampons ou des échantillons contenant ce détergent. |
| Dodecylmaltoside | Applichem, Darmstadt, Allemagne | |
| Triton X-100 | Roth, Karlsruhe, Germa-ny | Triton X-100 est toxique. Les gants doivent être portés lors de la manipulation des tampons ou des échantillons contenant ce détergent. |
II. Table des matières et équipements spécifiques:
| Équipement | Société |
| Membranes de dialyse (poids moléculaire de coupure de 10 à 50 kD) | Roth, Karlsruhe, Allemagne |
| Système d'électrophorèse sur gel | Par exemple chez Bio-Rad, Munich, Allemagne |
| Mélangeur de gradient | Self-made ou disponibles commercialement auprès de Bio-Rad, Munich, Allemagne |
| Pompe péristaltique | Amersham Pharmacia Biotech, Freiburg, Allemagne |
| Polyvinylidène difluorure (PVDF) | Immobilon-P, Millipore, Eschborn, Allemagne |
| Équipement de transfert semi-sec | Par exemple chez Bio-Rad, Munich, Allemagne |
| Tube en silicone (3 à 5 mm de diamètre, 1 m de longueur) | Neolab, Heidelberg, Allemagne |
III. Table des recettes:
| Non | Tampons et solutions | Contenu | Commentaires |
| 1 | Tampon phosphate salin (PBS) | Na 2 HPO 4 8,1 mMKH 2 PO 4 1,5 mM NaCl 138 mM KCl 2,7 mM | Solution devrait être un pH de 7,4, si bien préparés. |
| 2 | BN-Lysis Buffer | Tampon de base Bis-Tris 20 mM ε-aminocaproïque 500 mM NaCl 20 mM EDTA, pH 8,0 à 2 mM Glycérol 10% Ajuster le pH à 7,0 avec HCl. Conserver à 4 ° C. Détergent Digitonine 0,5 à 1,0% ou Brij 96 0,1 à 0,5% ou de Triton X-100 0,1 à 0,5% ou Dodecylmaltoside 0,1 à 0,5% Les inhibiteurs de protéase et de la phosphatase L'aprotinine 10 ug / ml Leupeptine 10 ug / ml PMSF 1 mM Le fluorure de sodium 0,5 mM Orthovanadate de sodium 0,5 mM | Le détergent approprié doit être déterminée de manière empirique et devrait être le même que celui utilisé dans les autres recettes du tampon de lyse. Digitonine doit être ajouté juste avant l'utilisation d'une solution stock de 2% en dH 2 O (magasin en aliquotes de 5 ml à -20 ° C). Protéase et phosphatase inhibent-SRO devrait être ajouté immédiatement avant utilisation. Lors de l'addition de sodium orthova-nadate, le tampon devient jaunâtre. |
| 3 | BN-dialyse Tampon | Tampon de base Bis-Tris 20 mM ε-aminocaproïque 500 mM NaCl 20 mM EDTA, pH 8,0 à 2 mM Glycérol 10% Ajuster le pH à 7,0 avec HCl. Conserver à 4 ° C. Détergent Digitonine 0,3 à 0,5% ou de Triton X-100 0,1% ou Brij 96 0,1% ou Dodecylmaltoside 0,1% Les inhibiteurs de protéase et de la phosphatase PMSF 1 mM Orthovanadate de sodium 0,5 mM | Le détergent approprié doit être déterminée de manière empirique et devrait être le même que celui utilisé dans les tampons de lyse d'autres, mais à la baisse indiquée concen-tration. Détergent doit être ajoutée à l'agrégation de pré-ventilation à l'étape de superposition d'électrophorèse sur gel. Protéase et phosphatase inhibent-SRO devrait être ajouté immédiatement avant utilisation. |
| 4 | 3x BN-Gel Tampon | Bis-tris 150 mM ε-aminocaproïque 200 mM Ajuster le pH à 7,0 avec HCl. Conserver à 4 ° C. | |
| 5 | 4% gel séparateur | 3x BN-Gel Tampon (recette 4) 5,00 ml Acrylamide / bisacrylamide 1,50 ml dH 2 O 8,50 ml APS, 10% en DH 2 O 54 uL TEMED 5,4 uL | Ajouter APS et TEMED Immedia-Liste des sites avant de verser de gel, comme ces réactifs favoriser la polymérisation. Cette recette est suffisante pour jeter un gel de 30 ml. Ajustez le volume pour le nombre et la taille des gels d'être versé. |
| 6 | 15% gel séparateur | 3x BN-Gel Tampon (recette 4) 5,00 ml Acrylamide / bisacrylamide 5,63 ml Glycérol 70% 4,38 ml APS, 10% en DH 2 O 42 uL TEMED 4,2 uL | Ajouter APS et TEMED Immedia-Liste des sites avant de verser de gel, comme ces réactifs favoriser la polymérisation. Cette recette est suffisante pour jeter un gel de 30 ml. Ajustez le volume pour le nombre et la taille des gels d'être versé. La concentration d'acrylamide-bisacrylamide peuvent également être variés que nécessaires de 10 à 18%. |
| 7 | 3,2% d'empilage Gel | 3x BN-gel Tampon (recette 4) 3,00 ml Acrylamide / bisacrylamide 0,72 ml dH 2 O 5,28 ml APS, 10% en DH 2 O 120 pi TEMED 12 pl | Ajouter APS et TEMED Immedia-Liste des sites avant de verser de gel, comme ces réactifs favoriser la polymérisation. Cette recette est suffisante pour jeter un gel de 30 ml. Ajustez le volume pour le nombre et la taille des gels d'être versé. |
| 8 | Tampon cathodiques | Bis-tris 15 mM Tricine 50 mM Bleu de Coomassie G250 0,02% Préparer 1 litre comme un stock de 10x, ajuster le pH à 7,0 avec HCl, et conserver à 4 ° C. Diluer à 1:10 avec dH 2 O avant utilisation. | Ne pas remplacer d'autres types de Coomassie colorant tel que le bleu de Coomassie R250 ou colloïdale bleus Coomassie. |
| 9 | Tampon Anode | Bis-Tris 50 mM Préparer 1 litre comme un stock de 10x, ajuster le pH à 7,0 avec HCl, et conserver à 4 ° C. Diluer à 1:10 avec dH 2 O avant utilisation. | |
| 10 | Mélanger Marker | Aldolase (158 kD) 10 mg / ml Catalase (232 kD) 10 mg / ml La ferritine (440 et 880 kD) 10 mg / ml Thyroglobuline (670 kD) 10 mg / ml BSA (66 et 132 kD) 10 mg / ml Bis-Tris 20 mM NaCl 20 mM Glycérol 10% Ajuster le pH à 7,0 avec HCl. Conserver à 4 ° C. | Des marqueurs de poids moléculaire sont également disponibles dans le commerce provenant de plusieurs sources, y compris Invitro-Gen ou Pharmacia. |
| 11 | Tampon d'échantillon SDS | Tris 12,5 mM SDS 4% 20% de glycérol Bleu de bromophénol 0,02% Ajuster le pH à 6,8. Afin de réduire les liaisons disulfure, ajouter 9 ml β-mercaptoéthanol. | SDS sous forme de poudre et de β-mer-captoethanol sont toxiques. Par conséquent, utiliser des gants et travailler sous une hotte. |
| 12 | 4x moins de tampon | Tris 1,5 M SDS 0,4% Ajuster le pH à 8,8. | SDS sous forme de poudre est toxique. Par conséquent, utiliser des gants et travailler sous une hotte. |
| 13 | 4x supérieure du tampon | Tris 0,5 M SDS 0,4% Ajuster le pH à 6,8. | SDS sous forme de poudre est toxique. Par conséquent, utiliser des gants et travailler sous une hotte. |
| 14 | 10% gel séparateur | L'acrylamide (30%) 2,0 ml 4x moins de 1,5 mL de tampon dH 2 O 2,454 ml APS, 10% en DH 2 O 40 ul TEMED 6 pl | Ajouter APS et TEMED Immedia-Liste des sites avant de verser de gel, comme ces réactifs favoriser la polymérisation. Cette recette est suffisante pour jeter un gel de 30 ml. Ajustez le volume pour le nombre et la taille des gels d'être versé. |
| 15 | 4,8% d'empilage Gel | Acylamide (30%) 320 uL 4x supérieure 500 ul de tampon dH 2 O 1,16 ml APS, 10% en DH 2 O 20 pl TEMED 2 uL | Ajouter APS et TEMED Immedia-Liste des sites avant de verser de gel, comme ces réactifs favoriser la polymérisation. Cette recette est suffisante pour jeter un gel de 30 ml. Ajustez le volume pour le nombre et la taille des gels d'être versé. |
| 16 | Tampon de transfert Semidry | Tris 48 mM Glycine 39 mM 20% de méthanol SDS 0,1% Réglez le volume à 1 litre avec dH 2 O. Stocker à température ambiante. | SDS sous forme de poudre et le méthanol sont toxiques. Par conséquent, utiliser des gants et travailler sous une hotte. |
Discussion
Dans cette étude, nous décrivons l'analyse des PPM par BN-PAGE. Une approche 2D est utilisée d'abord PPM séparés dans des conditions natives, puis de continuer à les subdiviser en leurs composants individuels par une deuxième dimension SDS-PAGE.
Les échantillons sont préparés à partir de lysats cellulaires. Pour la solubilisation des PPM nombreuses, un détergent approprié est nécessaire, ce qui préserve la structure des complexes protéiques. Ici, nous utilisons 0,1% de Triton X-100. Toutefois, le détergent et sa concentration optimale appropriées doivent être déterminées empiriquement pour chaque PPM. En cas de Triton X-100, par exemple, il a été rapporté que les concentrations de détergent bas permettent l'identification d'une forme dimérique de la F 1 F 0-ATPase complexes (Arnold, Pfeiffer et al. 1998). Supérieur Triton X-100 concentrations, cependant, conduire à la dissociation du dimère et une augmentation correspondante de l'monomère F 1 F 0-ATPase complexes. Ceci est en ligne avec l'un de nos études antérieures, ont été, nous montrons que le complexe récepteur des cellules T multivalents (TCR) est conservée lorsque extrait avec de faibles concentrations de Brij 96, tandis que l'utilisation de plus forte concentration de détergent ou d'un autre appelé des résultats de la digitonine l'extraction des monomères TCR (Schamel, Aréchaga et al. 2005). Détergents couramment utilisés qui peuvent être testés comprennent digitonine (0,5 à 1%), le Triton X-100 (0,1 à 0,5%), Brij 96 (0,1 à 0,5%), ou dodecylmaltoside (0,1 à 0,5%). Ces réactifs sont des détergents non ioniques, qui tendent à être les meilleurs pour la stabilité MPC. Soyez conscient que le contact avec SDS et d'autres détergents puissants doivent être évités (Camacho-Carvajal, Wollscheid et al. 2004).
Dialyse des lysats est nécessaire pour obtenir la séparation MPC dans un BN-gel (Camacho-Carvajal, Wollscheid et al 2004.); (Heiss, Junkes et al 2005).. Il semble que l'ajustement de la concentration de sel ou de l'élimination des impuretés de faible poids moléculaire est cruciale pour une grande résolution. Il est à noter que également des préparations de membrane et des PPM, qui ont été immunopurifié et plus tard sur élue à partir de l'anticorps, sont adaptés pour BN-PAGE (Swamy, Siegers et al. 2006). Dans les deux cas, les échantillons n'ont pas à être dialysé pour BN-PAGE de séparation, si lyse membrane ou élution est effectuée dans BN-tampon de lyse.
Pour la séparation des protéines par BN-PAGE, le colorant bleu de Coomassie est nécessaire, qui se lie aux protéines non spécifique et les couvre de charges négatives. Ainsi, le bleu de Coomassie permet la mobilité électrophorétique des protéines vers la cathode à pH neutre (Schagger et Jagow 1991); (Schagger, Cramer et al, 1994).. Par ailleurs, le bleu de Coomassie empêche l'agrégation des protéines dans le gel empilage durant l'électrophorèse. Pour BN-PAGE, Coomassie G250 doit être utilisé au lieu du bleu de Coomassie R250 ou colloïdale bleus Coomassie.
Avant de lancer une BN-gel, il est nécessaire de s'assurer que le pourcentage du gel s'adapte à la taille attendue de la MPC d'intérêt. Préfabriqué BN-gels avec différents gradients et tampons appropriés sont disponibles commercialement auprès de Invitrogen (NativePAGE Novex Bis-Tris Gel System). Mais BN-gels peuvent également être préparés en utilisant un mélangeur de gradient avec une pompe persistaltic. Afin de garantir un gradient intactes, le liquide doit s'écouler en permanence pendant la coulée et les bulles doivent être évités. Nous recommandons le chargement des dilutions des échantillons différents sur le gel, car la surcharge peut conduire à la précipitation des protéines au cours du procédé d'électrophorèse. En outre, BN-gels doivent être exécutés à 4 ° C pour prévenir la dégradation des protéines et de garder intactes les PPM.
Après BN-PAGE, la visualisation des PPM peut être réalisé par coloration bleu brillant de Coomassie, coloration à l'argent ou d'immunoblot. Bandes de protéines visualisés par coloration au bleu de Coomassie ou en argent sont adaptés à une analyse approfondie par spectrométrie de masse (Camacho-Carvajal, Wollscheid et al. 2004). En cas d'immunoblot, les conditions de transfert optimal pour les PPM d'intérêt doivent être déterminées empiriquement. Soyez conscient que le bleu de Coomassie est également transféré au cours d'un buvard BN-gel. Par conséquent, le gel sera incolore après le transfert réussi, tandis que la membrane va exercer une couleur bleue. De plus, il est important de mentionner que chaque anticorps primaire, qui travaille pour la détection après SDS-PAGE, est applicable à immunoblot après BN-PAGE. Il peut arriver que les anticorps ne reconnaissent pas le MPC d'intérêt parce que leur épitope est caché dans la conformation native des protéines. Pour surmonter ce problème, il est possible de dénaturer les protéines au sein du BN-gel avant le transfert en faisant bouillir le gel peu dans le tampon 1x échantillon de SDS.
Dans notre exemple, nous n'avons pas l'objet de la BN-gel directement à la détection des bandes de protéines. Au lieu de cela, nous avons divisé le BN-PAGE, séparés par une seconde lysat dimensisur SDS-PAGE. Dans la deuxième dimension sur gel SDS, les protéines monomériques migrer à l'intérieur d'une diagonale hyperboliques due au gel de gradient dans le premier et le gel linéaire dans la deuxième dimension (Camacho-Carvajal, Wollscheid et al. 2004). Cela permet l'identification facile des PPM, car elles sont localisées en dessous de cette diagonale hyperbolique. Sous-composants d'un MPC distincts sont séparés dans une ligne verticale dans la deuxième dimension SDS-PAGE. Les composants qui sont des constituants des PPM dinstinct plusieurs peuvent être identifiés sur une ligne horizontale en fonction de la taille de la MPC. Cependant, il doit être considéré que les taches plusieurs protéines figurant dans une ligne verticale pourrait aussi faire partie de complexes distincts qui migrent à la même position dans BN-PAGE. La preuve définitive qu'ils sont présents dans la même MPC peut être obtenue par un dosage à base d'anticorps gel de quart de travail. Dans cet essai, lysat cellulaire est incubée avec un anticorps dirigé contre une protéine représentée par l'un des endroits identifiés avant BN-PAGE. Il en résulte un décalage de tous les PPM qui contiennent cette protéine vers une masse moléculaire plus élevée dans la première dimension. D'autres protéines qui sont aussi une partie de ces PPM va subir ce changement de complexes spécifiques et sont donc faciles à identifier dans la deuxième dimension SDS-gel.
Non seulement la composition des PPM peuvent être analysés par BN-PAGE, mais aussi la détermination de leur stœchiométrie est possible (et Schamel Reth 2000); (Schamel 2001), (Swamy, Minguet et al 2007).. À cette fin, un test NAMOS (native à base d'anticorps mobilité changement de dosage) peut être effectuée. Comme dans le dosage des anticorps gel à base de quart de travail, les lysats cellulaires sont incubés avec des anticorps monoclonaux sous-unité d'anticorps spécifiques. Cela conduit à l'induction de immunoshifts électrophorétique dans les gels BN-, qui permettent l'inférence à partir de la mesure de l'évolution de la stoechiométrie des PPM
En guise de conclusion, BN-PAGE est approprié pour l'identification des PPM et la détermination de leur taille, la composition, ainsi que l'abondance relative. Exécutée comme une épreuve NAMOS, il offre également la possibilité de déterminer la stœchiométrie d'une certaine MPC. Compte tenu de son applicabilité générale, cette technique est un outil très utile pour la caractérisation des PPM (Dekker, Müller et al 1996.); (Wittig et Schagger 2008); (Wagner, Rehling et al 2009.); (Wittig et Schagger 2009) .
Déclarations de divulgation
Remerciements
Nous tenons à remercier Michael Reth, Hermann Schagger, et Margarita Camacho-Carvajal d'appui scientifique. Ce travail a été financé par de la Bildung FORSYS Bundesministerium für Forschung et (BMBF), par BIOSS de la Deutsche Forschungsgemeinschaft (DFG), et soutenu en partie par l'Initiative d'excellence des gouvernements fédéral allemand et de l'Etat (CGC-4, Spemann Graduate School ).
Références
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon