Method Article
Blu nativi poliacrilammide gel elettroforesi (BN-PAGE) per l'analisi di complessi multiproteici da lisati cellulari
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo video, si descrive la caratterizzazione di complessi multiproteici (PPM) di blu elettroforesi su gel di poliacrilammide nativo (BN-PAGE). In una prima dimensione, dializzati lisati cellulari sono separati da BN-PAGE per identificare i singoli PPM. In una seconda dimensione SDS-PAGE, PPM di interesse sono ulteriormente suddivisi per analizzare i loro elettori mediante immunoblotting.
Abstract
Complessi multiproteici (PPM) svolgono un ruolo cruciale nella segnalazione cellulare, poiché la maggior parte delle proteine si trovano in complessi funzionali o di regolamentazione con altre proteine (Sali, Glaeser et al. 2003). Così, lo studio della proteina-proteina reti di interazione richiede la caratterizzazione dettagliata dei PPM di acquisire una comprensione integrativa della funzione della proteina e della regolamentazione. Per l'identificazione e l'analisi, MPC deve essere separata in condizioni native. In questo video, si descrive l'analisi di PPM di blu elettroforesi nativa su gel di poliacrilamide (BN-PAGE). BN-PAGE è una tecnica che permette la separazione di PPM in una conformazione nativa con una risoluzione superiore a quella offerta da gel filtrazione o la densità ultracentrifugazione saccarosio, ed è quindi utile per determinare la dimensione del MPC, la composizione e l'abbondanza relativa (Schägger e von Jagow 1991) ; (Schägger, Cramer et al 1994).. Con questo metodo, le proteine sono separate in base alle loro dimensioni e la forma idrodinamica in una matrice di poliacrilamide. Qui, dimostriamo l'analisi di PPM del totale lisati cellulari, sottolineando che la dialisi lisato è il passo fondamentale per rendere BN-PAGE applicabili a questi campioni biologici. Usando una combinazione di prima dimensione BN-e seconda dimensione SDS-PAGE, dimostriamo che PPM separati da BN-PAGE può essere ulteriormente suddivisa in loro singoli costituenti mediante SDS-PAGE. Visualizzazione dei componenti MPC su gel di separazione viene effettuata mediante immunoblotting standard. Come esempio di analisi da MPC BN-PAGE, abbiamo scelto la 19S ben caratterizzati eucariotiche, 20S, 26S e proteasomi.
Protocollo
** Questo protocollo video si basa su una pubblicazione associata 1: blu nativi elettroforesi su gel poliacrilammide (BN-PAGE) per l'identificazione e l'analisi di complessi multiproteici. Mahima Swamy, Gabrielle M. Siegers, Susana Minguet, Bernd Wollscheid, e Wolfgang WA Schamel. Scienza STKE 2006 (345): PL2, 25 luglio 2006, [DOI: 10.1126/stke.3892006pl4]. Clicca qui per vedere questa pubblicazione .
1. Preparazione del lisato cellulare dializzati
- Harvest 10x10 6 celle e pellet da centrifugazione a 350g per 5 minuti a 4 ° C.
- Lavare il pellet di cellule per tre volte con 1 ml di PBS ghiacciato (ricetta 1), centrifuga come al punto 1.1.
- Risospendere il pellet in 250 ml di ghiacciata BN-Lysis Buffer (ricetta 2) e incubare in ghiaccio per 15 minuti.
- Centrifugare a 13.000 g per 15 minuti a 4 ° C per rimuovere il materiale insolubile.
- Sciogliete un foro nel tappo di un 1,5 mL provetta utilizzando il lato riscaldato di grande diametro di una pipetta Pasteur, quindi inserire la provetta in ghiaccio per raffreddare a 4 ° C.
- Trasferire il surnatante dal passo 1,4 nel tubo raffreddato con il foro nel tappo.
- Inserire una membrana di dialisi (peso molecolare di cut-off di 10 kD) con una pinza sulla parte superiore del tubo aperto, chiudere il tappo, e tagliare l'eccesso di membrana di dialisi che sporge.
- Sigillare il tappo sul lato accuratamente con Parafilm.
- Invertire i tubi e centrifugare a testa in giù alla velocità più bassa possibile in una provette coniche da 50 ml in una centrifuga di coltura cellulare per 10 secondi a 4 ° C. Rimuovere il tubo invertito dalla centrifuga con una pinzetta per evitare di trasformare la parte destra del tubo alto.
- Preparare un becher da 100 ml con freddo BN-Dialisi Buffer (ricetta 3) e un piatto mescolate. Utilizzare almeno 10 ml di BN-dialisi-Buffer per 100 microlitri del campione.
- Fissare il tubo con del nastro adesivo a testa in giù dentro il bicchiere, e rimuovere le bolle d'aria dal foro sotto il tappo con una pipetta Pasteur piegato.
- Bicchiere posto sulla cima di un agitatore magnetico, accendere l'agitatore e lasciare per 6 ore o una notte in cella. Controllare di tanto in tanto per garantire che mescolando non è la creazione di bolle d'aria a livello della membrana di dialisi.
- Raccolgono il lisato cellulare dializzati in un tubo nuova microcentrifuga refrigerata.
2. Versamento di BN-gel
- Gel gradiente colata avviene a temperatura ambiente con un mixer gradiente. I guanti devono essere indossati perché poliacrilammide è un potente neurotossico. Evitare qualsiasi contatto con SDS.
- Posizionare il mixer gradiente su un piatto mescolare e allegarlo a un pezzo di tubo flessibile. Chiudere il canale utilizzando la valvola e chiudere il tubo con una fascetta. Posizionare un agitatore magnetico del 15% nel cilindro "alto" collegato al tubo.
- Infilare il tubo flessibile in una pompa peristalitic e inserire un ago siringa fino alla fine. Poi, posto l'ago tra le due lastre di vetro dell'apparato gel.
- Preparare 4% (ricetta 5) e 15% (ricetta 6) che separa le soluzioni gel, l'aggiunta di APS e TEMED immediatamente prima dell'uso. I volumi combinati dovrebbe essere pari al volume del gel di separazione.
- Versare queste soluzioni gel nei cilindri corrispondente del mixer pendenza (4% nel "basso" e il 15% nel cilindro "alto").
- Aprire la valvola e la forza fuori la bolla d'aria all'interno del canale che collega i due serbatoi in gel premendo sul cilindro sinistro con il pollice.
- Accendere l'agitatore magnetico, rimuovere la pinza, e accendere la pompa peristalitic a 5 ml al minuto. Lasciare che il gel di fluire lentamente tra le lastre di vetro. Assicurarsi che l'ago sia sempre al di sopra del liquido.
- Lasciare tutto il liquido di inserire l'apparato gel, e poi sovrapporre delicatamente con isopropanolo. Lasciare polimerizzare il gel per almeno 30 minuti a temperatura ambiente.
- Pulire l'apparato versando immediatamente con dH 2 O (non usare detergenti).
- Rimuovere l'isopropanolo, lavare con dH 2 O, e rimuovere il dH 2 O con una carta Whatman.
- Preparare un gel 3,2% accatastamento (ricetta 7), l'aggiunta di APS e TEMED immediatamente prima dell'uso.
- Versare il gel di impilamento sulla parte superiore del gel di separazione e di introdurre il pettine tra le lastre di vetro, evitando le bolle. Dopo che il gel di impilamento è polimerizzato, il gel fresco fino a 4 ° C.
- Immediatamente prima del caricamento del campione, rimuovere lentamente il pettine, tirando fuori un angolo rispetto al piano del gel. Questo permette all'aria di entrare rapidamente nelle tasche, che migliora la qualità dei pozzi.
3. Separazione di lisato cellulare dializzati da BN-PAGE
- Carico 1-40 ml di lisato dializzato e da 10 a 20 l di Mix Marker (ricetta 10) nei pozzi a secco a 4 ° C. Sovrapposizione dei campioni in ogni pozzetto con tampone di catodo freddo (ricetta 8).
- Riempire la camera interna con Cat freddonell'hode stabilizzatrice e la camera esterna / inferiore con Buffer anodo freddo (ricetta 9).
- Applicare 100 V ad un minigel o 150V per un gel di grandi dimensioni, fino a quando i campioni sono entrati nel gel di separazione. Attivare il gel a 4 ° C.
- Aumentare la tensione a 180 V (minigel) o 400 V (gel di grandi dimensioni) ed eseguire fino a quando il fronte del colorante raggiunge la fine del gel. La corsa dura da 3 a 4 ore per un mini-, e da 18 a 24 ore per un gel di grandi dimensioni.
4. Seconda dimensione SDS-PAGE
- Preparare uno standard di 10% SDS-gel (ricette 12-15) con una sola corsia di grandi dimensioni per la prima dimensione BN-PAGE corsia, una corsia regolare per il marcatore di peso molecolare, e una corsia regolare per un aliquota del lisato dializzati che ha stato mescolato con tampone campione SDS (ricetta 11) e bollite per 5 min a 95 ° C. Utilizzare distanziatori il cui spessore è stato aumentato da due strati di nastro adesivo per semplificare il caricamento della BN-PAGE fetta gel sul gel SDS.
- Rimuovere il BN-PAGE gel nei piatti dall'apparato elettroforesi e sollevare delicatamente alto di una lastra.
- Rimuovere il gel di impilamento e tagliare fuori la corsia del BN-PAGE gel contenenti le proteine di interesse.
- Posizionare il BN-PAGE fetta gel nel tampone 2x SDS campione e incubare per 10 minuti a temperatura ambiente.
- Far bollire il BN-PAGE brevemente fetta gel (non più di 20 sec) in un forno a microonde.
- Incubare la BN-PAGE fetta gel nel caldo Sample Buffer SDS per altri 15 min a temperatura ambiente.
- Caricare il BN-PAGE fetta gel nella grande ben oltre il gel di sovrapposizione del SDS-PAGE gel evitando bolle d'aria, e sovrapporre la fetta con Sample Buffer SDS. Carico marcatore e controllo lisato.
- Eseguire l'elettroforesi secondo protocolli standard.
5. Rilevazione di subunità MPC mediante immunoblotting
- Per il trasferimento, preparare sei documenti Whatman e una membrana PVDF adattamento alle dimensioni del SDS-gel.
- Incubare la membrana PVDF in 100% di metanolo per 30 s e godersi le carte Whatman nel buffer di trasferimento (ricetta 16).
- Inserire tre carte Whatman, la membrana PVDF, la SDS-gel (rimuovere stacking gel), e di nuovo tre carte Whatman in una struttura a sandwich in una cella trasferimento semisecco.
- Applicare 20 V per 25 min.
- Rilevare le proteine secondo i protocolli standard di immunoblotting.
6. Rappresentante Risultati
Vi presentiamo l'analisi del 19S eucariotiche, 20S e 26S proteasomi come esempio per la caratterizzazione dei MPC da 2D BN / SDS-PAGE (Figura 1A). HEK293 cellule sono state lisate con un tampone contenente 0,1% Triton X-100 come un detersivo per distruggere le membrane e solubilizzare complessi di proteina di membrana. Queste lisati sono stati dializzati contro BN-dialisi buffer per eliminare i sali e metaboliti di piccole dimensioni. Poi, PPM erano separati da 4-15% gradiente BN-PAGE seguita da una seconda dimensione SDS-PAGE. Le proteine sono state visualizzate mediante immunoblotting con anticorpi contro la subunità β2 e Mcp21 del proteasoma 20S.
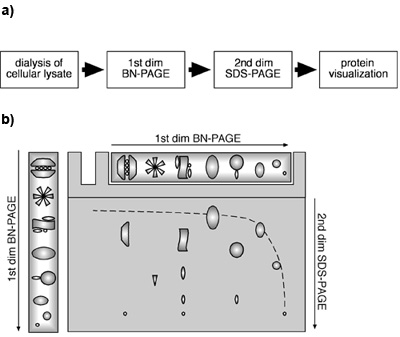
Figura 1. Un approccio bidimensionale BN-PAGE/SDS-PAGE utilizzando lisati cellulari. (A) diagramma di flusso di un approccio BN-PAGE/SDS-PAGE 2D da lisati cellulari. (B) schema schematica di un BN-PAGE/SDS-PAGE 2D. Proteine e PPM sono separati in condizioni native da BN-PAGE in una prima dimensione. Per la seconda dimensione, le proteine e / o PPM vengono denaturate dal SDS nella striscia di gel dopo la separazione da BN-PAGE e successivamente sottoposti a SDS-PAGE. Proteine monomeriche migreranno in una causa iperbolico diagonale per il gel gradiente nel primo e un gel lineare nella seconda dimensione. Componenti di una concreta MPC sarà trovato sotto la diagonale, che si trova su una linea verticale.
E 'stato dimostrato che dalla combinazione di prima dimensione BN-e seconda dimensione SDS-PAGE, proteine monomeriche migrare all'interno di un diagonale iperbolica a causa del gradiente di gel nel primo e il gel lineare nella seconda dimensione ((Camacho-Carvajal, Wollscheid et al 2004);. Figura 1B). I componenti di PPM si trovano sotto questa diagonale. Proteine che rappresentano subunità della stessa MPC può essere trovato in una linea verticale nella seconda dimensione, mentre diversi punti della stessa proteina in una linea orizzontale indicano la presenza della proteina in diversi PPM distinte. La Figura 2 mostra che nel nostro esperimento immunoblotting contro β2 e Mcp21 rivelato la presenza di complessi proteici specifici contenenti tali subunità del proteasoma. Entrambe le proteine erano rilevabili come punti singoli disposti in linea orizzontale, ad indicare che β2 e Mcp21 rappresentano costituenti di diversi PPM distinte. Questi PPM potrebbe essere chiaramente identificato come il proteasoma 26S (20S 19S più tappo), il proteasoma 20S insieme alla subunità regolatrice PA28, e il 20S proteasomi da solo, sulla base della loro dimensione e composizione. Presi insieme, questi resuLTS dimostrare che MPC endogena può essere identificato e caratterizzato da un approccio bidimensionale BN-PAGE/SDS-PAGE con lisato cellulare. Questo metodo è applicabile per la determinazione della dimensione, composizione e abbondanza relativa di PPM.

Figura 2. Dell'individuazione di forme diverse del proteasoma eucarioti mediante immunoblotting dopo bidimensionale BN-PAGE/SDS-PAGE. Per l'identificazione e l'analisi dei proteasomi eucariotiche, HEK293 cellule sono state lisate con 0.1% Triton X-100. Lisati cellulari sono stati dializzati e successivamente sottoposti a BN-PAGE (4-15%) di PPM separati. In seguito, una seconda dimensione SDS-PAGE (10%) è stato eseguito per la separazione delle sottocomponenti dimensione individuale. Immunoblotting è stata effettuata con anticorpi specifici riconoscendo il Mcp21 e β2 subunità del complesso nucleo 20S, e per la subunità regolatrice PA28.
Tabella I. di reagenti specifici (ordine alfabetico):
| Reagente | Azienda | Commenti |
| 6-aminohexanoic acido (Ε-aminocaproico acido) | Sigma-Aldrich, Taufkirchen, Germania | Questo prodotto chimico è un irritante e deve essere maneggiato con i guanti. |
| Acrilamide-bisacrylamide soluzione (40%), miscela 32:1 | Applichem, Darmstadt, Germania | Questa soluzione è neurotossico e deve essere maneggiato con i guanti. |
| Bis-tris | Roth, Karlsruhe, Germa-ny | |
| Brij 96 | Sigma-Aldrich, Taufkirchen, Germania | |
| Coomassie blu G250 | Serva, Heidelberg, Ger-mania | Non sostituire altri tipi di Coomassie colorante Coomassie blu come R250 o colloidale Coo-Massie blues. |
| Digitonina | Sigma-Aldrich, Taufkirchen, Germania | Digitonina è tossico. Dovrebbero indossare guanti protettivi quando si maneggiano i buffer o campioni contenenti questo detersivo. |
| Dodecylmaltoside | Applichem, Darmstadt, Germania | |
| Triton X-100 | Roth, Karlsruhe, Germa-ny | Triton X-100 è tossico. Dovrebbero indossare guanti protettivi quando si maneggiano tamponi o campioni contenenti questo detergente. |
II. Tabella di materiale e attrezzature specifiche:
| Attrezzatura | Azienda |
| Membrane di dialisi (peso molecolare di cut-off 10-50 kD) | Roth, Karlsruhe, Germania |
| Gel elettroforesi sistema | Per esempio da Bio-Rad, Monaco di Baviera, Germania |
| Gradiente mixer | Self-made o disponibili in commercio da Bio-Rad, Monaco di Baviera, Germania |
| Pompa peristaltica | Amersham Pharmacia Biotech, Friburgo, Germania |
| Polivinilidene fluoruro (PVDF), membrana | Immobilon-P, Millipore, Eschborn, Germania |
| Semisecco trasferimento attrezzature | Per esempio da Bio-Rad, Monaco di Baviera, Germania |
| Silicon tubing (3 a 5 mm di diametro, 1 m di lunghezza) | NeoLab, Heidelberg, Germania |
III. Tabella di ricette:
| No. | Tamponi e soluzioni | Contenuto | Commenti |
| 1 | Soluzione salina tamponata con fosfato (PBS) | Na 2 HPO 4 8,1 mMKH 2 PO 4 1.5 mM NaCl 138 mm KCl 2,7 mm | Soluzione deve essere pH 7,4, se preparate correttamente. |
| 2 | BN-Lysis Buffer | Base di buffer Bis-Tris 20 mM ε-aminocaproico acido 500 mM NaCl 20 mM EDTA, pH 8.0 2 mM Glicerolo 10% Regolare il pH a 7,0 con HCl. Conservare a 4 ° C. Detergente Digitonina 0,5-1,0% o Brij 96 0,1 allo 0,5% o Triton X-100 0,1 allo 0,5% o Dodecylmaltoside 0,1 allo 0,5% Inibitori della proteasi e fosfatasi Aprotinina 10 mcg / mL Leupeptina 10 mcg / mL PMSF 1 mM Fluoruro di sodio 0,5 mM Sodio orthovanadate 0,5 mM | Il detersivo appropriato deve essere determinato in modo empirico dovrebbe essere lo stesso di quello usato nelle ricette altre tampone di lisi. Digitonina devono essere aggiunti al momento dell'uso da una soluzione di riserva del 2% dH 2 O (negozio in 5 ml aliquote a -20 ° C). Proteasi e fosfatasi inibire-ORS deve essere aggiunto immediatamente prima dell'uso. Dopo l'aggiunta di sodio orthova-nadate, il buffer diventa di colore giallastro. |
| 3 | BN-dialisi Buffer | Base di buffer Bis-Tris 20 mM ε-aminocaproico acido 500 mM NaCl 20 mM EDTA, pH 8.0 2 mM Glicerolo 10% Regolare il pH a 7,0 con HCl. Conservare a 4 ° C. Detergente Digitonina 0,3-0,5% o Triton X-100 0,1% o Brij 96 0,1% o Dodecylmaltoside 0,1% Inibitori della proteasi e fosfatasi PMSF 1 mM Sodio orthovanadate 0,5 mM | Il detersivo appropriata deve essere determinata empiricamente e dovrebbe essere lo stesso di quello usato nel buffer di lisi, ma al più basso indicato concentrazioni di. Detergente deve essere aggiunto al pre-sfogo di aggregazione nella fase di sovrapposizione dei elettroforesi su gel. Proteasi e fosfatasi inibire-ORS deve essere aggiunto immediatamente prima dell'uso. |
| 4 | 3x BN-Gel Buffer | Bis-Tris 150 mM ε-aminocaproico acido 200 mM Regolare il pH a 7,0 con HCl. Conservare a 4 ° C. | |
| 5 | 4% gel separatore | 3x BN-Gel Buffer (ricetta 4) 5,00 ml Acrilamide / Bisacrylamide 1,50 ml dH 2 O 8,50 ml APS, il 10% in DH 2 O 54 microlitri TEMED 5,4 microlitri | Aggiungi APS e TEMED riconoscibili ad occhio nudo prima di versare gel, in quanto questi reagenti promuovere la polimerizzazione. Questa ricetta è sufficiente per lanciare un 30 ml di gel. Regolare i volumi per il numero e le dimensioni del gel viene versato. |
| 6 | 15% gel separatore | 3x BN-Gel Buffer (ricetta 4) 5,00 ml Acrilamide / Bisacrylamide 5,63 ml Glicerolo 70% 4,38 ml APS, il 10% in DH 2 O 42 microlitri TEMED 4,2 microlitri | Aggiungi APS e TEMED riconoscibili ad occhio nudo prima di versare gel, in quanto questi reagenti promuovere la polimerizzazione. Questa ricetta è sufficiente per lanciare un 30 ml di gel. Regolare i volumi per il numero e le dimensioni del gel viene versato. La concentrazione di acrilamide-bisacrylamide può anche essere variata, se necessario 10-18%. |
| 7 | 3,2% Stacking Gel | 3x BN-gel Buffer (ricetta 4) 3,00 ml Acrilamide / Bisacrylamide 0,72 ml dH 2 O 5,28 ml APS, il 10% in DH 2 O 120 microlitri TEMED 12 microlitri | Aggiungi APS e TEMED riconoscibili ad occhio nudo prima di versare gel, in quanto questi reagenti promuovere la polimerizzazione. Questa ricetta è sufficiente per lanciare un 30 ml di gel. Regolare i volumi per il numero e le dimensioni del gel viene versato. |
| 8 | Catodo Buffer | Bis-Tris 15 mM Tricine 50 mM Coomassie blu G250 0,02% Preparare 1 litro come uno stock 10x, aggiustare il pH a 7.0 con HCl, e conservare a 4 ° C. Diluire 1:10 con dH 2 O prima dell'uso. | Non sostituire altri tipi di colorante Coomassie come Coomassie R250 blu o blu Coomassie colloidale. |
| 9 | Buffer anodo | Bis-Tris 50 mM Preparare 1 litro come uno stock 10x, aggiustare il pH a 7.0 con HCl, e conservare a 4 ° C. Diluire 1:10 con dH 2 O prima dell'uso. | |
| 10 | Marker Mix | Aldolasi (158 kD) 10 mg / mL Catalasi (232 kD) 10 mg / mL Ferritina (440 e 880 kD) 10 mg / mL Tireoglobulina (670 kD) 10 mg / mL BSA (66 e 132 kD) 10 mg / mL Bis-Tris 20 mM NaCl 20 mM Glicerolo 10% Regolare il pH a 7,0 con HCl. Conservare a 4 ° C. | Marcatori peso molecolare sono anche disponibili in commercio da diverse fonti, tra cui Invitro generazione o Pharmacia. |
| 11 | SDS campione Tampone | Tris 12,5 mm SDS 4% Glicerolo 20% Blu di bromofenolo 0,02% Regolare il pH a 6,8. Per ridurre i ponti disolfuro, aggiungere 9 ml β-mercaptoetanolo. | SDS come polvere e β-mer-captoethanol sono tossici. Pertanto, utilizzare guanti e lavorare sotto una cappa. |
| 12 | 4x tampone inferiore | Tris 1,5 M SDS 0,4% Regolare il pH a 8,8. | SDS come polvere è tossico. Pertanto, utilizzare guanti e lavorare sotto una cappa. |
| 13 | 4x tampone superiore | Tris 0,5 M SDS 0,4% Regolare il pH a 6,8. | SDS come polvere è tossico. Pertanto, utilizzare guanti e lavorare sotto una cappa. |
| 14 | 10% gel separatore | Acrilamide (30%) 2,0 ml Inferiore tampone 4x 1,5 ml dH 2 O 2,454 ml APS, il 10% in DH 2 O 40 microlitri TEMED 6 microlitri | Aggiungi APS e TEMED riconoscibili ad occhio nudo prima di versare gel, in quanto questi reagenti promuovere la polimerizzazione. Questa ricetta è sufficiente per lanciare un 30 ml di gel. Regolare i volumi per il numero e le dimensioni del gel viene versato. |
| 15 | 4,8% Stacking Gel | Acylamide (30%) 320 microlitri 4 volte superiore di buffer 500 microlitri dH 2 O 1,16 ml APS, il 10% in DH 2 O 20 l TEMED 2 microlitri | Aggiungi APS e TEMED riconoscibili ad occhio nudo prima di versare gel, in quanto questi reagenti promuovere la polimerizzazione. Questa ricetta è sufficiente per lanciare un 30 ml di gel. Regolare i volumi per il numero e le dimensioni del gel viene versato. |
| 16 | Semisecco Transfer Buffer | Tris 48 mm Glycine 39 mm Metanolo 20% SDS 0,1% Regolare il volume a 1 litro con dH 2 O. Conservare a temperatura ambiente. | SDS come polvere e metanolo sono tossici. Pertanto, utilizzare guanti e lavorare sotto una cappa. |
Discussione
In questo studio, descriviamo l'analisi di PPM da BN-PAGE. Un approccio 2D viene utilizzato al primo PPM separare in condizioni native, e poi ulteriormente suddividere nelle loro componenti singoli da una seconda dimensione SDS-PAGE.
I campioni sono preparati con lisati cellulari. Per la solubilizzazione di PPM molti, un detergente appropriata è indispensabile, che conserva la struttura dei complessi proteici. Qui, usiamo 0,1% Triton X-100. Tuttavia, il detergente ottimale e la sua concentrazione adatta devono essere determinate empiricamente per ogni MPC. In caso di Triton X-100, per esempio, è stato riportato che le concentrazioni di detergenti a basso permettono l'identificazione di una forma dimerica della F 1 F 0-ATPasi complesso (Arnold, Pfeiffer et al. 1998). Superiore Triton X-100 concentrazioni, tuttavia, portano alla dissociazione del dimero e ad un corrispondente aumento del monomerico F 1 F 0-ATPasi complesso. Ciò è in linea con uno dei nostri studi precedenti, sono stati dimostriamo che il polivalente cellule T complesso recettore (TCR) viene conservato quando estratto con basse concentrazioni di Brij 96, mentre l'uso di una maggiore concentrazione o di un altro detergente chiamato digitonina risultati in l'estrazione di monomerico TCR (Schamel, Arechaga et al. 2005). Detergenti comunemente usati che possono essere testati includono digitonina (da 0,5 a 1%), Triton X-100 (da 0,1 a 0,5%), Brij 96 (da 0,1 a 0,5%), o dodecylmaltoside (0,1 allo 0,5%). Questi reagenti sono detergenti non ionici, che tendono ad essere migliori per la stabilità MPC. Essere consapevoli del fatto che il contatto con SDS e altri detergenti aggressivi deve essere evitato (Camacho-Carvajal, Wollscheid et al. 2004).
Dialisi del lisati è necessario per realizzare la separazione MPC in una BN-gel (Camacho-Carvajal, Wollscheid et al 2004.), (Heiss, Junkes et al 2005).. Sembra che la regolazione della concentrazione di sale o la rimozione delle impurità a basso peso molecolare è di fondamentale importanza per alta risoluzione. È interessante notare che anche le preparazioni di membrana e PPM, che sono stati immunopurified e poi eluito dalla anticorpi, sono adatti per BN-PAGE (Swamy, Siegers et al. 2006). In entrambi i casi, i campioni non devono essere dializzati per BN-PAGE la separazione, se lisi membrana o eluizione viene effettuata in BN-lisi buffer.
Per la separazione delle proteine da BN-PAGE, il colorante Coomassie blu è necessario, che si lega alle proteine unspecifically e li copre con cariche negative. In tal modo, Coomassie blu consente la mobilità elettroforetica delle proteine verso il catodo a pH neutro (Schägger e von Jagow 1991); (Schägger, Cramer et al 1994).. Inoltre, Coomassie blu impedisce l'aggregazione delle proteine nel gel di impilamento durante l'elettroforesi. Per BN-PAGE, Coomassie G250 deve essere usato al posto di Coomassie R250 blu o blu Coomassie colloidale.
Prima di eseguire una BN-gel, è necessario garantire che la percentuale di gel si adatta alla dimensione prevista del MPC di interesse. Prefabbricati BN-gel con pendenze diverse e tamponi adatti sono disponibili in commercio da Invitrogen (NativePAGE Novex Bis-Tris Gel System). Ma BN-gel può anche essere preparata usando un gradiente mixer insieme con una pompa persistaltic. Per garantire un gradiente intatto, il liquido deve fluire costantemente durante il getto e le bolle dovrebbero essere evitati. Si consiglia il caricamento di diverse diluizioni del campione sul gel perché sovraccarico può portare alla precipitazione delle proteine durante il processo di elettroforesi. Inoltre, BN-gel dovrebbe essere eseguito a 4 ° C per evitare la degradazione delle proteine e di mantenere intatto il PPM.
Dopo BN-PAGE, la visualizzazione di MPC può essere raggiunto con la colorazione Coomassie blu brillante, colorazione argento o immunoblotting. Bande proteiche visualizzate mediante colorazione Coomassie o argento sono adatti per ulteriori analisi mediante spettrometria di massa (Camacho-Carvajal, Wollscheid et al. 2004). In caso di immunoblotting, le condizioni di trasferimento ottimale per i PPM di interesse devono essere determinati empiricamente. Essere consapevoli del fatto che Coomassie blu è anche trasferito durante assorbente di una BN-gel. Pertanto, il gel sarà incolore dopo il trasferimento di successo, mentre la membrana in grado di esercitare un colore blu. Inoltre, è importante ricordare che non tutti gli anticorpi primari, che lavora per il rilevamento dopo SDS-PAGE, è applicabile a immunoblotting su BN-PAGE. Può succedere che gli anticorpi non riconoscono il MPC di interesse perché la loro epitopo è nascosto nella conformazione nativa delle proteine. Per superare questo problema, è possibile denaturare le proteine all'interno della BN-gel prima del trasferimento facendo bollire il gel a breve nella tampone 1x campione SDS.
Nel nostro esempio, noi non sottoporre il BN-gel direttamente al rilevamento di bande proteiche. Invece, abbiamo ulteriormente diviso il BN-PAGE-lisato separati da un secondo dimensisu SDS-PAGE. Nella seconda dimensione SDS-gel, proteine monomeriche migrare all'interno di un diagonale iperbolica a causa del gradiente di gel nel primo e il gel lineare nella seconda dimensione (Camacho-Carvajal, Wollscheid et al. 2004). Questo permette la facile identificazione dei PPM, dal momento che sono localizzati sotto questa diagonale iperbolica. Sottocomponenti di un distinto MPC sono separati in una linea verticale nella seconda dimensione SDS-PAGE. I componenti che rientrano nella composizione di PPM dinstinct diverse possono essere identificati su una linea orizzontale a seconda delle dimensioni del MPC. Tuttavia, è da considerare che gli spot di proteine diverse che appare in una linea verticale potrebbe anche far parte di complessi separati che migrano nella stessa posizione in BN-PAGE. La prova finale che sono presenti nello stesso MPC può essere ottenuta con un anticorpo saggio basato su gel shift. In questo saggio, lisato cellulare viene incubato con un anticorpo contro una proteina rappresentata da uno dei luoghi individuati prima BN-PAGE. Ciò si traduce in uno spostamento di tutti i PPM che contengono questa proteina verso una massa molecolare maggiore nella prima dimensione. Altre proteine che sono anche una parte di questi PPM subirà questo complesso specifico turno e sono quindi facili da identificare nella seconda dimensione SDS-gel.
Non solo la composizione del MPC può essere analizzato BN-PAGE, ma anche la determinazione della loro stechiometria è possibile (e Schamel Reth 2000); (Schamel 2001), (Swamy, Minguet et al 2007).. A tal fine, un test Namos (nativo a base di anticorpi mobilità-shift test) può essere eseguita. Come nel anticorpi saggio basato su gel di turno, il lisati cellulari vengono incubati con subunità monoclonali specifici anticorpi. Questo porta a l'induzione di immunoshifts elettroforetici nel BN-gel, che consentono l'inferenza dalla misura dello spostamento sulla stechiometria di PPM
In conlusion, BN-PAGE è adatto per l'identificazione di PPM e la determinazione della loro dimensione, composizione, così come l'abbondanza relativa. Eseguito come un test Namos, offre anche la possibilità di determinare la stechiometria di un certo MPC. Data la sua applicabilità generale, questa tecnica è uno strumento molto utile per la caratterizzazione di PPM (Dekker, Müller et al 1996.) (Wittig e Schagger 2008); (Wagner, Rehling et al 2009.) (Wittig e Schägger 2009) .
Divulgazioni
Riconoscimenti
Ringraziamo Michael Reth, Hermann Schägger, e Margherita Camacho-Carvajal al sostegno scientifico. Questo lavoro è stato finanziato dalla FORSYS dal Bundesministerium für Bildung e Forschung (BMBF), dal BIOS dalla Deutsche Forschungsgemeinschaft (DFG), e sostenuta in parte dal Iniziativa eccellenza dei governi tedesco e Stato (GSC-4, Spemann Graduate School ).
Riferimenti
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon