Method Article
Hücresel lizatları Multiprotein Kompleksleri Analizi Mavi Native Poliakrilamid Jel Elektroforez (BN-PAGE)
* Bu yazarlar eşit katkıda bulunmuştur
Özet
Bu video, mavi yerli poliakrilamid jel elektroforezi (BN-PAGE) multiprotein kompleksler (MPCs) karakterizasyonu açıklar. Birinci boyut, diyaliz hücresel lizatları bireysel MPCs tanımlamak için BN-PAGE ile ayrılır. Ikinci bir boyut SDS-PAGE, faiz MPCs daha immün bileşenleri analiz alt gruba ayrılır.
Özet
En proteinleri diğer proteinler ile fonksiyonel veya düzenleyici kompleksleri (Sali, Glaeser ve ark 2003) bulunabilir Multiprotein kompleksleri (MPCs), hücre sinyal çok önemli bir rol oynamaktadır. Bu nedenle, protein-protein etkileşim ağlarının çalışma, protein düzenleme fonksiyonu ve entegre bir anlayış kazanmak için MPCs detaylı karakterizasyonu gerektirir. Tanımlanması ve analizi için, MPCs yerli koşullar altında ayrılmalıdır. Bu video, mavi yerli poliakrilamid jel elektroforezi (BN-PAGE) MPCs analizi açıklanmaktadır. BN-PAGE jel filtrasyon veya sakkaroz yoğunluğu Ultrasantrifügasyon tarafından sunulan daha yüksek bir çözünürlüğe sahip bir doğal yapısındaki MPCs ayrılması sağlar ve MPC boyutu, kompozisyon ve göreceli bolluk (Schägger ve von Jagow 1991) belirlemek için bu nedenle yararlı bir tekniktir. (Schägger, Cramer ve ark 1994). Bu yöntemle, proteinler, hidrodinamik bir poliakrilamid matris boyutu ve şekli göre ayrılır. Burada, lizat diyaliz BN-PAGE bu biyolojik örnekler için geçerli hale getirmek için önemli bir adım olduğuna işaret ederek, toplam hücresel lizatları MPCs analiz göstermektedir. Birinci boyut, BN ve ikinci boyut SDS-PAGE bir kombinasyonunu kullanarak, BN-PAGE ile ayrılmış MPCs SDS-PAGE ile daha fazla bireysel bileşenlerinin içine alt edilebilir olduğunu göstermektedir. Jel ayrılması üzerine MPC bileşenleri Görselleştirme standart immunoblotting tarafından yapılır. PPK BN-PAGE ile analiz için bir örnek olarak, iyi karakterize ökaryotik 19S, 20S, ve 26S protozomları seçti.
Protokol
Multiprotein Kompleksleri Tanımlama ve Analiz Mavi Native Poliakrilamid Jel Elektroforez (BN-PAGE): ** Bu video protokolü ilişkili bir yayın 1 dayanmaktadır. Mahima Swamy, Gabrielle M. Siegers, Susana Minguet, Bernd Wollscheid, ve Wolfgang WA Schamel. Bilim STKE 2006 (345): PL2, Temmuz 25, 2006, [DOI: 10.1126/stke.3892006pl4] Bu yayının görmek için buraya tıklayınız .
1. Diyaliz hücre lizat hazırlanması
- 350g 4 5 dakika santrifüj yoluyla hasat 10x10 6 hücre ve pelet ° C
- Buz gibi soğuk PBS (tarifi 1) 1 ml hücre pelletini üç kez yıkayın, adım 1.1 'de santrifüj.
- Süspanse edin buz BN-Lizis Tamponu (tarifi 2) 250 mcL pelet ve 15 dakika buz üzerinde kuluçkaya yatmaktadır.
- 4 15 dakika 13.000 g Santrifüj ° C çözünmez malzemeyi kaldırmak için.
- Pasteur pipeti ısıtmalı geniş çaplı yan kullanarak 1.5 mL mikrosantrifüj tüp kapağı bir delik eritin, sonra 4 ° C'ye kadar soğuması için buz üzerinde tüp
- Soğutulmuş tüpe delik kapağı ile 1.4 adım süpernatant aktarın.
- Yakın açılan tüp üst kapağı forseps ile bir diyaliz membranı (10 kD molekül ağırlığı cut-off) yerleştirin ve dışarı sopalarla fazla diyaliz membran kesti.
- Parafilm dikkatli bir şekilde yan kapağı Seal.
- Tüpler ters çevirin ve 10 saniye boyunca 4 baş aşağı bir hücre kültür santrifüj 50 ml konik tüpler mümkün olan en düşük hızda santrifüj ° C Santrifüj ters tüp tüp sağ tarafında dönüm önlemek için cımbız kullanarak çıkarın.
- Soğuk BN-Diyaliz Buffer (tarifi 3) ve heyecan plaka ile 100 ml beher hazırlayın. En az 10 ml, 100-mcL örnek başına BN-Diyaliz Tampon kullanın.
- Yapıştırmayın beher içinde baş aşağı bant ile tüp ve boynu bükük Pasteur pipeti kullanarak kapağı altındaki delikten hava kabarcıkları giderin.
- Bir mıknatıs karıştırıcı üstüne yerleştirin beher karıştırıcı geçiş ve 6 saat veya soğuk oda gece bekletin. Ara sıra karıştırarak diyaliz membranı hava kabarcıkları oluşturarak olmadığından emin olmak için kontrol edin.
- Yeni bir soğuk mikrosantrifüj tüp diyaliz hücre lizat toplayın.
2. Dökme BN-jeller
- Dökme Gradient jel bir degrade karıştırıcı ile oda sıcaklığında yapılır. Poliakrilamid yüksek nörotoksik çünkü Eldiven takılmalıdır. SDS ile herhangi bir temastan kaçının.
- Degrade mikseri bir heyecan plaka üzerine yerleştirin ve esnek borular bir parçası ekleyin. Vana kullanarak kanalı kapatın ve bir kelepçe ile boru yakın. Hortumun bağlı "yüksek" bir silindirin içine bir manyetik karıştırıcı,% 15 yerleştirin.
- Konu peristalitic bir pompa içine esnek borular ve sonuna kadar bir şırınga iğne takılır. Daha sonra, jel aparat iki cam levha arasında iğne yerleştirin.
- % 4 (tarifi 5) ve% 15 (tarifi 6), jel çözümleri ayıran APS ekleme ve kullanmadan hemen önce TEMED hazırlayın. Kombine hacimleri ayıran jel hacmine eşit olmalıdır.
- Degrade mikser ilgili silindir ("düşük",% 4 ve% 15 "yüksek" silindirin içine) içine bu jel çözümler dökün.
- Başparmağı ile sol silindir üzerine basarak iki jel rezervuarları bağlayan kanal içinde hava kabarcığı dışarı vana ve kuvvet açın.
- Manyetik karıştırıcı açın, kelepçe kaldırmak ve dakika başına 5 ml peristalitic pompa geçiş. Jel, cam plakalar arasında yavaş yavaş akmasına izin verin. Iğne sıvı üzerinde her zaman olduğundan emin olun.
- Tüm sıvı jel aparat girmek için izin ver ve sonra izopropanol hafifçe kaplaması. Jel oda sıcaklığında en az 30 dakika süreyle polimerize izin verin.
- Dökme aparatı dH 2 O (deterjan kullanmayın) ile hemen temizleyin.
- Izopropanol çıkarın, dH 2 O ile yıkayın ve bir whatman kağıt dH 2 O kaldırmak.
- ,% 3.2 istifleme jel hazırlayın (tarifi 7), APS ekleyerek ve kullanmadan hemen önce TEMED.
- Istifleme jel ayıran jel üstüne dökün ve kabarcıklar kaçınarak, cam plakalar arasında tarak tanıtmak. Istifleme jel polimerize sonra, 4 ° C'ye kadar soğumasını jel
- Hemen örnek yüklemeden önce, jel düzlemine bir açı çekerek, yavaş yavaş tarak çıkarın. Bu kuyuların kalitesini artırır hızla cepler, girmek için hava sağlar.
3. BN-PAGE ile diyaliz hücre lizat ayrılması
- 4 kuru kuyu, 1 ile 40 diyaliz lizat mcL ve ul Marker Mix 10-20 (tarifi 10) yükleyin ° C. Soğuk Katot Buffer (tarifi 8) Her iyi örnekleri Yerleşimi.
- Iç odanın soğuk Cat doldurunhode soğuk Anot Tampon Tampon ve alt / dış kamara (tarifi 9).
- Örnekleri ayıran jel girene kadar, bir minigel ya da büyük bir jel ile 150V, 100 V uygulayın. Jel 4 ° C
- 180 V (minigel) veya 400 V (büyük jel) gerilimi artırmak ve boya ön jel sonuna ulaşana kadar çalıştırın. Çalıştırmak için 3 ila 4 saat sürer mini ve büyük bir jel için 18 ila 24 saat.
4. İkinci boyut SDS-PAGE
- Standart bir% 10'luk SDS-jel (tarifler 12-15), ilk boyut olan diyaliz lizat bir kısım için BN-PAGE şeritli, moleküler ağırlık belirteci normal bir şerit ve normal bir şerit tek bir büyük şerit ile hazırlayın SDS numune tamponu (tarifi 11) ile karıştırılır ve 95 ° C'de 5 dakika süreyle kaynatılır Kalınlığı SDS jel üzerine BN-PAGE jel dilim yükleme basitleştirmek için seloteyip iki kat artmıştır ayırıcılar kullanın.
- BN-PAGE jel elektroforez cihazdan plakaları çıkarın ve bir tabak hafifçe kaldırın.
- Istifleme jel çıkarın ve ilgi proteinler içeren BN-PAGE jel kulvar kesip.
- Oda sıcaklığında 10 dakika 2x SDS Örnek Tampon ve inkübe BN-PAGE jel dilim yerleştirin.
- Bir mikrodalga BN-PAGE jel dilim kısa bir süre (20 saniyeden fazla) kaynatın.
- Oda sıcaklığında 15 dakika boyunca sıcak SDS Örnek Tampon BN-PAGE jel dilim inkübe edin.
- BN-PAGE jel dilim, SDS-PAGE jel kaçınarak hava kabarcıkları ve bindirme SDS Örnek Tampon dilim yığınlama jel üzerinde de büyük yükleyin. Marker ve lizat kontrol yükleyin.
- Standart protokollere göre elektroforez yapın.
5. Immün MPC altbirimden Tespiti
- Transferi için, altı whatman kağıtları ve SDS-jel boyutu uydurma bir PVDF membran hazırlar.
- 30 sn için% 100 metanol PVDF membran inkübe ve transfer tamponu (tarifi 16) whatman kağıtları bekletin.
- Tekrar üç whatman kağıtları, PVDF membran, SDS-jel (jel istifleme kaldırmak), ve semidry transfer hücre içine sandviç benzeri bir yapı içinde üç whatman kağıtları yerleştirin.
- 20 V 25 dakika uygulayın.
- Standart immunoblotting protokollere göre proteinler algılar.
6. Temsilcisi Sonuçlar
Biz 2D BN / SDS-PAGE (Şekil 1A) MPC karakterizasyonu için ökaryotik 19S, 20S, ve 26S protozomları bir örnek olarak analiz sunuyoruz. HEK293 hücrelerinin% 0.1 içeren bir tampon ile parçalanmış bir deterjan gibi membranlar bozabilir ve membran protein kompleksleri çözünür Triton X-100. Bu lizatları tuzların ve küçük metabolitleri kaldırmak için BN-Diyaliz tampon karşı diyaliz edildi. Sonra, ikinci bir boyut SDS-PAGE ile% 4-15 degrade BN-PAGE MPCs ayrıldı. Proteinler, β2 ve Mcp21 proteazom 20S alt birimden karşı antikor immün görüntülendi.
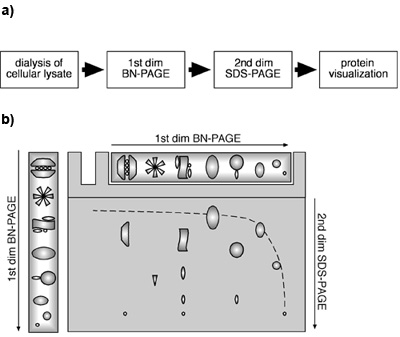
Şekil 1. Hücresel lizatları kullanarak iki boyutlu BN-PAGE/SDS-PAGE yaklaşım (A), hücresel lizatları bir 2B BN-PAGE/SDS-PAGE yaklaşım akış diyagramı . (B) bir 2D BN-PAGE/SDS-PAGE şematik düzeni. Proteinler ve MPCs ilk boyut BN-PAGE ile yerli koşullar altında ayrılır. Ikinci boyut için, proteinler ve / veya MPCs BN-PAGE ile ayrılık sonrası jel şerit SDS tarafından denatüre ve daha sonra SDS-PAGE tabi. Monomerik proteinler ilk degrade jel ve ikinci boyutta doğrusal bir jel bir hiperbolik çapraz nedeniyle göç. Bir beton MPC Bileşenleri bir dikey çizgi üzerinde bulunan, çapraz aşağıda yer almaktadır.
Birinci boyut BN ve ikinci boyut SDS-PAGE kombinasyonu, monomerik proteinler bir hiperbolik çapraz gradient jel nedeniyle birinci ve ikinci boyut (doğrusal jel içinde göç ettiğini gösterilmiştir (Camacho Carvajal, Wollscheid et ark 2004); Şekil 1B). MPCs Bileşenleri bu çapraz altındadır. Yatay bir çizgi aynı protein çeşitli noktalar, birkaç farklı MPCs protein varlığına işaret ise aynı MPC altbirimden temsil Proteinler, ikinci boyutta bir dikey çizgi bulunabilir. Şekil 2 deneyimimizi β2 ve Mcp21 karşı immün bu proteozomal altbirimleri içeren özel protein komplekslerinin varlığını ortaya koymuştur. Her iki proteinler, β2 ve Mcp21 birçok farklı MPCs bileşenlerinin temsil ettiğini belirten yatay bir çizgi olarak düzenlenmiş tek tek noktalar gibi algılanabilir. Bu MPCs açıkça düzenleyici altbirim PA28 ile birlikte proteazom 20S, 26S proteazom (20S + 19S kap) olarak tanımlanan ve 20S büyüklüğü ve bileşimi temelinde, tek başına protozomları olabilir. Birlikte ele alındığında, bu result endojen MPCs hücresel lizat kullanarak, iki boyutlu bir BN-PAGE/SDS-PAGE yaklaşımla tespit ve karakterize edilebilir olduğunu göstermektedir. Bu yöntem, boyutu, kompozisyonu ve MPCs göreceli bolluk belirlenmesi için uygulanabilir.

Şekil 2. Algılama, iki boyutlu BN-PAGE/SDS-PAGE sonra immün ökaryotik proteazom ökaryotik protozomları tanımlanması ve analizi için farklı formları HEK293 hücrelerin% 0.1 Triton X-100 ile parçalanmış. Hücresel lizatları diyaliz ve daha sonra ayrı MPCs BN-PAGE (4-15%) tabi idi. Daha sonra, ikinci bir boyut SDS-PAGE (% 10), bireysel alt bileşenleri boyutu ayrılması için çalıştırıldı. İmmünoblotting Mcp21 ve β2 altbirim 20S çekirdek kompleks ve düzenleyici altbirim PA28 tanıyan özel antikorlar ile yapıldı.
Özel reaktifler I. Masa (alfabetik sırayla):
| Reaktif | Şirket | Yorumlar |
| 6-aminohexanoic asit (Ε-aminocaproic asit) | Sigma-Aldrich, Taufkirchen, Almanya | Bu kimyasal bir tahriş edicidir ve eldiven ele alınmalıdır. |
| Akrilamid-bisacrylamide solüsyonu (% 40), Mix 32:1 | ¸, Darmstadt, Almanya | Bu çözüm, nörotoksik ve eldiven ele alınmalıdır. |
| Bis-tris | Roth, Karlsruhe, Germa-ny | |
| Brij 96 | Sigma-Aldrich, Taufkirchen, Almanya | |
| Coomassie mavi G250 | Serva, Heidelberg, Ger-many | Coomassie boya Coomassie mavi R250 veya kolloidal Coo-Massie mavi gibi diğer türleri yerine koymayın. |
| Digitonin | Sigma-Aldrich, Taufkirchen, Almanya | Digitonin zehirli. Bu caydırmak-gent içeren tamponlar veya örnekleri ele eldiven giyilmelidir. |
| Dodecylmaltoside | ¸, Darmstadt, Almanya | |
| Triton X-100 | Roth, Karlsruhe, Germa-ny | Triton X-100 toksiktir. Bu deterjan içeren tamponlar veya örnekleri ele eldiven giyilmelidir. |
II. Özel malzeme ve ekipman Tablo:
| Ekipman | Şirket |
| Diyaliz membranları (cut-off molekül ağırlığı 10 ila 50 kD) | Roth, Almanya'nın Karlsruhe |
| Jel elektroforezi sistemi | Örneğin Bio-Rad, Münih, Almanya |
| Gradient mikser | Self-made veya piyasada bulunan Bio-Rad, Münih, Almanya |
| Peristaltik pompa | Amersham Pharmacia Biotech, Freiburg, Almanya |
| Poliviniliden diflorür (PVDF) membran | Immobilon-P, Millipore, Eschborn, Almanya |
| Yarı-kuru transfer ekipmanları | Örneğin Bio-Rad, Münih, Almanya |
| Silikon tüp (3 ile 5 mm çapında, 1 m uzunluğunda) | NeoLab, Heidelberg, Almanya |
III. Tarifler Tablo:
| Hayır. | Tamponlar ve çözümler | Içerik | Yorumlar |
| 1 | Fosfat tamponlu salin (PBS) | Na 2 HPO 4 8.1 mMKH 2 PO 4 1.5 mM NaCl 138 mm KCl 2.7 mm | Çözüm düzgün pre-pared pH 7.4 olmalıdır. |
| 2 | BN-Lizis Tampon | Baz tampon Bis-tris 20 mM ε-aminocaproic asit 500 mM NaCl 20 mm EDTA, pH 8.0 2 mM Gliserol 10% HCl ile pH 7.0 'ye ayarlayın. 4 ° C saklayınız Deterjan Digitonin 0,5-1,0% veya Brij 96 0.1 -% 0.5 veya Triton X-100 0.1% 0.5 veya Dodecylmaltoside% 0.1 ila% 0,5 Proteaz ve fosfataz inhibitörleri Aprotinin 10 mcg / mL Leupeptin 10 mcg / mL PMSF 1 mm Sodyum florür 0.5 mM Sodyum orthovanadate 0.5 mM | Uygun deterjan ampirik olarak tespit edilmelidir ve diğer lizis tamponu tariflerde kullanılan aynı olmalıdır. Digitonin dH 2 O (5 ml alikotları mağaza -20 ° C)% 2'lik bir stok solüsyonu kullanımı hemen önce eklenmelidir. Proteaz ve phophatase inhibe-ors, kullanımdan hemen önce ilave edilmelidir. Sodyum orthova-nadate eklenmesi üzerine, tampon sarımsı renkli olacak. |
| 3 | BN-Diyaliz Tampon | Baz tampon Bis-tris 20 mM ε-aminocaproic asit 500 mM NaCl 20 mm EDTA, pH 8.0 2 mM Gliserol 10% HCl ile pH 7.0 'ye ayarlayın. 4 ° C saklayınız Deterjan Digitonin 0.3 ila 0.5% veya Triton X-100% 0.1 veya Brij 96% 0.1 veya Dodecylmaltoside% 0.1 Proteaz ve fosfataz inhibitörleri PMSF 1 mm Sodyum orthovanadate 0.5 mM | Ampirik olarak uygun bir deterjan tespit olmalı ve diğer lizis tamponlar kullanılan ile aynı olmalıdır, ama daha düşük konsantrasyonları belirtilir. Deterjan jel elektroforezi yığın aşamada ön havalandırma agregasyonu eklenmesi gerekir. Proteaz ve phophatase inhibe-ors, kullanımdan hemen önce ilave edilmelidir. |
| 4 | 3x BN-Jel Tampon | Bis-tris 150 mM ε-aminocaproic asit 200 mM HCl ile pH 7.0 'ye ayarlayın. 4 ° C saklayınız | |
| 5 | % 4 Jel ayırmak | 3x BN-Jel Tampon (reçete 4) 5.00 mL Akrilamid / Bisacrylamide 1,50 mL dH 2 O 8.50 mL APS, dH 2 O 54 mcL% 10 TEMED 5.4 mcL | Bu reaktiflerin polimerizasyonu teşvik olarak, APS ve TEMED immedia-tely jel dökülmeden önce ekleyin. Bu tarif, 30 ml jel döküm için yeterli. Birimlerdeki dökülür jeller sayısını ve boyutunu ayarlayın. |
| 6 | % 15 Jel ayırmak | 3x BN-Jel Tampon (reçete 4) 5.00 mL Akrilamid / Bisacrylamide 5.63 mL Gliserol 70% 4.38 mL APS, dH 2 O 42 mcL% 10 TEMED 4.2 mcL | Bu reaktiflerin polimerizasyonu teşvik olarak, APS ve TEMED immedia-tely jel dökülmeden önce ekleyin. Bu tarif, 30 ml jel döküm için yeterli. Birimlerdeki dökülür jeller sayısını ve boyutunu ayarlayın. Akrilamid-bisacrylamide konsantrasyonu da gerekli% 10-18 gibi çok çeşitli olabilir. |
| 7 | % 3.2 Jel İstifleme | 3x BN-jel Buffer (reçete 4) 3.00 mL Akrilamid / Bisacrylamide 0,72 mL dH 2 O 5.28 mL APS, dH 2 O 120 mcL% 10 TEMED 12 mcL | Bu reaktiflerin polimerizasyonu teşvik olarak, APS ve TEMED immedia-tely jel dökülmeden önce ekleyin. Bu tarif, 30 ml jel döküm için yeterli. Birimlerdeki dökülür jeller sayısını ve boyutunu ayarlayın. |
| 8 | Katot Tampon | Bis-tris 15 mM Tricine 50 mm Coomassie mavi G250% 0,02 1 litre 10x stok olarak hazırlayın, 4 HCl ile pH 7.0 'ye ayarlamak için, ve mağaza ° C Kullanmadan önce dH 2 O ile 1:10 sulandırınız. | Coomassie mavi R250 veya kolloidal Coomassie Blues Coomassie boya diğer türleri yerine koymayın. |
| 9 | Anot Tampon | Bis-tris 50 mM 1 litre 10x stok olarak hazırlayın, 4 HCl ile pH 7.0 'ye ayarlamak için, ve mağaza ° C Kullanmadan önce dH 2 O ile 1:10 sulandırınız. | |
| 10 | Marker Mix | Aldolase (158 kD) 10 mg / ml Katalaz (232 kD) 10 mg / ml Ferritin (440 ve 880 kD) 10 mg / ml Tiroglobulin (670 kD) 10 mg / ml 10 mg / ml BSA (66 ve 132 kD) Bis-tris 20 mM NaCl 20 mm Gliserol 10% HCl ile pH 7.0 'ye ayarlayın. 4 ° C saklayınız | Molekül ağırlığı işaretleri Invitro-gen veya Pharmacia dahil olmak üzere çeşitli kaynaklardan gelen de ticari olarak mevcuttur. |
| 11 | SDS Örnek Tampon | Tris 12,5 mm SDS 4% Gliserol 20% Bromofenol mavi% 0,02 PH 6.8 ayarlayın. Disülfür bağları azaltmak için, 9 mL β-mercaptoethanol ekleyin. | SDS gibi bir toz ve β-mer-captoethanol zehirlidir. Bu nedenle, koruyucu eldiven kullanın ve bir başlık altında çalışmak. |
| 12 | 4x alt tampon | Tris 1.5 M SDS 0.4% PH 8,8 'e ayarlayın. | SDS bir toz olarak toksiktir. Bu nedenle, koruyucu eldiven kullanın ve bir başlık altında çalışmak. |
| 13 | 4x üst tampon | Tris 0.5 M SDS 0.4% PH 6.8 ayarlayın. | SDS bir toz olarak toksiktir. Bu nedenle, koruyucu eldiven kullanın ve bir başlık altında çalışmak. |
| 14 | % 10 Jel ayırmak | Akrilamid (% 30) 2.0 mL 4x alt tampon 1,5 mL dH 2 O 2.454 ml APS, dH 2 O 40 mcL% 10 TEMED 6 mcL | Bu reaktiflerin polimerizasyonu teşvik olarak, APS ve TEMED immedia-tely jel dökülmeden önce ekleyin. Bu tarif, 30 ml jel döküm için yeterli. Birimlerdeki dökülür jeller sayısını ve boyutunu ayarlayın. |
| 15 | % 4.8 Jel İstifleme | Acylamide (% 30) 320 mcL 4x üst tampon 500 mcL dH 2 O 1.16 mL APS,% 10 dH 2 O 20 mcL TEMED 2 mcL | Bu reaktiflerin polimerizasyonu teşvik olarak, APS ve TEMED immedia-tely jel dökülmeden önce ekleyin. Bu tarif, 30 ml jel döküm için yeterli. Birimlerdeki dökülür jeller sayısını ve boyutunu ayarlayın. |
| 16 | Semidry Transferi Tampon | Tris 48 mm Glisin 39 mm Metanol 20% SDS 0,1% DH 2 O ile 1 litre hacim ayarlayın. Oda sıcaklığında saklayın. | Bir toz ve metanol gibi SDS zehirlidir. Bu nedenle, koruyucu eldiven kullanın ve bir başlık altında çalışmak. |
Tartışmalar
Bu çalışmada, biz MPCs BN-PAGE ile analizi açıklanmaktadır. 2D bir yaklaşım doğal koşullar altında ilk ayrı MPCs kullanılır ve daha sonra ikinci bir boyut SDS-PAGE ile onları kendi içerisinde münferit bileşenlerine ait bölümlere ayrılması için.
Örnekleri hücre lizatları hazırlanmıştır. Birçok MPCs çözünürleştirme için, uygun bir deterjan protein komplekslerinin yapısını korur ihtiyaç vardır. Burada,% 0.1 Triton X-100 kullanın. Ancak, en iyi deterjan ve uygun konsantrasyonda her MPC için deneysel olarak belirlenmelidir. Durumunda Triton X-100, örneğin, düşük deterjan konsantrasyonları F 1 dimerik formu kimlik izin verdiği rapor edilmiştir F 0-ATPaz kompleksi (Arnold, Pfeiffer ve ark 1998). Yüksek Triton X-100 konsantrasyonları Ancak, dimer ayrışma ve monomerik F 1 F 0-ATPaz kompleksi karşılık gelen bir artış yol. Yüksek konsantrasyon veya başka bir deterjan kullanımı digitonin sonuçları denilen oysa bizim eski çalışmalar doğrultusunda, düşük konsantrasyonlarda Brij 96 ile ekstrakte multivalent T-hücre reseptör kompleksi (TCR) korunmuş olduğunu gösterir edildi monomerik TCR çıkarımı (Schamel, Arechaga ve ark 2005). Yaygın olarak kullanılan deterjan test edilebilir digitonin (% 0.5 ila% 1), Triton X-100 (% 0.1 ila% 0,5), Brij 96 (% 0.1 ila% 0,5), ya da dodecylmaltoside (% 0.1 ila% 0,5) içermektedir. Bu reaktifler, noniyonik deterjan, MPC istikrar için en iyi olma eğilimindedir. SDS ve diğer güçlü deterjanlar ile temas (Camacho Carvajal, Wollscheid ve ark 2004) kaçınılması gerektiğini farkında olun.
Diyaliz lizatları BN-jel MPC ayırma (Camacho-Carvajal, Wollscheid ve ark 2004) ulaşmak için gerekli; (Heiss, Junkes ve ark 2005). Bu, tuz konsantrasyonu veya düşük molekül ağırlıklı kirliliklerin kaldırılması ayar yüksek çözünürlük için çok önemli olduğunu görünüyor. Immunopurified ve daha sonra antikor yıkandı, membran hazırlıklar ve MPCs, BN-PAGE için uygundur (Swamy, Siegers ve ark 2006) dikkat çekicidir. Her iki durumda da, örnekler membran lizis veya elüsyon BN-lizis tamponu yürütülen ise, BN-PAGE ayrılması için diyalize zorunda değilsiniz.
BN-PAGE ile protein ayırma için, boya Coomassie mavi unspecifically proteinlerine bağlanır ve onları olumsuz ücretleri kapsayan ihtiyaç vardır. Böylece, Coomassie mavi nötr pH (Schägger ve von Jagow 1991) katot doğru proteinlerin elektroforetik mobilite sağlar; (Schägger, Cramer ve ark 1994). Ayrıca, Coomassie mavi yığın jel elektroforez sırasında protein agregasyonunu önler. BN-PAGE, Coomassie G250 Coomassie mavi R250 veya kolloidal Coomassie mavi yerine kullanılmalıdır.
BN-jel çalıştırmadan önce, jel yüzde PPK faiz beklenen boyutuna uygun olduğundan emin olmak için gereklidir. BN-jeller Prekast farklı gradyanlar ve uygun tamponlar Invitrogen (NativePAGE Novex Bis-Tris Jel Sistemi) temin edebilirsiniz. Ancak, BN-jeller de bir persistaltic pompa ile birlikte bir degrade mikser kullanılarak hazırlanmış olabilir. Sağlam bir degrade garanti etmek için, sıvı dökme ve kabarcıkları kaçınmak olmalıdır sırasında sürekli akmalıdır. Aşırı yükleme elektroforez işlemi sırasında protein yağış yol açabilir, çünkü jel üzerine farklı numune dilüsyonları yükleme tavsiye ederiz. Buna ek olarak, BN-jeller 4 çalıştırmak olmalıdır ° C proteini bozulmasını önlemek için ve MPCs sağlam tutmak için.
MPCs BN-PAGE, görselleştirme Coomassie parlak mavi boyama, gümüş boyama veya immunoblotting elde edilebilir sonra. Coomassie veya gümüş boyama ile görüntülendi protein bantları kütle spektrometresi (Camacho Carvajal, Wollscheid ve ark 2004) tarafından daha fazla analiz için uygundur. Immunoblotting durumunda, ilgi MPCs için en iyi transferi koşulları deneysel olarak belirlenmelidir. Coomassie mavi BN-jel blot sırasında da transfer olduğunu farkında olun. Bu nedenle, membran mavi bir renk uygulamayın ise jel, başarılı transferinden sonra renksiz olacak. Ayrıca, SDS-PAGE sonra tespiti için çalışan her primer antikor, BN-PAGE üzerine immunoblotting için geçerli olduğunu söylemek çok önemlidir. Bu onların epitop proteinlerin doğal yapısındaki gizli olduğu için antikorlar ilgi MPC görmezsek bu gerçekleşebilir. Bu sorunu aşmak için, BN-jel içinde transfer etmek için önce kısa bir süre jel 1x SDS numune tamponu kaynatarak proteinler denatüre mümkündür.
Bizim örneğimizde, protein bantları tespit doğrudan BN-jel tabi değildi. Bunun yerine, daha ikinci bir dimensi BN-PAGE ayrılmış lizat bölünmüşSDS-PAGE. Monomerik proteinler SDS-jel ikinci boyutu, ikinci boyut (Camacho Carvajal, Wollscheid ve ark, 2004) ilk ve doğrusal jel gradient jel nedeniyle bir hiperbolik çapraz içinde göç ederler. Bu hiperbolik çapraz altında lokalize olduğundan bu MPCs kolay kimlik sağlar. İkinci boyut SDS-PAGE bir dikey çizgi biri ayrı bir MPC Alt Bileşenleri ayrılır. Birkaç dinstinct MPCs bileşenleri Bileşenleri MPC büyüklüğüne göre yatay bir çizgi üzerinde tespit edilebilir. Ancak, tek bir dikey çizgi görünen birçok protein noktalar da BN-SAYFA aynı pozisyonda göç eden ayrı bir kompleksleri parçası olabileceği göz önünde bulundurulmalıdır. Aynı MPC mevcut olduğunu son kanıtı, antikor bazlı bir jel vardiya yöntemi ile elde edilebilir. Bu testte, hücresel lizat biri BN-SAYFA önce belirlenen noktalar tarafından temsil edilen bir protein karşı bir antikor ile inkübe edilir. Bu sonuçlar ilk boyut daha yüksek bir moleküler kütlesi doğru bu protein içeren tüm MPCs bir kayma. Bu MPCs bir parçası olan diğer proteinleri bu karmaşık özel bir değişime ve bu nedenle ikinci boyut SDS-jel tanımlamak daha kolay olacaktır.
Sadece MPCs bileşimi BN-PAGE ile analiz aynı zamanda kendi stokiyometri belirlenmesi mümkündür (Schamel ve Reth 2000) olabilir; (Schamel 2001), (Swamy, Minguet ve ark 2007). Bu amaçla, bir NAMOS assay (yerli antikor bazlı hareketlilik kayma yöntemi) yapılabilir. Antikor bazlı jel kayma yöntemi olduğu gibi, hücresel lizatları altbirim-spesifik monoklonal antikorlar ile inkübe edilir. Bu MPCs stokiyometri vardiya ölçüde çıkarım izin BN-jel elektroforetik immunoshifts indüksiyonu yol açar
Conlusion, BN-PAGE boyutu, kompozisyonu, gibi göreceli bolluk MPCs tanımlanması ve belirlenmesi için uygundur. NAMOS tahlil olarak yapılır, o da belirli bir MPC stokiyometri belirlemek için imkanı sunar. Genel uygulanabilirliği göz önüne alındığında, bu tekniğin MPCs karakterizasyonu (Dekker, Müller ve ark 1996) için çok yararlı bir araç, (2008 Wittig ve Schagger) (Wagner, Rehling ve ark 2009); (Wittig ve Schägger 2009) .
Açıklamalar
Teşekkürler
Biz Michael Reth, Hermann Schägger ve Margarita Camacho-Carvajal bilimsel destek için teşekkür ederiz. Bu çalışma, Deutsche Forschungsgemeinschaft (DFG) BIOS'ları Bundesministerium für Bildung ve Forschung (BMBF) FORSYS tarafından finanse edilen ve Alman Federal ve Eyalet Hükümetleri Mükemmellik Girişimi (GSC-4, Spemann Enstitüsü tarafından desteklenen .)
Referanslar
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır