Method Article
셀룰러 Lysates에서 Multiprotein의 단지의 분석을 위해 블루 기본 Polyacrylamide 젤 전기 영동 (BN - PAGE)
요약
이 비디오에서는, 우리는 푸른 원시의 polyacrylamide 겔 전기 영동 (BN - PAGE)에 의해 multiprotein의 단지 (MPCs)의 특성을 설명합니다. 첫 번째 차원에서 dialyzed 세포 lysates은 개별 MPCs을 식별할 BN - PAGE로 구분됩니다. 두 번째 차원 SDS - PAGE에 관심 MPCs은 더욱 immunoblotting하여 성분을 분석하기 위해 세분화됩니다.
초록
대부분의 단백질이 다른 단백질과 기능이나 규제 단지 (살리, Glaeser 외. 2003)에서 찾을 수 있으므로 Multiprotein의 단지 (MPCs)은 세포 신호 전달에 중요한 역할을한다. 따라서, 단백질 - 단백질 상호 작용 네트워크의 연구는 단백질 기능과 규정의 통합 이해를 얻을 수 MPCs의 세부 특성이 필요합니다. 식별 및 분석을 위해, MPCs는 기본 조건 구분해야합니다. 이 비디오에서는, 우리는 푸른 원시의 polyacrylamide 겔 전기 영동 (BN - PAGE)에 의해 MPCs의 분석을 설명합니다. BN - PAGE은 젤 여과 또는 자당 밀도 ultracentrifugation에 의해 제공되는보다 높은 해상도와 고유의 형태에 MPCs의 분리를 허용하고, MPC 크기, 구성, 그리고 상대적으로 풍부 (Schägger 및 본 Jagow 1991)를 결정하는 것이 유용합니다 기술입니다 ; (Schägger, 크래머 외 1994.). 이 방법으로 단백질들은 유체 크기와 polyacrylamide의 매트릭스에 형태에 따라 구분됩니다. 여기, 우리는 lysate 투석은 BN - PAGE 이러한 생물 학적 샘플에 적용을하는 중요한 단계입니다 지적, 전체 세포 lysates의 MPCs의 분석을 보여줍니다. 첫째 차원 BN -와 두 번째 차원 SDS - PAGE의 조합을 사용하여, 우리는 BN - PAGE로 구분 MPCs이 더욱 SDS - PAGE에 의해 그들의 개인적인 성분으로 세분화 될 수 보여줍니다. 겔 분리시 MPC 구성 요소의 시각화 표준 immunoblotting에 의해 수행됩니다. BN - PAGE에 의해 MPC 분석을위한 예를 들어, 우리는 잘 특징 진핵세포 19S, 20 대, 그리고 26S proteasomes를 선택했습니다.
프로토콜
Multiprotein의 단지의 확인 및 분석을위한 블루 기본 Polyacrylamide 젤 전기 영동 (BN - PAGE) : **이 비디오 프로토콜은 관련 출판 일을 기반으로합니다. Mahima 스와미, 가브리엘 M. Siegers, 수자 Minguet, 번드 Wollscheid, 그리고 볼프강 WA Schamel. 과학의 STKE 2006 (345) : pl2, 2006년 7월 25일, [간접 : 10.1126/stke.3892006pl4]. 본 자료를 보시려면 여기를 클릭하십시오 .
1. dialyzed 세포 lysate의 준비
- 4 5 분 350g에 원심 분리하여 수확 10x10 6 셀 및 펠릿 ° C.
- 얼음처럼 차가운 PBS (조리법 1) 1 ML과 세포 펠렛을 세 번 씻어 단계 1.1에서와 같이 원심 분리기.
- Resuspend 얼음처럼 차가운 BN - 용해 완충액 (제조법 2) 250 μL에 펠렛과 15 분 얼음에 품어.
- 4 15 분 1만3천그램에서 원심 분리기는 ° C는 불용성 물질을 제거합니다.
- 파스퇴르 피펫의 온수 큰 직경 측면을 사용하여 1.5 - ML의 microcentrifuge 관 뚜껑에 구멍을 용해 후 4 ° C. 아래로 냉각 얼음에 튜브를 삽입
- 뚜껑에있는 구멍과 냉각 튜브로 단계 1.4에서 뜨는을 전송합니다.
- 닫기 열린 튜브 상단의 뚜껑에 집게와 투석 막 (10 KD의 분자량 컷 - 오프) 장소 밖 스틱 초과 투석 막 잘라.
- Parafilm와 함께 신중하게 측면에 뚜껑을 밀봉합니다.
- 튜브를 반전 4에서 10 초위한 세포 배양 원심 분리기에서 50 ML 원뿔 튜브 가능 최저 속도로 거꾸로 원심 분리기 ° C. 최대 튜브 오른쪽 측면을 전환하지 않도록 핀셋을 사용하여 원심에서 거꾸로 튜브를 제거합니다.
- 추위 BN - 투석 버퍼 (제조법 3)와 저어 플레이트와 100 ML 비커를 준비합니다. 100 μL 시료 당 BN - 투석 버퍼의 최소 10 ML을 사용합니다.
- 부착 거꾸로 비커 내부 테이프와 튜브, 그리고 구부러진 파스퇴르 피펫을 사용하여 뚜껑 아래 구멍에서 기포를 제거합니다.
- 자석 활동가 위에 플레이스 비커는 활동가 스위치 6 시간 또는 차가운 방에서 하룻밤을 위해 두십시오. 감동이 투석 막에서 공기 방울을 생성하지 않도록 가끔 확인하십시오.
- 새로운 냉장 microcentrifuge 관에서 dialyzed 세포 lysate를 수집합니다.
2. 의 용탕 주입 BN - 젤
- 붓는 그라데이션 젤은 그라디언트 믹서와 함께 실온에서 이루어집니다. polyacrylamide 높은 neurotoxic 때문에 장갑을 착용해야합니다. SDS와의 접촉을 피하십시오.
- 저어 접시에 그라디언트 믹서를 삽입하고 유연한 튜브의 한 부분에 첨부해 주시기 바랍니다. 밸브를 사용하여 채널을 닫고 클램프로 튜브를 닫습니다. 튜브에 연결된 "높음"실린더에 자기 활동가에게 15 %를 놓으십시오.
- peristalitic 펌프로 유연한 튜브를 스레드와 끝까지 주사기 바늘을 연결합니다. 그런 다음 젤 장치의 두 유리 접시 사이에 바늘을 넣으십시오.
- 4퍼센트 (조리법 5) 15 % (제조법 6), 젤 솔루션을 분리 APS를 추가하고 사용하기 전에 바로 TEMED를 준비합니다. 통합 볼륨 분리 젤의 볼륨과 동일해야합니다.
- 그라디언트 믹서의 해당 실린더 (이하 "낮은"로 4%하고 "높은"실린더로 15 %)로이 젤 솔루션을 붓고.
- 엄지로 왼쪽 실린더 이상 눌러 두 겔 저수지를 연결하는 채널 내부의 기포 밖으로 밸브와 강제를 엽니다.
- 자기 활동가 스위치, 클램프를 제거하고, 분당 5 ML에 peristalitic 펌프 스위치. 젤 천천히 유리 플레이트 사이의 흐름을 허용합니다. 바늘이 액체 위에 항상 확인하십시오.
- 모든 액체가 젤 장치를 입력할 수 있도록 허용하고 이소프로판올와 함께 부드럽게 오버레이. 젤 실온에서 최소 30 분 중합 수 있습니다.
- DH 2 O (세제를 사용하지 마십시오)와 즉시 쏟아져 장치를 청소합니다.
- 이소프로판올 제거 DH 2 O로 씻어 및 왓먼 종이와 DH 2 O를 제거합니다.
- , 3.2 % 스태킹 젤 (제조법 7) 준비 APS를 추가하고 사용하기 전에 바로 TEMED.
- 분리 젤 위에 쌓아 젤 붓고하고 거품을 피하기 위해, 유리 접시 사이 빗을 소개합니다. 스태킹 젤 polymerized 후 4 ° C.를 젤 진정
- 즉시 샘플 로딩 전에 젤의 비행기 각도에서 그것을 꺼내 천천히 빗를 제거합니다. 이것은 우물의 품질을 향상 빠르게 주머니를 입력하기 위해 공기 수 있습니다.
3. BN - PAGE에 의해 dialyzed 세포 lysate의 분리
- 4 마른 우물에 dialyzed lysate의 1-40 μL 및 마커 믹스의 10-20 μl (제조법 10) 부하 ° C. 차가운 음극의 버퍼 (제조법 8) 각 우물에 샘플을 중첩.
- 감기 고양이와 내부 챔버를 채우감기 양극 버퍼로 hode 버퍼와 하단 / 외부 챔버 (비법 9).
- 샘플이 분리 젤를 입력 때까지 minigel 또는 대형 젤로 150V 100 V를 적용할 수 있습니다. 4 젤을 실행 ° C.
- 180 V (minigel) 또는 400 V (대형 젤)에 전압을 향상시키고 염료 앞에는 젤의 끝에 도달할 때까지 실행합니다. 실행을위한 3~4시간 소요 소형 및 대형 젤에 대한 18~24시간.
4. 두 번째 차원 SDS - PAGE
- 이 dialyzed lysate의 나누어지는에 대한 첫 번째 차원 BN - PAGE 레인, 분자량 마커 한 정기 차선, 한 일반 차선에 대해 하나의 큰 레인있는 표준 10% SDS - 젤 (조리법 12-15)를 준비 SDS 샘플 버퍼 (제조법 11)과 함께 혼합하고 95 ° C.에서 5 분 삶아되었습니다 누구의 두께 SDS 겔에 BN - PAGE 젤 슬라이스의 로딩을 단순화하기 위해 스카치 테이프의 두 레이어에 의해 증가되었다 스페이서를 사용합니다.
- 전기 영동 장치에서 접시에 BN - PAGE 젤을 제거하고 부드럽게 한 접시를 캐내다.
- 스태킹 젤를 제거하고 관심의 단백질을 포함하고있는 BN - PAGE 젤의 차선을 잘라 버릴거야.
- 상온 10 분 2X SDS 샘플 버퍼와 부화에 BN - PAGE 젤 슬라이스를 놓습니다.
- 전자렌지에 BN - PAGE 젤 슬라이스 간단히를합니다 (20 개 이상의 초) 보일.
- 상온에서 또 다른 15 분에 대한 뜨거운 SDS 샘플 버퍼에있는 BN - PAGE 젤 슬라이스를 품어.
- SDS - PAGE 젤 피하고 공기 방울, 그리고 오버레이 SDS 샘플 버퍼로 슬라이스의 스택 젤 위에 잘 대형에있는 BN - PAGE 젤 슬라이스를로드합니다. 마커 및 lysate 컨트롤을로드합니다.
- 표준 프로토콜에 따라 전기 영동을 수행합니다.
5. immunoblotting하여 MPC의 subunits의 감지
- 전송을위한 여섯 왓먼 서류 및 SDS - 젤의 크기에 맞춤 PVDF 막을 준비합니다.
- 30 S에 대한 100 % 메탄올에서 PVDF 막 부화 및 전송 버퍼 (제조법 16)에 왓먼 서류를 만끽해보세요.
- 플레이스 다시 셋을 왓먼 서류, PVDF 막, SDS - 젤 (젤 스태킹 제거), 그리고 semidry 전송 세포로 샌드위치와 같은 구조로 세 왓먼 서류.
- 25 분 20 V를 적용합니다.
- 표준 immunoblotting 프로토콜에 따라 단백질을 감지합니다.
6. 대표 결과
우리는 2D BN / SDS - PAGE (그림 1A)에 의해 MPC 특성화를위한 진핵세포 19S, 20 대, 그리고 예를 들어 26S proteasomes의 분석을 제시한다. HEK293 세포는 0.1 %를 포함하는 버퍼 lysed되었습니다 튼과 세포막을 방해하고 막 단백질 단지를 solubilize하는 세제로 X - 100. 이러한 lysates은 소금 작은 metabolites를 제거하는 BN - 투석 버퍼에 대한 dialyzed되었습니다. 그런 다음, MPCs는 두 번째 차원 SDS - PAGE 다음 4-15% 기울기 BN - PAGE에 의해 분리되었다. 단백질은 proteasome subunits 20 대의 β2 및 Mcp21에 대한 항체와 immunoblotting하여 시각되었습니다.
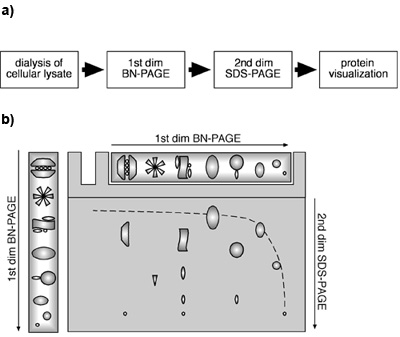
그림 1. 세포 lysates를 사용하여 2 차원 BN-PAGE/SDS-PAGE 접근. 세포 lysates에서 2D BN-PAGE/SDS-PAGE 접근의 (A) 흐름 다이어그램. 2D BN-PAGE/SDS-PAGE의 (B) 도식 제도. 단백질과 MPCs은 첫 번째 차원의 BN - PAGE에 의해 기본 조건 하에서 구분됩니다. 두 번째 차원 들어, 단백질 및 / 또는 MPCs는 BN - PAGE에 의해 분리 후 겔 스트립에서 SDS에 의해 변성하고 이후 SDS - PAGE를 받게. Monomeric 단백질은 첫 번째에있는 그라데이션 젤하고 두 번째 차원의 선형 젤로 쌍곡선 대각선으로 인해로 마이 그 레이션됩니다. 한 콘크리트 MPC의 구성 요소는 수직선에 위치하고 있으며, 대각선 아래 찾을 것입니다.
그것은 첫째 차원 BN -와 두 번째 차원 SDS - PAGE의 조합에 의해, monomeric 단백질은 두 번째 차원 (의 첫 번째와 선형 겔에서 그라디언트 젤로 인해 쌍곡선 대각선 이내에 마이 그 레이션하는 것으로 나타났습되었습니다 (카마초 - Carvajal, Wollscheid 동부 표준시 알 2004);. 그림 1B). MPCs의 구성 요소는이 대각선 아래에 위치하고 있습니다. 수평선에서 동일한 단백질의 여러 명소가 여러 독특한 MPCs에있는 단백질의 존재를 나타내는 반면 같은 MPC의 subunits를 나타내는 단백질은 두 번째 차원에서 한 수직선에서 찾을 수 있습니다. 우리의 실험에 β2 및 Mcp21에 대한 immunoblotting 그림 2 보여줍이 proteasomal subunits를 포함하는 특정 단백질 단지의 존재를 공개했다. 두 단백질은 β2 및 Mcp21 여러 독특한 MPCs의 성분을 나타내는 것을 나타내는 수평선에 배치 각각의 장소로 감지되었다. 이러한 MPCs은 명확하게 규제 subunit PA28 함께 proteasome 20 대 (20 대 플러스 19S 뚜껑) 26S proteasome로 식별하고, 20 대 자신의 크기와 구성을 바탕으로, 혼자 proteasomes 수 있습니다. 함께 촬영이 열매가 나타나고타우 내생 MPCs은 세포 lysate를 사용하여 2 차원 BN-PAGE/SDS-PAGE 접근에 의해 식별하고 특징 수있다는 것을 보여준다. 이 방법은 크기, 구성, 그리고 MPCs의 상대적인 풍요의 결정에 대해 적용됩니다.

그림 2. 2 차원 BN-PAGE/SDS-PAGE 후 immunoblotting하여 진핵세포 proteasome. 진핵세포 proteasomes의 식별 및 분석을 위해 다양한 형태의 검색은 HEK293 세포는 0.1 % 트리톤 X - 100 lysed되었습니다. 셀룰러 lysates은 dialyzed하고 이후 별도의 MPCs로 BN - PAGE (4~15%)를 받게되었습니다. 이후, 두 번째 차원 SDS - PAGE (10 %)는 개별 하위 구성 요소의 크기 분리에 대해 실행되었습니다. Immunoblotting는 Mcp21과 20 대 핵심 복합 β2 subunit, 그리고 규제 subunit PA28을 인식 특정 항체와 함께 수행했다.
특정 시약의 I. 테이블 (알파벳 순서) :
| 시약 | 회사 | 댓글 |
| 6 - aminohexanoic 산성 (ε - aminocaproic 산성) | 시그마 - 알드리치, Taufkirchen, 독일 | 이 화학 물질은 자극이며 장갑으로 취급해야합니다. |
| 아크릴 아미드 - bisacrylamide 용액 (40 %), 혼합 32:1 | Applichem, 다름슈타트, 독일 | 이 솔루션은 neurotoxic하고 장갑으로 취급해야합니다. |
| 비스 - 트리스 | 로스, 카를 스루에, Germa - NY | |
| Brij 96 | 시그마 - 알드리치, Taufkirchen, 독일 | |
| 쿠매시 블루 G250 | Serva, 하이 델베르크, 게르 - 많은 | 이러한 쿠매시 블루 R250이나 콜로이드 쿠 - 매시 블루스로 쿠매시 염료의 다른 유형을 대체하지 마십시오. |
| Digitonin | 시그마 - 알드리치, Taufkirchen, 독일 | Digitonin 독성이 있습니다. 버퍼 또는 억제 - 젠트를 포함하는 샘플을 다룰 때 장갑을 착용하여야한다. |
| Dodecylmaltoside | Applichem, 다름슈타트, 독일 | |
| 트리톤 X - 100 | 로스, 카를 스루에, Germa - NY | 트리톤 X - 100은 독성이있다. 버퍼 또는 세제를 포함하는 샘플을 다룰 때 장갑을 착용하여야한다. |
II. 특정 재료와 장비의 테이블 :
| 장비 | 회사 |
| 투석 점막 (분자량 컷 - 오프 10-50 KD) | 로스, 카를 스루에, 독일 |
| 겔 전기 영동 시스템 | 바이오 래드, 뮌헨, 독일의 예를 들면 |
| 그라데이션 믹서 | 자체 제작 또는 바이오 래드, 뮌헨, 독일에서 상용 |
| 연동 펌프 | 애머스햄 Pharmacia 생명 공학, 프라이 부르크, 독일 |
| Polyvinylidene difluoride (PVDF) 막 | Immobilon - P, Millipore, Eschborn, 독일 |
| 세미 드라이 전송 장비 | 바이오 래드, 뮌헨, 독일의 예를 들면 |
| 실리콘 튜브 (3~5밀리미터 직경 1 미터 길이) | NeoLab, 하이 델베르크, 독일 |
III. 조리법 표 :
| 번호 | 버퍼 및 솔루션 | 내용 | 댓글 |
| 1 | 인산 버퍼 살린 (PBS) | 나 2 HPO 4 8.1 mMKH 2 PO 4 1.5 MM NaCl 138 MM KCl 2.7 MM | 제대로 예약 앞에 서있다면 해결책은 산도 7.4 있어야합니다. |
| 2 | BN - 용해 완충액 | 베이스 버퍼 비스 - 트리스 20 MM ε - aminocaproic 산성 500 MM NaCl 20 MM EDTA (에틸렌 다이아 민 테트라 초산), 산도 8.0이 MM 글리세롤 10% HCL과 7.0 산도를 조정합니다. 4 스토어 ° C. 세제 Digitonin 0.5-1.0 % 또는 Brij 96 0.1-0.5 % 또는 트리톤 X - 100 0.1-0.5 % 또는 Dodecylmaltoside 0.1-0.5 % 단백 분해 효소 및 인산 가수 분해 효소 억제제 Aprotinin 10 μg / ML 류펩틴 10 μg / ML PMSF 1 ㎜ 나트륨 불화 0.5 MM 나트륨 orthovanadate 0.5 MM | 적절한 세제는 경험적으로 결정되어야하며 다른 용해 버퍼 조리법에 사용되는 것과 동일해야합니다. Digitonin 단지 DH 2 O (-20에서 5 ML의 aliquots에 저장 ° C)에서 2 % 주식 솔루션에서 사용하기 전에 추가해야합니다. 단백 분해 효소 억제 및 phophatase - ors은 즉시 사용하기 전에 추가되어야합니다. 나트륨 orthova - nadate의 추가되면 버퍼는 색상 노란 될 것입니다. |
| 3 | BN - 투석 버퍼 | 베이스 버퍼 비스 - 트리스 20 MM ε - aminocaproic 산성 500 MM NaCl 20 MM EDTA (에틸렌 다이아 민 테트라 초산), 산도 8.0이 MM 글리세롤 10% HCL과 7.0 산도를 조정합니다. 4 스토어 ° C. 세제 Digitonin 0.3-0.5 % 또는 트리톤 X - 100 0.1 % 또는 Brij 96 0.1 % 또는 Dodecylmaltoside 0.1 % 단백 분해 효소 및 인산 가수 분해 효소 억제제 PMSF 1 ㎜ 나트륨 orthovanadate 0.5 MM | 적절한 세제는 경험적으로 결정되어야하며 다른 용해 버퍼에서 사용되는 것과 동일해야하지만,에 집중하고 낮은 - tions를 지적했다. 세제는 겔 전기 영동의 스택 단계에서 사전 환기 집합에 추가합니다. 단백 분해 효소 억제 및 phophatase - ors은 즉시 사용하기 전에 추가되어야합니다. |
| 4 | 배 BN - 젤 버퍼 | 비스 - 트리스 150 MM ε - aminocaproic 산성 200 MM HCL과 7.0 산도를 조정합니다. 4 스토어 ° C. | |
| 5 | 4 % 젤 분리 | 배 BN - 젤 버퍼 (제조법 4) 5.00 ML 아크릴 아미드 / Bisacrylamide 1.50 ML DH 2 O 8.50 ML APS, DH 2 O 54 μL에서 10 % TEMED 5.4 μL | 이 시약은 중합을 촉진 등 immedia - tely 젤 쏟아져 전에 APS와 TEMED를 추가합니다. 이 요리법은 30 ML 젤을 행사할 충분하다. 부어되는 젤의 수와 크기 볼륨을 조정합니다. |
| 6 | 15 % 젤 분리 | 배 BN - 젤 버퍼 (제조법 4) 5.00 ML 아크릴 아미드 / Bisacrylamide 5.63 ML 글리세롤 70% 4.38 ML APS, DH 2 O 42 μL에서 10 % TEMED 4.2 μL | 이 시약은 중합을 촉진 등 immedia - tely 젤 쏟아져 전에 APS와 TEMED를 추가합니다. 이 요리법은 30 ML 젤을 행사할 충분하다. 부어되는 젤의 수와 크기 볼륨을 조정합니다. 아크릴 아미드 - bisacrylamide의 농도도 10~18%에서 필요에 따라 다양한 수 있습니다. |
| 7 | 3.2 %가 젤 스태킹 | 배 BN - 겔 버퍼 (제조법 4) 3.00 ML 아크릴 아미드 / Bisacrylamide 0.72 ML DH 2 O 5.28 ML APS, DH 2 O 120 μL에서 10 % TEMED 12 μL | 이 시약은 중합을 촉진 등 immedia - tely 젤 쏟아져 전에 APS와 TEMED를 추가합니다. 이 요리법은 30 ML 젤을 행사할 충분하다. 부어되는 젤의 수와 크기 볼륨을 조정합니다. |
| 8 | 음극 버퍼 | 비스 - 트리스 15 MM Tricine 50 MM 쿠매시 블루 G250 0.02 % 10X 주식으로 1리터 준비, 4 HCL와 7.0 산도를 조절하고, 저장 ° C. 사용하기 전에 DH 2 O와 1시 10분을 희석. | 이러한 쿠매시 블루 R250이나 콜로이드 쿠매시 블루스로 쿠매시 염료의 다른 유형을 대체하지 마십시오. |
| 9 | 양극 버퍼 | 비스 - 트리스 50 MM 10X 주식으로 1리터 준비, 4 HCL와 7.0 산도를 조절하고, 저장 ° C. 사용하기 전에 DH 2 O와 1시 10분을 희석. | |
| 10 | 마커 믹스 | Aldolase (158 KD) 10 MG / ML 카탈 라 아제 (232 KD) 10 MG / ML 페리틴 (440 및 880 KD) 10 MG / ML Thyroglobulin (670 KD) 10 MG / ML BSA (66 132 KD) 10 MG / ML 비스 - 트리스 20 MM NaCl 20 MM 글리세롤 10% HCL과 7.0 산도를 조정합니다. 4 스토어 ° C. | 분자량 마커는 Invitro - 젠 또는 Pharmacia 포함한 여러 소스로부터도 상업적으로 사용할 수 있습니다. |
| 11 | SDS 샘플 버퍼 | 트리스 12.5 MM SDS 4% 글리세롤 20% Bromophenol 블루 0.02 % 6.8으로 산도를 조정합니다. 이황화 채권을 줄이기 위해, 9 ML β - 메르 캅 토 에탄올을 추가합니다. | 가루와 β - 메르 - captoethanol로 SDS는 독성이있다. 따라서, 장갑을 사용하여 후드를 작동합니다. |
| 12 | 4X 낮은 버퍼 | 트리스 1.5 M SDS 0.4 % 8.8으로 산도를 조정합니다. | 가루로 SDS는 독성이다. 따라서, 장갑을 사용하여 후드를 작동합니다. |
| 13 | 4X 상단 버퍼 | 트리스 0.5 M SDS 0.4 % 6.8으로 산도를 조정합니다. | 가루로 SDS는 독성이다. 따라서, 장갑을 사용하여 후드를 작동합니다. |
| 14 | 10 % 젤 분리 | 아크릴 아미드 (30 %) 2.0 ML 4X 낮은 버퍼 1.5 ML DH 2 O 2.454 ML APS, DH 2 O 40 μL에서 10 % TEMED 6 μL | 이 시약은 중합을 촉진 등 immedia - tely 젤 쏟아져 전에 APS와 TEMED를 추가합니다. 이 요리법은 30 ML 젤을 행사할 충분하다. 부어되는 젤의 수와 크기 볼륨을 조정합니다. |
| 15 | 4.8 %가 젤 스태킹 | Acylamide (30 %) 320 μL 4X 상단 버퍼 500 μL DH 2 O 1.16 ML APS, DH 2 O 10 % 20 μL TEMED 2 μL | 이 시약은 중합을 촉진 등 immedia - tely 젤 쏟아져 전에 APS와 TEMED를 추가합니다. 이 요리법은 30 ML 젤을 행사할 충분하다. 부어되는 젤의 수와 크기 볼륨을 조정합니다. |
| 16 | Semidry 전송 버퍼 | 트리스 48 MM 글리신 39 MM 메탄올 20% SDS 0.1 % DH 2 O.과 1리터로 볼륨을 조정 상온에서 보관하십시오. | 분말과 메탄올로 SDS는 독성이있다. 따라서, 장갑을 사용하여 후드를 작동합니다. |
토론
본 연구에서는, 우리는 BN - PAGE에 의해 MPCs의 분석을 설명합니다. 2D 접근이 기본 조건 첫째 별도 MPCs하는 데 사용됩니다, 그리고 추가로 두 번째 차원 SDS - PAGE하여 개별 구성 요소로 그들을 나눌 수 있습니다.
샘플은 세포 lysates의 준비가되어 있습니다. 많은 MPCs의 solubilization 들어, 적절한 세제는 단백질 단지의 구조를 유지하는, 필요합니다. 여기, 우리는 0.1 % 트리톤 X - 100을 사용합니다. 그러나, 최적의 세제와 적당한 농도는 모든 MPC에 대해 경험적으로 결정해야합니다. 의 경우에는 트리톤 X - 100, 예를 들면, 그것은 낮은 세제 농도가 F 1 dimeric 양식의 식별을 허용되는 것으로보고되었습니다 F 0 - ATPase 복합 (아놀드, 파이퍼 외. 1998). 높은 트리톤 X - 100 농도는하지만, 이합체의 분리와 monomeric F 1 F 0 - ATPase 복합 해당 증가로 이어집니다. 높은 농도 또는 다른 세제의 사용가 digitonin 결과를 불리는 반면, 이것은 과거의 연구 중 하나와 라인에, 우리는 Brij 96 낮은 농도로 추출하면 multivalent T - 세포 수용체 복합 (TCR)가 보존는 것을 보여주고 있었다 monomeric TCR의 추출 (Schamel, Arechaga 외. 2005). 테스트할 수 있습니다 일반적으로 사용되는 세제는 digitonin (0.5-1 %), 트리톤 X - 100 (0.1-0.5 %), Brij 96 (0.1-0.5 %), 또는 dodecylmaltoside을 (0.1-0.5 %) 등이 있습니다. 이 시약은 MPC의 안정성을 위해 최선이 될 경향이 nonionic 세제입니다. SDS와 다른 강한 세제과 접촉이 (카마초 - Carvajal, Wollscheid 외. 2004) 피해야한다고 알고 있습니다.
lysates의 투석은 BN - 젤의 MPC 분리 (. 카마초 - Carvajal, Wollscheid 외 2004) 달성하는 데 필요한, (Heiss, Junkes 외 2005.). 그것은 소금 농도 또는 낮은 분자량의 불순물의 제거의 조정은 높은 해상도를 위해 중요 것 같습니다. 또한 immunopurified 나중에 항체에서 eluted되었습니다 막 준비와 MPCs이 (스와미, Siegers 외. 2006) BN - PAGE에 적합한 것을 주목할만한 것입니다. 두 경우 모두에서, 샘플은 멤브레인 용해 또는 용출이 BN - 용해 버퍼에서 실시하는 경우, BN - PAGE 분리에 대한 dialyzed 될 필요가 없습니다.
BN - PAGE로 단백질 분리, 염료 쿠매시 파란색 단백질 unspecifically 바인딩과 부정 청구와 함께 그들을 포함하는, 필요합니다. 따라서, 쿠매시 파란색 중립 PH (Schägger 및 본 Jagow 1991)에서 음극쪽으로 단백질의 전기 영 동적 이동성을 가능하게, (Schägger, 크래머 외 1994.). 또한, 쿠매시 파란색 전기 영동하는 동안 쌓아 겔의 단백질 집합을 방지합니다. BN - PAGE 들어, 쿠매시 G250은 쿠매시 청색 R250이나 콜로이드 쿠매시 블루스 대신 사용할 수 있습니다.
BN - 젤을 실행하기 전에, 그것은 젤의 비율은 관심의 MPC의 예상 크기에 맞는 것을 보장하기 위해 필요합니다. 다양한 그라디언트와 적절한 버퍼 Invitrogen (NativePAGE Novex BIS - 트리스 젤 시스템)에서 상업적으로 사용할 수로 BN - 젤을 프리 캐스트. 그러나 BN - 젤 또한 persistaltic 펌프와 함께 그라디언트 믹서를 사용하여 준비하실 수 있습니다. 손상 그라데이션을 보장하기 위해 액체가 쏟아져과 거품을 피해야한다 동안 끊임없이 유동한다. 과부하가 전기 과정 중에 단백질 침전으로 이어질 수 있기 때문에 우리는 겔에 다른 샘플 dilutions의 로딩을 권장합니다. 또한, BN - 젤은 4 실행되어야 ° C 단백질 저하를 방지하고 MPCs 그대로 유지합니다.
MPCs의 BN - PAGE, 시각화가 쿠매시 빛나는 푸른 얼룩, 실버 얼룩이나 immunoblotting하여 얻을 수있다 후에. 단백질 밴드 대량 분석계 (카마초 - Carvajal, Wollscheid 외. 2004)에 의해 더 분석에 적합합니다 쿠매시 또는 실버 얼룩의 시각. immunoblotting의 경우 관심의 MPCs에 대한 최적의 전송 상태는 경험적으로 결정해야합니다. 쿠매시 블루도 BN - 젤의 모래 바닥 동안 전송되는 점에 유의하십시오. 막이 파란 색깔을 발휘합니다 반면 따라서, 젤은 성공적인 전송 후에 무색됩니다. 또한, SDS - PAGE 후 검색을 위해 일하는 게 아니 모든 기본 항체가, BN - PAGE에 immunoblotting에 적용할 수 있다고 언급하는 것이 중요합니다. 그것은 그들의 에피토프이 단백질의 원래 형태에 숨겨져 있기 때문에 항체가 관심의 MPC를 인식하지 않는 것이 발생할 수 있습니다. 이 문제를 극복하기 위해서는 1X SDS 샘플 버퍼에 곧 젤 끓는 사전 전송 BN - 겔 내에서 단백질을 변성 수 있습니다.
우리의 예제에서는, 우리는 단백질 밴드의 검출에 직접 BN - 젤 적용되지 않았다. 대신, 우리는 추가로 두 번째 dimensi하여 BN - PAGE로 구분 lysate를 나누어SDS - PAGE에. 두 번째 차원 SDS - 겔에서 monomeric 단백질은 두 번째 차원 (카마초 - Carvajal, Wollscheid 외. 2004)의 첫 번째와 선형 겔에서 그라디언트 젤로 인해 쌍곡선 대각선 이내에 마이 그 레이션. 그들이 쌍곡선 대각선 아래화된되기 때문에 이것은, MPCs의 쉽게 확인하실 수 있습니다. 한 별개의 MPC의 하위 구성 요소는 두 번째 차원 SDS - PAGE의 수직선에서 구분됩니다. 여러 dinstinct의 MPCs의 성분 구성 요소는 MPC의 크기에 따라 수평선에서 확인할 수 있습니다. 그러나, 하나의 수직선에 나타나는 여러 가지 단백질의 명소도 BN - PAGE의 동일한 위치에서 마이 그 레이션 개별 단지의 일부가 될 수 있다고 간주되어야한다. 그들은 같은 MPC에 나타날 수있는 마지막 증거는 항체 기반 겔 변화 분석에 의해 얻을 수 있습니다. 이 분석에서는 셀룰러 lysate 전에 BN - PAGE로 확인 명소 중 하나에 의해 대표되는 단백질에 대한 항체와 함께 incubated입니다. 첫 번째 차원 높은 분자 질량으로이 단백질을 포함하는 모든 MPCs의 변화이 발생합니다. 이러한 MPCs의 일부 다른 단백질이 복잡한 특정 변화를 받아야하므로 두 번째 차원 SDS - 겔에서 식별하는 쉬운 것입니다.
뿐만 아니라 MPCs의 구성은 BN - PAGE로 분석뿐만 아니라 자신의 stoichiometry의 결정은 (Schamel 및 Reth 2000) 수도 수 있으며 (Schamel 2001), (스와미, Minguet 외 2007.). 이를 위해 NAMOS 분석 (기본 항체 기반 이동성 교대 분석)을 수행할 수 있습니다. 항체 기반 겔 변화 분석에서와 마찬가지로, 세포 lysates은 단클론 subunit 특정 항체와 incubated 있습니다. 이것은 MPCs의 stoichiometry에있는 변화의 범위에서 추론을 허용 BN - 젤에서 전기 immunoshifts의 유도에 연결
conlusion에서 BN - PAGE은 MPCs의 식별과 크기, 구성뿐만 아니라, 상대 풍요의 결정에 적합합니다. NAMOS 분석으로 수행, 그것은 또한 특정 MPC의 stoichiometry을 결정할 수있는 가능성을 제공합니다. 의 일반적인 적용을 감안할 때,이 기법은 MPCs의 특성 (. 데커, 뮐러 외 1996)에 대한 매우 유용한 도구입니다, (위티그 및 Schagger 2008), (바그너, Rehling 외 2009)., (위티그 및 Schägger 2009) .
공개
감사의 말
우리는 마이클 Reth, 헤르만 Schägger와 마가리타 과학 지원 카마초 - Carvajal 감사합니다. 이 작품은 독일 Forschungsgemeinschaft (DFG)에서 BIOSS하여 Bundesministerium fuer Bildung 및 Forschung (BMBF)에서 FORSYS에 의해 재정 지원하고, 독일 연방 및 주 정부의 우수 이니셔티브 (GSC - 4, Spemann 대학원에서 일부 지원이 ).
참고문헌
- Arnold, I., Pfeiffer, K. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits. EMBO J. 17 (24), 7170-7178 (1998).
- Camacho-Carvajal, M. M., Wollscheid, B. Two-dimensional Blue native/SDS gel electrophoresis of multi-protein complexes from whole cellular lysates: a proteomics approach. Mol. Cell. Proteomics. 3 (2), 176-182 (2004).
- Heiss, K., Junkes, C. Subproteomic analysis of metal-interacting proteins in human B cells. Proteomics. 5 (14), 3614-3622 (2005).
- Sali, A., Glaeser, R. From words to literature in structural proteomics. Nature. 422, 216-225 (2003).
- Schägger, H., Cramer, W. A. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217 (2), 220-230 (1994).
- Schägger, H., von Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form. Anal. Biochem. 199 (2), 223-231 (1991).
- Schamel, W. W. Biotinylation of protein complexes may lead to aggregation as well as to loss of subunits as revealed by Blue Native PAGE. J Immunol Methods. 252 (1-2), 171-174 (2001).
- Schamel, W. W., Arechaga, I. Coexistence of multivalent and monovalent TCRs explains high sensitivity and wide range of response. J. Exp. Med. 202, 493-503 (2005).
- Schamel, W. W., Reth, M. Monomeric and oligomeric complexes of the B cell antigen receptor. Immunity. 13 (1), 5-14 (2000).
- Swamy, M., Minguet, S. A native antibody-based mobility-shift technique (NAMOS-assay) to determine the stoichiometry of multiprotein complexes. J Immunol Methods. 324 (1-2), 74-83 (2007).
- Swamy, M., Siegers, G. M. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci STKE. 2006 (345), 4-4 (2006).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8, 3974-3990 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유