このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
組織の表面張力測定ごとの集計凝集力の測定
要約
我々は、三次元組織のような凝集体中の細胞間、組織の表面張力として表現結合エネルギーを、測定する方法を説明します。組織の表面張力の違いは、肺、筋肉、脳の腫瘍の侵襲性と相関することが実証され、異なる種類の細胞間の空間関係を確立するための基本的な決定要因であるされています。
要約
細胞間結合エネルギーの厳密な測定は、平衡状態でのシステムの熱力学的原理に立脚した方法を用いて製造することができます。我々は特に細胞間相互作用の表面自由エネルギーを測定するために組織の表面張力測定(TST)を開発しました。 TSTの基礎となる生物物理学的な概念は、以前は次の詳細の1,2に記載されている。メソッドは、相互に凝集細胞は、振盪培養で維持した場合、自発的にクラスタにアセンブルするという観測に基づいています。時間が経つにつれて、これらのクラスタは、球を形成するために切り上げになります。この丸めアップの動作は、液体システムの動作特性を模倣しています。細胞間の結合エネルギーは、カスタム設計された組織の表面張力計で、平行平板間に球状凝集体を圧縮することによって測定されます。液滴の表面張力を測定するために使用したのと同じ数学的な方程式は、三次元組織のような球状の凝集体の表面張力を測定するために使用されます。液体の表面張力の携帯電話と同等の細胞間結合エネルギー、またはより一般的に、組織のcohesivityです。我々の研究室からこれまでの研究では、組織の表面張力(1)胚細胞の二つのグループは1-5、(2)強くできる生体材料6、(3)と相互作用する組織の能力に影響を与えることができるように相互作用する方法を予測することが示されているカドヘリンベースの細胞間の凝集7の直接操作して、だけでなく、FN 8-11と4などの主要なECM分子の操作によってのみ変更できます)肺癌12、線維肉腫13、脳腫瘍14と前立腺腫瘍の侵襲性と相関細胞株15。この記事では、集約の圧縮を開始する、と生成された組織の表面張力の測定値を分析し、検証するために、張力計室にスフェロイドをロードする装置、細部スフェロイドを生成するために必要な手順を、説明します。
プロトコル
1。組織の表面張力の測定のための集約準備。
接着細胞の場合は、スフェロイドはどちらハンギングドロップ法を使用するか、1 mmの断片に切断することができる細胞の首尾一貫したシートを生成することにより形成することができる。
ハンギングドロップ法による凝集体形成:
- ほぼコンフルエント接着細胞の培養は、90%コンフルエントまで増殖されるべき、whereupon単層をPBSで2回リンスする必要があります。よく排水後、0.05%トリプシン- 1mMのEDTAの2 MLSを(100 mmプレートの場合)追加し、37℃での細胞がデタッチされるまで。完全培地の2 MLSを追加することにより、トリプシン処理を停止し、静かに、細胞が懸濁液になるまで混合物を砕いて粉にするために5 mlのピペットを使用してください。 15 mlコニカルチューブに細胞を移す。
- に10 mg / mlのDNaseストック溶液40μlを加え、室温で5分間インキュベートする。 5分間、200 xgで軽くボルテックスして、遠心。
- 上清を捨て、1mlの完全な組織培養の培地でペレットを洗浄。繰り返しますが、その後、完全な組織培養培地の2 MLSで細胞を懸濁します。
- 血球計算盤、または自動細胞計数装置を用いて細胞をカウントし、2.5 × 10 6細胞/ mlに濃度を調整する。
- 60 mmの組織培養皿と皿の底の場所のPBS 5mlのをから蓋を外します。これは、水和室として機能します。
- 蓋を逆さにして蓋の底部上に10μlの滴を堆積させるために20μlのピペットを使用してください。触れないでするように十分離れてドロップが配置されていることを確認してください。皿ごとに少なくとも20滴を配置することが可能です。
- 37 PBS -満ちボトムチャンバーとインキュベート℃/ 5%CO 2 /湿度95%の上にふたを反転させる、毎日の低下を監視し、細胞シートまたは凝集体のいずれかが形成するまでインキュベートする。
- 一度シートの形、それらが回転楕円体の形になるまで℃、5%CO 2を完全培地の3のMLSを含む丸底ガラスシェーカーフラスコに移し、37で振とう水浴中でインキュベートすることができます。
細胞シート法による凝集体形成:
- 単一の細胞懸濁液は、上記で調製されるが、濃度が1 × 10 6細胞/ mlに調整されます。
- 10ミリリットルの丸底フラスコ(Belco、ヴァインランド、ニュージャージー州)に細胞懸濁液の3mlを転送する。
- 細胞はトリプシン処理から回復するまで旋回水浴/ 37シェーカー(ニューブランズウィックサイエンティフィック、エジソン、ニュージャージー州)° C、120 rpmで4時間、5%CO 2のフラスコをインキュベートする。
- ガラス丸底遠沈管と薄いペレットに200 X gで遠心して細胞を移す。一貫性のあるシートのフォームになるまでさらに24時間インキュベートする。
- ゆっくりと旋回培養チューブにシートを取り除くと、小さな、滅菌ガラスの組織培養皿に培養試験管の内容を注ぐことに。
- さまざまなサイズのフラグメントに複数のシートをカットするマイクロメスを使用してください。
- 2〜3日のために37℃、5%CO 2下で120rpmで旋回水浴シェーカー上でC言語をフラグメントをインキュベートするか、彼らは球状になるまで。
2。骨材の表面張力の測定
- 組織の表面張力計 。装置は図に示されています。 1と2。圧縮のセル(図3)は、2つのチャンバーで構成されています。外室(OC)を37℃の循環水ポンプに接続され、内側のチャンバー(IC)の温度を調節する働きをする。チャンバーは、粉砕されたデルリン製で、集約の可視化のための石英窓を含みます。インナーチャンバーの底にアセンブリ(LA)ねじ下、1)内側のチャンバー内に集約して配置するために使用され、2)インナーチャンバーの底をシールし、3)圧縮を開始するために集計を高める、(4 )パラレルプレート、したがって、集約の圧縮の間の距離を制御する。アセンブリの中央コア(CC)が調整可能です。中央のコア(台座)の先端は、滑らかなテフロンで構成され、低い圧縮プレート(LCP)として機能します。上部の圧縮プレート(UCP)は、バランスのアームからハング(B)難まっすぐニッケルクロムワイヤーで(NCW)長いテフロンのシリンダー15ミリメートル*です。実験の過程で、細胞の集合体は、()下のプレート上に位置しているとに接触するまで、上部プレートを調達。上部のプレートは、バランスアーム(B)に接続されています。集合体の圧縮は、バランスアームの変位を引き起こす。バランスはヌルバランスの原理で動作カーン/ Ventronモデル2000の記録電気てんびん、です。バランスアームの支点は、永久磁界内に電機子を持っています。バランスが動作しているとき、それは継続的に順番に水平位置でバランスの腕を維持する電磁アセンブリ、流れる電流を変調する。オブジェクトは、バランスがhorizoに腕を保つために適用されるバランスのアーム、電圧、から中断されている場合ntal位置は、オブジェクトの重さに比例します。この電圧は、アグリゲートに印加される外部圧縮力を測定します。骨材の形状は、フレームグラバーを装備しているコンピュータに結合さ25 ×ニコンSMZ10Aのステレオスコープを介して目視により監視されます。圧縮プレートに細胞凝集体の付着を最小限に抑えるため、両方の下限と上限圧縮板にするためのポリ(2 -ヒドロキシエチルメタクリレート){ポリ(HEMA)}、細胞が16を付着していないために高分子材料で被覆した。
*ワイヤーは、レトルトのスタンドからワイヤーの15インチの長さを吊り下げて最後に小さなバインダークリップをクランプして、火炎をまっすぐにしています。線が赤色に点灯するまで、ブンゼンバーナーは、ワイヤの長さを上下に実行している。まっすぐに伸ばした線は適切な長さに切断することができます。小さなフックは2つのかみそりの刃を使用してエンドから1インチのワイヤー約¼を曲げることにより形成される。もう一方の端は、低い圧縮プレートのバレルに挿入されます。 - 骨材の圧縮。
- インナーチャンバーは、予め温めておいたCO 2に依存しない組織培養培地(GIBCO / BRL、NY)で満たされている。
- 約200〜300μからサイズの範囲の凝集体は、低い圧縮プレート(図4A)に配置されています。集計は、シリコン球を装着したパスツールピペットの先端までの組織培養の培地半分の方法で集計を吸引し、内側チャンバーにピペットを転送、およびLCP上記ピペットの先端を置くことによってロードされます。集計は、優しく静かに球を押し込んでLCPに排出されます。また、骨材は、LCPの上に重力によって落下することが許可されます。
- 上部の圧縮プレート(UCP)は、骨材の上に配置し、圧縮前見かけUCPの重量のベースラインを確立し、沈降さ。
- アグリゲートがUCP(図4B)に対して圧縮されるまで、LCPは、その後発生します。下の装置の内部コアの高さを調整すると、圧縮の程度の違いを制御します。圧縮は、CCDビデオカメラを備えた解剖顕微鏡を通して観察によって監視されます。
- 集約画像は、キャプチャ、デジタル化、およびImageJを用いて分析している。見かけのUCPの体重の変化が連続的にストリップチャートレコーダーに記録され、形状の均衡の達成は、カーンのバランスの電圧出力の平準化オフで示されている。各集合体は、圧縮の2種類の異なる度に供される。
- 骨材の表面張力の計算。
形状の平衡状態では、それが付着していないために平行平板間の圧縮された細胞の集合体のcohesivityはcohesivityは、Fは集約を圧縮するために作用する力であるσのヤングラプラスの方程式(図5)、から得ることができます。 、πR3 2は、力Fの力が作用する際に骨材の表面の面積であり、そしてR 2及びR 3は 、それぞれ、圧縮された集合体の赤道の半径とその表面形状が通常の定義円弧の半径です。プレートを圧縮し、それら(図6)との間に延在する。力と形状の平衡状態での圧縮力と形状を測定し、ヤングラプラスの方程式に、これらの測定値を適用すると、見かけの組織の表面張力の数値を生成します。 σの1の平衡と計算に到達すると、凝集体が解凍され、第2平衡に近づくと、上記のように2が算出されるσをすることができました。 - 集合体流動性の確認。
二つの異なる圧縮を受けた液体の集計、計算した表面張力が一定に維持されます。このような凝集体では2 /σをσ1の比は1に等しくなり、それぞれの連続圧縮(F 2 / F 1)に印加される力の比よりも小さくなります。対照的に、弾性骨材の計算された表面張力は、フックの法則に従うだろうし、加えられた力に比例して増加する。弾性骨材の場合は2 /σをσ1の比は1に等しくされませんが、代わりにF 2 / F 1の比率に近づいていきます。液体凝集体の表面張力は、集合のサイズ2,17の独立となります。表面張力が加えられた力と大きさの独立となっているだけの測定は、平均がそれぞれの細胞株でのσの計算に使用されます。
3。代表的な結果:
下ラットの前立腺線維芽細胞(RPF)とラット前立腺平滑筋細胞(RPSMC)の集合体の典型的なTSTの結果の表です。図に見られるように。 RPFの細胞の7凝集体は22.8の表面張力± 1.1ダイン/ cmを持っている。また、圧縮1と後の圧縮2の後に測定された平均表面張力の値は、統計的にIDENTいた対応のあるt -検定によって比較してiCalの。我々はまた、彼らは同じように彼らは弾性固体として振る舞う場合は、これらの凝集体は、フックの法則に従うていないことを保証するために2 /σを1とF 2 / F 1、σの比を比較した。表1に示すように、2 /σをσ1の比は、実際に1.0をアプローチではありません。また、F 2 / F 1の比率はさらに、これらの凝集体は、フックの法則に従うと、実際に液体として動作しないことを確認、σ2 / 1(P <0.05、t検定)σよりも有意に大きかった。コントラストRPSMCsではフックの法則は従った。表1で明らかなように、2 /σをσ1の比は1よりも有意に大きいとF 2 / F 1のそれよりも統計的に差はなかった。さらに液体のような挙動を示すために、我々は、表面張力(σ)と骨材量との関係を調査した。図に見られるように。 RPSMCs(青回帰直線、R 2 = 0.146)のボリューム上にシグマのいくつかの依存性があるように表示されるのに対し、8は、ボリュームは、RPFの細胞(赤回帰直線、R 2 = 0.002)のためにシグマとは無関係です。これらのデータは、さらにRPSMCsのものが弾性固体としてより多くの動作を行うように見えるのに対し、RPFの凝集は、液体のような方法で振る舞うことを確認してください。唯一の液体として振る舞うの集計から得られたものmesurementsは、表面張力を計算するために使用されます。

図1組織の表面張力計の概要。

図2。テンシオメータチャンバー(右パネル)のより詳細なビュー。
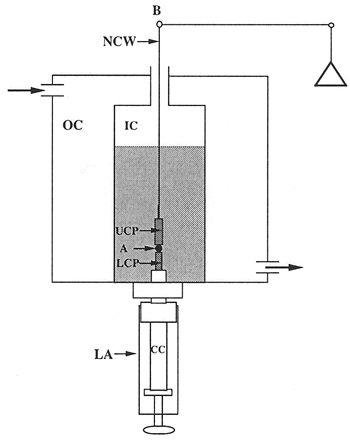
図3。テンシオメータチャンバーの模式図。

図4非圧縮(A)と圧縮(B)凝集体の画像。

図5。ラプラスの方程式。
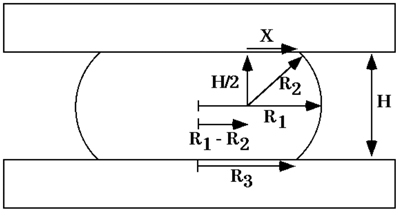
図6。形状の平衡時のそれは不完全に付着する2つの平行平板間の圧縮液滴の図。 R 1及びR 2はそれぞれ、液滴の赤道でと対称軸を介して平面に、曲率の二つの主要半径です。 R 3は、どちらの圧縮板との接触の液滴の円形領域の半径である。 Hは、上部と下部圧縮板との間の距離である。 Xは、液滴の表面と圧迫板のいずれかの接点に伸びる2斜辺のRと直角三角形の一面です。
| 1(ダイン/ cm ± SEM)を、σ | σ2(ダイン/ cm ± SEM) | Pσ1対2、σ | 1,2(ダイン/ cm ± SEM)を、σ | σ2 /σ1 | F 2 / F 1 | 2 /σを1とF 2 F 1を Pσ | |
| RPF | 22.6 ± 1.7 | 22.9 ± 1.4 | > 0.05 * | 22.8 ± 1.1 | 1.04 ± 0.04 | 1.47 ± 0.06 | <0.05 |
| RPSMC | 15.0 ± 2.8 | 23.0 ± 3.2 | 0.039 | NA | 1.9 ± 0.3 | 1.6 ± 0.1 | 0.16 * |
図7。TSTの測定およびラットの前立腺線維芽細胞と平滑筋細胞の集合体の集合体流動性の確認。
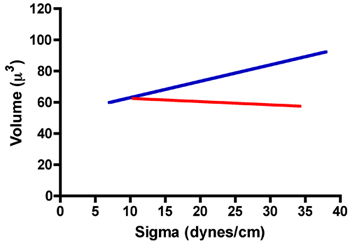
図8。RPF(赤線)とRPSMCs(青線)の集合体のためのシグマとボリュームの関係。
ディスカッション
TSTによって集計凝集を測定することは比較的簡単です。使用可能なTSTのデータを生成するために習得しなければならない重要なステップは、しかし、そこには、1)集合体は"健康的"でなければなりません。これは、凝集体形成が剥離する前に最適な合流点にある細胞で始まることを確認することで制御することができます。文化の集合体のサイズと時間は、集合内の壊死性コアの開?...
開示事項
資料
- 水浴/シェーカー(ニューブランズウィックサイエンティフィック、エジソン、ニュージャージー州)
- 10ミリリットルの丸底フラスコ(Belco、ヴァインランド、ニュージャージー州)
参考文献
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Phys Rev Lett. 72, 2298-2301 (1994).
- Foty, R. A., Pfleger, C. M., Forgacs, G., Steinberg, M. S. Surface tensions of embryonic tissues predict their mutual envelopment behavior. Development. 122, 1611-1620 (1996).
- Schotz, E. -. M. Quantitative differences in tissue surface tension influence zebrafish germ layer positioning. HFSP Journal. 2, 42-56 (2008).
- Jia, D., Dajusta, D., Foty, R. A. Tissue surface tensions guide in vitro self-assembly of rodent pancreatic islet cells. Dev Dyn. 236, 2039-2049 (2007).
- Schwarz, M. A., Zheng, H., Legan, S., Foty, R. A. Lung Self-Assembly is Modulated by Tissue Surface Tensions. Am J Respir Cell Mol Biol. , (2010).
- Ryan, P. L., Foty, R. A., Kohn, J., Steinberg, M. S. Tissue spreading on implantable substrates is a competitive outcome of cell-cell vs. cell-substratum adhesivity. Proc Natl Acad Sci U S A. 98, 4323-4327 (2001).
- Foty, R. A., Steinberg, M. S. The differential adhesion hypothesis: a direct evaluation. Dev Biol. 278, 255-263 (2005).
- Robinson, E. E., Foty, R. A., Corbett, S. A. Fibronectin matrix assembly regulates alpha5beta1-mediated cell cohesion. Mol Biol Cell. 15, 973-981 (2004).
- Robinson, E. E., Zazzali, K. M., Corbett, S. A., Foty, R. A. alpha5beta1 integrin mediates strong tissue cohesion. J Cell Sci. 116, 377-386 (2003).
- Winters, B. S., Raj, B. K., Robinson, E. E., Foty, R. A., Corbett, S. A. Three-dimensional culture regulates Raf-1 expression to modulate fibronectin matrix assembly. Mol Biol Cell. 17, 3386-3396 (2006).
- Caicedo-Carvajal, C. E., Shinbrot, T., Foty, R. A. Alpha5beta1 integrin-fibronectin interactions specify liquid to solid phase transition of 3D cellular aggregates. PLoS One. 5, e11830-e11830 (2010).
- Foty, R. A., Steinberg, M. S. Measurement of tumor cell cohesion and suppression of invasion by E- or P-cadherin. Cancer Res. 57, 5033-5036 (1997).
- Foty, R. A., Corbett, S. A., Schwarzbauer, J. E., Steinberg, M. S. Dexamethasone up-regulates cadherin expression and cohesion of HT-1080 human fibrosarcoma cells. Cancer Res. 58, 3586-3589 (1998).
- Winters, B. S., Shepard, S. R., Foty, R. A. Biophysical measurement of brain tumor cohesion. Int J Cancer. 114, 371-379 (2005).
- Foty, R. A., Cummings, K. B., Ward, S. Tissue surface tensiometry: a novel technique for predicting invasive potential of prostate tumors based on tumor cell aggregate cohesivity in vitro. Surgical Forum L. , 707-708 (1999).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Physical Review Letters. 72, 2298-2301 (1994).
- Guevorkian, K., Colbert, M. J., Durth, M., Dufour, S., Brochard-Wyart, F. Aspiration of biological viscoelastic drops. Phys Rev Lett. 104, 218101-218101 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved