Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure de la cohésion globale par tensiométrie surface du tissu
Dans cet article
Résumé
Nous décrivons une méthode de mesure de l'énergie de liaison, exprimable que la tension de surface des tissus, entre les cellules dans les tissus 3D-comme agrégats. Les différences de tension de surface de tissu ont été démontrés à corréler avec envahissement des poumons, les muscles et les tumeurs du cerveau, et sont des déterminants fondamentaux de l'établissement de relations spatiales entre les différents types cellulaires.
Résumé
Mesure rigoureuse d'énergie de liaison intercellulaire ne peut être faite en utilisant des méthodes fondées sur des principes thermodynamiques dans les systèmes à l'équilibre. Nous avons développé tensiométrie surface du tissu (TST) spécifiquement pour mesurer l'énergie libre de surface d'interaction entre les cellules. Les concepts sous-jacents biophysiques TCT ont été décrits précédemment dans 1,2 détail. La méthode est basée sur l'observation que les cellules mutuellement cohérente, si elle est maintenue en secouant la culture, sera s'assemblent spontanément en clusters. Au fil du temps, ces grappes rondes jusqu'à former des sphères. Ce comportement rafles imite le comportement caractéristique des systèmes liquide. Intercellulaire énergie de liaison est mesurée par la compression des agrégats sphériques entre les plaques parallèles dans un tensiomètre conçu sur mesure tissu de surface. La même équation mathématique utilisé pour mesurer la tension de surface d'une gouttelette liquide est utilisé pour mesurer la tension de surface de la 3D des tissus tels que des agrégats sphériques. L'équivalent cellulaire de la tension de surface liquide est l'énergie de liaison intercellulaire, ou plus généralement cohésivité tissus,. Des études antérieures de notre laboratoire ont montré que la tension de surface du tissu (1) prédit comment deux groupes de cellules embryonnaires va interagir avec un autre 1-5, (2) peut fortement influencer la capacité des tissus à interagir avec des biomatériaux 6, (3) peut être modifié non seulement par la manipulation directe de la cadhérine-7 basée cohésion intercellulaire, mais aussi par la manipulation de molécules d'ECM clés tels que FN 8-11 et 4) est en corrélation avec le potentiel invasif du cancer du poumon 12, fibrosarcome 13, 14 tumeur au cerveau et tumeur de la prostate lignées cellulaires 15. Dans cet article nous allons décrire l'appareil, le détail les étapes nécessaires pour générer des sphéroïdes, de charger les sphéroïdes dans la chambre de tensiomètre, d'initier une compression globale, et pour analyser et valider les mesures de tension superficielle des tissus générés.
Protocole
1. La préparation globale pour la mesure de la tension de surface des tissus.
Pour les cellules adhérentes, sphéroïdes peuvent être formées en utilisant soit la méthode goutte suspendue ou en générant une feuille cohérente de cellules qui peuvent ensuite être découpé en fragments 1 mm.
La formation d'agrégats par la méthode de goutte pendante:
- Proche-confluentes cultures de cellules adhérentes doivent être cultivés à 90% de confluence, les monocouches quoi doivent être rincés deux fois avec du PBS. Après la vidange bien, ajoutez 2 ml (pour les plaques de 100 mm) de 0,05% de trypsine-1 mM EDTA, et incuber à 37 ° C jusqu'à ce que les cellules se détacher. Arrêtez trypsinisation en ajoutant 2 ml de milieu complet et doucement l'utilisation d'une pipette 5 ml de triturer le mélange jusqu'à cellules sont en suspension. Transfert des cellules dans un tube de 15 ml conique.
- Ajouter 40 ul d'une 10 mg / ml solution stock DNAse et incuber pendant 5 minutes à température ambiante. Brièvement au vortex et centrifuger à 200 xg pendant 5 minutes.
- Rejeter le surnageant et laver culot avec 1 ml de culture de tissus milieu complet. Répéter, puis remettre les cellules en 2 ml de milieu de culture de tissu complet.
- Compter les cellules en utilisant un hématimètre, ou un compteur de cellules automatisé et d'ajuster la concentration de 2,5 x 10 6 cellules / ml.
- Retirez le couvercle d'une boîte de culture de tissu de 60 mm et placer 5 ml de PBS dans le fond du plat. Ceci agira comme une chambre de l'hydratation.
- Inverser le couvercle et l'utilisation d'une pipette 20 ul de déposer 10 gouttes ul sur le fond du couvercle. Assurez-vous que des gouttes sont placées suffisamment éloignés afin de ne pas toucher. Il est possible de placer au moins 20 gouttes par plat.
- Inverser le couvercle sur le PBS-remplie chambre inférieure et incuber à 37 ° C CO / 5% 2 / 95% d'humidité, de surveiller l'gouttes par jour et incuber jusqu'au feuilles cellule soit ou agrégats sont formés.
- Une fois la forme des feuilles, ils peuvent être transférés à fond rond en verre Agitateur flacons contenant 3 ml de milieu complet et incubés dans un bain d'eau agité à 37 ° C et 5% de CO 2 jusqu'à la formation de sphéroïdes.
La formation d'agrégats par la méthode feuille de cellules:
- Suspensions cellulaires simples sont préparés comme décrit ci-dessus, mais la concentration est ajustée à 1x10 6 cellules / ml.
- Transfert de 3 ml de la suspension cellulaire à 10 ml ballons à fond rond (Belco, Vineland, NJ).
- Incuber fioles dans un bain d'eau giratoire / agitateur (New Brunswick Scientific, Edison, NJ) à 37 ° C, 5% de CO 2 de 4h à 120 rpm jusqu'à cellules récupérer trypsinisation.
- Transfert des cellules à un tube à centrifuger en verre à fond rond et centrifuger à 200 xg dans une fine granulés. Incuber pendant 24 h un autre jusqu'à ce qu'une feuille de formes cohérentes.
- Remuer doucement le tube de culture pour déloger la plaque et versez le contenu du tube de culture dans un petit plat en verre de culture stérile tissus.
- Utilisez scalpels micro pour couper les feuilles en fragments de tailles différentes.
- Incuber fragments à 37 ° C sur l'agitateur giratoire bain-marie à 120 rpm de moins de 5% de CO 2 pendant 2 à 3 jours ou jusqu'à ce qu'ils deviennent sphériques.
2. Mesure de la tension de surface totale
- Le tensiomètre surface du tissu. L'appareil est représenté dans les figures. 1 et 2. La cellule de compression (Fig. 3) est composé de deux chambres. La chambre extérieure (CO) est relié à une pompe à 37 ° C l'eau circule, et sert à réguler la température de la chambre intérieure (IC). Les chambres sont construites en Delrin broyé et comportent des fenêtres en quartz pour la visualisation de l'agrégat. Le montage inférieure (LA) vis dans la base de la chambre intérieure et est utilisé pour 1) la position de l'agrégat dans la chambre intérieure; 2) sceller le fond de la chambre intérieure; 3) d'élever l'agrégat de lancer la compression, et (4 ) contrôle la distance entre les plaques parallèles et donc la compression de l'agrégat. Le noyau central (CC) de l'assemblage est réglable. La pointe du noyau central (le piédestal) est composée de lisses en Teflon et agit comme la plaque de compression plus faible (LCP). La plaque de compression supérieur (UCP) est un cylindre en téflon 15mm de long qui pend au bras d'équilibre (B) par une flamme redressé nickel-chrome métallique (NCW) *. Au cours d'une expérience, l'agrégat de cellules (A) est positionné sur la plaque inférieure et soulevé jusqu'à ce qu'il touche la plaque supérieure. Le plateau supérieur est relié au bras de la balance (B). La compression de l'ensemble provoque un déplacement du balancier. L'équilibre est un Électrobalance Cahn / Ventron modèle d'enregistrement 2000, qui fonctionne sur le principe de l'équilibre nulle. Le pivot du bras de la balance a une armature dans un champ magnétique permanent. Lorsque la balance est en marche, il module en permanence le courant passant par l'assemblage électromagnétique, qui permet de maintenir l'équilibre du bras en position horizontale. Quand un objet est suspendu au bras de l'équilibre, la tension, dont le solde s'applique à maintenir le bras dans le Horizoposition de NTAL, est proportionnelle à peser l'objet. Cette tension mesure la force extérieure de compression appliquée à l'agrégat. La forme de l'agrégat est contrôlée par l'observation visuelle à travers un stéréoscope 25 x Nikon SMZ10A couplé à un ordinateur équipé d'une carte d'acquisition. Afin de minimiser l'adhérence des agrégats de cellules sur les plaques de compression, à la fois les plaques de compression inférieure et supérieure ont été recouvertes de poly (2-hydroxyéthylméthacrylate) {poly (HEMA)}, un matériau polymère à laquelle les cellules n'adhèrent pas 16.
* Le fil est-flammes redressé par pendaison d'une longueur de 15 pouces de fil à partir d'un statif et une pince de serrage liant petite à la fin. Un bec Bunsen est alors monter et descendre la longueur du fil jusqu'à ce que le fil est rouge. Le fil redressé peut alors être coupé dans la longueur appropriée. Un petit crochet est formé par la flexion du fil d'environ ¼ de pouce de la fin en utilisant deux lames de rasoir. L'autre extrémité est ensuite insérée dans le canon de la plaque de compression plus faible. - La compression globale.
- La chambre intérieure est remplie de pré-chauffé en CO 2 indépendante milieu de culture tissulaire (Gibco / BRL, NY).
- Granulats une taille allant de environ 200-300 μ sont positionnés sur la plaque de compression plus faible (figure 4A). Les agrégats sont chargés par l'aspiration d'un agrégat en milieu de culture tissulaire à mi-hauteur de la pointe d'une pipette Pasteur munie d'une ampoule de silicone, le transfert de la pipette à la chambre intérieure, et le positionnement de la pointe de la pipette au-dessus du PAFR. L'agrégat est alors doucement expulsés sur le LCP en pressant doucement l'ampoule. Alternativement, l'agrégat est autorisé à tomber par gravité sur la LCP.
- La plaque de compression supérieur (UCP) est positionné au-dessus du total et a permis de régler, en établissant un pré-compression de base apparente de poids UCP.
- Le LCP est alors soulevé jusqu'à ce que l'agrégat est comprimé contre l'UCP (figure 4B). Réglage de la hauteur de l'âme intérieure de l'appareil sera inférieure de contrôle différents degrés de compression. La compression est contrôlée par l'observation à travers un microscope à dissection équipé d'une caméra vidéo CCD.
- Des images globales sont capturés, numérisés et analysés à l'aide d'ImageJ. Changement de poids apparente UCP est enregistrée en continu sur un enregistreur à bande, la réalisation de l'équilibre de forme étant désigné par le tassement de la production de tension de l'équilibre Cahn. Chaque agrégat est soumis à deux degrés différents de compression.
- Calcul de la tension de surface totale.
A l'équilibre la forme, la cohésivité d'un agrégat de cellules comprimées entre des plaques parallèles à laquelle il n'adhère pas peut être obtenu à partir de l'équation de Young-Laplace (fig. 5), où σ est cohésivité, F est la force qui agit pour compresser l'agrégat , πr 3 2 est l'aire de la surface de l'agrégat sur lequel s'exerce la force F, et R 2 et R 3 sont, respectivement, le rayon de l'équateur de l'agrégat comprimé et le rayon d'un arc de définir son profil de surface normale à la compression des plaques et s'étendant entre eux (fig. 6). Mesure de la force de compression et de la géométrie à la force et l'équilibre de forme et l'application de ces mesures à l'équation de Young-Laplace génère des valeurs numériques de la tension des tissus de surface apparente. Après avoir atteint l'équilibre et le calcul de σ 1, les agrégats sont décompressées et a permis d'aborder un second équilibre et de σ 2 est calculé comme décrit ci-dessus. - Confirmation de la liquidité globale.
La tension de surface calculée d'un agrégat liquide, lorsqu'il est soumis à deux compressions différents restera constante. Dans ces agrégats du rapport de σ 2 / σ 1 sera égal à 1 et sera inférieur au ratio de la force appliquée à chaque compression successives (F 2 / F 1). En revanche, la tension de surface calculée d'un agrégat élastique obéir à la loi de Hooke et d'augmenter proportionnellement à la force appliquée. Pour les agrégats élastiques le ratio de σ 2 / σ 1 ne sera pas égal à 1, mais sera plutôt l'approche du ratio de F 2 / F 1. La tension de surface d'agrégats liquides sera également indépendant de la taille des agrégats 2,17. Seules des mesures dans laquelle la tension de surface est indépendante de la force appliquée et la taille sont utilisés pour calculer σ moyenne pour chaque lignée cellulaire.
3. Les résultats représentatifs:
Voici un tableau des résultats du TCT typique pour des agrégats de fibroblastes prostate de rat (FPR) et le rat des cellules musculaires lisses de la prostate (RPSMC). Comme on peut le voir dans la Fig. 7 des agrégats de cellules du FPR ont une tension superficielle de 22,8 ± 1,1 dynes / cm. Par ailleurs, les valeurs moyennes tension de surface mesurée après compression 1 et 2 après compression étaient statistiquement identiCal lorsque comparés par un t-test apparié. Nous avons également comparé les ratios de σ 2 / σ 1 et F 2 / F 1 pour s'assurer que ces agrégats ne pas obéir à la loi de Hooke, comme ils le feraient si elles se comportaient comme des solides élastiques. Comme l'a démontré dans le tableau 1, le ratio de σ 2 / σ une approche en effet de 1,0. Par ailleurs, le ratio de F 2 / F 1 a été significativement plus importante que σ 2 / σ 1 (t-test apparié, p <0,05), confirmant que ces agrégats ne pas obéir à la loi de Hooke et en fait se comporter comme des liquides. En revanche RPSMCs obéi loi de Hooke. Comme on le voit dans le tableau 1, le ratio de σ 2 / σ 1 est significativement supérieure à 1 et n'était pas statistiquement différente de celle de F 2 / F 1. Pour démontrer davantage de liquide comme le comportement, nous avons exploré la relation entre la tension superficielle (σ) et au volume global. Comme on peut le voir dans la Fig. 8, le volume est indépendant de sigma pour les cellules du FPR (droite de régression rouge, r 2 = 0,002), alors qu'il semble y avoir une certaine dépendance de sigma sur le volume pour RPSMCs (droite de régression bleu, r 2 = 0,146). Ces données confirment en outre que les agrégats du FPR se comporter de manière liquide comme, alors que ceux de RPSMCs semblent se comporter davantage comme des solides élastiques. Seuls ceux obtenus à partir de mensurations agrégats se comporter comme des liquides serait utilisée pour calculer la tension de surface.

Figure 1. Aperçu du tensiomètre surface du tissu.

Figure 2. Une vue plus détaillée de la chambre de tensiomètre (à droite).
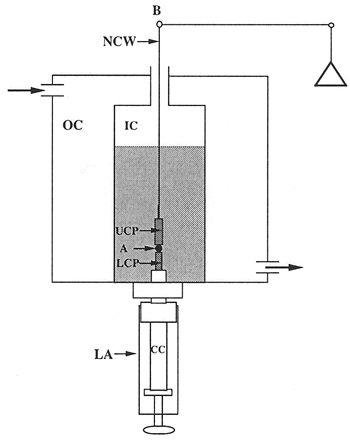
Figure 3. Vue schématique de la chambre de tensiomètre.

Figure 4. Images de non-compressé (A) et compressés (B) des agrégats.

Figure 5. L'équation de Laplace.
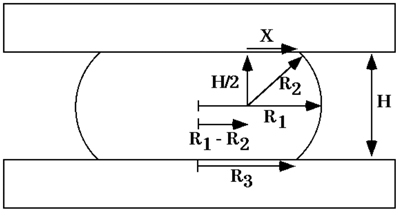
Figure 6. Schéma d'une gouttelette liquide comprimé entre deux plaques parallèles à laquelle il adhère mal, à l'équilibre forme. R 1 et R 2 sont les deux rayons de courbure principaux, à l'équateur de la goutte et dans un plan passant par son axe de symétrie, respectivement. R 3 est le rayon de la gouttelette zone circulaire de contact avec la plaque de compression soit. H est la distance entre les plaques de compression supérieurs et inférieurs. X est un côté d'un triangle rectangle avec R hypoténuse 2 s'étendant à un point de contact entre la surface de la goutte et la plaque de compression soit.
| σ 1 (dynes / cm ± SEM) | σ 2 (dynes / cm ± SEM) | Pσ 1 vs 2 σ | σ 1,2 (dynes / cm ± SEM) | σ 2 / σ 1 | F 2 / F 1 | Pσ 2 / σ 1 et F 2 F 1 | |
| FPR | 22,6 ± 1,7 | 22,9 ± 1,4 | > 0,05 * | 22,8 ± 1,1 | 1,04 ± 0,04 | 1,47 ± 0,06 | <0,05 |
| RPSMC | 15,0 ± 2,8 | 23,0 ± 3,2 | 0,039 | NA | 1,9 ± 0,3 | 1,6 ± 0,1 | 0,16 * |
Figure 7. Mesures TCT et la confirmation de la liquidité globale pour les agrégats de fibroblastes de la prostate de rat et les cellules musculaires lisses.
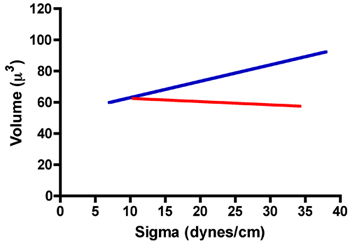
Figure 8. Relation entre sigma et le volume des agrégats du FPR (ligne rouge) et RPSMCs (ligne bleue).
Discussion
Mesure de la cohésion globale par TST est relativement simple. Il ya, cependant, les principales étapes qui doivent être maîtrisées afin de générer des données utilisables TST; 1) les agrégats doivent être "saine". Ceci peut être contrôlé en assurant que la formation d'agrégats commence avec les cellules qui sont à confluence optimale avant de détachement. La taille des agrégats et du temps dans la culture doit également être contrôlé pour minimiser le développement d'un noyau né...
Déclarations de divulgation
matériels
- l'eau du bain / agitateur (New Brunswick Scientific, Edison, NJ)
- 10 ml ballons à fond rond (Belco, Vineland, NJ)
Références
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Phys Rev Lett. 72, 2298-2301 (1994).
- Foty, R. A., Pfleger, C. M., Forgacs, G., Steinberg, M. S. Surface tensions of embryonic tissues predict their mutual envelopment behavior. Development. 122, 1611-1620 (1996).
- Schotz, E. -. M. Quantitative differences in tissue surface tension influence zebrafish germ layer positioning. HFSP Journal. 2, 42-56 (2008).
- Jia, D., Dajusta, D., Foty, R. A. Tissue surface tensions guide in vitro self-assembly of rodent pancreatic islet cells. Dev Dyn. 236, 2039-2049 (2007).
- Schwarz, M. A., Zheng, H., Legan, S., Foty, R. A. Lung Self-Assembly is Modulated by Tissue Surface Tensions. Am J Respir Cell Mol Biol. , (2010).
- Ryan, P. L., Foty, R. A., Kohn, J., Steinberg, M. S. Tissue spreading on implantable substrates is a competitive outcome of cell-cell vs. cell-substratum adhesivity. Proc Natl Acad Sci U S A. 98, 4323-4327 (2001).
- Foty, R. A., Steinberg, M. S. The differential adhesion hypothesis: a direct evaluation. Dev Biol. 278, 255-263 (2005).
- Robinson, E. E., Foty, R. A., Corbett, S. A. Fibronectin matrix assembly regulates alpha5beta1-mediated cell cohesion. Mol Biol Cell. 15, 973-981 (2004).
- Robinson, E. E., Zazzali, K. M., Corbett, S. A., Foty, R. A. alpha5beta1 integrin mediates strong tissue cohesion. J Cell Sci. 116, 377-386 (2003).
- Winters, B. S., Raj, B. K., Robinson, E. E., Foty, R. A., Corbett, S. A. Three-dimensional culture regulates Raf-1 expression to modulate fibronectin matrix assembly. Mol Biol Cell. 17, 3386-3396 (2006).
- Caicedo-Carvajal, C. E., Shinbrot, T., Foty, R. A. Alpha5beta1 integrin-fibronectin interactions specify liquid to solid phase transition of 3D cellular aggregates. PLoS One. 5, e11830-e11830 (2010).
- Foty, R. A., Steinberg, M. S. Measurement of tumor cell cohesion and suppression of invasion by E- or P-cadherin. Cancer Res. 57, 5033-5036 (1997).
- Foty, R. A., Corbett, S. A., Schwarzbauer, J. E., Steinberg, M. S. Dexamethasone up-regulates cadherin expression and cohesion of HT-1080 human fibrosarcoma cells. Cancer Res. 58, 3586-3589 (1998).
- Winters, B. S., Shepard, S. R., Foty, R. A. Biophysical measurement of brain tumor cohesion. Int J Cancer. 114, 371-379 (2005).
- Foty, R. A., Cummings, K. B., Ward, S. Tissue surface tensiometry: a novel technique for predicting invasive potential of prostate tumors based on tumor cell aggregate cohesivity in vitro. Surgical Forum L. , 707-708 (1999).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Physical Review Letters. 72, 2298-2301 (1994).
- Guevorkian, K., Colbert, M. J., Durth, M., Dufour, S., Brochard-Wyart, F. Aspiration of biological viscoelastic drops. Phys Rev Lett. 104, 218101-218101 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon