È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misura della coesione aggregata da parte del tessuto superficiale Tensiometry
In questo articolo
Riepilogo
Descriviamo un metodo di misurazione dell'energia di legame, esprimibile come la tensione superficiale dei tessuti, tra le cellule all'interno del tessuto 3D-come aggregati. Le differenze di tensione superficiale del tessuto hanno dimostrato di correlare con l'invasività del polmone, dei muscoli, e tumori al cervello, e sono determinanti fondamentali di stabilire relazioni spaziali tra i diversi tipi di cellule.
Abstract
Su misurazioni rigorose degli intercellulare energia di legame può essere effettuato solo con metodi fondati principi termodinamici in sistemi all'equilibrio. Abbiamo sviluppato superficie tensiometry tessuto (TST) specificamente per misurare l'energia libera della superficie di interazione tra le cellule. I concetti alla base biofisica TST sono stati precedentemente descritti in dettaglio 1,2. Il metodo si basa sull'osservazione che le cellule reciprocamente coesa, se mantenuta in agitazione cultura, si assemblano spontaneamente in cluster. Nel corso del tempo, questi cluster si completano a formare sfere. Questo arrotondamento comportamento simula il caratteristico comportamento dei sistemi liquidi. Intercellulare energia di legame è misurata comprimendo aggregati sferici tra piatti paralleli in un design personalizzato tensiometro tessuto superficiale. La stessa equazione matematico utilizzato per misurare la tensione superficiale di una goccia di liquido viene utilizzato per misurare la tensione superficiale del tessuto 3D-come aggregati sferici. L'equivalente cellulare della tensione superficiale liquido intercellulare energia di legame, o più in generale, cohesivity tessuti. Studi precedenti del nostro laboratorio hanno dimostrato che la tensione superficiale dei tessuti (1) predice come due gruppi di cellule embrionali potranno interagire tra loro 1-5, (2) può influenzare fortemente la capacità dei tessuti di interagire con biomateriali 6, (3) può essere modificato non solo attraverso la manipolazione diretta di caderina-based coesione intercellulare 7, ma anche per la manipolazione di molecole chiave ECM come FN 8-11 e 4) si correla con potenziale invasivo di cancro al polmone 12, fibrosarcoma 13, 14 e tumore al cervello tumore alla prostata linee cellulari 15. In questo articolo andremo a descrivere l', particolare dell'apparato i passaggi necessari per generare sferoidi, per caricare il sferoidi nella camera di tensiometro, di avviare la compressione aggregati, e per analizzare e convalidare le misure di tensione superficiale del tessuto generato.
Protocollo
1. Preparazione aggregato per la misura della tensione superficiale dei tessuti.
Per le cellule aderenti, sferoidi può essere formata utilizzando il metodo goccia o generando un foglio coerente di cellule che possono poi essere tagliato in frammenti di 1 mm.
Formazione di aggregati con il metodo goccia pendente:
- Quasi confluenti colture di cellule aderenti dovrebbe essere cresciuta al 90% di confluenza, monostrati dopo di che devono essere risciacquati due volte con PBS. Dopo aver svuotato bene, aggiungere 2 ml (per 100 piastre mm) del 0,05% tripsina-1 mM EDTA, e incubare a 37 ° C fino a staccare le cellule. Fermare tripsinizzazione aggiungendo 2 ml di terreno completo e delicatamente utilizzare un pipetta da 5 ml per triturare il composto fino a quando le cellule sono in sospensione. Trasferire le cellule in una provetta da 15 ml.
- Aggiungere 40 microlitri di una 10 mg / ml soluzione madre DNAsi e incubare per 5 minuti a temperatura ambiente. Vortex brevemente e centrifugare a 200 xg per 5 minuti.
- Gettare il surnatante e lavare pellet con 1 media tessuto completo cultura ml. Ripeto, poi risospendere le cellule in 2 ml di terreno completo coltura dei tessuti.
- Contare le cellule utilizzando un emocitometro o contatore di cellule automatizzati e regolare la concentrazione di 2,5 x 10 6 cellule / ml.
- Togliere il coperchio da un piatto tessuto 60 millimetri cultura e luogo 5 ml di PBS sul fondo del piatto. Questo fungerà da camera di idratazione.
- Invertire il coperchio e utilizzare una pipetta 20 microlitri di depositare 10 gocce microlitri sul fondo del coperchio. Assicurarsi che gocce sono posti sufficientemente distanziati in modo da non toccare. E 'possibile mettere almeno 20 gocce al piatto.
- Invertire il coperchio sulla PBS camera piena basso e incubare a 37 ° C / 5% di CO 2 / 95% di umidità, monitorare le gocce giornaliere e incubare fino a quando i fogli di cellule o aggregati si sono formati.
- Una volta forma fogli, essi possono essere trasferiti a fondo rotondo in vetro shaker palloni contenenti 3 ml di terreno completo e incubate in un bagno d'acqua agitazione a 37 ° C e 5% di CO 2 fino a formare sferoidi.
Formazione di aggregati con il metodo strato di cellule:
- Sospensioni singola cella sono preparato come descritto sopra, ma la concentrazione è regolata a 1x10 6 cellule / ml.
- Trasferire 3 ml di sospensione cellulare a 10 ml a fondo sferico (Belco, Vineland, New Jersey).
- Incubare fiaschi in un bagno d'acqua rotatorio / agitatore (New Brunswick Scientific, Edison, NJ) a 37 ° C, 5% di CO 2 per 4 ore a 120 rpm fino a quando le cellule recuperare tripsinizzazione.
- Trasferire le cellule in una provetta di vetro a fondo rotondo da centrifuga e centrifugare a 200 g in un sottile pellet. Incubare per altri 24 h fino a quando un foglio di forme coerente.
- Capovolgere delicatamente il tubo di cultura per rimuovere il foglio e versare il contenuto della provetta cultura in una piccola capsula di Petri sterile fibra di vetro.
- Usa bisturi micro per tagliare i fogli in frammenti di varie dimensioni.
- Incubare frammenti a 37 ° C sul bagnomaria rotatorio shaker a 120 rpm sotto il 5% di CO 2 per 2 o 3 giorni o fino a diventare sferica.
2. Misura della tensione superficiale aggregato
- Il tessuto tensiometro superficie. L'apparato è mostrato in fig. 1 e 2. La cella di compressione (Fig. 3) è composto da due camere. La camera esterna (OC) è collegato ad un 37 ° C acqua pompa di circolazione, e serve a regolare la temperatura della camera interna (IC). Le camere sono costruiti in Delrin fresato e contengono quarzo finestre per la visualizzazione dell'aggregato. Abbassare il montaggio (LA) viti nella base della camera interna ed è usato per 1) la posizione di aggregazione nella camera interna, 2) sigillare il fondo della camera interna, 3) elevare l'aggregato di avviare la compressione, e (4 ) controllare la distanza tra le placche parallele e quindi la compressione dell'aggregato. Il nucleo centrale (CC) del gruppo è regolabile. La punta del nucleo centrale (il piedistallo) è composto liscio Teflon e agisce come la piastra di compressione inferiore (LCP). La piastra di compressione superiore (UCP) è un cilindro in teflon 15mm che pende dal braccio della bilancia (B) da una fiamma raddrizzata filo nichel-cromo (NCW) *. Nel corso di un esperimento, l'aggregato di cellule (A) è posizionato sulla piastra inferiore e cresciuto finché non tocca la piastra superiore. La piastra superiore è collegato al braccio della bilancia (B). Compressione dell'aggregato cause spostamento del braccio della bilancia. L'equilibrio è un Cahn / Ventron modello 2000 electrobalance registrazione, che opera secondo il principio dell'equilibrio nullo. Il fulcro del braccio della bilancia ha un armatura all'interno di un campo magnetico permanente. Quando l'equilibrio è in funzione, si modula continuamente la corrente che passa attraverso l'assemblea elettromagnetiche, che a sua volta mantiene il braccio della bilancia in posizione orizzontale. Quando un oggetto è sospeso dal braccio della bilancia, la tensione, che l'equilibrio si applica a tenere il braccio nella horizoposizione ntale, è proporzionale al peso dell'oggetto. Questa tensione misura la forza esterna di compressione applicato al aggregata. La forma aggregata è monitorata mediante osservazione visiva attraverso una x 25 stereoscopio Nikon SMZ10A accoppiato ad un computer dotato di un frame grabber. Al fine di minimizzare l'adesione di aggregati cellulari alle piastre di compressione, sia le piastre di compressione inferiore e superiore sono stati rivestiti con poli (2-idrossietilmetacrilato) {poli (HEMA)}, un materiale polimerico a cui le cellule non aderiscono 16.
* Il filo è fiamma raddrizzata per impiccagione di 15 pollici di lunghezza del filo da uno stand storta e un piccolo clip di fissaggio raccoglitore fino alla fine. Un becco Bunsen è poi correre su e giù la lunghezza del filo fino a quando il filo si illumina di rosso. Il filo raddrizzato possono poi essere tagliati nella lunghezza appropriata. Un gancio piccolo è formato piegando il filo circa ¼ di pollice a partire dalla fine con due lame di rasoio. L'altra estremità viene quindi inserito nella canna della piastra di compressione inferiore. - Compressione aggregata.
- La camera interna è piena di pre-riscaldato CO 2-indipendente terreni di coltura (Gibco / BRL, NY).
- Aggregati di dimensioni variabili da circa 200-300 μ sono posizionati sulla piastra di compressione più basso (Fig. 4A). Aggregati sono caricati da aspirando un aggregato in terreni di coltura a metà strada la punta di una pipetta Pasteur dotata di un bulbo in silicone, trasferendo la pipetta alla camera interna, e il posizionamento della punta della pipetta al di sopra del LCP. L'aggregato è quindi delicatamente espulso sul LCP premendo delicatamente il bulbo. In alternativa, l'aggregato è lasciato cadere per gravità sul LCP.
- La piastra di compressione superiore (UCP) è posizionato sopra l'aggregato e il permesso di stabilirsi, che istituisce un pre-compressione apparente baseline peso UCP.
- Il LCP viene poi portata fino a quando l'aggregato viene compressa contro l'UCP (Fig. 4B). Regolare l'altezza del nucleo interno del dispositivo sarà inferiore di controllo diversi gradi di compressione. La compressione è monitorata attraverso l'osservazione attraverso un microscopio da dissezione dotato di una telecamera CCD.
- Immagini aggregato vengono catturati, digitalizzati e analizzati utilizzando ImageJ. Apparente variazione di peso UCP è continuamente registrati su un registratore a nastro di carta, la realizzazione di equilibrio forma sia indicata con il livellamento-off della tensione di uscita della bilancia Cahn. Ogni aggregato è sottoposto a 2 gradi diversi di compressione.
- Calcolo della tensione superficiale aggregato.
A forma di equilibrio, la cohesivity di un aggregato di cellule compressa tra piastre parallele a cui non aderisce possono essere ottenute presso il Young-Laplace l'equazione (Fig. 5), dove σ è cohesivity, F è la forza che agisce per comprimere l'aggregato , πr 3 2 è l'area della superficie dell'aggregato su cui viene esercitata forza F e R 2 e R 3 sono, rispettivamente, il raggio dell'equatore dell'aggregato compressi e il raggio di un arco definizione del suo profilo normale alla superficie alla compressione piatti e si estende tra loro (Fig. 6). Misurare la forza di compressione e geometria alla forza ed equilibrio la forma e l'applicazione di queste misure per la Young-Laplace equazione genera valori numerici della tensione apparente superficie del tessuto. Dopo aver raggiunto l'equilibrio e il calcolo di σ 1, aggregati vengono decompressi e ha permesso di avvicinare un equilibrio secondo e σ 2 è calcolato come sopra descritto. - Conferma di liquidità aggregata.
La tensione superficiale calcolato di un aggregato liquido, quando viene sottoposto a due diverse compressioni rimarrà costante. In tali aggregati il rapporto tra σ 2 / σ 1 sarà uguale a 1 e sarà inferiore al rapporto tra la forza applicata ad ogni compressione successive (F 2 / F 1). Al contrario, la tensione superficiale calcolato di un aggregato elastica obbedisce la legge di Hooke e aumentare proporzionalmente alla forza applicata. Per gli aggregati elastico il rapporto tra σ 2 / σ 1 non sarà uguale a 1, ma sarà invece l'approccio al rapporto di F 2 / F 1. La tensione superficiale del liquido aggregati anche essere indipendente dalle dimensioni aggregate 2,17. Misure unica in cui tensione superficiale è indipendente dalla forza applicata e le dimensioni vengono utilizzati per calcolare σ media per ciascuna linea cellulare.
3. Rappresentante dei risultati:
Di seguito una tabella di risultati TST tipici per aggregati di fibroblasti della prostata di ratto (RPF) e nel ratto cellule muscolari lisce della prostata (RPSMC). Come si può vedere in fig. 7 aggregati di cellule RPF hanno una tensione superficiale di 22,8 ± 1,1 dyne / cm. Inoltre, i valori medi di tensione superficiale misurati dopo la compressione 1 e dopo la compressione 2 erano statisticamente identiCal se confrontato con un paired t-test. Abbiamo anche confrontato i rapporti di σ 2 / σ 1 e F 2 / F 1 per assicurare che questi aggregati non obbedire alla legge di Hooke, come farebbero se si comportassero come solidi elastici. Come dimostrato nella tabella 1, il rapporto tra σ 2 / σ 1 in effetti l'approccio 1.0. Inoltre, il rapporto di F 2 / F 1 era significativamente maggiore di σ 2 / σ 1 (paired t-test, P <0,05), confermando che questi aggregati non obbedire alla legge di Hooke e di fatto si comportano come liquidi. In RPSMCs contrasto obbedito legge di Hooke. Come è evidente nella tabella 1, il rapporto tra σ 2 / σ 1 è significativamente maggiore di 1 e non era statisticamente differente da quello di F 2 / F 1. Per dimostrare ulteriormente a liquido come il comportamento, abbiamo esplorato la relazione tra tensione superficiale (σ) e al volume totale. Come si può vedere in fig. 8, il volume è indipendente dal sigma per le cellule RPF (linea di regressione rosso, r 2 = 0.002), mentre sembra che vi sia qualche dipendenza della sigma sul volume per RPSMCs (linea di regressione blu, r 2 = 0,146). Questi dati confermano ulteriormente che aggrega RPF si comportano in un liquido-come il modo, mentre quelli di RPSMCs sembrano comportarsi più come solidi elastici. Solo quelli Misure ottenute da aggregati comportarsi come liquidi sarebbe stato usato per calcolare la tensione superficiale.

Figura 1. Panoramica del tensiometro superficie del tessuto.

Figura 2. Una visione più dettagliata della camera tensiometro (pannello di destra).
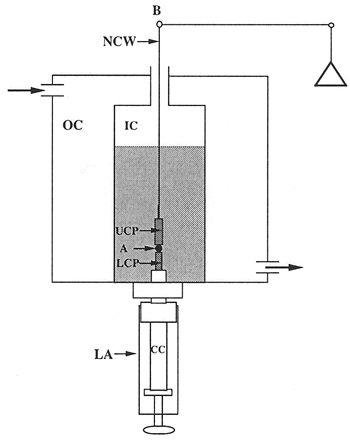
Figura 3. Schematica della camera di tensiometro.

Figura 4. Immagini di non compresso (A) e compresso (B) aggregati.

Figura 5. L'equazione di Laplace.
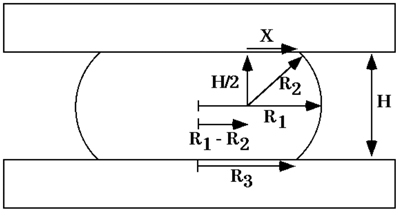
Figura 6. Schema di una goccia di liquido compresso tra due piastre parallele alla quale aderisce male, all'equilibrio della forma. R 1 e R 2 sono i due raggi principali di curvatura, all'equatore la goccia e in un piano che passa il suo asse di simmetria, rispettivamente. R 3 è il raggio della zona circolare la goccia di contatto sia con piastra di compressione. H è la distanza tra le piastre di compressione superiore e inferiore. X è un lato di un triangolo rettangolo con ipotenusa R 2 si estende ad un punto di contatto tra la superficie della goccia e sia la piastra di compressione.
| σ 1 (dyne / cm ± SEM) | σ 2 (dyne / cm ± SEM) | Pσ 1 vs 2 σ | σ 1,2 (dyne / cm ± SEM) | σ 2 / 1 σ | F 2 / F 1 | Pσ 2 / σ 1 e F 2 F 1 | |
| RPF | 22,6 ± 1,7 | 22,9 ± 1,4 | > 0,05 * | 22,8 ± 1,1 | 1,04 ± 0,04 | 1,47 ± 0,06 | <0,05 |
| RPSMC | 15,0 ± 2,8 | 23,0 ± 3,2 | 0,039 | NA | 1,9 ± 0,3 | 1,6 ± 0,1 | 0,16 * |
Figura 7. Misurazioni TST e la conferma di liquidità aggregata per aggregati di fibroblasti della prostata di ratto e cellule muscolari lisce.
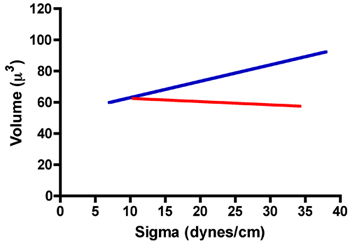
Figura 8. Relazione tra sigma e il volume degli aggregati di RPF (linea rossa) e RPSMCs (linea blu).
Discussione
Misurare la coesione aggregato da TST è relativamente semplice. Vi sono, tuttavia, passaggi chiave che deve essere padroneggiato al fine di generare dati TST utilizzabile; 1) aggregati deve essere "sano". Questo può essere controllato facendo in modo che la formazione di aggregati inizia con le cellule che sono alla confluenza ottimale prima di distacco. Formato aggregato e l'ora in cultura deve essere controllato anche a minimizzare lo sviluppo di un core necrotico all'interno dell'aggregato, 2)...
Divulgazioni
Materiali
- acqua bagno / agitatore (New Brunswick Scientific, Edison, NJ)
- 10 ml a fondo sferico (Belco, Vineland, NJ)
Riferimenti
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Phys Rev Lett. 72, 2298-2301 (1994).
- Foty, R. A., Pfleger, C. M., Forgacs, G., Steinberg, M. S. Surface tensions of embryonic tissues predict their mutual envelopment behavior. Development. 122, 1611-1620 (1996).
- Schotz, E. -. M. Quantitative differences in tissue surface tension influence zebrafish germ layer positioning. HFSP Journal. 2, 42-56 (2008).
- Jia, D., Dajusta, D., Foty, R. A. Tissue surface tensions guide in vitro self-assembly of rodent pancreatic islet cells. Dev Dyn. 236, 2039-2049 (2007).
- Schwarz, M. A., Zheng, H., Legan, S., Foty, R. A. Lung Self-Assembly is Modulated by Tissue Surface Tensions. Am J Respir Cell Mol Biol. , (2010).
- Ryan, P. L., Foty, R. A., Kohn, J., Steinberg, M. S. Tissue spreading on implantable substrates is a competitive outcome of cell-cell vs. cell-substratum adhesivity. Proc Natl Acad Sci U S A. 98, 4323-4327 (2001).
- Foty, R. A., Steinberg, M. S. The differential adhesion hypothesis: a direct evaluation. Dev Biol. 278, 255-263 (2005).
- Robinson, E. E., Foty, R. A., Corbett, S. A. Fibronectin matrix assembly regulates alpha5beta1-mediated cell cohesion. Mol Biol Cell. 15, 973-981 (2004).
- Robinson, E. E., Zazzali, K. M., Corbett, S. A., Foty, R. A. alpha5beta1 integrin mediates strong tissue cohesion. J Cell Sci. 116, 377-386 (2003).
- Winters, B. S., Raj, B. K., Robinson, E. E., Foty, R. A., Corbett, S. A. Three-dimensional culture regulates Raf-1 expression to modulate fibronectin matrix assembly. Mol Biol Cell. 17, 3386-3396 (2006).
- Caicedo-Carvajal, C. E., Shinbrot, T., Foty, R. A. Alpha5beta1 integrin-fibronectin interactions specify liquid to solid phase transition of 3D cellular aggregates. PLoS One. 5, e11830-e11830 (2010).
- Foty, R. A., Steinberg, M. S. Measurement of tumor cell cohesion and suppression of invasion by E- or P-cadherin. Cancer Res. 57, 5033-5036 (1997).
- Foty, R. A., Corbett, S. A., Schwarzbauer, J. E., Steinberg, M. S. Dexamethasone up-regulates cadherin expression and cohesion of HT-1080 human fibrosarcoma cells. Cancer Res. 58, 3586-3589 (1998).
- Winters, B. S., Shepard, S. R., Foty, R. A. Biophysical measurement of brain tumor cohesion. Int J Cancer. 114, 371-379 (2005).
- Foty, R. A., Cummings, K. B., Ward, S. Tissue surface tensiometry: a novel technique for predicting invasive potential of prostate tumors based on tumor cell aggregate cohesivity in vitro. Surgical Forum L. , 707-708 (1999).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Physical Review Letters. 72, 2298-2301 (1994).
- Guevorkian, K., Colbert, M. J., Durth, M., Dufour, S., Brochard-Wyart, F. Aspiration of biological viscoelastic drops. Phys Rev Lett. 104, 218101-218101 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon