É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição de Coesão agregados por tensiometria superfície do tecido
Resumo
Nós descrevemos um método de medir energia de ligação, expressável como tensão superficial do tecido, entre as células dentro do tecido 3D-como agregados. Diferenças na tensão superficial do tecido têm demonstrado correlação com invasão do pulmão, músculos e tumores cerebrais, e são determinantes fundamentais de estabelecer relações espaciais entre diferentes tipos celulares.
Resumo
Medição rigorosa de energia de ligação intercelular só pode ser feita através de métodos baseados em princípios termodinâmicos em sistemas em equilíbrio. Nós desenvolvemos tensiometria tecido da superfície (TST) especificamente para medir a energia livre de superfície de interação entre as células. Os conceitos biofísicos subjacentes TST têm sido descritos anteriormente em 1,2 detalhe. O método é baseado na observação de que células mutuamente coesa, se mantida em agitação cultura, espontaneamente montar em clusters. Ao longo do tempo, esses grupos irão arredondar para cima para formar as esferas. Este comportamento arredondamento imita o comportamento característico de sistemas líquidos. Energia de ligação intercelular é medido através da compressão agregados esférico entre placas paralelas em um tensiômetro de superfície de design personalizado tecido. A mesma equação matemática usada para medir a tensão superficial de uma gota de líquido é usado para medir a tensão superficial do tecido 3D-como agregados esféricos. O equivalente celular de tensão superficial líquido é energia de ligação intercelular, ou, mais geralmente coesividade tecidos,. Estudos anteriores de nosso laboratório mostraram que a tensão de superfície de tecido (1) prevê como dois grupos de células embrionárias vão interagir uns com os outros 1-5, (2) pode influenciar fortemente a capacidade dos tecidos para interagir com biomateriais 6, (3) pode ser alterada, não só através da manipulação direta da caderina-base da coesão intercelular 7, mas também pela manipulação de moléculas-chave ECM, como FN 11/08 e 4) se correlaciona com o potencial invasivo de câncer de pulmão 12, 13 fibrossarcoma, tumor cerebral 14 e tumor de próstata linhagens de células 15. Neste artigo vamos descrever o aparelho detalhe, os passos necessários para gerar esferóides, para carregar o esferóides na câmara de tensiômetro, para iniciar a compressão agregado, e analisar e validar as medições de superfície de tecido tensão gerada.
Protocolo
1. Preparação agregado para a medição da tensão superficial do tecido.
Para células aderentes, esferóides podem ser formadas usando o método da gota pendente ou através da geração de uma folha coerente de células que podem então ser cortada em fragmentos 1 mm.
Formação de agregados pelo método de gota em suspensão:
- Quase confluentes culturas de células aderentes devem ser cultivadas a confluência de 90%, quando então monocamadas devem ser lavados duas vezes com PBS. Depois de drenar bem, adicionar 2 ml (para 100 placas mm) de 0,05% de tripsina-EDTA 1 mM, e incubar a 37 ° C até que as células detach. Parar tripsinização adicionando 2 ml de meio completo e gentilmente usar uma pipeta de 5 ml para triturar a mistura até que as células estão em suspensão. Transferência de células para um tubo de 15 ml.
- Adicionar 40 mL da solução estoque a 10 mg / ml DNAse e incubar por 5 minutos em temperatura ambiente. Brevemente Vortex e centrifugar a 200 xg por 5 minutos.
- Elimine o sobrenadante e lavar pellet com 1 ml completa meio de cultura de tecidos. Repita, então as células ressuspender em 2 ml de meio completo de cultura de tecidos.
- Contar as células usando um hemocitômetro, ou contador de células automatizado e ajustar a concentração para 2,5 x 10 6 células / ml.
- Remova a tampa de um prato de 60 milímetros de cultura de tecidos e coloque 5 ml de PBS no fundo do prato. Este funcionará como uma câmara de hidratação.
- Inverter a tampa e use uma pipeta de 20 l para depositar 10 gotas mL para o fundo da tampa. Certifique-se que gotas são colocadas suficientemente distante para não tocar. É possível colocar pelo menos 20 gotas por prato.
- Inverter a tampa do PBS-cheia câmara inferior e incubar a 37 ° CO C / 5% 2 / 95% de umidade, monitorar as gotas diárias e incubar até folhas ou células ou agregados formaram.
- Uma vez que formam folhas, podem ser transferidos para fundo redondo de vidro shaker frascos contendo 3 ml de meio completo e incubados em um agitador banho maria a 37 ° C e 5% CO 2 até formar esferóides.
Formação de agregados pelo método de camada de células:
- Suspensões de células individuais são preparadas como descrito acima, mas a concentração é ajustada para 1x10 6 células / ml.
- Transferência de 3 ml de suspensão de células de 10 ml de fundo redondo de balões (Belco, Vineland, NJ).
- Incubar frascos em um banho de água giratórios / agitador (New Brunswick Scientific, Edison, NJ) a 37 ° C, 5% de CO 2 para 4h de 120 rpm até que as células se recuperar de tripsinização.
- Transferência de células para um tubo de centrífuga de vidro de fundo redondo e centrifugar a 200 X g em um pellet fina. Incubar por mais 24 h até formar uma folha coerente.
- Agite suavemente o tubo de cultura para desalojar a folha e despejar o conteúdo do tubo de cultura em um pequeno prato de vidro estéril, cultura de tecidos.
- Use micro bisturis para cortar as folhas em fragmentos de vários tamanhos.
- Incubar fragmentos a 37 ° C no banho de água giratórios shaker a 120 rpm com menos de 5% CO 2 por 2 a 3 dias ou até que se tornem esféricos.
2. Medição da tensão superficial agregado
- O tensiômetro superfície do tecido. O aparelho é mostrado nas Figs. 1 e 2. A célula de compressão (Fig. 3) é composto por duas câmaras. A câmara externa (OC) é conectado a uma bomba de 37 ° C água circulante, e serve para regular a temperatura da câmara interna (CI). As câmaras são construídas de Delrin moído e conter janelas de quartzo para a visualização do agregado. Quanto menor a montagem (LA) parafusos na base da câmara interna e é utilizada para: 1) a posição do agregado na câmara interna; 2) selar o fundo da câmara interna; 3) elevar o total para iniciar a compressão e (4 ) controlar a distância entre as placas paralelas e, portanto, a compressão do agregado. O núcleo central (CC) do conjunto é ajustável. A ponta do núcleo central (o pedestal) é composto de Teflon liso e atua como a placa de compressão mais baixa (LCP). A placa de compressão superior (UCP) é um cilindro de teflon 15 milímetros de comprimento que trava do braço de equilíbrio (B) por uma chama-se endireitou fio de níquel-cromo (NCW) *. Durante o curso de um experimento, o agregado de células (A) está posicionada na parte inferior do prato e levantou até que os contatos da placa superior. A placa superior está ligado ao braço de equilíbrio (B). Compressão do agregado causas deslocamento do braço equilíbrio. A balança é um Cahn / Ventron modelo electrobalance gravação de 2000, que opera no princípio de equilíbrio nulo. O fulcro do braço equilíbrio tem uma armadura dentro de um campo magnético permanente. Quando o saldo está operando, continuamente modula a corrente que passa através do conjunto eletromagnético, que por sua vez mantém o braço de equilíbrio na posição horizontal. Quando um objeto é suspenso a partir do braço de equilíbrio, a tensão, que se aplica o equilíbrio para manter o braço na horizoposição ntal, é proporcional ao peso do objeto. Esta tensão mede a força externa aplicada a compressão do agregado. Forma da agregação é monitorado por observação visual através de um estereoscópio Nikon x 25 SMZ10A acoplado a um computador equipado com uma placa de captura. A fim de minimizar a adesão de agregados celulares para as placas de compressão, ambas as placas de compressão inferior e superior foram revestidos com poli (2-hydroxyethylmethacrylate) {poli (HEMA)}, um material polimérico a que as células não aderem 16.
* O fio é chama-se endireitou por enforcamento um comprimento de 15 polegadas de fio a partir de uma posição de aperto retorta e um clipe de binder pequeno até o fim. Um bico de Bunsen é, então, corra para cima e para baixo o comprimento do fio até o fio de luz vermelha. O fio esticado pode então ser cortada em comprimentos apropriados. Um pequeno gancho é formado por dobrar o fio cerca de ¼ de polegada a partir do final usando duas lâminas de barbear. A outra extremidade é então inserido no cano da placa de compressão mais baixa. - Compressão agregado.
- A câmara interior é preenchido com pré-aquecido CO 2-meio de cultura independente do tecido (Gibco / BRL, NY).
- Agregados variando em tamanho de cerca de 200-300 μ são posicionados na placa de compressão mais baixa (Fig. 4A). Agregados são carregados por um agregado de aspiração em meio de cultura de tecidos metade do caminho até a ponta de uma pipeta Pasteur equipado com uma lâmpada de silicone, transferindo a pipeta para a câmara interior, eo posicionamento da ponta da pipeta sobre a LCP. O agregado é então gentilmente expulsos para o LCP, pressionando ligeiramente o bulbo. Alternativamente, o agregado é permitida a cair por gravidade para a LCP.
- A placa de compressão superior (UCP) está posicionado acima do agregado e deixado em repouso, estabelecendo uma linha de base pré-compressão peso aparente UCP.
- A LCP é então levantado até que a soma é comprimida contra a UCP (Fig. 4B). Ajustar a altura do núcleo interno da parte inferior do aparelho irá controlar diferentes graus de compressão. Compressão é monitorada pela observação através de um microscópio de dissecação equipado com uma câmera de vídeo CCD.
- Imagens agregada são capturados, digitalizados e analisados utilizando ImageJ. Mudança de peso aparente UCP é continuamente gravadas em um registador de agulhas, a realização de equilíbrio de forma a ser indicada pelo nivelamento da tensão de saída da balança Cahn. Cada agregado é submetido a dois diferentes graus de compressão.
- Cálculo da tensão superficial agregado.
No equilíbrio, forma a coesividade de um agregado de células comprimido entre placas paralelas a que não adere podem ser obtidas a partir da equação de Young-Laplace (Fig. 5), onde σ é coesividade, F é a força que age para comprimir o agregado , πr 3 2 é a área da superfície do agregado em que F força é exercida, e R 2 e R 3 são, respectivamente, o raio do equador do agregado comprimido eo raio de um arco definir seu perfil de superfície normal para a compressão de placas e estendendo entre eles (Fig. 6). Medir a força de compressão e da geometria com força e equilíbrio de forma e aplicar essas medidas para a equação de Young-Laplace gera valores numéricos de tensão aparente tecido da superfície. Ao atingir o equilíbrio e cálculo de σ 1, os agregados são descompactados e permitiu a abordagem de um equilíbrio de segundo e σ 2 é calculado conforme descrito acima. - Confirmação da liquidez agregada.
A tensão superficial calculada de um agregado líquido, quando submetido a duas compressões diferentes permanecerá constante. Em tais agregados a relação entre σ 2 / σ 1 será igual a 1 e será menor do que a razão entre a força aplicada em cada compressão sucessivas (F 2 / F 1). Em contraste, a tensão superficial calculada de um agregado elástica vai obedecer à lei de Hooke e aumentar proporcionalmente à força aplicada. Para os agregados elástica a relação entre σ 2 / σ 1 não será igual a 1, mas em vez disso, a abordagem da relação de F 2 / F 1. A tensão superficial dos agregados líquidos também será independente do tamanho total 2,17. Medições apenas em que a tensão de superfície é independente da força aplicada e tamanho são usados para calcular σ média para cada linhagem celular.
3. Resultados representativos:
Abaixo está uma tabela de resultados TST típicos para agregados de fibroblastos de rato próstata (RPF) e próstata de ratos células musculares lisas (RPSMC). Como pode ser visto na fig. 7 agregados de células RPF tem uma tensão superficial de 22,8 ± 1,1 dinas / cm. Além disso, os valores de temperatura média tensão medida após a compactação 1 e após a compressão 2 foram estatisticamente identical, quando comparados por um teste t pareado. Também comparamos os índices de σ 2 / σ 1 e F 2 / F 1 para garantir que estes agregados não obedeceu a lei de Hooke, como fariam se eles se comportaram como sólidos elásticos. Conforme demonstrado na Tabela 1, a proporção de σ 2 / σ uma abordagem realmente 1.0. Além disso, a proporção de F 2 / F 1 foi significativamente maior que σ 2 / σ 1 (teste t pareado, P <0,05), confirmando que estes agregados não obedecem a lei de Hooke e de fato se comportam como líquidos. Em contraste RPSMCs obedeceu a lei de Hooke. Como é evidente na Tabela 1, a relação entre σ 2 / σ 1 é significativamente maior que 1 e não foi estatisticamente diferente do que a de F 2 / F 1. Para demonstrar ainda mais líquido como o comportamento, que explorou a relação entre a tensão superficial (σ) e volume agregado. Como pode ser visto na fig. 8 de volume é independente do sigma para células RPF (linha de regressão vermelho, r 2 = 0,002), enquanto parece haver alguma dependência da sigma no volume de RPSMCs (linha de regressão azul, r 2 = 0,146). Estes dados confirmam que agrega RPF se comportam de maneira semelhante líquido, enquanto que os de RPSMCs parecem se comportar mais como sólidos elásticos. Somente aqueles obtidos a partir de agregados mesurements comportando-se como líquidos seriam usados para calcular a tensão superficial.

Figura 1. Visão geral do tensiômetro superfície do tecido.

Figura 2. Uma visão mais detalhada da câmara de tensiômetro (painel direito).
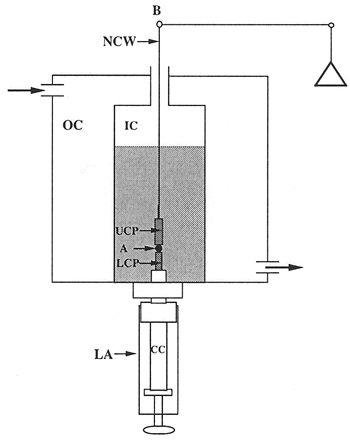
Figura 3. Visão esquemática da câmara de tensiômetro.

Figura 4. Imagens de descompactado (A) e comprimido (B) agregados.

Figura 5. A Equação de Laplace.
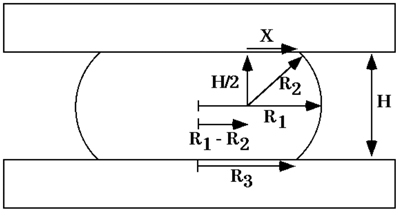
Figura 6. Diagrama de uma gota de líquido comprimido entre duas placas paralelas a que adere mal, em equilíbrio forma. R 1 e R 2 são os dois raios de curvatura principal, no equador da gota e em um plano através do seu eixo de simetria, respectivamente. R 3 é o raio da área circular a gota de contato com qualquer placa de compressão. H é a distância entre as placas de compressão superior e inferior. X é um lado de um triângulo retângulo com hipotenusa R 2 estendendo-se até um ponto de contato entre a superfície da gota e nem placa de compressão.
| σ 1 (dinas / cm ± SEM) | σ 2 (dinas / cm ± SEM) | Pσ 1 vs 2 σ | σ 1,2 (dinas / cm ± SEM) | σ 2 / σ 1 | F 2 / F 1 | Pσ 2 / σ 1 e F 2 F 1 | |
| RPF | 22,6 ± 1,7 | 22,9 ± 1,4 | > 0,05 * | 22,8 ± 1,1 | 1,04 ± 0,04 | 1,47 ± 0,06 | <0,05 |
| RPSMC | 15,0 ± 2,8 | 23,0 ± 3,2 | 0,039 | NA | 1,9 ± 0,3 | 1,6 ± 0,1 | 0,16 * |
Figura 7. Medições TST e confirmação de liquidez agregada para agregados de fibroblastos de rato próstata e células musculares lisas.
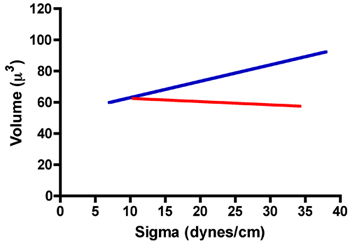
Figura 8. Relação entre sigma e volume de agregados de RPF (linha vermelha) e RPSMCs (linha azul).
Discussão
Medir a coesão agregado pelo TST é relativamente simples. Há, no entanto, passos-chave que devem ser dominados, a fim de gerar dados TST utilizável; 1) agregados deve ser "saudável". Isto pode ser controlado, garantindo que a formação de agregados começa com as células que estão na confluência ideal antes de desapego. Tamanho agregado eo tempo na cultura também deve ser controlado para minimizar o desenvolvimento de um núcleo necrótico dentro do agregado; 2) Outro parâmetro que pode influenciar ...
Divulgações
Materiais
- água do banho / agitador (New Brunswick Scientific, Edison, NJ)
- 10 ml de fundo redondo de balões (Belco, Vineland, NJ)
Referências
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Phys Rev Lett. 72, 2298-2301 (1994).
- Foty, R. A., Pfleger, C. M., Forgacs, G., Steinberg, M. S. Surface tensions of embryonic tissues predict their mutual envelopment behavior. Development. 122, 1611-1620 (1996).
- Schotz, E. -. M. Quantitative differences in tissue surface tension influence zebrafish germ layer positioning. HFSP Journal. 2, 42-56 (2008).
- Jia, D., Dajusta, D., Foty, R. A. Tissue surface tensions guide in vitro self-assembly of rodent pancreatic islet cells. Dev Dyn. 236, 2039-2049 (2007).
- Schwarz, M. A., Zheng, H., Legan, S., Foty, R. A. Lung Self-Assembly is Modulated by Tissue Surface Tensions. Am J Respir Cell Mol Biol. , (2010).
- Ryan, P. L., Foty, R. A., Kohn, J., Steinberg, M. S. Tissue spreading on implantable substrates is a competitive outcome of cell-cell vs. cell-substratum adhesivity. Proc Natl Acad Sci U S A. 98, 4323-4327 (2001).
- Foty, R. A., Steinberg, M. S. The differential adhesion hypothesis: a direct evaluation. Dev Biol. 278, 255-263 (2005).
- Robinson, E. E., Foty, R. A., Corbett, S. A. Fibronectin matrix assembly regulates alpha5beta1-mediated cell cohesion. Mol Biol Cell. 15, 973-981 (2004).
- Robinson, E. E., Zazzali, K. M., Corbett, S. A., Foty, R. A. alpha5beta1 integrin mediates strong tissue cohesion. J Cell Sci. 116, 377-386 (2003).
- Winters, B. S., Raj, B. K., Robinson, E. E., Foty, R. A., Corbett, S. A. Three-dimensional culture regulates Raf-1 expression to modulate fibronectin matrix assembly. Mol Biol Cell. 17, 3386-3396 (2006).
- Caicedo-Carvajal, C. E., Shinbrot, T., Foty, R. A. Alpha5beta1 integrin-fibronectin interactions specify liquid to solid phase transition of 3D cellular aggregates. PLoS One. 5, e11830-e11830 (2010).
- Foty, R. A., Steinberg, M. S. Measurement of tumor cell cohesion and suppression of invasion by E- or P-cadherin. Cancer Res. 57, 5033-5036 (1997).
- Foty, R. A., Corbett, S. A., Schwarzbauer, J. E., Steinberg, M. S. Dexamethasone up-regulates cadherin expression and cohesion of HT-1080 human fibrosarcoma cells. Cancer Res. 58, 3586-3589 (1998).
- Winters, B. S., Shepard, S. R., Foty, R. A. Biophysical measurement of brain tumor cohesion. Int J Cancer. 114, 371-379 (2005).
- Foty, R. A., Cummings, K. B., Ward, S. Tissue surface tensiometry: a novel technique for predicting invasive potential of prostate tumors based on tumor cell aggregate cohesivity in vitro. Surgical Forum L. , 707-708 (1999).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Foty, R. A., Forgacs, G., Pfleger, C. M., Steinberg, M. S. Liquid properties of embryonic tissues: Measurement of interfacial tensions. Physical Review Letters. 72, 2298-2301 (1994).
- Guevorkian, K., Colbert, M. J., Durth, M., Dufour, S., Brochard-Wyart, F. Aspiration of biological viscoelastic drops. Phys Rev Lett. 104, 218101-218101 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados