このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
原子間力顕微鏡によるイメージングのための細菌の固定化
要約
住んでいるグラム陰性およびグラム陽性細菌は、ゼラチンコートしたマイカ上に固定し、原子間力顕微鏡(AFM)を用いて液体中に撮像することができます。
要約
AFMは、イメージングツールを機械的プローブ表面の高分解能(ナノスケール)です。それは化学的にサンプルを治療することなく、液体環境では、画像セルと生体分子への能力を持っています。この目標を達成するために、サンプルが十分にスキャンAFMのカンチレバーの先端によって加えられる力によって除去を防ぐために、取り付け面に付着する必要があります。多くの例では、成功した画像は、取付面へのサンプルの固定化に依存します。最適に、固定化は、代謝プロセスと機能的な属性が損なわれないように、サンプルへの低侵襲である必要があります。ブタ(豚)、ゼラチンでコーティングしたばかりの劈開マイカの表面によって、負に帯電した細菌が表面に固定化することができるとAFMによる液中に撮像。ゼラチン被覆マイカ上の細菌の細胞の固定化は、負に帯電した細菌と正に帯電したゼラチンの間の静電相互作用に起因する可能性が最も高いです。いくつかの要因は、細菌が中断されている液体の化学成分、ゼラチンコートされたマイカ上の細菌の培養時間、菌株や菌がイメージングされる媒体の表面特性を含む細菌の固定化、妨げになることがあります。全体的に、ゼラチンコートされたマイカの使用は、イメージングの微生物細胞のための一般的に適用可能であることが判明した。
プロトコル
1。マイカの準備:
- AFM顕微鏡(約22 × 30 mm)を合わせて必要なサイズにハサミでマイカを(電子顕微鏡の科学)カット。
- 唯一の滑らかな連続した層が残るまで、外側の層を除去するためにテープを使用して、一般的に開裂し、両側のマイカ、。
2。ゼラチン溶液の調製:
- 実験室の瓶に100mlの蒸留水を追加。
- 水が沸騰し始めるまで電子レンジでボトルを加熱する。 (電子レンジが使用できない場合は、水をホットプレート上でビーカーで加熱することができます。)
- ゼラチン0.5グラム(シグマG - 6144、G - 2625またはG - 2500)を秤量し、熱い蒸留水に加える。
- ゆっくりとゼラチンになるまで渦巻き瓶が完全に溶解されています。
- 60から70℃にゼラチン溶液を冷却
- カット切断されたマイカを浸漬することが可能な小型のビーカー(20ml)に約15 mLを注ぐ。
3。マイカ塗装:
- 温めたゼラチン溶液に浸すマイカの正方形をしてマイカが(図1a)コーティングであることがすぐにそのような撤回。
- コーティング後は、(図1b)周囲の空気中で乾燥するためにペーパータオルで、エッジで、すぐにマイカをサポートしています。ゼラチン被覆マイカは、少なくとも2週間に使用することができます。過剰ゼラチン溶液は冷蔵保管し、単純に60から70℃の間にストック溶液を加熱によって約ヶ月間使用できます。ケアは、ゼラチンが再加熱時に沸騰されないように注意する必要があります。
4。ゼラチンコートされたマイカの取り付け細菌:
- 800〜4500 rcfで - 細菌培養物のペレットを1 mLの(600nmで1.0 OD 0.5)。細菌によっては、最小のRCFを使用しているペレットは〜5分で細胞なります。
- フィルタ処理された脱イオン水または緩衝液の同量でペレットを洗浄します。
- 遠心分離によって再び細胞を回収。
- nanopure脱イオン水または緩衝液の500μLで速やかにペレットを再懸濁する。 (細菌懸濁液が目に見えてAFMイメージングのための細胞の適切な濃度を得るために濁ってしてください。)
- ピペットチップ(図1c)を使用して表面にゼラチン被覆マイカと拡散して細胞懸濁液(10〜20μL)を適用します。ケアは、菌液を適用したり、拡散しながら物理的にピペットの先端をゼラチン表面に触れないように注意してください。
- 表面は10分間休ませ、水または緩衝液(図1 CD)のストリームでリンスすることができます。手順では、サンプルが乾燥して許可されていないことを保証するように注意してください。
5。代表的な結果:
図2は、ゼラチン被覆マイカ上でマウントされており、AFMによって画像化された細菌細胞の例の画像を示す。我々の研究室では、サンプルは一般的に100μmの走査ヘッドを装備したPicoPlus原子間力顕微鏡を(アジレントテクノロジー、寺院、アリゾナ州)を用いて撮像される。楽器は、0.5から1.0行/秒の走査速度でラインスキャン当たり128から512ピクセルで運営されています一般的に使用されるカンチレバーは、0.01〜0.1 NN / nmの範囲の公称ばね定数とVeeco社の窒化シリコンプローブ(MLCT - AUHW、Veeco社、サンタバーバラ、カリフォルニア州)です。

図1。60〜70 ° C、20 mlのビーカーに入れているの温度でゼラチン。ピンセットを使用すると、新鮮な劈開マイカの正方形は、完全にマイクロ遠心ラック(B)にもたれてペーパータオルの上に直立撤回し、配置された()ゼラチン中に浸漬されています。細菌サンプルの液滴は、XとY方向(c)の両方のピペットチップマイカと拡散に配置されます。サンプルは、少なくとも10分間雲母表面にインキュベートさせた後、蒸留水の流れでサンプルをすすいでください。固定化がうまくいったら(d)の右パネルに示すように雲母に不透明な点を見ることができます。固定化が成功しなかった場合には、左側のパネルのように雲母の明確な部分を取得します。ゼラチン扱わマイカ上に置かれた液滴の細菌の濃度にマイカスケール上の不透明なスポット。
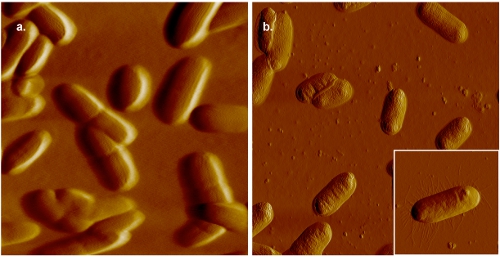
E.の図2。AFM像大腸菌 。パネル()で、細胞をゼラチンコートしたマイカ上にマウントされ、0.005 M PBSで画像化。比較のために、ゼラチンコートされたマイカ上に実装し、空中で結像される細菌細胞の画像は、パネル(b)に示されています。セプタムは、液体中に収集された画像ではっきりと表示されますが、のような毛の存在(挿入図(b))で示される以上の解像度は、、空気中で得ることができます。
ディスカッション
様々な要因がAFMによる微生物取付けセルおよびイメージングに影響を与える可能性があります。コーティングのために使用されるゼラチンは、雲母が重要です。商業用ゼラチンは、魚、牛、そして豚を含む脊椎動物の数から絶縁されています。起源と処理方法はどちらも細菌の固定化のためのゼラチンの適合性を決定する。多数の情報源とゼラチンのタイプは固定細菌で、その有効性を?...
開示事項
利害の衝突は宣言されません。
謝辞
この研究は、生物環境研究局、米国エネルギー省のとバージニア州の連邦保健研究委員会からの助成金によって後援される。オークリッジ国立研究所は、契約番号DE - AC05 - 00OR22725下で米国エネルギー省のためにUT - Battelle氏、LLCによって管理されます。
資料
| Name | Company | Catalog Number | Comments |
| の名前 | 会社 | カタログ番号 | |
| ゼラチン | シグマ、セントルイス、MO | G6144、G2625やG2500 | |
| PicoPlus原子間力顕微鏡 | アジレントテクノロジー、テンペ、アリゾナ州 | ||
| AFMのカンチレバー | Veeco社、サンタバーバラ、カリフォルニア州 | MLCT - AUHW |
参考文献
- Bernal, R., Pullarkat, P. A. Mechanical properties of axons. Phys Rev Lett. 99, 018301-018301 (2007).
- Bray, D. Axonal growth in response to experimentally applied mechanical tension. Dev Biol. 102, 379-389 (1984).
- Chetta, J., Kye, C. Cytoskeletal dynamics in response to tensile loading of mammalian axons. Cytoskeleton (Hoboken). 67, 650-665 (2010).
- Dennerll, T. J., Lamoureux, P. The cytomechanics of axonal elongation and retraction. J Cell Biol. 109, 3073-3083 (1989).
- Fu, S. Y., Gordon, T. The cellular and molecular basis of peripheral nerve regeneration. Mol Neurobiol. 14, 1-2 (1997).
- Gray, C., Hukkanen, M. Rapid neural growth: calcitonin gene-related peptide and substance P- containing nerves attain exceptional growth rates in regenerating deer antler. Neuroscience. 50, 953-963 (1992).
- Heidemann, S. R., Buxbaum, R. E. Tension as a regulator and integrator of axonal growth. Cell Motil Cytoskeleton. 17, 6-10 (1990).
- Heidemann, S. R., Buxbaum, R. E. Mechanical tension as a regulator of axonal development. Neurotoxicology. 15, 95-107 (1994).
- Heidemann, S. R., Lamoureux, P. Cytomechanics of axonal development. Cell Biochem Biophys. 27, 135-155 (1995).
- Iwata, A., Browne, K. D. Long-term survival and outgrowth of mechanically engineered nervous tissue constructs implanted into spinal cord lesions. Tissue Eng. 12, 101-110 (2006).
- Lamoureux, P., Heidemann, S. R. Growth and elongation within and along the axon. Dev Neurobiol. 70, 135-149 (2010).
- Lamoureux, P., Zheng, J. A cytomechanical investigation of neurite growth on different culture surfaces. J Cell Biol. 118, 655-661 (1992).
- Lindqvist, N., Liu, Q. Retinal glial (Muller) cells: sensing and responding to tissue stretch. Invest Ophthalmol Vis Sci. 51, 1683-1690 (2010).
- Loverde, J. R., Ozoka, V. C. Live Imaging of Axon Stretch Growth in Embryonic and Adult Neurons. J. Neurotrauma. , (2011).
- Lu, Y. B., Franze, K. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci U S A. 103, 17759-17764 (2006).
- O'Toole, M., Lamoureux, P. A physical model of axonal elongation: force, viscosity, and adhesions govern the mode of outgrowth. Biophys J. 94, 2610-2620 (2008).
- Pfister, B. J., Bonislawski, D. P. Stretch-grown axons retain the ability to transmit active electrical signals. FEBS Lett. 580, 3525-3531 (2006).
- Pfister, B. J., Gordon, T. Biomedical Engineering Strategies for Peripheral Nerve Repair: Surgical Applications, State of the Art, and Future Challenges. Crit Rev Biomed Eng. 39, 81-124 (2011).
- Pfister, B. J., Iwata, A. Extreme stretch growth of integrated axons. J Neurosci. 24, 7978-7983 (2004).
- Pfister, B. J., Iwata, A. Development of transplantable nervous tissue constructs comprised of stretch-grown axons. J Neurosci Methods. 153, 95-103 (2006).
- Siechen, S., Yang, S. Mechanical tension contributes to clustering of neurotransmitter vesicles at presynaptic terminals. Proc Natl Acad Sci U S A. 106, 12611-12616 (2009).
- Smith, D. H. Stretch growth of integrated axon tracts: extremes and exploitations. Prog Neurobiol. 89, 231-239 (2009).
- Smith, D. H., Wolf, J. A. A new strategy to produce sustained growth of central nervous system axons: continuous mechanical tension. Tissue Eng. 7, 131-139 (2001).
- Weiss, P. Nerve patterns: The mechanics of nerve growth. Growth, Third Growth Symposium. 5, 163-203 (1941).
- Zheng, J., Lamoureux, P. Tensile regulation of axonal elongation and initiation. J Neurosci. 11, 1117-1125 (1991).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved