JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
원자 힘 현미경에 의해 영상에 대한 세균 고정
요약
라이브 그람 음성 및 그람 양성 세균은 젤라틴 코팅 운모에 고정화 및 원자 힘 현미경 (AFM)을 사용하여 액체에 몇 군데 있습니다.
초록
AFM은 이미징 도구를 기계적으로 프로브 표면 고해상도 (NM 규모)입니다. 그것은 화학 샘플을 치료하기 위해 필요없이, 액체 환경에서, 이미지 세포 biomolecules 수있는 능력이 있습니다. 이러한 목표를 달성하기 위해 예제는 충분히 스캔 AFM의 캔틸레버 팁 의해 끼쳤다 힘에 의해 제거를 방지하기 위해 장착 표면을 준수해야합니다. 많은 경우에, 성공적인 영상이 장착 표면에 시료의 고정에 따라 달라집니다. 최적 고정은 신진 대사 프로세스와 기능 특성이 손상되지 않습니다 같은 샘플을 법으로서해야합니다. 돼지의 (돼지) 젤라틴과 코팅 갓 죽습 운모 표면에 의해 부정 청구 박테리아가 표면에 고정화 수 있으며 AFM에 의해 액체에 몇 군데. 젤라틴 - 코팅 운모에 세균 세포의 고정은 부정 청구 세균과 긍정적인 혐의 젤라틴 사이의 정전 기적 상호 작용에 의한 가능성이 높습니다. 여러 가지 요인은 박테리아가 일시 중지되는 액체, 세균 긴장과 세균이 몇 군데있는 매체의 젤라틴 코팅 운모, 표면 특성에 박테리아의 배양 시간의 화학 성분을 포함하여 세균의 고정과 방해할 수 있습니다. 전반적으로, 젤라틴 코팅 운모의 사용은 이미지의 미생물 세포에 대해 일반적으로 적용할 수 발견됩니다.
프로토콜
1. 미카 준비 :
- AFM 현미경 (약 22 × 30mm)에 맞게 필요한 크기로 가위로 운모를 (전자 현미경 과학) 잘라.
- 클리브가 양쪽에있는 미카가 일반적으로 바깥쪽 레이어를 제거하는 테이프를 사용하는 것은 부드럽고 깨지지 레이어가 남을 때까지.
2. 젤라틴 용액의 준비 :
- 실험실 병에 증류수 100 ML을 추가합니다.
- 물이 끓기 시작할 때까지 전자 레인지에 병을 열. (전자 레인지를 사용할 수없는 경우, 물은 뜨거운 접시에 비커에 가열 수 있습니다.)
- 젤라틴 0.5 g (를 시그마 G - 6144, G - 2625 또는 G - 2500)가 무게와 뜨거운 증류수에 추가할 수 있습니다.
- 부드럽게 소용돌이는 젤라틴까지 병이 완전히 녹아있다.
- 60-70 ° C.에 젤라틴 용액을 쿨
- 컷 죽습 미카가 담근 수있는에 작은 비커 (20 ML)에 약 15 ML 하거라.
3. 미카 코팅 :
- 예열 젤라틴 용액에 잠수함 미카 사각형과 운모가 (그림 1A) 코팅되어 신속하게 철회 등.
- 코팅 후 (그림 1B의) 주변 공기의 건조에 종이 타월에 가장자리에 즉시 운모를 지원합니다. 젤라틴 코팅 운모는 최소 2 주 동안 사용할 수 있습니다. 초과 젤라틴 솔루션은 냉장 보관 간단 60-70 사이 ° C.에 대한 재고 솔루션을 재가열하여 약 한 달 동안 사용할 수 있습니다 케어는 젤라틴이 재가열하는 동안 삶은 아니라는 것을 보장하기 위해 이동해야합니다.
4. 젤라틴 코팅 운모에 박테리아를 장착 :
- 펠렛 세균성 문화 1 ML (0.5-600 nm의에서 1.0 OD) 800 4500 RCF에서. 세균에 따라 최소 RCF를 사용하는 것이 펠렛이 ~ 5 분 안에 세포 것입니다.
- 필터링 탈이온수 또는 버퍼의 같은 볼륨에서 펠렛을 씻으십시오.
- 원심 분리하여 다시 세포를 수집합니다.
- nanopure 탈이온수 또는 버퍼 500 μL에 즉시 펠렛을 Resuspend. (세균성 정지 가시 AFM 이미징을위한 세포의 적절한 농도를하기 위해 흐린해야합니다.)
- 피펫 팁 (그림 1C)를 사용하여 표면에 젤라틴 - 코팅 운모 및 확산에 세포 현탁액 (10-20 μL)를 적용합니다. 치료는 세균 솔루션을 적용하거나 유포하는 동안 물리적으로 피펫 팁로 젤라틴 표면을 만지지로 이동해야합니다.
- 표면이 10 분 정도 휴식과 물 또는 버퍼 (그림 1 CD)의 흐름과 함께 씻어 수 있습니다. 절차 전반에 걸쳐, 샘플이 건조 허용되지 않도록하는데주의를 기울여야.
5. 대표 결과 :
그림 2는 젤라틴 - 코팅 운모에 장착된와 AFM에 의해 몇 군데있다 세균성 세포의 예제 이미지를 보여줍니다. 우리 실험실에서는 샘플은 일반적으로 100 μm의 검사 머리 복 PicoPlus 원자 힘 현미경을 (애질런트 테크놀로지, 템플, AZ)를 사용하여 몇 군데 있습니다. 악기는 0.5-1.0 라인 / s의의 스캔 속도로 라인 스캔 당 128-512 픽셀에서 운영하고 있습니다 일반적으로 사용되는 cantilevers는 0.01에서 0.1 NN / NM에 이르기까지 명목 스프링 상수와 Veeco 실리콘 질화물 프로브 (MLCT - AUHW, Veeco, 산타 바바라, CA)입니다.

그림 1. 60-70 ° C가 20 ML의 비커에 배치됩니다의 온도에서 다행. 족집게 한 켤레를 사용하면 갓 미카 사각형이 완전히 젤라틴 (A) 철회와 마이크로 원심 분리기 걸이 (B) 기대어 종이 타월에 직립 위치로 포장되어 아르 죽습. 세균성 시료의 비말은 X와 Y 방향 (C) 모두에서 pipet 팁있는 미카와 보급에 위치합니다. 샘플 적어도 10 분 동안 운모 표면에 품어 수 있도록 후, 증류수의 흐름에 샘플을 씻어. 고정이 효과가있다면 당신은 (D)의 오른쪽 패널에서 같이 미카에 불투명 자리를 볼 수 있습니다. 고정 문제가 해결되지 않았다면 당신은 왼쪽 패널에서와 같이 미카의 명확한 부분을 얻을 것이다. 비말에있는 박테리아의 농도에 미카 저울에 불투명 지점 젤라틴 처리된 운모에이 곳 저.
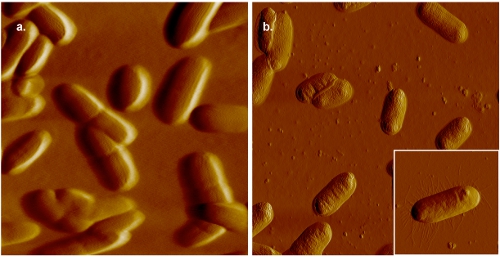
E.의 그림 2. AFM 이미지 대장균. 패널 (A)에서 세포는 젤라틴 코팅 운모에 탑재하고 0.005 M PBS에서 몇 군데. 비교, 젤라틴 코팅 운모에 장착하고 공중에서 몇 군데 세균성 세포의 이미지를 패널 (B)로 표시됩니다. septa 분명로서 필리 (삽입된 페이지 패널 (B))의 존재로 표시 액체, 높은 해상도,에서 수집된 이미지에 표시되는 공기를 얻을 수 있습니다. 있지만
토론
다양한 요인에 의해 미생물의 AFM 장착 휴대폰 및 이미징에 영향을 미칠 수 있습니다. 코팅에 사용되는 젤라틴은 운모가 중요합니다. 상업 젤라틴은 물고기, 소, 돼지를 포함한 척추 동물의 숫자에서 격리됩니다. 기원과 처리 방법은 모두 고정 세균에 대한 젤라틴의 적합성을 결정합니다. 다양한 소스 및 젤라틴의 종류 immobilizing 박테리아에서 효과에 대한 평가되었다 [1]. 두 가지 가장 효과적인 gel...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 연구는 생물학과 환경 연구의 사무실, 에너지 미국학과로와 버지니아 연방 보건 연구위원회에서 부여 기금을 후원합니다. 오크 리지 국립 연구소는 계약 번호 DE - AC05 - 00OR22725에 따라 에너지의 미국학과에 대한 UT - 바텔, LLC에 의해 관리됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 이름 | 회사 | 카탈로그 번호 | |
| 젤라틴 | 시그마, 세인트 루이스, MO | G6144, G2625 또는 G2500 | |
| PicoPlus 원자 포스 현미경 | 애질런트 테크놀로지 템피, AZ | ||
| AFM의 cantilevers | Veeco, 산타 바바라, CA | MLCT - AUHW |
참고문헌
- Bernal, R., Pullarkat, P. A. Mechanical properties of axons. Phys Rev Lett. 99, 018301-018301 (2007).
- Bray, D. Axonal growth in response to experimentally applied mechanical tension. Dev Biol. 102, 379-389 (1984).
- Chetta, J., Kye, C. Cytoskeletal dynamics in response to tensile loading of mammalian axons. Cytoskeleton (Hoboken). 67, 650-665 (2010).
- Dennerll, T. J., Lamoureux, P. The cytomechanics of axonal elongation and retraction. J Cell Biol. 109, 3073-3083 (1989).
- Fu, S. Y., Gordon, T. The cellular and molecular basis of peripheral nerve regeneration. Mol Neurobiol. 14, 1-2 (1997).
- Gray, C., Hukkanen, M. Rapid neural growth: calcitonin gene-related peptide and substance P- containing nerves attain exceptional growth rates in regenerating deer antler. Neuroscience. 50, 953-963 (1992).
- Heidemann, S. R., Buxbaum, R. E. Tension as a regulator and integrator of axonal growth. Cell Motil Cytoskeleton. 17, 6-10 (1990).
- Heidemann, S. R., Buxbaum, R. E. Mechanical tension as a regulator of axonal development. Neurotoxicology. 15, 95-107 (1994).
- Heidemann, S. R., Lamoureux, P. Cytomechanics of axonal development. Cell Biochem Biophys. 27, 135-155 (1995).
- Iwata, A., Browne, K. D. Long-term survival and outgrowth of mechanically engineered nervous tissue constructs implanted into spinal cord lesions. Tissue Eng. 12, 101-110 (2006).
- Lamoureux, P., Heidemann, S. R. Growth and elongation within and along the axon. Dev Neurobiol. 70, 135-149 (2010).
- Lamoureux, P., Zheng, J. A cytomechanical investigation of neurite growth on different culture surfaces. J Cell Biol. 118, 655-661 (1992).
- Lindqvist, N., Liu, Q. Retinal glial (Muller) cells: sensing and responding to tissue stretch. Invest Ophthalmol Vis Sci. 51, 1683-1690 (2010).
- Loverde, J. R., Ozoka, V. C. Live Imaging of Axon Stretch Growth in Embryonic and Adult Neurons. J. Neurotrauma. , (2011).
- Lu, Y. B., Franze, K. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci U S A. 103, 17759-17764 (2006).
- O'Toole, M., Lamoureux, P. A physical model of axonal elongation: force, viscosity, and adhesions govern the mode of outgrowth. Biophys J. 94, 2610-2620 (2008).
- Pfister, B. J., Bonislawski, D. P. Stretch-grown axons retain the ability to transmit active electrical signals. FEBS Lett. 580, 3525-3531 (2006).
- Pfister, B. J., Gordon, T. Biomedical Engineering Strategies for Peripheral Nerve Repair: Surgical Applications, State of the Art, and Future Challenges. Crit Rev Biomed Eng. 39, 81-124 (2011).
- Pfister, B. J., Iwata, A. Extreme stretch growth of integrated axons. J Neurosci. 24, 7978-7983 (2004).
- Pfister, B. J., Iwata, A. Development of transplantable nervous tissue constructs comprised of stretch-grown axons. J Neurosci Methods. 153, 95-103 (2006).
- Siechen, S., Yang, S. Mechanical tension contributes to clustering of neurotransmitter vesicles at presynaptic terminals. Proc Natl Acad Sci U S A. 106, 12611-12616 (2009).
- Smith, D. H. Stretch growth of integrated axon tracts: extremes and exploitations. Prog Neurobiol. 89, 231-239 (2009).
- Smith, D. H., Wolf, J. A. A new strategy to produce sustained growth of central nervous system axons: continuous mechanical tension. Tissue Eng. 7, 131-139 (2001).
- Weiss, P. Nerve patterns: The mechanics of nerve growth. Growth, Third Growth Symposium. 5, 163-203 (1941).
- Zheng, J., Lamoureux, P. Tensile regulation of axonal elongation and initiation. J Neurosci. 11, 1117-1125 (1991).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유