Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Atomik Kuvvet Mikroskopi Görüntüleme Bakteriyel İmmobilizasyon
Bu Makalede
Özet
Canlı Gram-negatif ve Gram-pozitif bakterilerin jelatin kaplı mika üzerinde hareketsiz ve Atomik Kuvvet Mikroskobu (AFM) kullanarak sıvı görüntülü olabilir.
Özet
AFM görüntüleme aracı mekanik problar bir yüzey, yüksek çözünürlüklü (nm ölçekli). Numunenin kimyasal tedavi etmek gerek kalmadan, sıvı bir ortamda, görüntü hücreleri ve biyomoleküllerin yeteneği vardır. Bu amacı gerçekleştirmek için, örnek tarama AFM konsol ucu tarafından uygulanan kuvvetler tarafından kaldırılmasını engellemek için yeterli montaj yüzeyine uygun olmalıdır. Birçok durumda, başarılı görüntüleme için örnek montaj yüzeyine immobilizasyonu bağlıdır. Optimal, immobilizasyon minimal invaziv metabolik süreçleri ve fonksiyonel özellikleri tehlikeye böyle örnek olmalıdır. Domuz (domuz) jelatin kaplama taze bölünmüş mika yüzeyleri, negatif yüklü bakterilerin yüzeye immobilize ve sıvı AFM tarafından görüntülenmiş. Jelatin kaplı mika bakteri hücrelerinin immobilizasyonu negatif yüklü bakteri ve pozitif yüklü jelatin arasında elektrostatik etkileşim nedeniyle büyük olasılıkla. Çeşitli faktörler, kimyasal bileşenler bakteri asılı olduğu, sıvı, bakteri görüntülü hangi bakteri suşu ve orta jelatin kaplı mika, yüzey özellikleri bakteri inkübasyon süresi de dahil olmak üzere bakteriyel immobilizasyon, müdahale edebilirsiniz. Genel olarak, jelatin kaplı mika kullanımı genellikle görüntüleme mikrobiyal hücreler için geçerli olmak üzere bulunur.
Protokol
1. Mika hazırlanması:
- AFM mikroskobu (yaklaşık 22 × 30 mm) uyum için gerekli boyut makas ile mika (Elektron Mikroskobu Bilimleri) kesin.
- Cleave, her iki tarafta mika, genellikle bant kullanarak, dış katmanı kaldırmak için sadece yumuşak kesintisiz katmanları kalmayıncaya kadar.
2. Jelatin solüsyonu hazırlanması:
- Bir laboratuvar şişesi 100 ml distile su ekleyin.
- Mikrodalga şişe su kaynamaya başlayana kadar ısıtın. (Mikrodalga mevcut değilse, sıcak bir plaka üzerinde bir beher su ısıtılır.)
- 0.5 gram jelatin (Sigma G-6144, G-2625 ya da G-2500) tartılır ve sıcak distile su ekleyin.
- Yavaşça girdap jelatin kadar şişe tamamen çözülür.
- 60-70 ° C'ye kadar jelatin solüsyonu soğutun
- Kesim bölünmüş mika batırılmış olabilir içine küçük bir beher (20 ml) yaklaşık 15 ml dökün.
3. Mika kaplama:
- Batmak mika ısıtılmış jelatin çözüm içine kareler ve mika (Şekil 1a) kaplı olduğu gibi hızlı çekilme.
- Kaplama sonra, (Şekil 1b), havadaki kuru bir kağıt havlu üzerine, kenarında, hemen mika destek. Jelatin kaplı mika, en az 2 hafta süreyle kullanılabilir. Aşırı jelatin solüsyonu buzdolabında saklanmalı ve sadece 60-70 ° C arasında stok solüsyonu tekrar ısıtmayı tarafından yaklaşık bir ay için kullanılan Jelatin yeniden ısıtırken sırasında haşlanmış olmadığından emin olmak için alınmalıdır.
4. Jelatin kaplı mika bakteri Montaj:
- Pelet bakteri kültürü 1 ml (0.5 - 1.0 OD 600 nm) 800 4500 RCF. Bakteri bağlı olarak, minimum RCF pelet ~ 5 dakika içinde hücreler
- Filtreli deiyonize su ya da tampon aynı hacimde pelet yıkayın.
- Santrifüj yoluyla hücreler tekrar toplayın.
- Nanopure deiyonize su ya da tampon 500 mcL derhal pelletini tekrar. (Bakteriyel süspansiyon AFM görüntüleme için hücrelerin yeterli bir konsantrasyon elde etmek için gözle görülür bir şekilde bulanık olması gerekir.)
- Bir pipet ucu (Şekil 1c) kullanarak yüzey üzerinde jelatin kaplı mika ve yayılması için hücre süspansiyonu (10-20 mcL) uygulayın. Bakım bakteriyel bir çözüm uygulayarak veya yayarken fiziksel pipet ile jelatin yüzeyine dokunmayın değil alınmalıdır.
- İzin yüzeyi, 10 dakika dinlenme ve su ya da tampon (Şekil 1 cd) bir dere ile durulayın. Prosedürü boyunca, örnek kurumasına izin olmadığından emin olmak için özen gösterin.
5. Temsilcisi Sonuçlar:
Şekil 2, jelatin kaplı mika üzerine monte edilmiş ve AFM tarafından görüntülendi bakteri hücreleri örnek görüntüleri gösterir. Bizim laboratuvarlarımızda, örnekler, genellikle 100 mm tarama kafası ile donatılmış bir PicoPlus atomik kuvvet mikroskobu (Agilent Technologies, Tapınağı, AZ) kullanarak görüntülü. Cihaz bir tarama 0.5-1.0 satır / s hızda, line-scan başına 128-512 piksel işletilmektedir Tipik olarak kullanılan konsol Veeco 0.01 'den 0.1 nN / nm arasında değişen nominal yay sabitleri ile silisyum nitrür probları (MLCT-AUHW Veeco, Santa Barbara, CA).

Şekil 1: 60-70 ° C 20 ml beher yerleştirilen bir sıcaklık az jelatin . Bir cımbız kullanarak taze mika kareler tamamen jelatin (a) çekilmiş ve bir mikro santrifüj raf (b) yaslanmış bir kağıt havlu üzerine dik olarak yerleştirilen içine dalmış olan bölünmüş. Bakteriyel örnek bir damlacık X ve Y yönlerinde (c) hem de bir pipetlemeyin ucu ile mika ve yayılması üzerine yerleştirilir. Örnek mika yüzey üzerinde en az 10 dakika süreyle inkübe izin sonra distile su akışı örnek durulayın. Immobilizasyon çalıştı Eğer, (d) sağ panelinde görüldüğü gibi mika opak bir yerde görmek mümkün olacak. Immobilizasyon işe yaramadıysa sol paneldeki gibi net bir mika parçası alacak. Damlacık bakteri konsantrasyonu mika ölçeklerde opak nokta jelatin işlenmiş mika yerinde.
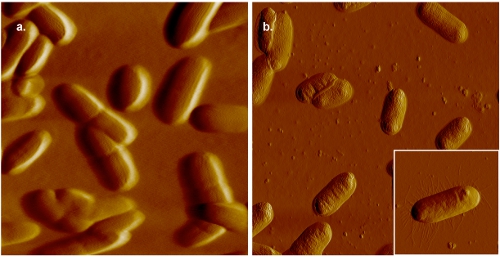
Şekil 2 E. AFM görüntüleri coli. Panel (a), hücreler, jelatin kaplı mika üzerine monte edilir ve görüntülü olarak 0.005 M PBS. Karşılaştırma için, jelatin kaplı mika üzerine monte edilmiş ve hava görüntülü bakteri hücrelerinin bir görüntü paneli (b) 'de gösterilmiştir. Septa pili (inset panel (b)) varlığı ile gösterildiği gibi sıvı, daha fazla çözünürlük, toplanan görüntü açıkça görülebilir hava elde edilebilir. Rağmen
Tartışmalar
Çeşitli faktörler AFM tarafından mikrobiyal montaj hücre ve görüntüleme etkileyebilir. Mika kaplama için kullanılan jelatin önemlidir. Ticari jelatin, balık, inek, ve domuz da dahil olmak üzere bir dizi omurgalıların izole edilmiştir. Kökeni ve işleme yöntemi Her iki bakteri immobilizasyon için jelatin uygunluğunu belirler. Sayısız kaynakları ve türleri jelatin hareketsizleştirir bakteri onların etkinliği değerlendirilmiştir [1]. Sigma G-6144, G-2625 için en etkili jelatin bulundu. Domuz (...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu araştırma, Biyolojik ve Çevresel Araştırma Dairesi, ABD Enerji Bakanlığı ve hibe finansmanı Virginia Commonwealth Sağlık Araştırma Kurulu tarafından desteklenmektedir. Oak Ridge Ulusal Laboratuvarı'nda, Sözleşme No: DE-AC05-00OR22725 altında ABD Enerji Bakanlığı için UT-Battelle, LLC tarafından yönetilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Isim | Şirket | Katalog numarası | |
| Jelâtin | Sigma, St Louis, MO | G6144, G2625 ve G2500 | |
| PicoPlus Atomik Kuvvet Mikroskobu | Agilent Technologies, Tempe, AZ | ||
| AFM Çıkma | Veeco, Santa Barbara, CA | MLCT-AUHW |
Referanslar
- Bernal, R., Pullarkat, P. A. Mechanical properties of axons. Phys Rev Lett. 99, 018301-018301 (2007).
- Bray, D. Axonal growth in response to experimentally applied mechanical tension. Dev Biol. 102, 379-389 (1984).
- Chetta, J., Kye, C. Cytoskeletal dynamics in response to tensile loading of mammalian axons. Cytoskeleton (Hoboken). 67, 650-665 (2010).
- Dennerll, T. J., Lamoureux, P. The cytomechanics of axonal elongation and retraction. J Cell Biol. 109, 3073-3083 (1989).
- Fu, S. Y., Gordon, T. The cellular and molecular basis of peripheral nerve regeneration. Mol Neurobiol. 14, 1-2 (1997).
- Gray, C., Hukkanen, M. Rapid neural growth: calcitonin gene-related peptide and substance P- containing nerves attain exceptional growth rates in regenerating deer antler. Neuroscience. 50, 953-963 (1992).
- Heidemann, S. R., Buxbaum, R. E. Tension as a regulator and integrator of axonal growth. Cell Motil Cytoskeleton. 17, 6-10 (1990).
- Heidemann, S. R., Buxbaum, R. E. Mechanical tension as a regulator of axonal development. Neurotoxicology. 15, 95-107 (1994).
- Heidemann, S. R., Lamoureux, P. Cytomechanics of axonal development. Cell Biochem Biophys. 27, 135-155 (1995).
- Iwata, A., Browne, K. D. Long-term survival and outgrowth of mechanically engineered nervous tissue constructs implanted into spinal cord lesions. Tissue Eng. 12, 101-110 (2006).
- Lamoureux, P., Heidemann, S. R. Growth and elongation within and along the axon. Dev Neurobiol. 70, 135-149 (2010).
- Lamoureux, P., Zheng, J. A cytomechanical investigation of neurite growth on different culture surfaces. J Cell Biol. 118, 655-661 (1992).
- Lindqvist, N., Liu, Q. Retinal glial (Muller) cells: sensing and responding to tissue stretch. Invest Ophthalmol Vis Sci. 51, 1683-1690 (2010).
- Loverde, J. R., Ozoka, V. C. Live Imaging of Axon Stretch Growth in Embryonic and Adult Neurons. J. Neurotrauma. , (2011).
- Lu, Y. B., Franze, K. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci U S A. 103, 17759-17764 (2006).
- O'Toole, M., Lamoureux, P. A physical model of axonal elongation: force, viscosity, and adhesions govern the mode of outgrowth. Biophys J. 94, 2610-2620 (2008).
- Pfister, B. J., Bonislawski, D. P. Stretch-grown axons retain the ability to transmit active electrical signals. FEBS Lett. 580, 3525-3531 (2006).
- Pfister, B. J., Gordon, T. Biomedical Engineering Strategies for Peripheral Nerve Repair: Surgical Applications, State of the Art, and Future Challenges. Crit Rev Biomed Eng. 39, 81-124 (2011).
- Pfister, B. J., Iwata, A. Extreme stretch growth of integrated axons. J Neurosci. 24, 7978-7983 (2004).
- Pfister, B. J., Iwata, A. Development of transplantable nervous tissue constructs comprised of stretch-grown axons. J Neurosci Methods. 153, 95-103 (2006).
- Siechen, S., Yang, S. Mechanical tension contributes to clustering of neurotransmitter vesicles at presynaptic terminals. Proc Natl Acad Sci U S A. 106, 12611-12616 (2009).
- Smith, D. H. Stretch growth of integrated axon tracts: extremes and exploitations. Prog Neurobiol. 89, 231-239 (2009).
- Smith, D. H., Wolf, J. A. A new strategy to produce sustained growth of central nervous system axons: continuous mechanical tension. Tissue Eng. 7, 131-139 (2001).
- Weiss, P. Nerve patterns: The mechanics of nerve growth. Growth, Third Growth Symposium. 5, 163-203 (1941).
- Zheng, J., Lamoureux, P. Tensile regulation of axonal elongation and initiation. J Neurosci. 11, 1117-1125 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır