A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Immobilization חיידקית עבור הדמיה על ידי מיקרוסקופית כוח אטומי
In This Article
Summary
חיים חיידקים גראם שליליים גראם חיוביים יכולים להיות משותקת על מיקה ג'לטין מצופה הדמיה בנוזל באמצעות מיקרוסקופ כוח אטומי (AFM).
Abstract
AFM הינה ברזולוציה גבוהה (בסולם ננומטר) כלי הדמיה כי מכנית בדיקות משטח. יש לו את היכולת תאים התמונה ביומולקולות, בסביבה נוזלית, ללא צורך כימית לטפל המדגם. כדי להשיג מטרה זו, המדגם חייב דיו לדבוק פני השטח גובר על מנת למנוע הסרה של כוחות המופעלים על ידי קצה שלוחה סריקה AFM. במקרים רבים, הדמיה מוצלח תלוי immobilization של המדגם על פני השטח גובר. באופן אופטימלי, צריך להיות immobilization פולשנית כדי לדגום את כזה תהליכים מטבוליים ותכונות פונקציונליות אינם בסכנה. עד ביקע טרי ציפוי משטחים מיקה עם חזירי (חזיר) ג'לטין, חיידקים בעלי מטען שלילי יכול להיות משותקת על פני השטח הדמיה בנוזל על ידי AFM. Immobilization של תאים חיידקיים על מיקה ג'לטין מצופה קרוב לוודאי בשל אינטראקציה אלקטרוסטטית בין חיידקים בעלי מטען שלילי ואת הג'לטין מטען חשמלי חיובי. מספר גורמים יכולים להפריע immobilization חיידקים, כולל מרכיבים כימיים של הנוזל שבו חיידקים מושעים, זמן הדגירה של החיידק על ג'לטין מצופה, נציץ תכונות פני השטח של זן חיידקים המדיום שבו הם צילמו את החיידקים. באופן כללי, השימוש מיקה ג'לטין מצופה יימצא החלים בדרך כלל תאים מיקרוביאליים הדמיה.
Protocol
1. מיכה הכנה:
- חותכים את מיקה (מדעי אלקטרונים מיקרוסקופית) עם מספריים לגודל הדרוש כדי להתאים את מיקרוסקופ AFM (בערך 22 × 30 מ"מ).
- קליב מיקה בשני הצדדים, בדרך כלל באמצעות קלטת כדי להסיר את השכבה החיצונית, עד שרק שכבות רצוף וחלק נשארים.
2. הכנת פתרון ג'לטין:
- מוסיפים 100 מ"ל מים מזוקקים כדי בקבוק מעבדה.
- מחממים את הבקבוק במיקרוגל עד שהמים מתחילים לרתוח. (אם במיקרוגל אינו זמין, המים ניתן לחמם בכוס על פלטה חשמלית).
- לשקול את 0.5 גרם של ג'לטין (Sigma-G-6144, G-2625 או G-2500), ולהוסיף למים מזוקקים חמים.
- מערבולת הבקבוק בעדינות עד הג'לטין נמס לחלוטין.
- מגניב הפתרון ג'לטין על 60-70 ° C.
- יוצקים כ 15 מ"ל לתוך כוס קטנה (20 מ"ל) שלתוכו מיקה לחתוך ביקע יכול להיות טבול.
3. מיכה ציפוי:
- להטביע את הריבועים נציץ לתוך הפתרון ג'לטין חימם ולסגת כזה מהר כי מיקה היא מצופה (איור 1 א).
- לאחר ציפוי, לתמוך מיקה מיד, על קצה, על מגבת נייר לייבוש באוויר הסביבה (איור 1b). נציץ מצופה ג'לטין יכול לשמש לפחות 2 שבועות. הפתרון ג'לטין עודף יכולים להישמר בקירור בשימוש במשך חודש בערך, פשוט על ידי reheating הפתרון המניות בין 60-70 ° C. יש להקפיד על מנת להבטיח כי ג'לטין אינו מבושל במהלך reheating.
4. הרכבה חיידקים על נציץ מצופה ג'לטין:
- גלולה 1 מ"ל של התרבות חיידקים (0.5-1.0 OD ב 600 ננומטר) בשעה RCF 800 עד 4500. בהתאם חיידקים, השתמש RCF המינימום גלולה יהיה התאים ~ 5 דקות.
- שטפו את גלולה בהיקף זהה של מים מסוננים או deionized חיץ.
- איסוף התאים שוב על ידי צנטריפוגה.
- Resuspend את הכדור מיד ב 500 μL מים deionized חיץ nanopure או. (השעיה חיידקי צריך להיות עכור בעליל כדי שיהיה ריכוז מספקת של תאים עבור הדמיה AFM).
- החל את ההשעיה תא (10-20 μL) כדי מיקה ג'לטין מצופה ולהתפשט על פני השטח באמצעות קצה פיפטה (איור 1 ג'). יש להקפיד לא לגעת פיזית את פני השטח ג'לטין עם קצה פיפטה תוך יישום או להפיץ את פתרון חיידקי.
- אפשר המשטח לנוח למשך 10 דקות ולשטוף עם זרם מים או חיץ (איור 1 cd). לאורך כל ההליך, דואגים להבטיח כי המדגם אינו רשאי יבש.
5. נציג תוצאות:
תרשים 2 מציג תמונות דוגמה תאים חיידקיים כי כבר רכוב על מיקה ג'לטין מצופה הדמיה על ידי AFM. במעבדות שלנו, דגימות הם צילמו בדרך כלל באמצעות מיקרוסקופ כוח אטומי PicoPlus (Agilent Technologies, בית המקדש, AZ) לבוש עם ראש מיקרומטר 100 סריקה. המכשיר מופעל על 128-512 פיקסלים לכל לסרוק קו במהירות סריקה של 0.5-1.0 קווי / s. Cantilevers המשמשים בדרך כלל הם Veeco בדיקות סיליקון ניטריד (MLCT-AUHW, Veeco, סנטה ברברה, קליפורניה) עם קבועי קפיץ הנומינלי החל 0.01-0.1 NN / ננומטר.

באיור 1. לטין בטמפרטורה של 60-70 מעלות צלזיוס ממוקם כוס 20 מ"ל. בעזרת פינצטה טרי ביקע ריבועים מיקה שקועים לגמרי לתוך הג'לטין (א) מכונס העמידו על מגבת נייר נשען על מדף צנטריפוגות מיקרו (ב). אגל של המדגם חיידקי מושם על מיקה ושל התפשטות עם טיפ pipet הן X ו Y כיוונים (ג). לאחר המאפשר המדגם כדי לדגור על פני השטח מיקה לפחות 10 דקות, לשטוף את המדגם בזרם של מים מזוקקים. אם immobilization עבדו תוכל לראות את המקום אטום על מיקה כפי שמוצג בלוח השמאלי של (ד). אם immobilization לא לעבוד תקבלו חתיכת ברורה של מיקה כמו בלוח השמאלי. הנקודה אטום על המאזניים מיקה ריכוז של חיידקים בתוך אגל לך מקום על מיקה התייחסו ג'לטין.
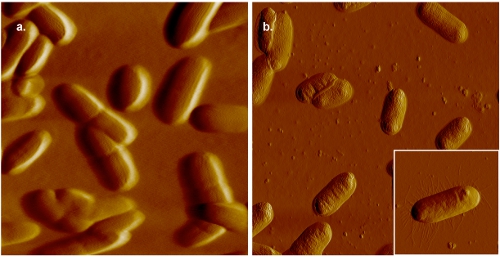
2. איור AFM תמונות של א coli. בלוח (א), התאים הם רכובים על מיקה ג'לטין מצופה הדמיה ב 0.005 M-PBS. לשם השוואה, דימוי של תאים חיידקיים רכוב על מיקה ג'לטין מצופה הדמיה באוויר מוצג בלוח (ב). למרות septa הם בבירור בתמונה שנאספו נוזלי, ברזולוציה גדולה יותר, כפי שצוין על ידי נוכחות של פילי (פאנל הבלעה (ב)), ניתן להשיג באוויר.
Discussion
גורמים שונים יכולים להשפיע על התא של חיידקים הרכבה הדמיה באמצעות AFM. ג'לטין המשמש לציפוי מיקה חשוב. מסחרי ג'לטין מבודד ממספר חוליות כולל דגים, פרות וחזירים. שניהם מקורם ואת שיטת עיבוד לקבוע התאמתו של ג'לטין עבור immobilization חיידקי. מקורות רבים וסוגי ג'לטין הוערכו ע...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
מחקר זה ממומן על ידי משרד המחקר הביולוגיים הסביבה, משרד האנרגיה של ארה"ב ועל ידי מענק למימון ממועצת העמים של וירג'יניה לחקר בריאות. Oak Ridge National Laboratory מנוהלת על ידי UT-באטל, LLC, עבור משרד האנרגיה של ארה"ב תחת חוזה מס 'DE-AC05-00OR22725.
Materials
| Name | Company | Catalog Number | Comments |
| שם | חברה | מספר קטלוגי | |
| לטין | סיגמא, סנט לואיס, מיזורי | G6144, G2625 או G2500 | |
| PicoPlus מיקרוסקופ כוח אטומי | Agilent Technologies, בטמפה, AZ | ||
| AFM cantilevers | Veeco, סנטה ברברה, קליפורניה | MLCT-AUHW |
References
- Bernal, R., Pullarkat, P. A. Mechanical properties of axons. Phys Rev Lett. 99, 018301-018301 (2007).
- Bray, D. Axonal growth in response to experimentally applied mechanical tension. Dev Biol. 102, 379-389 (1984).
- Chetta, J., Kye, C. Cytoskeletal dynamics in response to tensile loading of mammalian axons. Cytoskeleton (Hoboken). 67, 650-665 (2010).
- Dennerll, T. J., Lamoureux, P. The cytomechanics of axonal elongation and retraction. J Cell Biol. 109, 3073-3083 (1989).
- Fu, S. Y., Gordon, T. The cellular and molecular basis of peripheral nerve regeneration. Mol Neurobiol. 14, 1-2 (1997).
- Gray, C., Hukkanen, M. Rapid neural growth: calcitonin gene-related peptide and substance P- containing nerves attain exceptional growth rates in regenerating deer antler. Neuroscience. 50, 953-963 (1992).
- Heidemann, S. R., Buxbaum, R. E. Tension as a regulator and integrator of axonal growth. Cell Motil Cytoskeleton. 17, 6-10 (1990).
- Heidemann, S. R., Buxbaum, R. E. Mechanical tension as a regulator of axonal development. Neurotoxicology. 15, 95-107 (1994).
- Heidemann, S. R., Lamoureux, P. Cytomechanics of axonal development. Cell Biochem Biophys. 27, 135-155 (1995).
- Iwata, A., Browne, K. D. Long-term survival and outgrowth of mechanically engineered nervous tissue constructs implanted into spinal cord lesions. Tissue Eng. 12, 101-110 (2006).
- Lamoureux, P., Heidemann, S. R. Growth and elongation within and along the axon. Dev Neurobiol. 70, 135-149 (2010).
- Lamoureux, P., Zheng, J. A cytomechanical investigation of neurite growth on different culture surfaces. J Cell Biol. 118, 655-661 (1992).
- Lindqvist, N., Liu, Q. Retinal glial (Muller) cells: sensing and responding to tissue stretch. Invest Ophthalmol Vis Sci. 51, 1683-1690 (2010).
- Loverde, J. R., Ozoka, V. C. Live Imaging of Axon Stretch Growth in Embryonic and Adult Neurons. J. Neurotrauma. , (2011).
- Lu, Y. B., Franze, K. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci U S A. 103, 17759-17764 (2006).
- O'Toole, M., Lamoureux, P. A physical model of axonal elongation: force, viscosity, and adhesions govern the mode of outgrowth. Biophys J. 94, 2610-2620 (2008).
- Pfister, B. J., Bonislawski, D. P. Stretch-grown axons retain the ability to transmit active electrical signals. FEBS Lett. 580, 3525-3531 (2006).
- Pfister, B. J., Gordon, T. Biomedical Engineering Strategies for Peripheral Nerve Repair: Surgical Applications, State of the Art, and Future Challenges. Crit Rev Biomed Eng. 39, 81-124 (2011).
- Pfister, B. J., Iwata, A. Extreme stretch growth of integrated axons. J Neurosci. 24, 7978-7983 (2004).
- Pfister, B. J., Iwata, A. Development of transplantable nervous tissue constructs comprised of stretch-grown axons. J Neurosci Methods. 153, 95-103 (2006).
- Siechen, S., Yang, S. Mechanical tension contributes to clustering of neurotransmitter vesicles at presynaptic terminals. Proc Natl Acad Sci U S A. 106, 12611-12616 (2009).
- Smith, D. H. Stretch growth of integrated axon tracts: extremes and exploitations. Prog Neurobiol. 89, 231-239 (2009).
- Smith, D. H., Wolf, J. A. A new strategy to produce sustained growth of central nervous system axons: continuous mechanical tension. Tissue Eng. 7, 131-139 (2001).
- Weiss, P. Nerve patterns: The mechanics of nerve growth. Growth, Third Growth Symposium. 5, 163-203 (1941).
- Zheng, J., Lamoureux, P. Tensile regulation of axonal elongation and initiation. J Neurosci. 11, 1117-1125 (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved