Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Бактериальные Иммобилизация для обработки изображений методом атомно-силовой микроскопии
В этой статье
Резюме
Живая грамотрицательных и грамположительных бактерий, может быть иммобилизованным на желатин покрытием слюда и отображается в жидкости с помощью атомно-силовой микроскопии (АСМ).
Аннотация
АСМ с высоким разрешением (нм масштабе) изображения инструментом, который механически зондов поверхность. Она имеет способность изображения клеток и биомолекул, в жидкой среде, без необходимости обращаться к химически образца. Для достижения этой цели, образец должен достаточно придерживаться монтажной поверхности, чтобы предотвратить удаление силами со стороны кантилевера сканирования АСМ. Во многих случаях успешное изображения зависит от иммобилизации образца к монтажной поверхности. Оптимально, иммобилизация должна быть минимально инвазивной к образцу, что обменные процессы и функциональные атрибуты не нарушена. Покрывая свежесколотой слюды поверхности свиньи (свинья) желатина, отрицательно заряженные бактерии могут быть иммобилизованных на поверхности и отображается в жидкости с помощью АСМ. Иммобилизация клеток бактерий на желатин покрытием слюда, скорее всего, из-за электростатического взаимодействия между отрицательно заряженными бактериями и положительно заряженные желатин. Ряд факторов может повлиять на бактериальную иммобилизации, в том числе химических составляющих жидкость, в которой бактерии приостановлено, времени инкубации бактерий на желатин покрытые слюдой, поверхностные характеристики бактериального штамма и среды, в которой бактерии образ. В целом, использование желатина покрытые слюдой оказывается вообще применимо для клеток изображений микроорганизмов.
протокол
1. Слюда подготовки:
- Вырезать слюды (наук Электронная микроскопия) с ножницами, чтобы размер необходимых, чтобы соответствовать микроскоп AFM (около 22 × 30 мм).
- Клив слюды с обеих сторон, как правило, с помощью липкой ленты для удаления наружного слоя, пока только гладкой непрерывной слои остаются.
2. Подготовка раствора желатина:
- Добавить 100 мл дистиллированной воды в лабораторию бутылку.
- Тепло бутылку в микроволновой печи, пока вода не закипит. (Если микроволновая печь не доступен, воду можно нагревать в химическом стакане на горячей плите.)
- Взвесьте из 0,5 г желатина (Sigma G-6144, G-2625 или G-2500) и добавить в горячей дистиллированной воде.
- Аккуратно водоворот бутылка пока желатин полностью не растворится.
- Охладите раствор желатина до 60-70 ° С.
- Налейте примерно 15 мл в небольшой стакан (20 мл), в которую сократить расщепляется слюды может быть ближнего.
3. Слюда покрытия:
- Погрузите слюды квадратов на нагревали раствор желатина и снимать быстро, что слюда покрытием (рис. 1а).
- После нанесения покрытия, поддержка слюды сразу же, на краю, на бумажное полотенце, чтобы сухой в атмосферном воздухе (рис. 1б). Желатин покрытые слюдой могут быть использованы, по крайней мере 2 недели. Избыток раствора желатина можно хранить в холодильнике и использовать в течение примерно месяца просто нагревательных маточного раствора в пределах от 60-70 ° C. Необходимо соблюдать осторожность, чтобы желатин не кипяченой во нагревательных.
4. Монтаж бактерий на желатин покрытые слюдой:
- Гранул 1 мл бактериальной культуры (0,5 - 1,0 ОП при 600 нм) при 800 до 4500 RCF. В зависимости от бактерий, использовать минимальное RCF, что будет гранул клеток в ~ 5 минут.
- Вымойте гранул в том же объеме с фильтром деионизированной водой или буфером.
- Сбор клетки снова с помощью центрифугирования.
- Ресуспендируют гранулы быстро в 500 мкл NanoPure деионизированной водой или буфером. (Бактериальной суспензии должны быть визуально мутными, чтобы иметь адекватные концентрации клеток для АСМ-изображений.)
- Применение клеточной суспензии (10-20 мкл) в желатин покрытием слюда и выкладывают на поверхность с помощью пипетки (рис. 1в). Следует проявлять осторожность, чтобы не физически коснуться желатин поверхность с кончика пипетки при применении или распространение бактериальной решение.
- Разрешить поверхности, чтобы отдохнуть в течение 10 минут и смыть струей воды или буфера (рис. 1 кд). На протяжении процедуры, принять меры к тому, что образец не может высохнуть.
5. Представитель Результаты:
На рисунке 2 показан пример изображения бактериальной клетки, которые были установлены на желатин покрытием слюда и изображено АСМ. В наших лабораториях образцы, как правило, отображаемого использованием PicoPlus атомно-силового микроскопа (Agilent Technologies, Храм, AZ) оснащен 100 голов сканирования мкм. Прибор работает при 128-512 пикселов на линии сканирования при сканировании скорость 0,5-1,0 строк / сек Консолей, которые обычно используются в Veeco нитрида кремния зондов (MLCT-AUHW, Veeco в Санта-Барбаре, Калифорния) с номинальным константы весной в диапазоне от 0,01 до 0,1 нН / нм.

Рисунок 1. Желатин при температуре 60-70 ° С находится в 20 мл стакан. Использование пинцета свежесколотой слюды квадратов полностью погружены в желатин () изъяты и помещены в вертикальном положении на бумажное полотенце, прислонившись к стойке микро центрифуги (б). Капли бактериального образец помещается на слюде и распространяются с наконечником пипетки в обоих направлениях х и у (с). После учета образец для инкубации на поверхности слюды, по крайней мере, 10 минут, смойте образца в потоке дистиллированной воды. Если иммобилизация работали, вы сможете увидеть непрозрачные пятна на слюду, как показано на правой панели (г). Если иммобилизация не работали, вы получите ясный кусок слюды, как в левой панели. Непрозрачная точка на весы слюды, чтобы концентрация бактерий в капле которые вы размещаете на желатин лечение слюды.
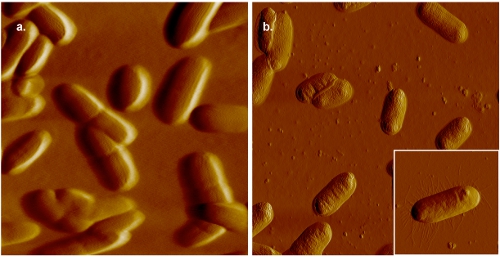
Рисунок 2. АСМ изображения E. палочки. В панель (а), клетки расположены на желатин покрытием слюда и отображается в 0,005 М PBS. Для сравнения, образ бактериальных клетках установлены на желатин покрытием слюда и отображается в воздухе показано на графике (б). Хотя перегородками отчетливо видны на изображении, собранных в жидкости, более высокое разрешение, о чем свидетельствует наличие пили (вставка панели (б)), могут быть получены в воздухе.
Обсуждение
Различные факторы могут повлиять на микробную клетку монтажа и обработки изображений с помощью АСМ. Желатин, который используется для покрытия слюды очень важно. Коммерческая желатин изолирован от числа позвоночных, включая рыб, коров и свиней. Оба происхождения и способа обработки о?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование проводится при финансовой поддержке Управления биологических и экологических исследований, Министерство энергетики США и при поддержке гранта финансирование из Содружества совета исследованиям в области здравоохранения штата Вирджиния. Oak Ridge National Laboratory управляет УТ-Battelle, LLC для Министерства энергетики США по контракту № DE-AC05-00OR22725.
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Компания | Номер в каталоге | |
| Желатин | Sigma, Сент-Луис, Миссури | G6144, G2625 и G2500 | |
| PicoPlus атомно-силовой микроскоп | Компания Agilent Technologies, Темпе, AZ | ||
| АСМ-кантилеверы | Veeco в Санта-Барбаре, штат Калифорния | MLCT-AUHW |
Ссылки
- Bernal, R., Pullarkat, P. A. Mechanical properties of axons. Phys Rev Lett. 99, 018301-018301 (2007).
- Bray, D. Axonal growth in response to experimentally applied mechanical tension. Dev Biol. 102, 379-389 (1984).
- Chetta, J., Kye, C. Cytoskeletal dynamics in response to tensile loading of mammalian axons. Cytoskeleton (Hoboken). 67, 650-665 (2010).
- Dennerll, T. J., Lamoureux, P. The cytomechanics of axonal elongation and retraction. J Cell Biol. 109, 3073-3083 (1989).
- Fu, S. Y., Gordon, T. The cellular and molecular basis of peripheral nerve regeneration. Mol Neurobiol. 14, 1-2 (1997).
- Gray, C., Hukkanen, M. Rapid neural growth: calcitonin gene-related peptide and substance P- containing nerves attain exceptional growth rates in regenerating deer antler. Neuroscience. 50, 953-963 (1992).
- Heidemann, S. R., Buxbaum, R. E. Tension as a regulator and integrator of axonal growth. Cell Motil Cytoskeleton. 17, 6-10 (1990).
- Heidemann, S. R., Buxbaum, R. E. Mechanical tension as a regulator of axonal development. Neurotoxicology. 15, 95-107 (1994).
- Heidemann, S. R., Lamoureux, P. Cytomechanics of axonal development. Cell Biochem Biophys. 27, 135-155 (1995).
- Iwata, A., Browne, K. D. Long-term survival and outgrowth of mechanically engineered nervous tissue constructs implanted into spinal cord lesions. Tissue Eng. 12, 101-110 (2006).
- Lamoureux, P., Heidemann, S. R. Growth and elongation within and along the axon. Dev Neurobiol. 70, 135-149 (2010).
- Lamoureux, P., Zheng, J. A cytomechanical investigation of neurite growth on different culture surfaces. J Cell Biol. 118, 655-661 (1992).
- Lindqvist, N., Liu, Q. Retinal glial (Muller) cells: sensing and responding to tissue stretch. Invest Ophthalmol Vis Sci. 51, 1683-1690 (2010).
- Loverde, J. R., Ozoka, V. C. Live Imaging of Axon Stretch Growth in Embryonic and Adult Neurons. J. Neurotrauma. , (2011).
- Lu, Y. B., Franze, K. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci U S A. 103, 17759-17764 (2006).
- O'Toole, M., Lamoureux, P. A physical model of axonal elongation: force, viscosity, and adhesions govern the mode of outgrowth. Biophys J. 94, 2610-2620 (2008).
- Pfister, B. J., Bonislawski, D. P. Stretch-grown axons retain the ability to transmit active electrical signals. FEBS Lett. 580, 3525-3531 (2006).
- Pfister, B. J., Gordon, T. Biomedical Engineering Strategies for Peripheral Nerve Repair: Surgical Applications, State of the Art, and Future Challenges. Crit Rev Biomed Eng. 39, 81-124 (2011).
- Pfister, B. J., Iwata, A. Extreme stretch growth of integrated axons. J Neurosci. 24, 7978-7983 (2004).
- Pfister, B. J., Iwata, A. Development of transplantable nervous tissue constructs comprised of stretch-grown axons. J Neurosci Methods. 153, 95-103 (2006).
- Siechen, S., Yang, S. Mechanical tension contributes to clustering of neurotransmitter vesicles at presynaptic terminals. Proc Natl Acad Sci U S A. 106, 12611-12616 (2009).
- Smith, D. H. Stretch growth of integrated axon tracts: extremes and exploitations. Prog Neurobiol. 89, 231-239 (2009).
- Smith, D. H., Wolf, J. A. A new strategy to produce sustained growth of central nervous system axons: continuous mechanical tension. Tissue Eng. 7, 131-139 (2001).
- Weiss, P. Nerve patterns: The mechanics of nerve growth. Growth, Third Growth Symposium. 5, 163-203 (1941).
- Zheng, J., Lamoureux, P. Tensile regulation of axonal elongation and initiation. J Neurosci. 11, 1117-1125 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены