É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A imobilização de bactérias for Imaging por Microscopia de Força Atômica
Neste Artigo
Resumo
Vivem as bactérias Gram-negativas e Gram-positivos podem ser imobilizadas em gelatina-mica revestidas com imagens e em líquido usando Microscopia de Força Atômica (AFM).
Resumo
AFM é um de alta resolução (escala nm) ferramenta de imagem que mecanicamente um sondas de superfície. Ele tem a capacidade de células e biomoléculas imagem, em um ambiente líquido, sem a necessidade de tratar quimicamente a amostra. A fim de atingir esse objetivo, a amostra deve suficientemente aderir à superfície de montagem para evitar a remoção por forças exercidas pela ponta cantilever digitalização AFM. Em muitos casos, a imagem de sucesso depende de imobilização da amostra à superfície de montagem. Idealmente, a imobilização deve ser minimamente invasivo para a amostra de tal forma que os processos metabólicos e atributos funcionais não sejam comprometidas. Por superfícies de revestimento recém clivada com mica suína (porco) gelatina, bactérias carga negativa pode ser imobilizada na superfície e fotografada em líquido por AFM. Imobilização de células bacterianas em gelatina-mica revestida é mais provável devido à interação eletrostática entre as bactérias com carga negativa e positivamente carregada a gelatina. Vários fatores podem interferir com a imobilização de bactérias, incluindo componentes químicos do líquido em que as bactérias estão suspensos, o tempo de incubação da bactéria na gelatina mica revestidas características, superfície da estirpe bacteriana e do meio em que as bactérias são gravadas. No geral, o uso de gelatina revestido mica é encontrado para ser geralmente aplicável para as células microbianas imagem.
Protocolo
1. Preparação Mica:
- Corte a mica (Ciências Microscopia Eletrônica) com uma tesoura para o tamanho necessário para caber o microscópio AFM (cerca de 22 × 30 mm).
- Cleave a mica em ambos os lados, geralmente usando a fita para remover a camada externa, até que apenas suaves camadas ininterrupta permanecem.
2. Preparação da solução de gelatina:
- Adicione 100 ml de água destilada para um frasco de laboratório.
- Aqueça a garrafa em um forno de microondas até que a água começa a ferver. (Se um microondas não está disponível, a água pode ser aquecido em um copo sobre uma chapa quente.)
- Pesar 0,5 gramas de gelatina (Sigma G-6144, G-2625-2500 ou G) e adicione à água quente destilada.
- Agite suavemente o frasco até que a gelatina esteja completamente dissolvido.
- Arrefecer a solução de gelatina a 60-70 ° C.
- Despeje aproximadamente 15 mL para um copo pequeno (20 mL) em que a mica clivada corte podem ser mergulhados.
3. Mica revestimento:
- Submergir as praças mica na solução aquecida gelatina e retirar rapidamente de modo que a mica é revestido (Fig. 1a).
- Após o revestimento, o apoio da mica imediatamente, no limite, sobre um papel toalha para secar no ar ambiente (Figura 1b). A mica revestidas de gelatina pode ser usada por pelo menos duas semanas. O excesso de solução de gelatina pode ser mantido refrigerado e usado por aproximadamente um mês, basta aquecer a solução de ações para entre 60-70 ° C. Cuidados devem ser tomados para assegurar que a gelatina não é fervida durante o aquecimento.
4. Montagem de bactérias em mica revestidas de gelatina:
- Pellet 1 mL de uma cultura bacteriana (0,5-1,0 OD a 600 nm) em 800 a 4500 rcf. Dependendo da bactéria, use o mínimo rcf que irá agregar as células em ~ 5 minutos.
- Lavar o sedimento em um mesmo volume de água filtrada ou deionizada buffer.
- Coletar as células por centrifugação novamente.
- Ressuspender o sedimento em 500 mL de imediato de água deionizada NanoPure ou buffer. (A suspensão bacteriana deve ser visivelmente turva, a fim de ter uma concentração adequada de células para AFM).
- Aplicar a suspensão de células (10-20 mL) para a mica revestidas de gelatina e espalhe sobre a superfície usando uma ponteira de pipeta (Fig. 1c). Cuidados devem ser tomados para não tocar fisicamente a superfície da gelatina com a ponta da pipeta enquanto aplica ou espalhar a solução bacteriana.
- Permitir que a superfície em repouso por 10 minutos e enxágüe com um fluxo de água ou tampão (Fig. cd 1). Durante todo o procedimento, tome cuidado para assegurar que a amostra não é permitida para secar.
5. Resultados representativos:
A Figura 2 mostra imagens de exemplo de células bacterianas que foram montadas em gelatina-revestido mica e fotografada pela AFM. Em nossos laboratórios, amostras são tipicamente fotografada usando um microscópio de força atômica PicoPlus (Agilent Technologies, Temple, AZ) equipado com uma cabeça de digitalização 100 mm. O instrumento é operado em 128-512 pixels por linha de varredura a uma velocidade de varredura de linhas de 0,5-1,0 / s. As vigas que são normalmente utilizados são sondas Veeco nitreto de silício (MLCT-AUHW, Veeco, Santa Barbara, CA) com constantes primavera nominal variando ,01-0,1 nN / nm.

Figura 1. Gelatina a uma temperatura de 60-70 ° C é colocado em um copo de 20 ml. Usando um par de pinças recém clivada quadrados de mica são totalmente imerso na gelatina (a) retirada e colocada na vertical sobre uma toalha de papel encostado a um rack de micro centrífuga (b). Uma gota de amostra bacteriana é colocada sobre a mica e espalhar com a ponta da pipeta em ambas as direções X e Y (c). Depois de permitir que a amostra para incubar na superfície mica de pelo menos 10 minutos, lavar a amostra em um fluxo de água destilada. Se a imobilização trabalhou você será capaz de ver uma mancha opaca na mica, como mostrado no painel direito de (d). Se a imobilização não trabalho que você vai pegar um pedaço de mica clara como no painel esquerdo. A mancha opaca na balança mica para a concentração das bactérias na gota que você coloque na mica gelatina tratada.
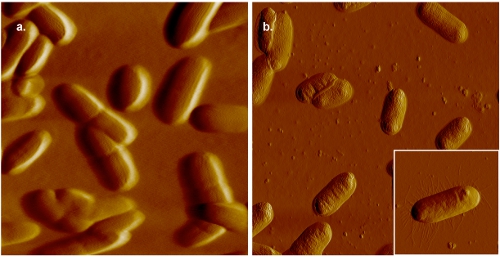
Imagens figura 2. AFM da E. coli. No painel (a), as células são montadas em gelatina-mica revestidas e fotografada em 0,005 M PBS. Para efeito de comparação, uma imagem de células bacterianas montados em gelatina-mica e revestido com imagens no ar é mostrado no painel (b). Embora septos são claramente visíveis em imagens coletadas no estado líquido, maior a resolução, como indicado pela presença de pili (painel inset (b)), podem ser obtidas no ar.
Discussão
Vários fatores podem afetar célula microbiana de montagem e de imagem por AFM. A gelatina que é usado para o revestimento da mica é importante. Comercial de gelatina é isolado a partir de um número de vertebrados, incluindo peixes, vacas e porcos. Tanto a origem eo método de processamento de determinar a adequação da gelatina para imobilização de bactérias. Várias fontes e tipos de gelatina foram avaliados quanto à sua eficácia em bactérias imobilizar [1]. As duas gelatinas mais eficazes foram encontrado...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Esta pesquisa é patrocinada pelo Escritório de Pesquisa Biológica e Ambiental, Departamento de Energia dos EUA e por subvenções do Conselho de Pesquisa em Saúde da Virginia Commonwealth. Oak Ridge National Laboratory é gerenciado por UT-Battelle, LLC, para o Departamento de Energia dos EUA sob o n º do contrato DE-AC05-00OR22725.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Companhia | Número de catálogo | |
| Gelatina | Sigma, St. Louis, MO | G6144, G2625 ou G2500 | |
| PicoPlus Microscópio de Força Atômica | Agilent Technologies, Tempe, AZ | ||
| Cantilevers AFM | Veeco, Santa Barbara, CA | MLCT-AUHW |
Referências
- Bernal, R., Pullarkat, P. A. Mechanical properties of axons. Phys Rev Lett. 99, 018301-018301 (2007).
- Bray, D. Axonal growth in response to experimentally applied mechanical tension. Dev Biol. 102, 379-389 (1984).
- Chetta, J., Kye, C. Cytoskeletal dynamics in response to tensile loading of mammalian axons. Cytoskeleton (Hoboken). 67, 650-665 (2010).
- Dennerll, T. J., Lamoureux, P. The cytomechanics of axonal elongation and retraction. J Cell Biol. 109, 3073-3083 (1989).
- Fu, S. Y., Gordon, T. The cellular and molecular basis of peripheral nerve regeneration. Mol Neurobiol. 14, 1-2 (1997).
- Gray, C., Hukkanen, M. Rapid neural growth: calcitonin gene-related peptide and substance P- containing nerves attain exceptional growth rates in regenerating deer antler. Neuroscience. 50, 953-963 (1992).
- Heidemann, S. R., Buxbaum, R. E. Tension as a regulator and integrator of axonal growth. Cell Motil Cytoskeleton. 17, 6-10 (1990).
- Heidemann, S. R., Buxbaum, R. E. Mechanical tension as a regulator of axonal development. Neurotoxicology. 15, 95-107 (1994).
- Heidemann, S. R., Lamoureux, P. Cytomechanics of axonal development. Cell Biochem Biophys. 27, 135-155 (1995).
- Iwata, A., Browne, K. D. Long-term survival and outgrowth of mechanically engineered nervous tissue constructs implanted into spinal cord lesions. Tissue Eng. 12, 101-110 (2006).
- Lamoureux, P., Heidemann, S. R. Growth and elongation within and along the axon. Dev Neurobiol. 70, 135-149 (2010).
- Lamoureux, P., Zheng, J. A cytomechanical investigation of neurite growth on different culture surfaces. J Cell Biol. 118, 655-661 (1992).
- Lindqvist, N., Liu, Q. Retinal glial (Muller) cells: sensing and responding to tissue stretch. Invest Ophthalmol Vis Sci. 51, 1683-1690 (2010).
- Loverde, J. R., Ozoka, V. C. Live Imaging of Axon Stretch Growth in Embryonic and Adult Neurons. J. Neurotrauma. , (2011).
- Lu, Y. B., Franze, K. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci U S A. 103, 17759-17764 (2006).
- O'Toole, M., Lamoureux, P. A physical model of axonal elongation: force, viscosity, and adhesions govern the mode of outgrowth. Biophys J. 94, 2610-2620 (2008).
- Pfister, B. J., Bonislawski, D. P. Stretch-grown axons retain the ability to transmit active electrical signals. FEBS Lett. 580, 3525-3531 (2006).
- Pfister, B. J., Gordon, T. Biomedical Engineering Strategies for Peripheral Nerve Repair: Surgical Applications, State of the Art, and Future Challenges. Crit Rev Biomed Eng. 39, 81-124 (2011).
- Pfister, B. J., Iwata, A. Extreme stretch growth of integrated axons. J Neurosci. 24, 7978-7983 (2004).
- Pfister, B. J., Iwata, A. Development of transplantable nervous tissue constructs comprised of stretch-grown axons. J Neurosci Methods. 153, 95-103 (2006).
- Siechen, S., Yang, S. Mechanical tension contributes to clustering of neurotransmitter vesicles at presynaptic terminals. Proc Natl Acad Sci U S A. 106, 12611-12616 (2009).
- Smith, D. H. Stretch growth of integrated axon tracts: extremes and exploitations. Prog Neurobiol. 89, 231-239 (2009).
- Smith, D. H., Wolf, J. A. A new strategy to produce sustained growth of central nervous system axons: continuous mechanical tension. Tissue Eng. 7, 131-139 (2001).
- Weiss, P. Nerve patterns: The mechanics of nerve growth. Growth, Third Growth Symposium. 5, 163-203 (1941).
- Zheng, J., Lamoureux, P. Tensile regulation of axonal elongation and initiation. J Neurosci. 11, 1117-1125 (1991).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados