このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生殖障害を持つヒトで同定されたGC -リッチなKISS1受容体配列の遺伝的変異の変異導入と解析
要約
キスペプチン受容体(KISS1R)の変異は患者の生殖障害に関連付けられています。ここでは、免疫沈降とウェスタンブロットによる受容体の分解経路を特徴づけるためにKISS1RのGC -リッチ配列と同様にKISS1Rの構文の使用に関心の突然変異を導入する方法について説明します。
要約
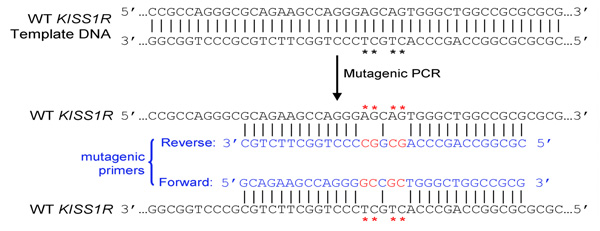
キスペプチン受容体(KISS1R)は思春期の引き金と成人1,2,3の生殖能力の調節因子として認識され、Gタンパク質共役型受容体です。患者で同定KISS1Rの不活性化変異がiodiopathic低ゴナドトロピン性性腺機能低下症(IHH)1,2と思春期早発症4に関連している。これらの変異体の機能的研究は、この受容体による生殖の調節だけでなく、病気の結果を整形したものと、結果は異常KISS1Rシグナリングと機能からの根底にあるメカニズムの理解にとってきわめて重要である。しかし、KISS1Rの遺伝子の高度にGC -リッチ配列は、それはかなり困難な突然変異を導入またはPCRによってこの受容体をコードする遺伝子を増幅することができます。
ここでは、我々の研究室で十数KISS1R変異体を介して生成するために正常に使用されているこの非常にGCリッチな配列に興味の変異を導入する方法を説明します。我々はKISS1Rシーケンスで置換、欠失又は挿入を含むKISS1R変異体の範囲の増幅を促進するためのPCR条件を最適化してきました。 PCRエンハンサー溶液の添加は、同様にDMSOのわずかな割合のような増幅を向上させるために特に有用であった。この最適化された手順は、他のGCリッチなテンプレートの役に立つかもしれません。
KISS1Rをコードする発現ベクターは、変異がKISS1R機能を変更すると関連する生殖表現型に導く方法を理解するために、この受容体のシグナル伝達と機能を特徴付けるために使用されています。従って、部位特異的突然変異誘発により生成されたKISS1R変異体の潜在的なアプリケーションは、多くの研究1,4,5,6,7,8によって説明することができます。例として、思春期早発症に関連付けられているKISS1R(Arg386Pro)、、の機能獲得型変異はKISS1R 9の分解速度を変化させるリガンド刺激4と同様に受容体の応答性を延長することが示されている。興味深いことに、我々の研究は、ほとんどのGタンパク質共役受容体9のために説明古典リソソーム分解するのではなく、KISS1Rはプロテアソームにより分解されることを示している。ここで紹介する例では、KISS1Rの劣化は、一時的にmycタグKISS1R(MycKISS1R)を発現するヒト胎児腎臓細胞(HEK - 293)で検討されており、プロテアソームやリソソーム阻害剤で処理した。細胞溶解物をウェスタンブロット分析に続いてアガロース結合抗- myc抗体を用いて免疫沈降している。ブロット上MycKISS1Rの検出および定量は、LI - CORのオデッセイ赤外線システムを使用して実行されます。このアプローチでは、同様に関心のある他のタンパク質の分解の研究に有用である。
プロトコル
1。非常にGC -リッチなKISS1Rの遺伝子配列の部位特異的変異誘発
- テンプレート:そのN末端に融合させたMycタグとの人間KISS1Rの完全なcDNA配列。このシーケンスは、その後、トランスフェクションに使用される哺乳動物細胞株との互換性があるpCS2 +発現ベクターにクローニングされています。この発現ベクターは、pCS2 + MycのKISS1Rと称する。
- プライマーの設計プライマーはQuikchange部位特異的突然変異誘発キット(Stratagene社)の指示にしたがって、所望の変異を運ぶために設計されています。要約すると:
- 両方(フォワードおよびリバース)プライマーは、所望の変異を含み、プラスミドの反対の鎖に同じシーケンスにアニールする必要があります(例えば、フォワードプライマーとリバースプライマーは、互いに相補的である)
- プライマーは25〜45塩基長および1つまたは複数のCまたはG塩基で終了してください
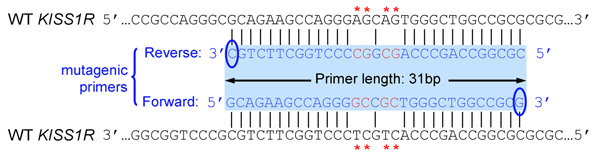

- 導入された変異(s)はプライマーの中央になると両側に正しいシーケンスの〜10月15日基地が隣接してください
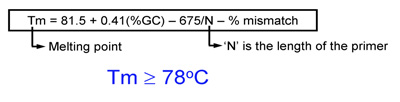
- プライマーの融解温度(Tm)が等しいか、または78℃以上でなければなりませんTmを推定するためには、次の式を使用します。
- 変異を導入した場合:Tm値= 81.5 + 0.41(%GC) - 675 / N - %のミスマッチ(Nは塩基のプライマーの長さです)
- - 675 / N(Nは、挿入または削除されている塩基を含んでいない)のTm = 81.5 + 0.41(%GC):挿入または欠失を導入した場合
- 脱塩プライマーを(必要に応じてそれ以上の精製)を使用してください。
- 両方(フォワードおよびリバース)プライマーは、所望の変異を含み、プラスミドの反対の鎖に同じシーケンスにアニールする必要があります(例えば、フォワードプライマーとリバースプライマーは、互いに相補的である)
- 最高の増幅条件は、PCRxエンハンサー溶液(Invitrogen社)とDMSOの添加が含まれています。例えば4%と8%とDMSOの少なくとも2濃度は、、テストする必要があります。 PCR条件は、Iと図1の表に示されている、とpCS2 + MycKISS1Rの代表的なPCR増幅の結果を図2に示されています。
- DpnIの10倍NEBuffer 42μlを持つPCR産物の遠心分離管の17.5μlのミックスと0.5μl(;ニューイングランドバイオラボ10U):37℃で1時間30分間DpnIによるメチル化DNAの消化により、増幅産物について、親のDNAを排除する。
- XL10 - GoldをUltracompetent E.の45μlをDpnI処理DNAのミックス2μlの:DpnI処理したPCR産物を変換あらかじめ冷却した15 mlの細胞培養チューブの大腸菌 (ストラタジーン社製)。 β-メルカプトエタノールの2μlのを追加し、Stratagene社の指示に従ってください。プレート37100μg/mlアンピシリンとインキュベートを含むLB -寒天プレートで形質転換されたバクテリア℃の100 -400μl
- ミニプレップ2〜4個のコロニーは、プラスミドDNAを単離する。単離されたDNAの塩基配列決定と解析による所望の変異の導入に成功を確認してください。
2。 HEK - 293細胞へのMycKISS1Rの一過性トランスフェクション
- 以下の実験は37℃CO 2インキュベーター(5%CO 2)で培養したヒト胎児腎臓細胞(HEK - 293)で実行されます° DMEMでCは、10%ウシ胎児血清(FBS)および1%ペニシリン/ストレプトマイシンを補充した。
- シード6ウェルプレートにHEK - 293 2.5x10 5細胞/ mlの細胞は、それらを37℃で一晩増殖° Cをトランスフェクションの前にしましょう。注:(i)各実験条件に対して3つのウェルを使用すること、(ii)トランスフェクション時の理想的な細胞の合流は30%〜50%である。
- トランスフェクションHEK - 293、製造元の指示に従ってGenePorterトランスフェクション試薬(Genlantis)を用いて細胞、:DNA /ウェルの1μgの積算に0.5μgpCS2 + MycKISS1Rプラス0.5μg制御(空の)ベクトルと無血清DMEMのミックスの半分。トランスフェクトしたDNAのμgのあたり10μlをトランスフェクション試薬を使用して残りの半分を混ぜる。注:理想的なプラスミドDNAの濃度は異なる場合があります。
3。細胞治療と溶解
- トランスフェクション後24時間、1ミリリットルDMEM、2.5%FBSを(細胞の代謝を減少させる)を含むと、細胞培地を交換してください。注意:血清中のこの減少は、容易に、および/または結果の検出を増幅することができる。
- リソソーム阻害剤(100μg/ウェルロイペプチンの)直接重ね全体を6ウェルプレートの各ウェルに追加します。 37℃6または16時間(またはその他の所望の時間)のためのCを
- 直接2つの全体の6ウェルプレートの全ウェルに調製したばかりのプロテアソーム阻害剤(MG132の10μM/ウェル)を追加します。 ° C、2、4、6または16時間(または必要な時間)を37でインキュベートする。第四6ウェルプレート(0タイムポイント)の全ウェルに車両を追加し、37℃で16時間のためのC
- インキュベーションが終了すると、氷にプレートを移動し、蛋白質の劣化を防止するために、氷上でこの全体の溶解の手順を実行します。
- タンパク質の収量を高めるために、単一のCENTRで6 - ウェルプレート上に三連を組み合わせるifugeチューブ
- 培地を吸引除去し、緩衝生理食塩水氷冷リン酸塩(PBS)を1mlで細胞を1回洗浄
- 氷冷した溶解バッファー(20mMのHEPES、pH7.4の、1%NP - 40、150MMのNaCl、1mMのEDTA、0.25%デオキシコール酸ナトリウム)を含むプロテアーゼ阻害剤(1Xカクテル100mMのAEBSF - 塩酸、80μmのアプロチニン、5mMのベスタチンを含む100μLを加える各ウェルに1.5mmのE - 64、0.5M EDTA、2mMのロイペプチン及び1mMのペプスタチンA、プラス2mMのPMSF)
- チューブを遠心して細胞スクレーパーと転送細胞のライセートで細胞を取り除く
- 20ゲージの針を介して細胞〜10回を渡します。注:膜タンパク質のウェスタンブロットの検出を目的としたサンプルを超音波処理しないでください。超音波処理は、電気泳動中に正しく移行されません膜タンパク質の凝集、につながる
- ロッキングプラットフォーム上で4℃で1時間のために細胞ライセートをインキュベート
- 4℃で遠心細胞ライセート° 10,000 ×回転数と新しいチューブへの転送上清で10分間。注:このステップの間にペレットを乱さないようにする
- BCA法を用いて上清の10μlの(ピアース)でタンパク質濃度を決定する
- プロテアーゼ阻害剤を含む溶解緩衝液で1mg/mlに溶解して希釈する。
4。免疫沈降とMycKISS1Rのウェスタンブロット検出
- 氷(または4℃)で、次の免疫沈降の手順を実行します。
- 氷冷したPBSで2回アガロース結合抗- myc抗体(2.5μg/サンプル)の適切な量を洗うとライセートのタンパク質400μgにこれを追加します。
- ライセートにMycKISS1Rを免疫沈降4℃で一晩穏やかに撹拌しながらロッキングプラットフォームのC。
- 4でパルス遠心分離によってアガロースビーズをスピンダウン° C(最大10,000 ×回転数)
- 吸引し(ペレットを邪魔することなく)上清を捨てる
- 氷冷した溶解緩衝液で二回氷冷PBSで1回ビーズを洗浄する。紡績前に軽くチューブを反転
- 10パーセントβ-メルカプトエタノールを含む2 ×サンプルローディングバッファーに抗体結合MycKISS1Rを含むRessuspendビーズ。
- MycKISS1Rの免疫複合体のウェスタンブロット:
- 37℃で30分間加熱サンプル℃までの注:膜タンパク質のウェスタンブロットの検出を目的とした試料を沸騰しないでください。超音波処理と同様に、沸騰は、これらのタンパク質の凝集につながる
- 5分間氷にすぐにチューブを移動する
- 4〜15パーセントの勾配ゲルでSDS - PAGEで分離タンパク質。
- Bio - Rad社製セミドライトランスファーを使用してトランスファーバッファー中で30分間(48mMトリスベース、39mmのグリシン、1.2mmのSDS、20%メタノール、pHは9.2)のために25Vでイモビロン- FL PVDF膜(赤外線検出のため)に転送する装置
- Licorのオデッセイは、ロッキングプラットフォーム(代わりに、TBSで5%の牛乳が非特異的結合をブロックするために使用することができる)のブロッキング室温で1時間のためにトリス緩衝食塩水(TBS)とブロックで、室温で5分間メンブレンを洗浄してください。
- 4℃で一晩インキュベートメンブレン· 0.1%Tween - 20を含むブロッキング溶液でウサギ抗myc抗体(1:500)とC
- 一次抗体を除去し、0.1%Tween - 20を含むTBSで5分間ずつ(TBST)の膜を3回洗浄
- 0.1%のTween - 20、0.01%SDSを含むブロッキングバッファーでヤギ赤外線RedDye ® 800CW標識抗ウサギIgG抗体(1:10,000)と室温で1時間のための膜をインキュベート
- 、二次抗体を削除する5分だけTBSとTBSTと最後にもう一度とそれぞれの膜を3回洗浄(Tween - 20を、残りを削除する)
- LI - CORのオデッセイ赤外線イメージャを使用してMycKISS1Rのイメージングと定量化:
- 膜上MycKISS1Rは、LI - CORのオデッセイ赤外線イメージャーを用いて画像化されます。開始するには、グリッドでそれを合わせ、オデッセイのスキャナの左下隅に膜を置きます。ゴム製のマットで覆い、ローラーで気泡を滑らかにし、ふたを閉める
- コンピュータ上で新しいプロジェクトファイルを作成します。ファイルに名前を付け、"完了"をクリックし、"スキャン"でスキャナのログインを入力します。サイズスキャナのコンソールボックスお膜をフィットし、169μmの解像度と媒体の画質を選択する
- 各信号の予想される強度に応じて700(赤)および800(緑)のチャネルの強度設定を選択します。これは、信号の可視化を目的としたものであり、定量化に影響を与えません。 "スキャンを開始"をクリックします
- スキャンに名前を付けて保存し、定量化のための新しいウィンドウで開くために"OK"をクリックします。 MycKISS1Rモノマーは、約43kDで見えるはずです
- "ボックス"ツール(左側のサイドバー上で)使用して、最初のバンドの周りにボックスを描きます。 "コピー"し、すべてのバンドがで収まることを確認するの周囲にボックスをドラッグして、すべてのバンド上にボックスを"貼り付ける"
- "Ctrlキー+ A"を使用してすべてのボックスを選択し、[中央値、バックグラウンドを減算するためのオプションを選択します。上部メニューの"レポート"をクリックし、定量値とのスプレッドシートが表示されます。ここに示されている代表的な結果がrepreseです未処理の細胞上に折りたたみ式の増加(時間ゼロ)としてnted
5。代表的な結果:
- 非常にGC -リッチなKISS1Rの遺伝子配列の部位特異的突然変異誘発:
表1は、。KISS1R の増幅の効率を改善する試薬の組み合わせを示しています。この組み合わせが正常にKISS1R cDNA配列の異なる領域に対してだけでなく、この高度にGCリッチな遺伝子の増幅のために向けられたいくつかの突然変異を導入するために使用されています。図1は、KISS1Rの突然変異誘発のためのサイクリングと増幅の条件を示しています。これらの条件は、QuikChange部位特異的突然変異誘発キット(Stratagene社製)から変更されています。
図2は、この最適化されたプロトコルを使用する代表的な結果を示しています。 PCRxエンハンサーと組み合わせて4パーセントまたは8%DMSOの添加は、GC -リッチなKISS1R cDNAを含有プラスミドの増幅の収量を大幅に向上します。この代表的な実験では、4%DMSOは8%DMSOに比べてわずかに良好な増幅条件を提供した。 ultracompetent E.とDpnI処理増幅産物の変換大腸菌は、通常、1,000以上のコロニーに100を得られる、そしてDNA配列決定によって決定される所望の変異の導入に成功率は80〜90%です。 - 受容体の生理機能を研究するMycKISS1Rの構文の使用:
この代表的な実験では、最適化されたプロトコルここで説明にしたがって増幅された野生型pCS2 + MycKISS1Rは一過性MycKISS1Rを発現して、関連する細胞株(HEK - 293) の in vivo KISS1受容体の劣化で勉強するために使用されます。トランスフェクションしたHEK - 293の方法で説明されているプロトコルに従ってリソソーム(ロイペプチン)またはプロテアソーム(MG132)阻害剤で細胞を処理した後、細胞は、ウェスタンブロットのために溶解し、処理されます。底面パネルはトップパネルに表示されているバンドの定量化を示すのに対し、図3の上部パネルには、MycKISS1Rモノマーのスキャンを示しています。バンドの定量は、ロイペプチン、治療の6時間も16HのどちらがMycKISS1Rタンパク質レベルに影響を与えたことを示しています。逆に、MG132で処理すると、MG132とのインキュベーションの16時間後の受容体の45倍の蓄積で絶頂に達するこれらの細胞におけるMycKISS1Rタンパク質の時間依存的な増加となりました。これらの観察は、ほとんどのGタンパク質共役受容体とは異なり、KISS1Rはプロテアソーム(というリソソームより)により分解される、ことを示している。
| DMSO | |||
| 試薬 | 0 | 4パーセント | 8パーセント |
| 水 | 35 | 33 | 31 |
| 10倍PfuのウルトラTaqポリメラーゼバッファー | 5 | 5 | 5 |
| dNTPミックス(10mMの) | 1 | 1 | 1 |
| プライマーのセンス(25pmol/μl) | 1 | 1 | 1 |
| プライマーのアンチセンス(25pmol/μl) | 1 | 1 | 1 |
| 10倍PCRxエンハンサーソリューション | 5 | 5 | 5 |
| DMSO | 0 | 2 | 4 |
| PFUウルトラTaqポリメラーゼ(2.5U/μl) | 1 | 1 | 1 |
| プラスミドDNA(20ng/μl) | 1 | 1 | 1 |
表1:無事 GC -リッチなKISS1Rを変異と増幅に用いる試薬の組み合わせ
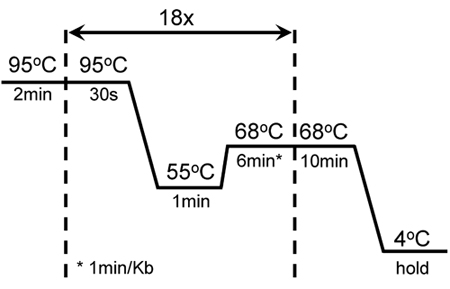
図1。 GC -リッチなKISS1Rの成功変異誘発および増幅のサイクリング条件:2分ホットスタートが95℃で30秒間の融解の18サイクル、続いていた℃、55℃でアニーリング1分間68℃、6分間の延長℃の68追加の10分の延長° Cは、最後のサイクルの終わりに追加されました。これらの設定は、QuikChange II XL -部位特異的突然変異誘発キット(Stratagene社製)のオリジナルの変異誘発のプロトコルから調整した。
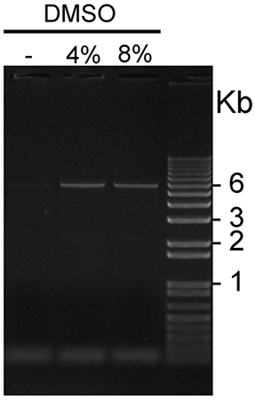
図2。 pCS2の5μlを+ Mycの0の存在下で増幅KISS1R、4または8%DMSOをエチジウムで染色したこの代表的な1%アガロースゲルにロードされた:DMSOの存在下または非存在下で増幅されたGC -リッチなpCS2 + MycのKISS1Rの可視化ブロマイドと紫外線光を使用して可視化。 6KBのプラスミドのバンドは、PCRの4%の存在下で増幅産物と8%のDMSOを搭載した両レーンではなく、PCRでロードされた最初の車線、上に表示されますDMSOの存在下で増幅産物。
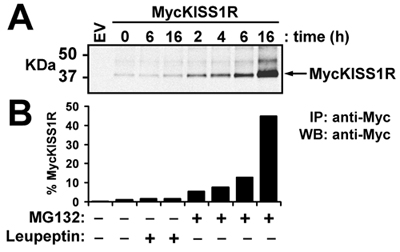
図3。 HEK - 293細胞にMycのKISS1Rタンパク質のレベルでロイペプチンまたはMG132の効果:MycのKISS1Rを発現している HEK - 293細胞を37℃で100μg/mlロイペプチンまたは10μMのMG132で処理°で指定された時間のためのC。細胞ライセートの400μg上MYC KISS1Rは、アガロース結合抗- myc抗体の2.5μgで免疫沈降とウェスタンブロットにより解析した。 IRDye 800CW標識抗ウサギとのインキュベーションに続いてウサギ抗Myc - tag抗体によるイムノブロットのインキュベーション後のMycのKISS1Rの(A)LI - CORのオデッセイの検出、使用に示すようにMycのKISS1Rのバンドの(B)定量() LI - CORのオデッセイの定量化ソフトウェア。結果は、未処理の細胞倍以上 - 増加(時間0)として表されます。
ディスカッション
部位特異的突然変異誘発法は、30年以上を対象とした遺伝子のコーディング配列でヌクレオチド変化を導入することによって、蛋白質機能を研究するために使用されています。オリジナルの技術は、英国、カナダの化学者、ノーベル賞受賞者のマイケルスミス10で1978年に記述されていた。マイケルスミスはケイリーンマリス、ポリメラーゼ連鎖反応(PCR)11を発明したアメリ?...
開示事項
利害の衝突は宣言されません。
謝辞
とチャールズHフード財団若手研究者母子保健研究賞(ボストン、マサチューセッツ州)によって - この作品の一部は国立小児保健発育研究所(R21 HD059015 NICHD)の生殖支店によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| 10倍PCRxエンハンサーソリューション | インビトロジェン | 52391 | |
| PfuUltra高忠実度DNAポリメラーゼの代替洗浄剤 | ストラタジーン | 600385 | |
| DPN - I | ニューイングランドバイオラボ | R0176 | |
| XL10 - GoldをUltracompetent E.大腸菌細胞 | ストラタジーン | 200314 | |
| DMEM | Cellgro | 10から013 - CV | |
| ウシ胎仔血清 | アトランタバイオ | S11550 | |
| Geneporterトランスフェクション試薬 | Genlantis | T201007 | |
| ロイペプチン | カルビオケム | 108975 | |
| MG132 | カルビオケム | 47491 | |
| 10xPBS | アンビオン | AM9625 | |
| プロテアーゼ阻害剤カクテルとPMSF | サンタクルスバイオテクノロジー | SC - 24948 | |
| ピアスBCAタンパク質アッセイキット | サーモサイエンティフィック | 23225 | |
| 抗Mycタグ(クローン4A6)アガロース抱合体 | ミリポア | 16から219 | |
| 2倍のローディングバッファー | BioRad社 | 161-0737 | |
| 基準のトリス- HClプレキャストゲル、4-15%の勾配 | BioRad社 | 345-0028 | |
| イモビロン- FL PVDF膜 | ミリポア | IPFL00010 | |
| オデッセイブロッキングバッファー | LI - COR Biosciences社 | 927から40000 | |
| 10xTBS | BioRad社 | 170-6435 | |
| ウサギ抗myc抗体 | 細胞シグナリング | 2272 | |
| ヤギ抗ウサギIRDye 800CW | LI - COR Biosciences社 | 926から32211 | |
| オデッセイイメージング赤外線システム | LI - COR Biosciences社 | ||
| 停止のプロテアーゼインヒビターカクテル(100倍) | サーモサイエンティフィック | 78430 |
参考文献
- Seminara, S. B., Messager, S., Chatzidaki, E. E. The GPR54 Gene as a Regulator of Puberty. N Engl J Med. 349, 1614-1627 (2003).
- de Roux, N., Genin, E., Carel, J. C. Hypogonadotropic Hypogonadism Due to Loss of Function of the KiSS1-Derived Peptide Receptor GPR54. Proc Natl Acad Sci U S A. 100, 10972-10976 (2003).
- Messager, S., Chatzidaki, E. E., Ma, D. Kisspeptin Directly Stimulates Gonadotropin-Releasing Hormone Release via G Protein-Coupled Receptor 54. Proc Natl Acad Sci U S A. 102, 1761-1766 (2005).
- Teles, M. G., Bianco, S. D., Brito, V. N. A GPR54-Activating Mutation in a Patient with Central Precocious Puberty. N Engl J Med. 358, 709-715 (2008).
- Tenenbaum-Rakover, Y., Commenges-Ducos, M., Iovane, A. Neuroendocrine Phenotype Analysis in Five Patients with Isolated Hypogonadotropic Hypogonadism due to a L102P Inactivating Mutation of GPR54. J Clin Endocrinol Metab. 92, 1137-1144 (2007).
- Semple, R. K., Achermann, J. C., Ellery, J. Two Novel Missense Mutations in G Protein-Coupled Receptor 54 in a Patient with Hypogonadotropic Hypogonadism. J Clin Endocrinol Metab. 90, 1849-1855 (2005).
- Wacker, J. L., Feller, D. B., Tang, X. B. Disease-Causing Mutation in GPR54 Reveals the Importance of the Second Intracellular Loop for Class A G-Protein-Coupled Receptor Function. J Biol Chem. 283, 31068-31078 (2008).
- Szereszewski, J. M., Pampillo, M., Ahow, M. R. GPR54 regulates ERK1/2 activity and hypothalamic gene expression in a Galpha(q/11) and beta-arrestin-dependent manner. PLoS One. 5, e12964-e12964 (2010).
- Bianco, S. D. C., Vandepas, L., Correa-Medina, M., Gereben, B., Mukherjee, A., Kuohung, W., Carroll, R., Teles, M. G., Latronico, A. C., Kaiser, U. B. KISS1R Intracellular Trafficking and Degradation: Effect of the Arg386Pro Disease-Associated Mutation. Endocrinology. , (2011).
- Hutchison, C. A., Phillips, S., Edgell, M. H. Mutagenesis at a Specific Position in a DNA Sequence. J Biol Chem. 253, 6551-6560 (1978).
- Mullis, K. B. The Unusual Origin of the Polymerase Chain Reaction. Sci Am. 262, 56-61 (1990).
- Henke, W., Herdel, K., Jung, K., Schnorr, D., Loening, S. A. Betaine improves the PCR amplification of GC-rich DNA sequences. Nucleic Acids Res. 25, 3957-3958 (1997).
- Sahdev, S., Saini, S., Tiwari, P., Saxena, S., Singh Saini, K. Amplification of GC-rich genes by following a combination strategy of primer design, enhancers and modified PCR cycle conditions. Mol Cell Probes. 21, 303-307 (2007).
- Kong, K. C., Poyner, D. R., Wheatly, M. Chapter 10. MSTA. in G Protein-Coupled Receptors: Essential Methods. , 197-204 (2010).
- Hall, R. A., George, S. R., O'Dowd, B. F. Chapter 9. G protein-Coupled Receptor-Protein Interactions. , 170-171 (2005).
- Chaturvedi, K., Bandari, P., Chinen, N., Howells, R. D. Proteasome Involvement in Agonist-Induced Down-Regulation of Mu and Delta Opioid Receptors. J Biol Chem. 276, 12345-12355 (2001).
- Shenoy, S. K., McDonald, P. H., Kohout, T. A., Lefkowitz, R. J. Regulation of Receptor Fate by Ubiquitination of Activated Beta 2-Adrenergic Receptor and Beta-Arrestin. Science. 294, 1307-1313 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved