Method Article
培養神経細胞における膜タンパク質の側方拡散とエキソサイトーシスは、蛍光回復と蛍光損失光退色を用いて評価
要約
このレポートでは、ニューロンの細胞膜に発現する外因性、pH感受性GFPタグ融合タンパク質の表面発現、輸送経路や人身売買の速度を決定するための生細胞イメージングと光退色技術の使用について説明します。
要約
プロトコル
1。細胞培養、ウイルス伝達、およびタンパク質発現
- in vitroで 14から25日(DIV)のポリ-L-リジンコートしたカバーガラス上に胎生18日(E18)仔ラットからの培養高密度海馬ニューロン。
- 前の超黄道pHluorin(SEP)でタグライブの実験は、目的の膜タンパク質を含む弱毒シンドビスウイルスによる形質導入細胞の6-24。
- 培地1mLのを含んでいるカバースリップに直接偽ウイルス含有培地を追加し、培養インキュベーターに戻されます。ウイルスの伝達以下のタンパク質発現のための力価と時間は、ウイルスのバッチによって異なりますし、前の生細胞の実験を開始するにバッチごとに決定されるべきである。
2。 FRAP-FLIP生細胞イメージング
- 機器のセットアップ
- ツァイスAxiovert LSM 510 META共焦点顕微鏡の撮像室にカバースリップを転送します。撮影時に電力の変動を最小限に抑えるために、顕微鏡イメージングの前に少なくとも20分間、100%のレーザー出力で、オンされていることを確認。
- すぐに、140 mM NaClを含む予め温めておいた(37°C)細胞外記録液、5mMのKClを、15 mMグルコース、1.5mMのCaCl 2を 、1.5mMのMgCl 2、20〜25 mMのHEPES(pHに調整して培養液を交換するNaOHで7.4)とツァイスAxiovertの予熱段階(37℃)に室を配置します。
細胞外記録液の浸透圧があなたの培地の10浸透圧範囲内に調整されていることを確認してください。有意な蒸発実験の経時中に発生しない限り、このCO 2の独立したソリューションは、短期実験(<10時間)に適しています。 1から2 mMの炭酸水素ナトリウムで補完することをお勧めします。
- 画像のキャプチャパラメータを定義する
- まず、組換えプロを表現するニューロンを同定興味のあるテインとフォーカスにそれをもたらす。
- 63X油は反対に、低レーザパワーで488nmのレーザー光の励起を使用してセル全体のイメージを取得します。退色最小限に抑えるために、(512から512)総走査速度<1秒維持速い公称速度(7-9)と低画素の解像度を使用します。
- ROIを(〜1.5から2.5倍光学ズーム)を含むフレームをキャプチャした画像とズームの樹状突起の部分を選択します。可能であれば、リファレンス·樹状突起からの測定値を得ることができるように、視野が発生している非特異的買収による退色かどうかを判断するために、いくつかのプロセスが含まれていることを確認してください。
- フィルター、ピンホール、スキャン速度と最小のレーザー励起からではなく、限られた彩度の最大の蛍光を有効にするには、検出器のゲインを調整します。大きなピンホール径(2μmのは、棘と三元樹状突起に適しています)光子コレクションを最大化するために、推奨されます。検出器のゲインは、小さな蛍光増分を検出するのに十分な強さでなければなりません退色する前に、非常に最初のイメージは、飽和ピクセルの10%を克服しないような。
- 実験のプリ/ポスト·漂白剤と回復の段階に使用するこの設定を保存します。
- 次の退色領域を定義し、後続の反復的な退色相の初期退色と隣接領域のROIを選択します。フランキング領域(通常は5μm以下、図を参照してください。2)スキャンの間に拡散して、リカバリを防止するために十分な幅であることを確認します。
- 退色のROIの両方の漂白パラメータを調整します。初期の光退色は、光学ズームとROIのボリュームに応じて、1-5回の反復の間に必要な迅速な(0.1〜0.5秒)でなければなりません。隣接する地域では、レーザー励起は光毒性が損傷することなく、隣接領域の連続光退色を確保するために調整する必要があります。
- ガイドラインとして、我々は最初の光退色に100%のレーザー励起を使用して、反復的な退色のpHは10%ASE。
- 画像収集
- すべてのパラメータが設定されていたら、以下の4ブロックで説明されている変数タイムラプスイメージシーケンスとしてFRAP-FLIPの実験を、実行します。
ブロック1:3-10プレ漂白剤のベースラインイメージ、低レーザパワーで、時間がないの遅延
ブロック2:光退色完全なレーザーパワーで中心的なROI、1-5回の反復
ブロック3:3-10ポスト漂白リカバリイメージ
ブロック4:1の典型的な時間間隔で画像キャプチャを持つ媒体のレーザーパワーで隣接領域の繰り返し退色 - 5秒、調査中のタンパク質の回収率に応じて。 - 最後に、140mMのNaCl、5 mMの塩化カリウム、15mMのグルコース、1.5mMのCaCl 2を 、1.5mMのMgCl 2、20〜25 mMのMES(蛍光クエンチするために)または50 mMの補完を含むpH6ででバッファ記録液で細胞外記録のソリューションを置き換える90 mM塩化ナトリウム、5 mMの塩化カリウム、15mMのグルコース、1.8 mMのCaCl 2を 、0.8mMの塩化アンモニウムを含むのMgCl 2、20から25 mMのHEPES、pH7.4の(低pH細胞内貯蔵中のタンパク質を明らかにする)、(図2参照)。
- 統計分析を有効にするには、それぞれの組換えタンパク質に対して少なくとも10から20のデータセットを収集します。バイアスの結果を避けるために、撮像条件は、複製され一貫した維持されていることを確認してください。任意のデータを破棄する不完全な漂白、重要な焦点面のドリフトや光毒性細胞の損傷が観察されている場所を設定します。
- すべてのパラメータが設定されていたら、以下の4ブロックで説明されている変数タイムラプスイメージシーケンスとしてFRAP-FLIPの実験を、実行します。
3。データ解析
- ImageJのソフトウェアで画像を開きます。
- Stackregプラグイン(プラグイン→stackreg→変換を用いた時系列全体で発生した可能性があり、xy平面の小さな変動を考慮するためにスタックを整列:剛体→ 。)
- ツァイス焦点で撮影した画像は、テキストファイルとして、時刻の値を報告するLSM Toolboxのプラグインを使用する(プラグイン→LSMツール]→[LSMツール→ → )および分析のスプレッドシートにこれらの値をインポートします。
- FRAP-FLIP実験中の蛍光の変動を測定するために、個々の画素領域(〜20pixels)に退色セグメントを分割し、各時点(F)でこれらのROIの平均蛍光を測定します。すぐにこれらの値を取得するには、ImageJの "ROIマネージャ"分析ツール(→ツール→ROI Managerを分析する)を使用して複数のROIを選択し、 "プロットZ軸プロファイルのコマンドを実行します(使用して、ピクセルあたりの平均蛍光を報告画像→スタック→プロットZ軸のプロファイル)。
- 背景は、非蛍光の領域の蛍光強度を測定するには、この手順を繰り返します。
- 実験的なノイズを除去し、平均プリ漂白ベースラインの測定ですべての値を分割してバックグラウンド値を差し引くことにより、各時点で蛍光強度を正規化します。
- 非特定のレベルを評価するために隣接する非退色樹状突起の蛍光強度を測定する取得中に退色。非特定の退色の補正は "FRAP-FLIPのデータの解釈のために推奨され、可能な限り避けるべきである。
- 大幅な回復はROIで行われた場合に計算するには、最初の5〜10の対策(ΔF)の平均値から、シーケンスの最後の5から10までの対策の平均値を減算し、統計的有意性を決定します。エキソサイトーシスのパターン(すなわち、エキソサイトーシスのホットスポットや背骨対シャフトの回復)を評価するための回復と非回復ROIを分類します。
4。代表的な結果
典型的なFRAP-FLIP実験の結果は、図に示されています。 2。ここでは、9月でタグ付けのAMPA型グルタミン酸受容体のサブユニットGluA2を表現するニューロンが選択的に樹状突起の領域に沿って退色しています。図2.Aは、イメージングと(ホワイトボックス領域)退色のために選択されているROIを示していますされている樹状突起の領域を示しています。番目の電子大きな白いボックス領域が二重に向かっ青矢印で強調表示された隣接するボックス領域の漂白繰り返し、続いて一回漂白されました。赤い矢印が下のパネルで高倍率に示すように、測定されたROIを示しています。
図2.Bは、実験の時間経過とともに測定したROI内の蛍光強度を示しています。この例では、1分間の回復期間は無漂白の受容体は横方向の拡散によってROIを入力できるようにするための最初の光退色後に記録した。フランキング領域を退色されている場合、受容体のこの非常に運動性の画分からの蛍光シグナルは、中央領域から遮蔽されており、地域内のものは外で希釈されています。 "FLIP"シーケンスにわたって観察蛍光(ΔF)の増加は、したがって、樹状シャフトのSEP-GluA2の挿入に起因することができます。低pHの洗浄とpH 7.4 +塩化アンモニウムに加え、それぞれ測定した蛍光は、表面から導出されていることを確認タンパク質や測定ROI内の細胞、隔離タンパク質の割合を明らかにした。
FRAPとは対照的に、この方法論は退色領域の蛍光の回復を大幅に低減レベル、その結果、エキソサイトーシスによる回復を分離します。ない信頼性の数学的モデルを常にないようにすると、この選択的な漂白技術を使用して記録された回復トレースを適合し、分析するために開発されました。それはモノ指数回復で回復のトレースに合うように、しかし可能です:
F(T)= S 0 - E(-t /τ)の
F(t)は時刻tでの蛍光である場合には、sは 、定常状態の値である0は時間0でのオフセットで、τは時定数である。回復の伸びは、挿入と拡散の間で定常状態に対応する平衡に到達するために与えられたレートで固定されています。重要なのは、時定数は、このから抽出されたnalysisはエキソサイトーシスの時定数を反映していないだけで個々のタンパク質の比較処理に使用することができます。
また、蛍光回復の予想パターンは、退色領域に沿ってサブドメインで観察される可能性がある。退色セグメント内の小さなROIの分析は、エキソサイトーシス "ホットスポット"を明らかにするために不可欠である可能性があり、それは計算速度に影響を与える樹状突起の間でこれらのスポットの密度のばらつきと同程度の長さの領域を解析することをお勧めします。
図3は、ビューのフィールドに複数の樹状突起を持つ大規模なセクションのROIに光退色を適用し、このプロトコルの拡張を示しています、1つだけの樹状突起の漂白選択の繰り返しが続く。このアプローチは、従来の "FRAP"と並行して取得するための "FRAP-FLIPのデータを有効にします。この例では、海馬ニューロンは、カイニン酸クラスのグルタミン酸受容体サブユニットに感染している。GluK2 SEP-タグが付けられます。 PRIOrは、イメージング、これらのニューロンは、されたタンパク質合成をブロックするために、cylcohexamide(200μg/mlで約2時間)で処理した。それぞれの測定されたROI(図3.B)のような、蛍光回復としては、 "FRAP-FLIP 'プロトコルに受ける樹状突起に単独でリサイクル対標準FRAPの樹状突起の側方拡散やリサイクルによる回収の割合を明らかにする。 FRAP対"FRAP-FLIP"の回復曲線からΔF値を比較し、リサイクル(ΔFREC = 11.05パーセント)対側方拡散(ΔF のdiff = 9.35パーセント)の相対的な寄与を推測することができます。図2とは異なり、回復はタンパク質合成の阻害に起因するではなく、定常状態のレベルを維持していませんが、観察可能な受容体プールの枯渇(に相当する約20%減少し、信号の一時的増加、ドロップオフ、後続を示しています。記録期間)。
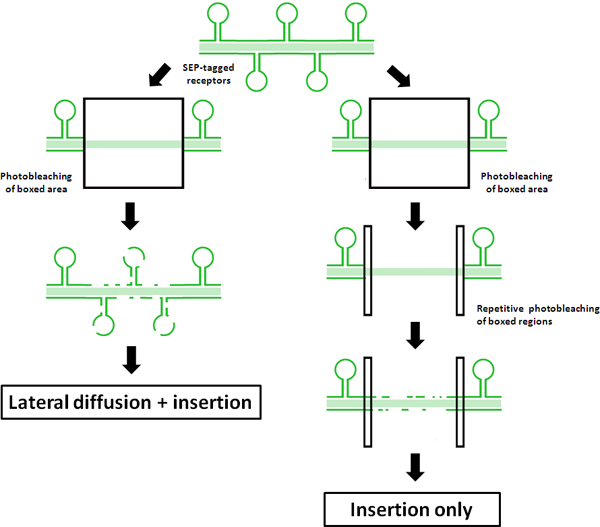
図1。FRAP FRAP VS-FLIPプロトコルのプリンシパルの模式図この図は、SEP-タグ付き受容体を使用して、 "FRAP-FLIP 'プロトコルに対する定期的なFRAPの成果を示しています。従来のFRAPの蛍光回復が左側に表示されます。中央のROIの測定蛍光回復は、リサイクルおよび/ または樹状シャフトにde novoのエキソサイトーシスを介して退色ROIと受容体の挿入、外部からの側方拡散fは非退色SEP-タグ付き受容体の組み合わせに起因しています。対照的に、右側に示す隣接するROIの反復的な退色は、横方向に拡散するためにどのようにこの更新 "FRAP-FLIP 'プロトコル無音の回復を示しています。このように、任意の測定した蛍光の回復がROIの直接挿入に起因することができます。
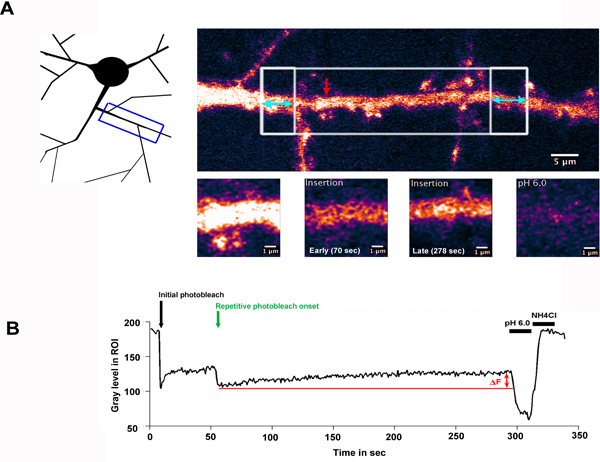
図2。樹状突起軸に細胞膜にSEP-GluA2の挿入
A)SEP-GluA2を発現している海馬のニューロンは、選択的に樹状突起の領域に沿って退色。回路図は、左上のパネルには、退色のために選択されているROIを浮き彫りにしながら、撮像された樹状突起の領域を示しています。大きな白いボックス領域が二重に向かっ青い矢印で強調表示され、隣接するボックス領域の漂白繰り返し、続いて一回漂白されました。このパネルには、退色する前に樹状突起を示しています。赤い矢印が下のパネルで高倍率に示すように、測定されたROIを示しています。 B)実験の時間経過とともに測定したROI内の蛍光強度、ROI内のグレーレベル(正規化されていない)としてプロットを示しています。黒い矢印のハイライトは、初期の光退色と緑色の矢印のタイムポイントは、繰り返し退色の開始を示します。 ΔFは、THを示します。樹状シャフトにSEP-GluA2の挿入による回復期間中に観察され蛍光のe増加しました。その後の低pHとpH 7.4 + NH 4 Clの洗浄、回収蛍光が発現して受容体を表面に関連していることを確認します。
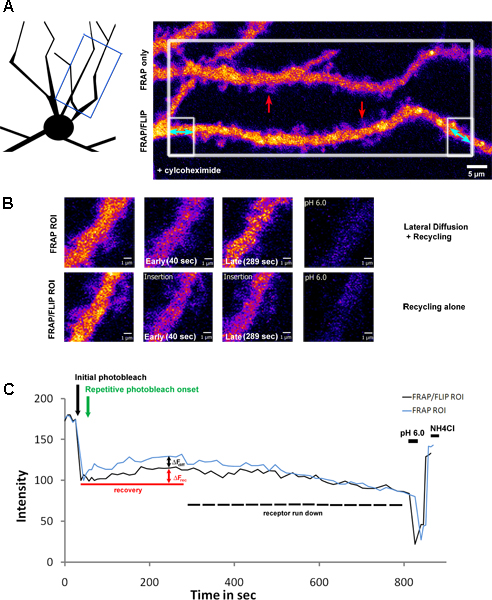
図3シクロヘキ治療後の樹状突起軸にリサイクル&SEP-GluK2の横方向の拡散対のリサイクル
A)海馬ニューロンは並列FRAPと独立した樹状ROIをに沿って実行"FRAP-FLIPの回復プロトコルと選択的に退色SEP-GluK2を発現する。このニューロンは(200μg/ mlの2時間)タンパク質合成をブロックするために、シクロヘキサミドによる前処理の対象となった。回路図は、左側のパネルには、退色のために選択されているROIを強調しながら、撮像された樹状突起の領域を示しています。番目の電子大きな白いボックス領域が二重に向かっ青矢印で強調表示された唯一の低樹状突起の隣接ボックスの領域、の漂白繰り返し、続いて一回漂白されました。このパネルは、前の退色への樹状突起を示しています。赤い矢印は"FRAP-FLIP 'プロトコルと従来のFRAPの蛍光回復を示す)Bで高倍率に示すように、ROIを強調表示します。回復の後期(第三パネル)における蛍光強度のレベルの比較だけではリサイクル対側方拡散やリサイクルの寄与を示しています。C)は、実験の時間経過とともに測定したROI内の蛍光強度を示し、正規化強度としてプロット値を示します。黒い矢印のハイライトは、初期の光退色と緑色の矢印のタイムポイントは、繰り返し退色の開始を示します。 ΔFRECは FRAP / FLIP樹状突起から決定受容体のリサイクルのために一時的な回復を示し、一方、ΔFdiff 'はFRAPのみ"に樹状軸にROIをSEP-GluK2の側方拡散の寄与を測定します。一時的な増加は、シクロヘキ治療の結果として利用できる受容体のダウンの実行に対応する信号が徐々に減少し、続いています。その後の低pHとpH 7.4 + NH 4 Clの洗浄、回収蛍光が発現して受容体を表面に関連していることを確認します。
ディスカッション
我々は、原形質膜タンパク質輸送のコンポーネントを可視化する革新的な戦略について説明します。 SEP-tagタンパク質の退色技術のコンビナトリアルアプローチは、細胞膜の挿入イベントを評価することを選択できます。継続的に回復中にフランキング領域で膜タンパク質を退色することにより、 "FRAP-FLIP 'メソッドは蛍光回復への小胞輸送の寄与を評価しています。この新しいアプローチは、決定される定常状態での回復が観察されたサブコンパートメントの数と回復(ΔF)の振幅の両方を有効にすると、タンパク質の膜挿入の直接録音することができます。さらに、FLIPの有無にかかわらずFRAPの比較が計算される横方向の拡散への回復の割合が起因することができます。
また、同じ実験では、隣接退色領域に隣接する非退色樹状突起の領域は、することができます質的に回復中に評価、これらの地域で観察された蛍光損失が樹状突起のこれらの非退色セグメントに退色受容体の側方拡散に起因します。
この選択退色プロトコルはそのような(例えば、樹状突起または棘)またはパラレルFRAPを行うことにより、横方向の拡散対挿入の寄与を評価し、 "FRAP定義されているサブ領域で細胞膜にexcocytosisを特徴づけるように細胞輸送過程の様々な調査をするために利用することができます。隣接した樹状突起に沿って、FLIP "プロトコル(図3)。
具体的なガイドラインが提示されてきたが、明らかに、各ラボでは、特定の標本や機器に係る撮像パラメータを最適化する必要があります。重要なのは、ROI内のすべての表面受容体は、退色z軸焦点面の独立したが、かなり光毒性損傷または非特定の退色せずにしておく必要があります。私達細胞体では、このプロトコルをしようとすると、ERSは、これらの地域では比較的低pH細胞内区画高いバックグラウンド蛍光の典型的結果の割合が高いので、注意が必要です。また、事前に選択的光退色実験を開始する、方法を変える我々はこの技術がどのように適用できるかを実証した一方で新しいSEP-タグ付きの構築、我々は、タグ付き受容体の初期特性は、最初アシュビーらによって前述のように、行われることをお勧めし2。
全体的に、このメソッドは、ほぼリアルタイムで評価される細胞膜に挿入イベントを有効にすると、標準FRAPプロトコルの強力かつ汎用性の高い適応したものです。
開示事項
利害の衝突が宣言されません。
謝辞
我々は、財政支援のためにWellcome TrustとERCに感謝しています。 IMGGはEMBOフェローです。 KLHは、BBSRCの資金博士課程の学生です。我々は、顕微鏡による保守と支援のための技術的および細胞培養支持体と博士アンドリュー·ドハーティのためにフィリップ·ルービンとパトリックTidballに感謝します。
資料
名前会社概要カタログ番号コメント(オプション) 1mg/ml 2% 1% 2mMの/ 0.8mmの 10%のみ
| Name | Company | Catalog Number | Comments |
| 24ミリメートルカバーガラス | VWRインターナショナル | 631-0161 | |
| ポリ-L-リジン | シグマ | P2636 | |
| Neurobasal中 | インビトロジェン | 21103 | |
| B27 | インビトロジェン | 17504-044 | |
| ペニシリンストレプトマイシン | シグマ | P0781 | |
| L-グルタミン | インビトロジェン | 25030 | |
| ウマ血清 | Biosera | DH-291H | |
| pSIN ReP5クローニングベクター | インビトロジェン | K75001 | シンドビスウイルス産生のために |
| LSM510 META共焦点システム | ツァイス | ||
| 画像Jソフトウェア | NIH | オープンアクセスソフトウェアです。本明細書に記載のすべてのプラグインがご利用いただけます http://rsbweb.nih.gov/ij/plugins/ |
参考文献
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- Ashby, M. C., Ibaraki, K., Henley, J. M. It's green outside: tracking cell surface proteins with pH-sensitive GFP. Trends Neurosci. 27, 257-261 (2004).
- Swaminathan, R., Hoang, C. P., Verkman, A. S. Photobleaching recovery and anisotropy decay of green fluorescent protein GFP-S65T in solution and cells: cytoplasmic viscosity probed by green fluorescent protein translational and rotational diffusion. Biophys. J. 72, 1900-1907 (1997).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophys. J. 73, 2782-2790 (1997).
- Wiedenmann, J., Oswald, F., Nienhaus, G. U. Fluorescent proteins for live cell imaging: opportunities, limitations, and challenges. IUBMB Life. 61, 1029-1042 (2009).
- Ashby, M. C. Removal of AMPA receptors (AMPARs) from synapses is preceded by transient endocytosis of extrasynaptic AMPARs. J. Neurosci. 24, 5172-5176 (2004).
- Bouschet, T., Martin, S., Henley, J. M. Receptor-activity-modifying proteins are required for forward trafficking of the calcium-sensing receptor to the plasma membrane. J. Cell. Sci. 118, 4709-4720 (2005).
- Ashby, M. C., Maier, S. R., Nishimune, A., Henley, J. M. Lateral diffusion drives constitutive exchange of AMPA receptors at dendritic spines and is regulated by spine morphology. J. Neurosci. 26, 7046-7055 (2006).
- Martin, S., Bouschet, T., Jenkins, E. L., Nishimune, A., Henley, J. M. Bidirectional regulation of kainate receptor surface expression in hippocampal neurons. J. Biol. Chem. 283, 36435-36440 (2008).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent membrane drift recruits AMPA receptors to dendritic spines. J. Biol. Chem. 284, 12491-12503 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved