Method Article
Laterale Diffusion und Exozytose von Membranproteinen in kultivierten Neuronen Veranlagte mit Fluorescence Recovery-und Fluoreszenz-Verlust Photobleaching
In diesem Artikel
Zusammenfassung
Dieser Bericht beschreibt die Verwendung von Live Cell Imaging und Photobleichmittels Techniken, um die Oberfläche Ausdruck, Transportwege und-handel Kinetik der exogen exprimiert, pH-sensitiven GFP-markierten Proteine an der Plasmamembran von Nervenzellen zu ermitteln.
Zusammenfassung
Protokoll
1. Cell Culture, virale Transduktion, und Protein Expression
- Kultur mit hoher Dichte hippocampalen Neuronen aus embryonalen Tag 18 (E18) Rattenbabys auf Poly-L-Lysin-beschichtete Deckgläser für 14-25 Tage in vitro (DIV).
- 6-24 Std. vor der Live-Experimente, transduzieren Zellen mit verminderter Sindbis-Virus enthält, der das Membranprotein von Interesse, mit dem Super-Ekliptik im Gegensatz zu GFP (SEP) markiert.
- In den Pseudovirion-Medium direkt auf das Deckglas mit 1 ml konditioniertes Medium und wieder in den Inkubator. Der Titer und die Zeit für die Proteinexpression nach virale Transduktion wird abhängig von der Charge-Virus und sollte für jede Charge vor Beginn lebenden Zellen ermittelt werden.
2. FRAP-FLIP Live Cell Imaging
- Gerätesatz-up
- Übertragen Sie das Deckglas auf dem Imaging-Kammer eines Zeiss Axiovert LSM 510 META konfokalen Mikroskop.Um Leistungsschwankungen während der Bilderzeugung zu minimieren, sicherzustellen, das Mikroskop eingeschaltet ist, mit 100% Laserleistung, für mindestens 20 Minuten vor der Bebilderung.
- Unmittelbar, ersetzen Sie das Kulturmedium mit vorgewärmten (37 ° C) Aufnahme extrazellulären Lösung mit 140 mM NaCl, 5 mM KCl, 15 mM Glucose, 1,5 mM CaCl 2, 1,5 mM MgCl 2, 20-25 mM HEPES (pH eingestellt 7,4 mit NaOH) und platzieren Sie die Kammer auf der vorgewärmten Bühne (37 ° C) des Zeiss Axiovert.
Stellen Sie sicher, die Osmolarität der extrazellulären Recording-Lösung, um innerhalb von 10 mOsM Ihrer Kulturmedium eingestellt. Keine wesentliche Verdampfung auftritt während der Zeitverlauf des Experiments, aber dieses CO 2-unabhängige Lösung für kurze Experimente (<10 Stunden). Die Ergänzung mit 1-2 mM Natriumbicarbonat wird empfohlen.
- Die Definition der Parameter Image Capturing
- Zuerst ermitteln die ein Neuron die Expression des rekombinanten ProProtein von Interesse und bringen sie in den Fokus.
- Mit einem 63X Öl widersprochen, erwerben Sie ein Bild der gesamten Zelle mit 488nm Laserlicht Anregung bei geringer Laserleistung. Zur Minimierung von Ausbleichen, verwenden Sie einen schnellen Nenndrehzahl (7-9) und geringen Pixel-Auflösung (512 bis 512) halten insgesamt Scan-Geschwindigkeit <1 Sekunde.
- Wählen Sie einen Teil der Dendriten zu Bild und Zoom, um einen Rahmen mit dem ROI (~ 1,5 bis 2,5 x optischen Zoom) zu erfassen. Wo möglich, sicherzustellen, das Gesichtsfeld enthält mehrere Prozesse, so dass Messungen von Referenz-Dendriten erhalten werden kann, um festzustellen, ob nicht-spezifische Photobleichen aus dem Erwerb auftritt.
- Veränderung der Filter aus, Pinhole, Scan-Geschwindigkeit und-Verstärkung, um maximale Fluoreszenz von minimal Laseranregung aber mit begrenzter Sättigung ermöglichen. Ein großer Durchmesser der Blende wird empfohlen, um Photon Sammlung zu maximieren (2 &mgr; m eignet sich für die Stacheln und ternären Dendriten). Der Detektor Gain sollte stark genug sein, um kleinen Schritten Fluoreszenz zu erkennen,derart, dass die allerersten Bilder, vor dem Ausbleichen nicht überwunden 10% aus gesättigten Pixel.
- Speichern Sie diese Konfiguration, um für die Pre-/ Post-Bleich-und Erholungsphasen des Experiments genutzt werden.
- Weiter definieren die Photobleichmittels Regionen; Auswahl eines ROI für die anfängliche Photobleichmittels und flankierenden Regionen für die nachfolgende Phase wiederholende Ausbleichen. Sicherstellen, dass die flankierenden Bereiche sind breit genug, um Recovery durch Diffusion zwischen den Scans (typischerweise 5 um, siehe Abb. 2) zu verhindern.
- Passen Sie die Parameter sowohl für Bleich-ROIs Photobleichmittels. Die anfängliche schnelle Photobleichmittel sollte (0,1-0,5 s) zwischen 1-5 Iterationen erforderlich, abhängig von der optischen Zoom und das Volumen des ROI sein. Für den flankierenden Regionen, sollte die Laseranregung eingestellt, um kontinuierliche Ausbleichen der flankierenden Regionen zu gewährleisten, aber ohne phototoxische Schäden.
- Als Anhaltspunkt gilt, verwenden wir 100% Laser-Anregung für die anfängliche Photobleichmittels, und 10% für die sich wiederholenden Photobleaching phase.
- Bildaufnahme
- Nachdem alle Parameter eingestellt sind, führen Sie die FRAP-FLIP-Experiment als Variable Zeitraffer-Bildfolge, in den 4 Blöcken im Folgenden erläutert:
Block 1: 10.03 Vorbleiche Basis-Images, bei niedrigen Laserleistung, keine Zeitverzögerung
Block 2: Photobleichmittel die zentrale ROI bei voller Laserleistung, 1-5 Iterationen
Block 3: 10.03 Post-Bleiche Recovery Images
Block 4: Repetitive Photobleichmittels der flankierenden Bereiche mit mittlerer Laserleistung mit der Aufnahme von Bildern in einer typischen Verzögerung von 1 - 5 Sekunden, abhängig von der Recovery Rate des Proteins untersucht. - Schließlich ersetzen die extrazelluläre Recording-Lösung mit Recording-Lösung bei pH 6 mit 140 mM NaCl, 5 mM KCl, 15 mM Glukose, 1,5 mM CaCl 2, 1,5 mM MgCl 2, 20-25 mM MES (zu löschen Fluoreszenz) oder ergänzt mit 50 mM gepufferten NH4Cl mit 90 mM NaCl, 5 mM KCl, 15 mM Glucose, 1,8 mM CaCl 2, 0,8 mMMgCl 2, 20-25 mM HEPES, pH 7,4 (um die Proteine im niedrigen pH-Wert intrazellulären Speichern verraten), (siehe Abb. 2).
- Sammeln von mindestens 10 bis 20 Datensätze für jede rekombinanten Proteins, die statistische Analyse zu ermöglichen. Um Voreingenommenheit Ergebnisse zu vermeiden, achten Imaging Bedingungen eingehalten werden konsistent repliziert. Entsorgen Sie Datensätze in denen eine unvollständige Bleichen, signifikante Brennebene Drift oder phototoxische Zellschädigung beobachtet werden.
- Nachdem alle Parameter eingestellt sind, führen Sie die FRAP-FLIP-Experiment als Variable Zeitraffer-Bildfolge, in den 4 Blöcken im Folgenden erläutert:
3. Datenanalyse
- Öffnen Sie die Bilder mit ImageJ-Software.
- Richten Sie die Stapel auf Rechnung für kleine Schwankungen in der xy-Ebene, die im gesamten Zeitserie im Stackreg Plugin (Plugins → stackreg → Transformation aufgetreten sein könnten: starrer Körper → ).
- Für Bilder auf konfokalen Zeiss genommen, verwenden Sie die LSM-Toolbox-Plugin, um die Zeitwerte als Textdatei (Plugins → LSM-Toolbox → Show LSM-Toolbox Bericht → → ),und importieren Sie diese Werte in einer Analyse Tabellenkalkulation.
- Um die Schwankungen bei der Fluoreszenz-FRAP-FLIP-Experiment zu messen, teilen die photogebleicht Segment in einzelne Pixel-Bereiche (~ 20pixels) und messen die mittlere Fluoreszenz von dieser ROIs zu jedem Zeitpunkt (F). Um schnell diese Werte zu erhalten, wählen Sie mehrere ROIs mit der ImageJ "ROI-Manager"-Analyse-Tool (Analyze → Extras → ROI-Manager) und melden Sie den mittleren Fluoreszenz pro Pixel unter Verwendung des 'Plot Z-Achse Profil "-Befehl (Bild → Stapel → Plot Z Profil-Achse).
- Wiederholen Sie diesen Schritt, um die Intensität der Fluoreszenz aus einem Hintergrund, nicht fluoreszierende Region zu messen.
- Normalisieren der Fluoreszenzintensität zu jedem Zeitpunkt durch Subtrahieren die Hintergrundwerte der experimentellen Rauschen zu entfernen, und teilen alle Werte durch den Mittelwert vorgebleicht Baseline-Messung.
- Messen der Fluoreszenzintensität der benachbarten nicht-photogebleicht Dendriten, die Höhe der nicht-spezifischen BeurteilungAusbleichen während der Akquisition. Korrektur für unspezifische Ausbleichen ist für die Interpretation von 'FRAP-Flip' Daten entmutigen und sollte möglichst vermieden werden.
- Um zu berechnen, wenn deutliche Erholung hat Platz in einer ROI genommen, subtrahieren Sie den Mittelwert der letzten 5-10 Maßnahmen der Sequenz aus dem Mittelwert der ersten 5-10 Maßnahmen (AF) und bestimmen die statistische Signifikanz. Kategorisieren Sie die Wiederherstellung und Rückgewinnung von Nicht-ROIs um das Muster der Exozytose (dh Exozytose Hotspots oder Wirbelsäule vs Welle Verwertung) zu beurteilen.
4. Repräsentative Ergebnisse
Das Ergebnis der typischen FRAP-FLIP-Experiment wird in Abb. 2. Hier wurde eine Expression des Neurons GluA2 Untereinheit von AMPA-Typ Glutamat-Rezeptor, mit SEP markiert selektiv entlang eines Bereichs von Dendriten gebleicht. Abb. 2.A zeigt die Region von Dendriten, die abgebildet wurde, und gibt die ROIs, die für Ausbleichen (White-Box-Regionen) ausgewählt wurden. The große weiße Box-Gebiet wurde einst, gebleicht, gefolgt von sich wiederholenden Bleichen der flankierenden boxed Regionen, mit Doppelkopf blauen Pfeilen markiert. Der rote Pfeil zeigt die gemessene ROI, in starker Vergrößerung in den unteren Platten gezeigt.
Abb. 2.B, zeigt die Fluoreszenzintensität in der gemessenen ROI über den Zeitverlauf des Experiments. In diesem Beispiel wurde eine Minute Erholungszeit nach der ersten Photobleichmittel aufgezeichnet, damit rohen Rezeptoren, den ROI durch laterale Diffusion in Kraft. Wenn die flankierenden Regionen gebleicht werden, wird das Fluoreszenzsignal von dieser hoch beweglichen Teil der Rezeptoren vom zentralen Bereich eingeschlossen ist, und die innerhalb der Region ausverdünnt werden. Der Anstieg der Fluoreszenz (AF) über das "Flip"-Sequenz kann daher beobachtet, um das Einsetzen des SEP-GluA2 in der dendritischen Welle zurückgeführt werden. Der niedrige pH-Wasch-und pH 7,4 + NH 4 Cl zusätzlich jeweils bestätigen, dass die gemessene Fluoreszenz von der Oberfläche abgeleitetProteine und zeigen den Anteil der intrazellulären, einsamen Proteine innerhalb der ROI gemessen.
Im Gegensatz zu FRAP isoliert dieser Methode Wiederherstellung aufgrund Exozytose, was zu einer stark verringerten Grad der Fluoreszenz Erholung der photogebleicht Region. Um keine zuverlässigen mathematischen Modell bisher wurde entwickelt, um zu passen und zu analysieren, die Erholung aufgezeichneten Traces über diese selektive Bleichen Technik. Es ist jedoch möglich, die Erholung mit einer Mono-Spur exponentiellen Aufschwung fit machen:
F (t) = A s - A 0 e (-t / τ)
Wobei f (t) Fluoreszenz zum Zeitpunkt t, A s stationären Wert ist, A 0 die zum Zeitpunkt 0 versetzt ist, ist τ die Zeitkonstante. Die Erholung Wachstum mit einer gegebenen Rate festgelegt, um ein Gleichgewicht zu erreichen, entsprechend einem stationären Zustand zwischen Insertion und Diffusion. Wichtig ist, extrahiert die Zeitkonstante aus diesem einnalyse spiegelt nicht die Zeitkonstante der Exozytose und können nur für vergleichbaren Behandlungen für ein einzelnes Protein verwendet werden.
Darüber hinaus ist das erwartete Muster von Fluoreszenz wieder wahrscheinlich in Unterbereichen entlang der photogebleicht Bereich beobachtet werden. Analyse von kleinen ROI innerhalb eines photogebleicht Segment wesentlich sein kann, um Exozytose "Hotspots" zu offenbaren und es ist ratsam, Regionen vergleichbarer Länge wie die Variabilität der Dichte dieser Flecken unter den Dendriten analysieren wird die berechnete Rate beeinflussen.
3 zeigt eine Erweiterung des Protokolls, die Anwendung des Photobleichmittels zu großer Teil ROI mit mehreren Dendriten in dem Sichtfeld, gefolgt von einer selektiven wiederholende Bleichen von nur einem Dendriten. Dieser Ansatz ermöglicht traditionellen "FRAP" und "FRAP-FLIP" Daten parallel erfasst werden. In diesem Beispiel haben hippocampalen Neuronen durch ein Glutamat-Rezeptor-Untereinheit der Klasse Kainat infiziert; GluK2 SEP-markiert. Prior, um Bildgebung, wurden diese mit Neuronen-cylcohexamide (2 Std. bei 200μg/ml), um die Proteinsynthese blockieren behandelt. Als solche Fluoreszenz Erholung in der jeweiligen gemessenen ROIs (Abb. 3.B) zeigt den Anteil der Wiederherstellung aufgrund laterale Diffusion und Recycling in der Standard-FRAP Dendriten im Vergleich zu Recycling allein in den Dendriten unterzogen, um die 'FRAP-Flip' Protokoll. Vergleicht man die Werte aus der &Dgr; FRAP versus 'FRAP-FLIP "Verwertung Kurven, die jeweiligen Beiträge des Recyclings (AF rec = 11,05%) versus laterale Diffusion (AF diff = 9,35%) geschlossen werden kann. Im Gegensatz zu Abbildung 2, die Erholung nicht halten einen stabilen Zustand Ebene, sondern aufgrund der Hemmung der Proteinsynthese, zeigt ein vorübergehender Anstieg und nachfolgende Drop-off in Signal, entsprechend Erschöpfung des zur Verfügung stehenden Rezeptor-Pool (ca. 20% Rückgang beobachtet über die Aufnahme Zeitraum).
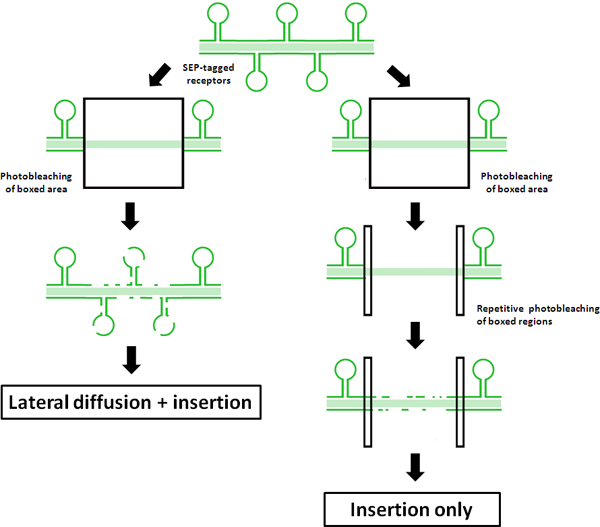
Abbildung 1. Schematische Darstellung der Prinzipien der FRAP vs FRAP-FLIP-Protokolle Dieses Diagramm veranschaulicht die Ergebnisse einer regelmäßigen FRAP im Vergleich zu einem 'FRAP-Flip' Protokoll, mit SEP-markierten Rezeptoren. Fluorescence Recovery in traditionellen FRAP ist auf der linken Seite gezeigt. Gemessen Fluoreszenzerholung im zentralen ROI ist eine Kombination der lateralen Diffusion f nicht photogebleicht SEP-markierten Rezeptoren von außerhalb der ROI photogebleicht und Einsetzen von Rezeptoren durch Recycling und / oder De-novo-Exozytose in die dendritische Welle zurückzuführen. Dagegen ist die sich wiederholende photogebleicht der flankierenden ROIs in der rechten Seite dargestellt ist, zeigt, wie diesem modifizierten "FRAP-Flip 'Protokoll Schweigen Erholung durch laterale Diffusion. Als solches kann jede gemessene Fluoreszenz wieder auf direkte Insertion in der ROI zurückgeführt werden.
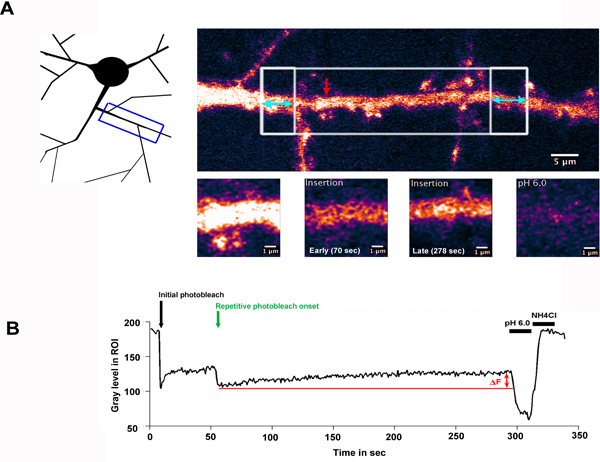
Abbildung 2.Einfügen von SEP-GluA2 in die Plasmamembran auf der dendritischen Welle
A) Eine Hippocampus exprimiert SEP-GluA2, selektiv entlang eines Bereichs von Dendriten gebleicht. Die Darstellung zeigt die Region von Dendriten, die abgebildet wurde, während der obere linke Panel unterstreicht die ROIs, die für Photobleaching ausgewählt wurden. Das große weiße Box-Gebiet wurde einst, gebleicht, gefolgt von sich wiederholenden Bleichen der flankierenden boxed Regionen, mit Doppelkopf blauen Pfeilen markiert. Diese Tafel zeigt die Dendriten vor Ausbleichen. Der rote Pfeil zeigt die gemessene ROI, in starker Vergrößerung in den unteren Platten gezeigt. B) zeigt die Fluoreszenzintensität in der gemessenen ROI über den Zeitverlauf des Experiments, dargestellt als Graupegel in dem ROI (nicht normalisiert). Der schwarze Pfeil markieren Sie den Zeitpunkt der ursprünglichen Photobleichmittels und grüne Pfeil zeigt den Beginn der repetitiven Ausbleichen. &Dgr; Zeigt the Anstieg der Fluoreszenz über der Erholungsphase beobachtet werden, durch Einsetzen der September-GluA2 in den dendritischen Schaft. Nachfolgende niedrigen pH-Wert und pH 7,4 + NH 4 Cl Wäschen bestätigen, dass die Fluoreszenz wieder zu exprimierten Rezeptoren Oberfläche bezieht.
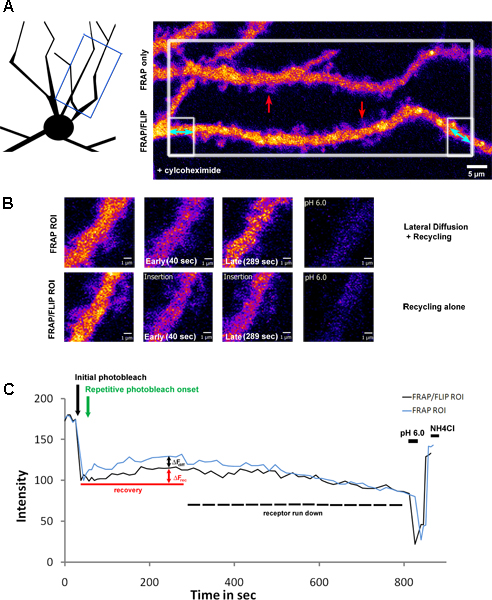
Abbildung 3. Recycling & laterale Diffusion vs Recycling von SEP-GluK2 auf der dendritischen Schaft nach Cyclohexamid Behandlung
A) Ein Hippocampus ausdrückt SEP-GluK2, selektiv photogebleicht mit parallelen FRAP und 'FRAP-FLIP "Verwertung Protokolle entlang getrennten dendritischen ROIs durchgeführt. Dieses Neuron war Gegenstand einer Vorbehandlung mit Cycloheximid, um die Proteinsynthese (2 Stunden bei 200 ug / ml) zu blockieren. Die Darstellung zeigt die Region von Dendriten, die abgebildet wurde, während die linke Hand Panel Hervorhebung der ROIs, die für Photobleaching ausgewählt wurden. The große weiße Box-Gebiet wurde einst, gebleicht, gefolgt von sich wiederholenden Bleichen der flankierenden Regionen boxed, der unteren Dendriten nur mit zwei Spitzen blauen Pfeilen markiert. Diese Tafel zeigt die Dendriten vor dem Ausbleichen. Rote Pfeile markieren die ROIs in hoher Vergrößerung in B gezeigt), welche die Fluoreszenz Erholung im traditionellen FRAP gegenüber dem 'FRAP-Flip' Protokoll. Ein Vergleich der Werte der Fluoreszenzintensität in der späten Phase der Rückgewinnung (dritte Feld) für den Beitrag der lateralen Diffusion und Recycling gegenüber Recycling allein. C) zeigt die Fluoreszenzintensität in der gemessenen ROIs über den Zeitverlauf des Experiments, dargestellt als normierte Intensität Werte. Der schwarze Pfeil markieren Sie den Zeitpunkt der ursprünglichen Photobleichmittels und grüne Pfeil zeigt den Beginn der repetitiven Ausbleichen. &Dgr; Rec zeigt den Einschwingvorgang durch Rezeptor-Recycling, von der FRAP / FLIP Dendriten bestimmt, während &Dgr;Unterschied wird der Beitrag des lateralen Diffusion von SEP-GluK2 in den dendritischen Welle in der "FRAP nur 'Return on Investment. Die vorübergehende Erhöhung wird durch allmählichen Rückgang der Signal entsprechend dem Herunterfahren der verfügbaren Rezeptoren durch Cycloheximid-Behandlung. Die anschließende niedrigen pH-Wert und pH 7,4 + NH 4 Cl Wäschen bestätigen, dass die Fluoreszenz wieder zu exprimierten Rezeptoren Oberfläche bezieht.
Diskussion
Wir beschreiben eine innovative Strategie, um die Komponenten des Plasmas Membranproteinen visualisieren. Der kombinatorische Ansatz von Photobleaching Techniken mit SEP-markierte Protein ermöglicht selektiv Plasmamembran Einfügung Ereignisse zu beurteilen. Durch die kontinuierliche Bleichen die Membranproteine in flankierenden Regionen während der Genesung, beurteilt die "FRAP-Flip 'Methode der Beitrag der Vesikeltransport zur Fluoreszenz Erholung. Dieser neue Ansatz ermöglicht die direkte Aufnahme von Protein Membraninsertion, so dass sowohl die Anzahl der Sub-Laderäumen, in denen Erholung beobachtet wird und die Amplitude der Erholung (AF) im stationären Zustand bestimmt werden. Ferner ermöglicht den Vergleich von FRAP mit und ohne FLIP der Anteil der Verwertung zurückzuführen laterale Diffusion zu berechnen.
Darüber hinaus, im gleichen Experiment können Bereiche von nicht-photogebleicht Dendriten benachbart zu den flankierenden Regionen photogebleichtwährend der Erholungsphase qualitativ beurteilt; Fluoreszenz Verlust in diesen Regionen zu beobachten sein wird durch laterale Diffusion photogebleicht Rezeptoren in diesen nicht-photogebleicht Segmente des Dendriten.
Diese selektive Photobleichen Protokoll kann verwendet werden, um eine Vielzahl von zellulären Transports Verfahren, wie die Charakterisierung excocytosis in der Plasmamembran in definierten Teilbereichen (z. B. Dendriten oder Stacheln) oder die Bewertung des Beitrags der lateralen Diffusion vs Einsetzen durch die parallele FRAP und "FRAP untersuchen -Flip 'Protokolle entlang benachbarten Dendriten (Abb. 3).
Klar, während spezifische Leitlinien präsentiert wurden, wird jedes Labor benötigen Optimierung der Bildparameter nach bestimmten Proben und Ausrüstungen. Wichtig ist, dass alle Oberflächen-Rezeptoren in der ROI zu photogebleicht, unabhängig von der z-Achse Brennebene, jedoch ohne signifikante Beschädigung oder phototoxische unspezifische Ausbleichen. UnsERS sollten Vorsicht walten lassen, wenn versucht wird dieses Protokoll in der Zelle soma, wie den hohen Anteil an relativ niedrigen pH intrazelluläre Kompartimente führt in der Regel hohe Hintergrundfluoreszenz in diesen Regionen. Darüber hinaus, während wir haben gezeigt, wie diese Technik angewendet werden kann in unterschiedlich Wege, vor Beginn der selektiven Bleichexperimenten auf eine neue September-Tag bauen, empfehlen wir, dass eine erste Charakterisierung der ersten markierten Rezeptoren durchgeführt wird, wie von Ashby et al 2.
Insgesamt ist diese Methode eine leistungsstarke und vielseitige Anpassung der Standard-FRAP-Protokoll, die das Einsetzen Ereignisse in Plasmamembran, um nahezu in Echtzeit ausgewertet werden.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken dem Wellcome Trust und dem ERC für finanzielle Unterstützung. IMGG ist ein EMBO-Fellow. KLH ist ein BBSRC finanzierte Doktorand. Wir danken Philip Rubin und Patrick Tidball für technische und Zellkultur-Unterstützung und Dr. Andrew Doherty für die Wartung und Unterstützung bei den Mikroskopen.
Materialien
Name des Reagenzes Unternehmen Katalog-Nummer Kommentare (optional)
| Name | Company | Catalog Number | Comments |
| 24mm Deckgläsern | VWR International | 631-0161 | |
| Poly-L-Lysin | Sigma | P2636 | 1 mg in Boratpuffer zu beschichten Deckgläser |
| Neurobasalmedium | Invitrogen | 21103 | |
| B27 | Invitrogen | 17504-044 | 2% in neuronalen Plattieren und Nährmedium |
| Penicillin Streptomycin | Sigma | P0781 | 1% in neuronalen Plattieren und Nährmedium |
| L-Glutamin | Invitrogen | 25030 | 2 mm / 0,8 mm in Ausplattieren / Fütterung Medium |
| Pferdeserum | Biosera | DH-291H | 10% in neuronalen Plattierungsmedien nur |
| PSIN ReP5 Klonierungsvektor | Invitrogen | K75001 | Für Sindbisvirus Produktion |
| LSM510 META Konfokalsystem | Zeiss | ||
| Image J Software | NIH | Open-Access-Software. Alle hier beschriebenen Plugins sind verfügbar unter Http://rsbweb.nih.gov/ij/plugins/ |
Referenzen
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- Ashby, M. C., Ibaraki, K., Henley, J. M. It's green outside: tracking cell surface proteins with pH-sensitive GFP. Trends Neurosci. 27, 257-261 (2004).
- Swaminathan, R., Hoang, C. P., Verkman, A. S. Photobleaching recovery and anisotropy decay of green fluorescent protein GFP-S65T in solution and cells: cytoplasmic viscosity probed by green fluorescent protein translational and rotational diffusion. Biophys. J. 72, 1900-1907 (1997).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophys. J. 73, 2782-2790 (1997).
- Wiedenmann, J., Oswald, F., Nienhaus, G. U. Fluorescent proteins for live cell imaging: opportunities, limitations, and challenges. IUBMB Life. 61, 1029-1042 (2009).
- Ashby, M. C. Removal of AMPA receptors (AMPARs) from synapses is preceded by transient endocytosis of extrasynaptic AMPARs. J. Neurosci. 24, 5172-5176 (2004).
- Bouschet, T., Martin, S., Henley, J. M. Receptor-activity-modifying proteins are required for forward trafficking of the calcium-sensing receptor to the plasma membrane. J. Cell. Sci. 118, 4709-4720 (2005).
- Ashby, M. C., Maier, S. R., Nishimune, A., Henley, J. M. Lateral diffusion drives constitutive exchange of AMPA receptors at dendritic spines and is regulated by spine morphology. J. Neurosci. 26, 7046-7055 (2006).
- Martin, S., Bouschet, T., Jenkins, E. L., Nishimune, A., Henley, J. M. Bidirectional regulation of kainate receptor surface expression in hippocampal neurons. J. Biol. Chem. 283, 36435-36440 (2008).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent membrane drift recruits AMPA receptors to dendritic spines. J. Biol. Chem. 284, 12491-12503 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten