Method Article
Difusão lateral e Exocitose de proteínas de membrana em neurônios cultivados avaliada através da recuperação de fluorescência e fluorescência perda de fotobranqueamento
Neste Artigo
Resumo
Este relatório descreve a utilização de imagens de células vivas e técnicas photobleach para determinar a expressão de superfície, as vias de transporte e de cinética de tráfico de exogenamente expressa, GFP sensível ao pH proteínas na membrana plasmática dos neurónios.
Resumo
Protocolo
1. Cultura de Células, Transdução Viral, e expressão de proteínas
- Neurónios do hipocampo de cultura de alta densidade a partir de embrionárias filhotes dia 18 (E18) de ratos sobre lamelas de poli-L-lisina-revestidos de vidro para 14-25 dias in vitro (DIV).
- 6-24h antes para as experiências vivos, as células transduzir com atenuada do vírus Sindbis que contêm a proteína de membrana de interesse, marcado com o pHluorin super-elíptica (SEP).
- Adicionar o meio contendo pseudo-directamente para a lamela contendo 1 ml de meio condicionado e voltou para a incubadora de cultura. O título e tempo para a expressão da proteína após a transdução virai irá variar dependendo do lote de vírus e deve ser determinada para cada lote antes de iniciar as experiências de células vivas.
2. FRAP-FLIP imagens de células vivas
- Equipamento set-up
- Transferir a lamela para a câmara de imagem de um microscópio Zeiss Axiovert LSM META 510 confocal.Para minimizar flutuações de energia durante o exame, certifique-se o microscópio foi ligado, com saída do laser de 100%, por pelo menos 20 minutos antes da imagem.
- Imediatamente, substituir o meio de cultura com pré-aquecido (37 ° C) solução de gravação extracelular contendo 140 mM de NaCl, 5 mM de KCl, 15 mM de glucose, 1,5 mM de CaCl2, 1,5 mM de MgCl2, 20-25 mM de HEPES (pH ajustado para 7,4 com NaOH) e colocar a câmara sobre a fase de pré-aquecido (37 ° C) do Axiovert Zeiss.
Assegurar a osmolaridade da solução de gravação extracelular é ajustada para dentro 10 mOsM do seu meio de cultura. Desde que não evaporação significativa ocorre durante o timecourse do experimento, esta solução 2 CO independente é adequado para experiências curtos (menos de 10 horas). A suplementação com 1-2 mM de bicarbonato de sódio é recomendada.
- Definir os parâmetros de captura de imagem
- Em primeiro lugar, identificar um neurônio expressar a pro recombinantetein de interesse e trazê-lo em foco.
- Com um óleo 63X opôs, adquirir uma imagem de toda a célula utilizando excitação de luz laser em 488nm potência do laser de baixa. Para minimizar a fotodegradação, use uma velocidade nominal (7-9) e pixels de resolução baixa (512-512), mantendo velocidade de digitalização total <1 segundo.
- Selecione uma parte de dendrite de imagem e zoom para capturar um quadro que contém o ROI (~ 1,5-2,5 x zoom óptico). Sempre que possível, assegurar o campo de visão contém vários processos de modo que as medições de dendrites de referência pode ser obtido, para determinar se não específica fotobranqueamento devido à aquisição está a ocorrer.
- Ajuste os filtros, pinhole, velocidade de varredura e ganho de detector de fluorescência para permitir máxima de excitação laser mínima, mas com a saturação limitado. Um diâmetro grande orifício é recomendado, para maximizar a recolha do fotão (2μm é adequado para a coluna e dendritos ternárias). O ganho de detector deve ser suficientemente forte para detectar pequenas incrementos de fluorescência,de tal modo que as imagens muito primeiro lugar, antes da fotobranqueamento não ultrapassar 10% de pixels saturados.
- Guardar esta configuração a ser usado para a pré-/ pós-lixívia e fases de recuperação da experiência.
- Em seguida definem as regiões photobleach; seleccionando um ROI para o photobleach inicial e regiões flanqueadoras para a fase subsequente fotobranqueamento repetitivo. Garantir as regiões flanqueadoras são suficientemente largas para impedir a recuperação por difusão entre as verificações (tipicamente 5 mM, ver fig. 2).
- Ajuste os parâmetros de água sanitária para ambos ROIs photobleach. O photobleach inicial deve ser rápida (0,1-0,5 seg) requerendo entre 1-5 iterações, dependendo do zoom óptico e do volume do ROI. Para as regiões flanqueadoras, a excitação laser deve ser ajustada para assegurar fotobranqueamento contínua das regiões flanqueadoras, mas sem danos fototóxico.
- Como orientação, usamos excitação com laser de 100% para o photobleach inicial, e 10% para o pH repetitivo fotobranqueamentoase.
- A aquisição de imagens
- Uma vez que todos os parâmetros terem sido definidos, a realização do experimento FRAP-FLIP como uma seqüência de imagens de lapso de tempo variável, delineada nos 4 blocos abaixo:
BLOCO 1: 3-10 imagens pré-branqueamento de base, a potência do laser de baixa, sem atraso de tempo
BLOCO 2: Photobleach o ROI central de potência do laser completa, 1-5 iterações
BLOCO 3: 3-10 imagens pós-recuperação de lixívia
Bloco 4: photobleach repetitiva de flanqueamento regiões de potência do laser meio com captura de imagem a um intervalo de tempo típico de 1 - 5 segundos, dependendo da taxa de recuperação da proteína sob investigação. - Finalmente, substituir a solução de gravação extracelular com solução de gravação tamponada a pH 6, contendo 140 mM de NaCl, 5 mM de KCl, 15 mM de glucose, 1,5 mM de CaCl2, 1,5 mM de MgCl2, 20-25 mM MES (para extinguir a fluorescência) ou complementado com 50 mM NH4Cl contendo 90 mM de NaCl, 5 mM de KCl, 15 mM de glucose, 1,8 mM de CaCl2, 0,8 mMMgCl2, 20-25 mM de HEPES, pH 7,4 (para revelar as proteínas em lojas de baixo pH intracelular), (ver fig. 2).
- Recolher pelo menos 10 a 20 conjuntos de dados para cada proteína recombinante, para permitir a análise estatística. Condições para evitar distorcer os resultados, garantir imagem são mantidos consistentes entre repetições. Descarte qualquer conjunto de dados onde incompleta branqueamento, deriva plano focal significativa ou dano celular fototóxica são observados.
- Uma vez que todos os parâmetros terem sido definidos, a realização do experimento FRAP-FLIP como uma seqüência de imagens de lapso de tempo variável, delineada nos 4 blocos abaixo:
3. Análise de Dados
- Abra as imagens com o software ImageJ.
- Alinhe as pilhas para explicar pequenas flutuações no plano xy que possam ter ocorrido ao longo da série histórica usando o plugin Stackreg (plugins → → stackreg transformação: corpo rígido → ).
- Para imagens tomadas em Zeiss confocal, use o plugin Toolbox LSM para relatar os valores de tempo como um arquivo de texto (plugins → LSM Toolbox → Mostrar LSM Toolbox → → ),e importar esses valores em uma planilha de análise.
- Para medir as flutuações de fluorescência durante a experiência FRAP-FLIP, dividir o segmento Foto-descoloração em regiões de pixel individuais (aprox. 20pixels) e medir a fluorescência média destes ROIs em cada ponto de tempo (F). Para obter rapidamente esses valores, selecione ROIs múltipla usando a ferramenta ImageJ "ROI Manager 'análise (analisar → Ferramentas → ROI Manager) e relatar a fluorescência média por pixel usando o" Plot eixo Z-profile' comando (→ Imagem → Stacks Plot Z eixo do perfil).
- Repetir este passo para medir a intensidade de fluorescência de uma região de fundo, não fluorescente.
- Normalizar a intensidade de fluorescência em cada ponto de tempo subtraindo os valores de fundo para remover o ruído experimental, e todos os valores de dividir pela medida de linha de base média pré-branqueada.
- Medir a intensidade da fluorescência da adjacentes não-Foto-descoloração dendritos para avaliar o nível de não-específicafotodegradação durante a aquisição. Correção para não-específica fotobranqueamento é desencorajado a interpretação de 'FRAP-FLIP "de dados e deve ser evitado sempre que possível.
- Para calcular se uma recuperação significativa ocorreu em um ROI, subtrair a média dos últimos medidas 5-10 da seqüência a partir da média das primeiras medidas 5-10 (Af) e determinar a significância estatística. Categorizar o ROIs recuperação e não de recuperar para avaliar o padrão de exocitose (hotspots exocitose ou seja, ou coluna de recuperação do eixo vs).
4. Os resultados representativos
O resultado da experiência FRAP FLIP-típica é mostrada na fig. 2. Aqui, um neurónio expressando a subunidade GluA2 de AMPA receptor de glutamato tipo, marcado com setembro foi selectivamente Foto-descoloração ao longo de uma região de dendrite. Fig. 2.A ilustra a região de dendrite que foi trabalhada e indica a ROIs que foram seleccionados para fotobranqueamento (regiões caixa branca). The área branca grande caixa foi branqueada uma vez, seguido pelo repetitivo branqueamento das regiões flanqueadoras em caixa, destacados com duas cabeças setas azuis. A seta indica o vermelho ROI medido, mostrado na ampliação elevada nos painéis inferiores.
Fig. 2.B, mostra a intensidade de fluorescência na ROI medido ao longo do tempo da experiência. Neste exemplo, um período de recuperação de um minuto foi registado após a photobleach inicial para permitir que os receptores não branqueado para introduzir o ROI por difusão lateral. Quando as regiões flanqueadoras são Foto-descoloração, o sinal de fluorescência a partir desta fracção altamente móveis de receptores está ocluída a partir da região central, e aqueles dentro da região são diluídos para fora. O aumento na fluorescência (Af) observada ao longo da sequência 'FLIP' pode, por conseguinte, ser atribuída à inserção de setembro-GluA2 no eixo dendrítica. A lavagem a pH baixo e pH 7,4 + adição NH4Cl respectivamente confirmar que a fluorescência medida é derivado a partir da superfícieproteínas e revelar a proporção de proteínas intracelulares, sequestrados no interior da ROI medido.
Em contraste com FRAP, esta metodologia isola recuperação devido à exocitose, resultando em um nível muito reduzido de recuperação de fluorescência na região Foto-descoloração. Até à data, nenhum modelo matemático fiável tem sido desenvolvido para se ajustar e analisar a recuperação traços de gravado utilizando esta técnica selectiva de branqueamento. É, no entanto, possível encaixar o traço de recuperação com uma recuperação mono exponencial:
F (t) = A s - A e 0 (-t / τ)
Em que F (t) é a fluorescência no tempo t, A, S é o valor de estado estacionário, um 0 é o deslocamento no tempo 0, τ é a constante de tempo. O crescimento de recuperação é fixada com uma dada taxa de alcançar um equilíbrio, o que corresponde a um estado estacionário entre a inserção e de difusão. Importante, a constante de tempo extraído desta umaNÁLISE não reflecte a constante de tempo de exocitose e só pode ser utilizado para tratamentos comparativos para uma proteína individual.
Além disso, o padrão esperado de recuperação de fluorescência é susceptível de ser observado na sub-domínios ao longo da região Foto-descoloração. Análise de ROI pequena dentro de um segmento Foto-descoloração pode ser essencial para revelar exocitose hotspots e é aconselhável para analisar as regiões de comprimentos comparáveis como a variabilidade da densidade destas manchas entre a dendrite irá afectar a taxa calculada.
Fig. 3 mostra uma extensão deste protocolo, aplicando o photobleach ao ROI grande secção com dendritos múltiplas no campo de visão, seguido por branqueamento repetitivo selectiva de apenas um dendrite. Esta abordagem permite "FRAP" tradicional e "FRAP-FLIP" dados a serem adquiridas em paralelo. Neste exemplo, neurónios do hipocampo foram infectadas com uma subunidade do receptor de glutamato de a classe de cainato; SEP-etiquetados GluK2. Prior para imagiologia, estes neurónios foram tratados com os cylcohexamide (2hrs em 200μg/ml), para bloquear a síntese de proteínas. Como a recuperação, como a fluorescência no ROIs respectivo medida (Fig. 3.B) revela a proporção de recuperação devido à difusão lateral e reciclagem no dendrito FRAP padrão versus reciclagem sozinho no dendrito submetido ao "FRAP-FLIP" protocolo. Comparando os valores a partir de curvas Af o FRAP versus 'FRAP-FLIP "de recuperação, as contribuições relativas de reciclagem (Af rec =% 11.05) versus difusão laterais (Af diff =% 9,35) pode ser inferida. Ao contrário Figura 2, a recuperação não mantém um nível de estado estacionário, mas em vez disso, devido à inibição da síntese de proteínas, mostra um aumento transitório e subsequente queda na sinal, correspondente a depleção do pool de receptor disponível (aproximadamente declínio de 20% observado durante o período de gravação).
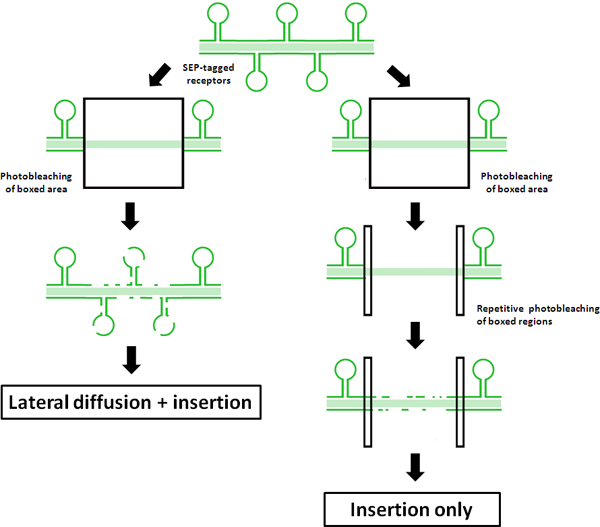
Figura 1. Esquemática dos princípios da FRAP vs FRAP-FLIP protocolos Este esquema ilustra os resultados de um protocolo FRAP regulares contra um "FRAP-FLIP", usando SEP-tag receptores. Recuperação de fluorescência em FRAP tradicional é mostrado na lado esquerdo. Medido de recuperação de fluorescência na ROI central é atribuída a uma combinação de difusão laterais não-f Foto-descoloração receptores SEP-marcados a partir de fora da ROI Foto-descoloração e inserção de receptores por meio de reciclagem e / ou exocitose de novo para o eixo dendrítica. Por outro lado, o Foto-descoloração repetitivo das ROIs acompanhamento ilustrado na lado direito, mostra como "FRAP-FLIP" este protocolo modificado de recuperação silêncios devido à difusão lateral. Como tal, qualquer recuperação fluorescência medida pode ser atribuída a inserção directa no ROI.
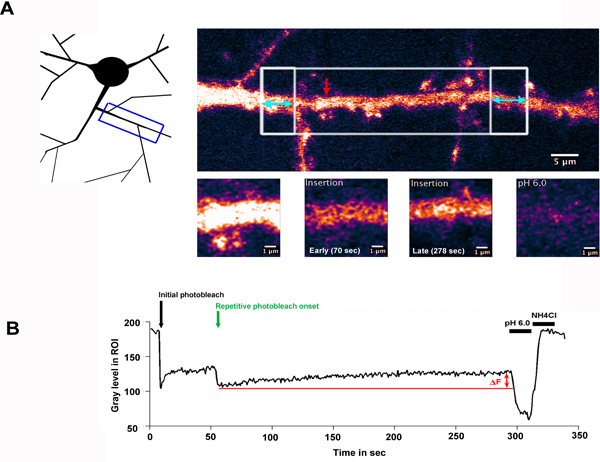
Figura 2.A inserção de setembro-GluA2 para a membrana plasmática no eixo dendrítica
A) Um neurônio hipocampo expressar SEP-GluA2, seletivamente Foto-descoloração ao longo de uma região de dendrite. O esquema ilustra a região de dendrite que foi fotografada, enquanto que o painel do lado esquerdo superior destaca a ROIs que foram seleccionados para fotobranqueamento. A área branca grande caixa foi branqueada uma vez, seguido pelo repetitivo branqueamento das regiões flanqueadoras em caixa, destacados com duas cabeças setas azuis. Este painel mostra a dendrite antes de fotodegradação. A seta indica o vermelho ROI medido, mostrado na ampliação elevada nos painéis inferiores. B) mostra a intensidade de fluorescência na ROI medido ao longo do tempo da experiência, traçada como o nível de cinzento na ROI (não normalizada). A seta preta realçar o instante do photobleach inicial e seta verde indica o início do fotobranqueamento repetitivo. Af indica thaumento na fluorescência e observado ao longo do período de recuperação, devido à inserção de setembro-GluA2 no eixo dendrítica. PH baixo subsequente e pH 7,4 + NH4 lavagens Cl confirmar que a fluorescência recuperado relaciona-se com tona receptores expressos.
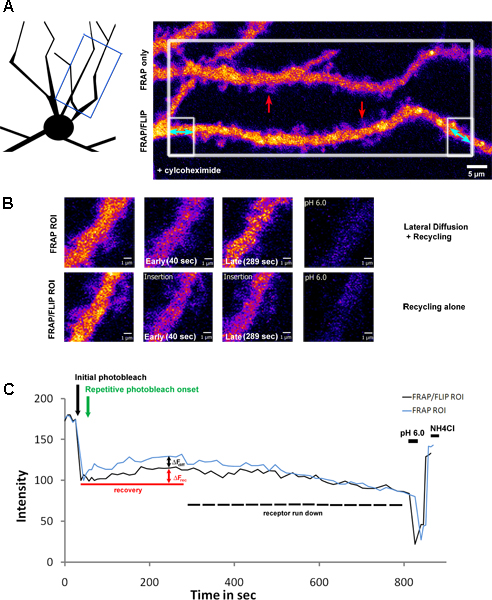
Figura 3. Reciclagem e Reciclagem vs laterais difusão do SEP-GluK2 no eixo dendrítica após o tratamento ciclohexamida
A) Um neurônio hipocampo expressar SEP-GluK2, seletivamente Foto-descoloração com FRAP paralelo e protocolos "FRAP-FLIP" de recuperação realizadas ao longo ROIs dendrítica separado. Este foi sujeito a neurónio pré-tratamento com ciclohexamida, para bloquear a síntese de proteínas (2 horas a 200 ug / ml). O esquema ilustra a região de dendrite que foi fotografada, enquanto que o painel do lado esquerdo destacando a ROIs que foram seleccionados para fotobranqueamento. The área branca grande encaixotado foi branqueada uma vez, seguido por repetitiva de branqueamento das regiões flanqueadoras encaixotadas, da parte inferior da dendrite apenas, em destaque com duas pontas setas azuis. Este painel mostra os dendritos antes de fotodegradação. As setas vermelhas destacar o ROIs mostrado em alta ampliação em B) ilustrando a recuperação de fluorescência em FRAP tradicional versus o protocolo "FRAP-FLIP". Comparações de níveis de intensidade de fluorescência na fase tardia da recuperação (painéis terceiros) mostram a contribuição da difusão lateral e reciclagem contra a reciclagem sozinho. C) mostra a intensidade de fluorescência na ROIs medido ao longo do tempo da experiência, representados como intensidade normalizada valores. A seta preta realçar o instante do photobleach inicial e seta verde indica o início do fotobranqueamento repetitivo. Af rec indica a recuperação transitória devido à reciclagem receptor, determinado a partir do dendrito FRAP / FLIP enquanto Afdiff mede a contribuição da difusão lateral do SEP-GluK2 no eixo dendrítica no 'FRAP apenas "ROI. O aumento transiente é seguido por um declínio gradual no sinal, correspondente ao funcionamento para baixo de receptores disponíveis como resultado do tratamento ciclohexamida. O pH baixo e subsequente pH 7,4 + NH4 lavagens Cl confirmar que a fluorescência recuperado relaciona-se com tona receptores expressos.
Discussão
Nós descrevemos uma estratégia inovadora para visualizar os componentes do plasma tráfico proteína de membrana. A abordagem combinatória de fotodegradação técnicas com a proteína SEP-tag permite seletivamente eventos de inserção da membrana plasmática para ser avaliado. Continuamente fotobranqueamento as proteínas da membrana em regiões acompanhamento durante a recuperação, o método 'FRAP-FLIP "avalia a contribuição do tráfico vesicular para a recuperação de fluorescência. Esta nova abordagem permite a gravação directa de inserção de proteína de membrana, permitindo que tanto o número de sub-compartimentos em que a recuperação é observado e da amplitude da recuperação (Af), no estado estacionário a ser determinado. Além disso, a comparação de FRAP com e sem FLIP permite a proporção de recuperação atribuível a difusão lateral de ser calculados.
Além disso, na mesma experiência, as regiões de não-Foto-descoloração dendrite adjacente às regiões flanqueadoras Foto-descoloração pode seravaliados qualitativamente durante a recuperação, a perda de fluorescência observada nestas regiões será devido à difusão lateral dos receptores Foto-descoloração para esses segmentos não-Foto-descoloração do dendrito.
Este protocolo selectiva fotobranqueamento pode ser utilizada para investigar uma variedade de processos celulares, tais como o tráfico caracterizando excocytosis na membrana plasmática em subáreas definidos (por exemplo, dendritos ou espinhas) FRAP ou avaliar a contribuição da inserção lateral, difusão através da realização de vs FRAP paralelo e ' protocolos-FLIP 'ao longo dendritos adjacentes (Fig. 3).
É evidente que, embora as orientações específicas foram apresentados, cada laboratório será necessário otimizar os parâmetros de imagem de acordo com amostras e equipamentos específicos. Importante, todos os receptores de superfície no ROI precisa ser Foto-descoloração, independente do plano z eixo focal, mas sem danos fototóxico significativa ou não-específica fotobranqueamento. NosERS deve ter cautela ao tentar este protocolo na soma das células, como a elevada percentagem de compartimentos de pH relativamente baixos intracelulares normalmente resulta em fluorescência de fundo de alta nestas regiões. Além disso, enquanto que tenhamos demonstrado como esta técnica pode ser aplicada em varia maneiras, antes de iniciar selectivos experiências fotobranqueamento sobre um novo SEP-etiquetados construir, aconselha que uma caracterização inicial dos receptores marcados é primeiro conduzido, tal como descrito por Ashby et ai 2.
Em geral, este método é uma adaptação potente e versátil do protocolo FRAP padrão, permitindo que os eventos de inserção na membrana de plasma a ser avaliada em tempo real.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Somos gratos a Wellcome Trust e do CEI pelo apoio financeiro. IMGG é um Fellow EMBO. KLH é uma BBSRC financiado pela estudante de doutorado. Agradecemos Philip Rubin e Patrick Tidball de apoio técnico e cultura celular e Andrew Dr Doherty para a manutenção e assistência com os microscópios.
Materiais
Nome do reagente Empresa Número de catálogo Comments (opcional)
| Name | Company | Catalog Number | Comments |
| 24mm lamínulas | VWR International | 631-0161 | |
| Poli-L-lisina | Sigma | P2636 | 1mg/ml em tampão de borato de lamelas revestimento |
| Médio Neurobasal | Invitrogen | 21103 | |
| B27 | Invitrogen | 17504-044 | 2% no chapeamento neuronal e alimentação médio |
| A penicilina estreptomicina | Sigma | P0781 | Médio de 1% no chapeamento neuronal e alimentação |
| L-Glutamina | Invitrogen | 25030 | 2 mm / 0,8 mM no chapeamento / alimentação médio |
| Soro de cavalo | Biosera | DH-291H | 10% em meios seletivos neuronais só |
| PSIN ReP5 vetor de clonagem | Invitrogen | K75001 | Para Sindbis produção de vírus |
| LSM510 META sistema confocal | Zeiss | ||
| Imagem J Software | NIH | Software livre acesso. Todos os plugins aqui descritas estão disponíveis em Http://rsbweb.nih.gov/ij/plugins/ |
Referências
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- Ashby, M. C., Ibaraki, K., Henley, J. M. It's green outside: tracking cell surface proteins with pH-sensitive GFP. Trends Neurosci. 27, 257-261 (2004).
- Swaminathan, R., Hoang, C. P., Verkman, A. S. Photobleaching recovery and anisotropy decay of green fluorescent protein GFP-S65T in solution and cells: cytoplasmic viscosity probed by green fluorescent protein translational and rotational diffusion. Biophys. J. 72, 1900-1907 (1997).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophys. J. 73, 2782-2790 (1997).
- Wiedenmann, J., Oswald, F., Nienhaus, G. U. Fluorescent proteins for live cell imaging: opportunities, limitations, and challenges. IUBMB Life. 61, 1029-1042 (2009).
- Ashby, M. C. Removal of AMPA receptors (AMPARs) from synapses is preceded by transient endocytosis of extrasynaptic AMPARs. J. Neurosci. 24, 5172-5176 (2004).
- Bouschet, T., Martin, S., Henley, J. M. Receptor-activity-modifying proteins are required for forward trafficking of the calcium-sensing receptor to the plasma membrane. J. Cell. Sci. 118, 4709-4720 (2005).
- Ashby, M. C., Maier, S. R., Nishimune, A., Henley, J. M. Lateral diffusion drives constitutive exchange of AMPA receptors at dendritic spines and is regulated by spine morphology. J. Neurosci. 26, 7046-7055 (2006).
- Martin, S., Bouschet, T., Jenkins, E. L., Nishimune, A., Henley, J. M. Bidirectional regulation of kainate receptor surface expression in hippocampal neurons. J. Biol. Chem. 283, 36435-36440 (2008).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent membrane drift recruits AMPA receptors to dendritic spines. J. Biol. Chem. 284, 12491-12503 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados