Method Article
Diffusione laterale e esocitosi delle proteine di membrana in neuroni in coltura valutata utilizzando Recovery fluorescenza e fluorescenza-loss photobleaching
In questo articolo
Riepilogo
Questo rapporto descrive l'uso di imaging cellulare dal vivo e le tecniche di fotosbiancante per determinare l'espressione di superficie, vie di trasporto e la cinetica di traffico esogeno espresso, sensibile al pH GFP-tagged proteine a livello della membrana plasmatica dei neuroni.
Abstract
Protocollo
1. Coltura cellulare, la trasduzione virale, e l'espressione proteica
- Cultura neuroni dell'ippocampo ad alta densità da embrionali cuccioli di ratto al giorno 18 (E18) su poli-L-lisina rivestite con vetrini per 14-25 giorni in vitro (DIV).
- 6-24 ore prima degli esperimenti dal vivo, le cellule con virus attenuato trasducono Sindbis contenenti la proteina di membrana di interesse, contrassegnati con il super-dell'eclittica pHluorin (SEP).
- Aggiungere il pseudovirione mezzo contenente direttamente al vetrino contenente 1 ml di mezzo condizionato e restituito al incubatore cultura. Il titolo e il tempo per l'espressione proteica dopo trasduzione virale varierà a seconda del lotto virus e deve essere determinata per ciascuna partita prima di iniziare esperimenti cellule vive.
2. FRAP-FLIP Live Cell Imaging
- Attrezzature set-up
- Trasferire il vetrino alla camera di imaging di un Axiovert META Zeiss LSM 510 microscopio confocale.Per minimizzare le fluttuazioni di potenza durante l'imaging, garantire il microscopio è stato attivato, con uscita laser 100%, per almeno 20 minuti prima di imaging.
- Immediatamente, sostituire il mezzo di coltura con pre-riscaldato (37 ° C) Soluzione di registrazione extracellulare contenente 140 mM NaCl, 5 mM KCl, 15 mM glucosio, 1.5 mM CaCl 2, 1,5 mM MgCl 2, 20-25 mM HEPES (pH regolato 7,4 con NaOH) e posizionare la camera di pre-riscaldato fase (37 ° C) del Zeiss Axiovert.
Assicurarsi che l'osmolarità della soluzione registrazione extracellulare viene regolata entro 10 mOsm del terreno di coltura. Purché non evaporazione significativa si verifica durante il periodo di tempo l'esperimento, questa CO 2 soluzione indipendente è adatta per esperimenti di breve (<10 ore). Completando con 1-2 mM di bicarbonato di sodio è consigliabile.
- Definire i parametri di imaging di cattura
- In primo luogo, identificare un neurone esprime il pro ricombinanteproteina di interesse e metterla a fuoco.
- Con un olio 63x opposta, acquisire un'immagine della cellula intera utilizzando 488nm eccitazione luce laser a bassa potenza laser. Per ridurre al minimo photobleaching, utilizzare una velocità elevata nominale (7-9) e la risoluzione pixel bassa (512-512) mantenendo la velocità di scansione totale <1 secondo.
- Selezionare una parte di dendrite di immagine e zoom per catturare un frame contenente il ROI (~ x 1,5-2,5 zoom ottico). Ove possibile, garantire il campo visivo contiene diversi processi modo che le misurazioni di dendriti di riferimento può essere ottenuta, per determinare se non specifico fotodegradazione dovuta all'acquisizione sta avvenendo.
- Regolare i filtri, il foro stenopeico, velocità di scansione e il guadagno del rivelatore a fluorescenza per consentire la massima dall'eccitazione laser minimal ma con saturazione limitata. Un diametro foro di grandi dimensioni si consiglia, per massimizzare la raccolta di fotoni (2μm è adatta per spine e dei dendriti ternari). Il guadagno rilevatore dovrebbe essere abbastanza forte per rilevare piccoli incrementi di fluorescenza,tale che le prime immagini, prima della fotodecolorazione non superare il 10% di pixel saturi.
- Salvare questa configurazione da utilizzare per la pre / post-candeggina e fasi di recupero dell'esperimento.
- Avanti definiscono le regioni fotosbiancante; la selezione di un ROI per il fotosbiancante iniziale e regioni fiancheggianti per la successiva fase photobleaching ripetitivo. Assicurarsi che le regioni fiancheggianti sono larghi abbastanza per prevenire il recupero per diffusione tra le scansioni (in genere 5 micron, vedi fig. 2).
- Regolare i parametri di candeggina per entrambi ROI fotosbiancante. Il fotosbiancante iniziale deve essere rapida (0,1-0,5 secondi) richiedendo tra 1-5 iterazioni, a seconda del zoom ottico e il volume della ROI. Per le regioni fiancheggianti, l'eccitazione laser dovrebbe essere regolato per garantire photobleaching continuo delle regioni fiancheggianti, ma senza danni fototossico.
- Come linea guida, usiamo l'eccitazione laser 100% per il fotosbiancante iniziale, e il 10% per il ph ripetitiva photobleachingase.
- Acquisizione di immagini
- Una volta che tutti i parametri sono stati impostati, eseguire l'esperimento di FRAP-FLIP come una variabile di time-lapse sequenza di immagini, delineato nelle 4 blocchi di seguito:
BLOCCO 1: 3-10 pre-candeggina le immagini di base, a bassa potenza del laser, nessun ritardo
BLOCCO 2: fotosbiancante la ROI centrale a piena potenza del laser, 1-5 iterazioni
BLOCCO 3: 3-10 post-candeggina immagini di ripristino
BLOCCO 4: fotosbiancante ripetitiva di regioni fiancheggianti di potenza del laser di media con la cattura delle immagini in un intervallo di tempo tipico di 1 - 5 secondi, a seconda del tasso di recupero della proteina in esame. - Infine, sostituire la soluzione extracellulare di registrazione con una soluzione tamponata a pH 6 registrazione contenente 140 mM NaCl, 5 mM KCl, 15mm glucosio, 1.5 mM CaCl 2, 1,5 mM MgCl 2, 20-25 mM MES (per spegnere fluorescenza) o integrato con 50 mM NH4Cl contenente 90 mM NaCl, 5 mM KCl, 15 mM di glucosio, 1,8 mM CaCl 2, 0,8 mMMgCl 2, 20-25 mM di HEPES, pH 7,4 (per rivelare le proteine nei negozi di basso pH intracellulari), (vedi Fig. 2).
- Raccogliere almeno 10 a 20 gruppi di dati di ciascuna proteina ricombinante, per consentire l'analisi statistica. Per evitare risultati di polarizzazione, garantiscono condizioni di ripresa sono mantenuti coerenti in replica. Eliminare qualsiasi serie di dati incompleti, dove il candeggio, deviazioni significative sul piano focale o danni alle cellule fototossico siano rispettate.
- Una volta che tutti i parametri sono stati impostati, eseguire l'esperimento di FRAP-FLIP come una variabile di time-lapse sequenza di immagini, delineato nelle 4 blocchi di seguito:
3. Analisi dei dati
- Aprire le immagini con il software ImageJ.
- Allineare le pile per conto di piccole fluttuazioni nel piano xy che possono essersi verificati in tutta la serie temporale utilizzando il plugin Stackreg (plugins → stackreg → trasformazione: corpo rigido → ).
- Per le immagini scattate sul confocale Zeiss, utilizzare il plugin Toolbox LSM per segnalare i valori di tempo come un file di testo (plugins → LSM Strumenti → Mostra LSM Toolbox → → ),e importare questi valori in un foglio di analisi.
- Per misurare le fluttuazioni di fluorescenza durante l'esperimento di FRAP-FLIP, dividere il segmento fotodecolorate in regioni dei singoli pixel (circa 20pixels) e misurare la fluorescenza media di questi ROI in ogni punto (F). Per ottenere rapidamente questi valori, selezionare ROI multiple utilizzando lo strumento di analisi del ImageJ 'ROI Manager' (Analizza → Strumenti → ROI Manager) e segnalare la fluorescenza media per pixel utilizzando la 'Plot asse Z profile' di comando (Immagine → Stacks → Plot Z asse profilo).
- Ripetere questo passaggio per misurare l'intensità di fluorescenza di uno, regione di sfondo non fluorescente.
- Normalizzare l'intensità di fluorescenza ad ogni tempo sottraendo i valori di fondo per rimuovere il rumore sperimentale, e dividere tutti i valori dalla media pre-sbiancato misura basale.
- Misurare l'intensità di fluorescenza adiacenti non fotodecolorate dendriti per valutare il livello di non-specificaphotobleaching durante l'acquisizione. Correzione per il non-specifica photobleaching è sconsigliato per l'interpretazione di 'FRAP-FLIP' dei dati e deve essere evitato quando è possibile.
- Per calcolare se il recupero significativo ha avuto luogo in una ROI, sottrarre la media degli ultimi provvedimenti 5-10 della sequenza dalla media delle prime misure 5-10 (Af) e determinare la significatività statistica. Categorizzare il ROI di recupero e non di recupero per valutare la configurazione della esocitosi (hotspot esocitosi cioè o di recupero vs spina dorsale dell'albero).
4. Risultati rappresentativi
Il risultato di tipica FRAP FLIP-esperimento è mostrato in fig. 2. Qui, un neurone che esprime il GluA2 subunità del recettore del glutammato di tipo AMPA, con etichetta settembre è stata selettivamente fotodecolorate lungo una regione di dendrite. Fig 2.A illustra la regione di dendrite che è stato ripreso e indica la ROI che sono state selezionate per fotodecolorazione (regioni riquadro bianco). The ampio spazio bianco in scatola è stata sbiancata volta, seguita da ripetitivo sbiancamento delle regioni fiancheggianti in scatola, evidenziati con una freccia doppia blu. La freccia rossa indica la ROI misurato, mostrata in alto ingrandimento nei pannelli inferiori.
Fig. 2.B, mostra l'intensità di fluorescenza nella ROI misurata nel corso del tempo dell'esperimento. In questo esempio, un periodo di recupero uno minuti è stata registrata dopo il fotosbiancante iniziale per consentire recettori greggio di entrare nel ROI per diffusione laterale. Quando le regioni fiancheggianti sono fotodecolorate, il segnale di fluorescenza da questa frazione altamente mobili di recettori è occluso dalla regione centrale, e quelli nella regione vengono diluiti out. L'aumento della fluorescenza (Af), osservato per la sequenza di 'FLIP' può quindi essere attribuita a inserimento di SEP-GluA2 nel vano dendritica. Il lavaggio pH basso e pH 7,4 + aggiunta NH4Cl rispettivamente confermare che la fluorescenza misurata è derivato dalla superficieproteine e rivelano la proporzione di proteine intracellulari, sequestrati all'interno del ROI misurato.
In contrasto FRAP, questa metodologia isolati recupero a causa di esocitosi, risultante in un livello molto ridotto di recupero fluorescenza nella regione fotodecolorate. Ad oggi nessun modello matematico affidabile è stato sviluppato per adattarsi e analizzare il recupero tracciati registrati con questa tecnica selettiva sbiancante. E 'comunque possibile inserire la traccia di recupero con una ripresa mono esponenziale:
F (t) = A s - A 0 e (-t / τ)
Dove F (t) è fluorescenza al tempo t, s è un valore di stato stazionario, A è l'offset 0 al tempo 0, τ è la costante di tempo. La crescita di recupero è fissato con un dato tasso di raggiungere un equilibrio, corrispondente ad uno stato stabile tra l'inserimento e la diffusione. È importante sottolineare che la costante di tempo estratto da questo unNALISI non riflette la costante di tempo di esocitosi e può essere utilizzato solo per trattamenti comparativi per una singola proteina.
Inoltre, il profilo previsto di recupero fluorescenza può essere osservato in sottodomini lungo la regione fotodecolorate. Analisi del ROI piccola all'interno di un segmento fotodecolorate può essere essenziale per rivelare esocitosi "hotspots", ed è consigliabile analizzare regioni di lunghezze comparabili come la variabilità della densità di questi luoghi tra i dendrite influirà sul tasso calcolato.
Fig 3 mostra un prolungamento di questo protocollo, applicando il fotosbiancante di ROI sezione più grande con dendriti nel campo di vista, seguito da sbianca ripetitiva selettiva di uno solo dendrite. Questo approccio consente tradizionale 'FRAP' e 'FRAP-FLIP' dati che devono essere acquisiti in parallelo. In questo esempio, i neuroni dell'ippocampo sono stati infettati con una subunità del recettore del glutammato della classe kainate; settembre-tagged GluK2. Prior per imaging, questi neuroni sono stati trattati con cylcohexamide (2 ore a 200μg/ml), per bloccare la sintesi proteica. Come tale, il recupero di fluorescenza nella ROI in questione misurata (Fig 3.B) rivela la percentuale di recupero a causa di diffusione laterale e riciclaggio nel dendrite FRAP standard di rispetto al riciclaggio solo nel dendrite sottoposto al 'FRAP-FLIP' protocollo. Confrontando i valori Af dal FRAP contro 'FRAP-FLIP' curve di recupero, i contributi relativi di riciclaggio (Af rec = 11,05%) rispetto laterali diffusione (Af diff = 9,35%) si può dedurre. A differenza di figura 2, il recupero non mantiene un livello di stato stazionario, ma piuttosto, a causa l'inibizione della sintesi proteica, mostra un aumento transitorio e conseguente calo dei segnali, corrispondente esaurimento del pool recettore disponibile (circa il 20% diminuzione osservata nel periodo di registrazione).
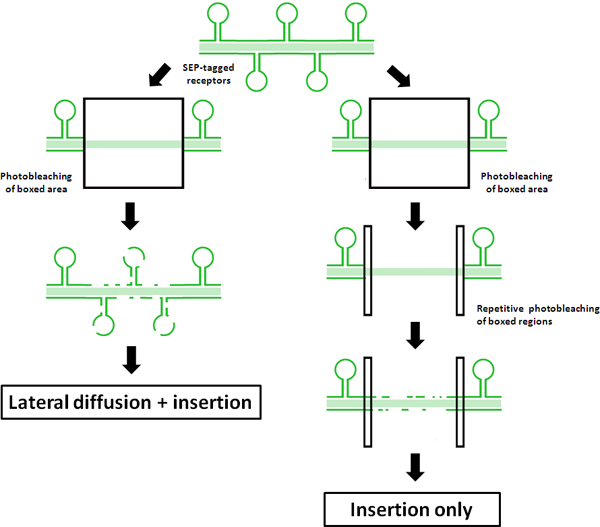
Figura 1. Schematica dei principi di FRAP vs FRAP-FLIP protocolli Questo schema illustra i risultati di un protocollo di FRAP regolare rispetto a 'FRAP-FLIP', usando sep-tagged recettori. Recupero fluorescenza in FRAP tradizionale viene visualizzata sulla sinistra. Misurato il recupero di fluorescenza nella centralissima ROI è attribuito ad una combinazione di laterali di diffusione f recettori SEP-tag non-fotodecolorate al di fuori del ROI fotodecolorate e l'inserimento di recettori attraverso il riciclaggio e / o de novo esocitosi nel pozzo dendritica. Al contrario, la fotodecolorate ripetitiva del ROI accompagnamento illustrato nella destra, mostra come questa modifica 'FRAP-FLIP' protocollo di silenzi recupero a causa di diffusione laterale. Come tale, qualsiasi recupero fluorescenza misurata può essere attribuito al inserimento diretto nella ROI.
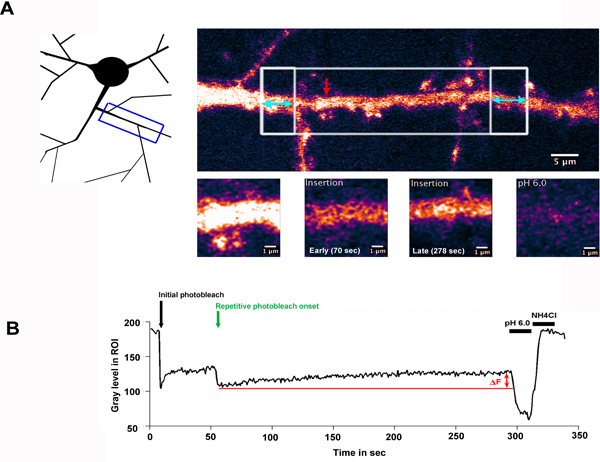
Figura 2.Inserimento di SEP-GluA2 nella membrana plasmatica sull'albero dendritico
A) Un neurone dell'ippocampo esprime SEP-GluA2, selettivamente fotodecolorate lungo una regione di dendrite. Lo schema illustra la regione di dendrite che è stato ripreso, mentre il pannello superiore sinistra evidenzia la ROI che sono state selezionate per photobleaching. La grande area bianca in scatola è stata sbiancata volta, seguita da ripetitivo sbiancamento delle regioni fiancheggianti in scatola, evidenziati con una freccia doppia blu. Questo pannello mostra la dendrite prima photobleaching. La freccia rossa indica la ROI misurato, mostrata in alto ingrandimento nei pannelli inferiori. B) mostra l'intensità di fluorescenza della ROI misurata nel corso del tempo dell'esperimento, tracciati come livello di grigio della ROI (non normalizzato). La freccia nera evidenziare la timepoint del fotosbiancante iniziale e freccia verde indica l'inizio del photobleaching ripetitivo. Af indica °e aumento della fluorescenza osservata nel corso del periodo di recupero, grazie all'inserimento di settembre-GluA2 nel pozzo dendritica. Successivamente pH basso e pH 7,4 + NH 4 Cl lavaggi confermare che la fluorescenza recuperato riguarda superficie recettori espressi.
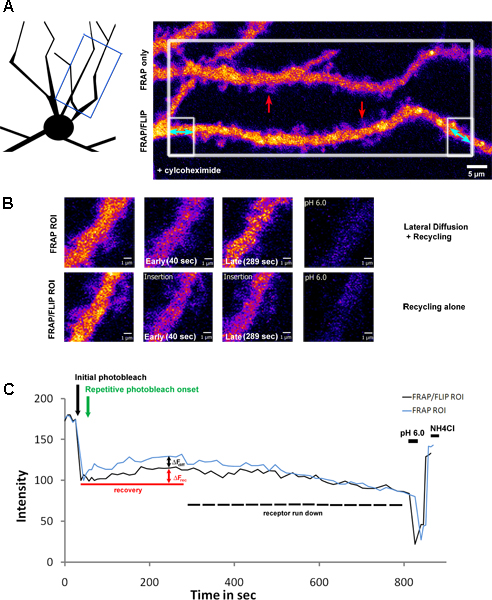
Figura 3. Riciclaggio Riciclaggio e laterali vs diffusione del SEP-GluK2 sull'albero dendritico in seguito al trattamento cyclohexamide
A) Un neurone dell'ippocampo esprime SEP-GluK2, selettivamente fotodecolorate con FRAP parallelo e 'FRAP-FLIP' protocolli di recupero eseguiti lungo separata ROI dendritica. Il neurone è stato oggetto di pretrattamento con cyclohexamide, per bloccare la sintesi proteica (2 ore a 200 pg / ml). Lo schema illustra la regione di dendrite che è stato ripreso, mentre il pannello di sinistra evidenziando la ROI che sono state selezionate per photobleaching. The ampio spazio bianco in scatola è stata sbiancata volta, seguita da ripetitivo sbiancamento delle regioni fiancheggianti in scatola, del dendrite inferiore solo, evidenziata con una freccia doppia blu. Questo pannello mostra i dendriti prima photobleaching. Le frecce rosse evidenziare il ROI mostrato in alto ingrandimento in B) che illustra il recupero di fluorescenza in FRAP tradizionale contro il protocollo del 'FRAP-FLIP'. Il confronto dei livelli di intensità di fluorescenza nella fase tardiva di recupero (pannelli terzi) mostrano il contributo di diffusione laterale e riciclaggio rispetto riciclaggio sola. C) mostra l'intensità di fluorescenza della ROI misurata nel corso del tempo dell'esperimento, tracciate come intensità normalizzate valori. La freccia nera evidenziare la timepoint del fotosbiancante iniziale e freccia verde indica l'inizio del photobleaching ripetitivo. Af rec indica il recupero transitorio dovuto al riciclaggio recettore, determinato dal FRAP / FLIP dendrite mentre Afdiff misura il contributo di diffusione laterale della SEP-GluK2 nel pozzo dendritica nella 'FRAP solo' ROI. L'aumento transitorio è seguita da graduale diminuzione del segnale, corrispondente alla corsa verso il basso di recettori disponibili a seguito di trattamento cyclohexamide. Il pH basso e successiva pH 7,4 + NH 4 Cl lavaggi confermare che la fluorescenza recuperato riguarda superficie recettori espressi.
Discussione
Abbiamo descritto una strategia innovativa per visualizzare le componenti di traffico proteina di membrana plasmatica. L'approccio combinatorio di photobleaching tecniche con proteine SEP-tag permette selettivamente l'inserimento della membrana plasmatica eventi da valutare. Continuamente photobleaching le proteine di membrana nelle regioni fiancheggianti durante il recupero, il metodo 'FRAP-FLIP' valuta il contributo del traffico vescicolare al recupero fluorescenza. Questo nuovo approccio permette la registrazione diretta di inserimento proteina di membrana, permettendo sia il numero di sotto-compartimenti dove si osserva il recupero e l'ampiezza del recupero (Af) allo stato stazionario da determinare. Inoltre, il confronto di FRAP con e senza FLIP permette la percentuale di recupero imputabile diffusione laterale da calcolare.
Inoltre, nello stesso esperimento, le regioni di non-fotodecolorate dendrite adiacente alle regioni fiancheggianti fotodecolorate può esserequalitativamente valutati durante il recupero, la perdita di fluorescenza osservata in queste regioni sarà a causa della diffusione laterale dei recettori fotodecolorate in questi non-fotodecolorate segmenti del dendrite.
Questo protocollo selettivo photobleaching può essere utilizzato per indagare su una serie di processi cellulari come il traffico che caratterizza excocytosis nella membrana plasmatica nelle sottozone definite (ad esempio, dendriti e spine) FRAP o valutare il contributo di inserimento laterale vs diffusione conducendo FRAP parallelo e ' -FLIP 'protocolli lungo dendriti adiacenti (Fig. 3).
Chiaramente, mentre le linee guida specifiche sono state presentate, ogni laboratorio sarà necessario ottimizzare i parametri di imaging in base agli esemplari ed attrezzature specifiche. È importante sottolineare che tutti i recettori di superficie della ROI devono essere fotodecolorate, indipendente dal asse z piano focale, ma senza danni significativi fototossico o non-specifici photobleaching. NoiERS deve esercitare cautela quando si tenta questo protocollo al soma cella, come l'alta percentuale di compartimenti pH relativamente bassi intracellulari genere si traduce in fluorescenza di fondo ad alto contenuto di queste regioni. Inoltre, mentre abbiamo dimostrato come questa tecnica può essere applicata in svariati modi, prima di iniziare selettivi photobleaching esperimenti su un nuovo SEP-tagged costruire, vi consigliamo una prima caratterizzazione dei recettori tag viene prima effettuata, come descritto da Ashby et al 2.
In generale, questo metodo è un adattamento potente e versatile del protocollo FRAP standard, consentendo eventi di inserzione in membrana plasmatica da valutare in tempo reale.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Siamo grati al Wellcome Trust e del CER per il sostegno finanziario. IMGG è un EMBO Fellow. KLH è un BBSRC finanziato dottorando. Ringraziamo Filippo Rubin e Patrick Tidball per il supporto cultura tecnica e la cella e il dottor Andrew Doherty per la manutenzione e l'assistenza con i microscopi.
Materiali
del reagente Azienda Numero di catalogo Commenti (opzionale)
| Name | Company | Catalog Number | Comments |
| Coprioggetto di vetro 24mm | VWR International | 631-0161 | |
| Poly-L-lisina | Sigma | P2636 | 1mg/ml in tampone borato per coprioggetti cappotto |
| Medio Neurobasal | Invitrogen | 21.103 | |
| B27 | Invitrogen | 17504-044 | 2% in placcatura neuronale e alimentazione medie |
| Penicillina Streptomicina | Sigma | P0781 | 1% in media placcatura neuronale e l'alimentazione |
| L-Glutammina | Invitrogen | 25.030 | 2mm / 0,8 mm in placcatura / alimentazione media |
| Horse Serum | Biosera | DH-291H | 10% in terreni in piastra neuronali solo |
| PSIN ReP5 vettore di clonazione | Invitrogen | K75001 | Per la produzione di virus Sindbis |
| LSM510 sistema META confocale | Zeiss | ||
| Immagine J Software | NIH | Software di accesso aperto. Tutti i plugin qui descritti sono disponibili all'indirizzo Http://rsbweb.nih.gov/ij/plugins/ |
Riferimenti
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- Ashby, M. C., Ibaraki, K., Henley, J. M. It's green outside: tracking cell surface proteins with pH-sensitive GFP. Trends Neurosci. 27, 257-261 (2004).
- Swaminathan, R., Hoang, C. P., Verkman, A. S. Photobleaching recovery and anisotropy decay of green fluorescent protein GFP-S65T in solution and cells: cytoplasmic viscosity probed by green fluorescent protein translational and rotational diffusion. Biophys. J. 72, 1900-1907 (1997).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophys. J. 73, 2782-2790 (1997).
- Wiedenmann, J., Oswald, F., Nienhaus, G. U. Fluorescent proteins for live cell imaging: opportunities, limitations, and challenges. IUBMB Life. 61, 1029-1042 (2009).
- Ashby, M. C. Removal of AMPA receptors (AMPARs) from synapses is preceded by transient endocytosis of extrasynaptic AMPARs. J. Neurosci. 24, 5172-5176 (2004).
- Bouschet, T., Martin, S., Henley, J. M. Receptor-activity-modifying proteins are required for forward trafficking of the calcium-sensing receptor to the plasma membrane. J. Cell. Sci. 118, 4709-4720 (2005).
- Ashby, M. C., Maier, S. R., Nishimune, A., Henley, J. M. Lateral diffusion drives constitutive exchange of AMPA receptors at dendritic spines and is regulated by spine morphology. J. Neurosci. 26, 7046-7055 (2006).
- Martin, S., Bouschet, T., Jenkins, E. L., Nishimune, A., Henley, J. M. Bidirectional regulation of kainate receptor surface expression in hippocampal neurons. J. Biol. Chem. 283, 36435-36440 (2008).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent membrane drift recruits AMPA receptors to dendritic spines. J. Biol. Chem. 284, 12491-12503 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon