Method Article
Diffusion latérale et l'exocytose des protéines membranaires dans des neurones en culture évaluée à l'aide de récupération de fluorescence et de fluorescence de perte de photoblanchiment
Dans cet article
Résumé
Ce rapport décrit l'utilisation de l'imagerie des cellules vivantes et des techniques de photoblanchiment pour déterminer l'expression de surface, les voies de transport et de la cinétique du trafic de manière exogène exprimé, sensible au pH GFP-protéines marquées à la membrane plasmique des neurones.
Résumé
Protocole
1. Culture cellulaire, transduction virale, et l'expression des protéines
- Neurones hippocampiques Culture à haute densité de embryonnaires ratons jour 18 (E18) sur des lamelles de verre poly-L-lysine pour 14-25 jours in vitro (DIV).
- 6-24h avant les expériences en direct, les cellules transduisent avec atténué virus Sindbis contenant la protéine membranaire d'intérêt, étiqueté avec le super-pHluorin écliptique (SEP).
- Ajouter le milieu contenant pseudovirion directement à la lamelle contenant 1 ml de milieu conditionné et retourné à la culture de l'incubateur. Le titre et l'heure de l'expression des protéines à la suite de transduction virale varie en fonction de la charge virale et doit être déterminée pour chaque lot avant de commencer les expériences de cellules vivantes.
2. FRAP-FLIP imagerie de cellules vivantes
- Equipement set-up
- Transférer la lamelle à la chambre de l'imagerie d'un microscope Zeiss Axiovert LSM 510 META confocale.Afin de minimiser les fluctuations de puissance lors de l'imagerie, d'assurer le microscope a été allumé, avec une sortie laser de 100%, pendant au moins 20 minutes avant l'imagerie.
- Immédiatement, remplacer le milieu de culture avec préchauffé (37 ° C) une solution d'enregistrement extracellulaire contenant 140 mM NaCl, 5 mM de KCl, 15 mM de glucose, 1,5 mM CaCl 2, 1,5 mM MgCl 2, 20-25 HEPES (pH ajusté à 7,4 avec NaOH) et placez la chambre sur la scène pré-chauffée (37 ° C) de la Axiovert Zeiss.
Assurez-vous de l'osmolarité de la solution d'enregistrement extracellulaire est ajustée à moins de 10 mOsM de votre milieu de culture. Si aucune évaporation notable se produit au cours de la timecourse de l'expérience, ce CO 2 solution indépendante est adapté pour de courtes expériences (<10 heures). Compléter avec 1-2 mM de bicarbonate de sodium est recommandé.
- Définir les paramètres de capture d'imagerie
- Tout d'abord, identifier un neurone exprimant la pro recombinantprotéine d'intérêt et de la mettre en focus.
- Avec une huile 63X opposé, acquérir une image de la cellule en utilisant l'ensemble 488nm d'excitation de lumière laser à faible puissance laser. Afin de minimiser photoblanchiment, utilisez une vitesse rapide nominale (7-9) et la résolution pixel faible (512-512) de la tenue vitesse de balayage total <1 seconde.
- Sélectionnez une partie de dendrite à l'image et le zoom pour capturer une image contenant le ROI (~ 1.5 à 2.5 x zoom optique). Lorsque cela est possible, assurer le champ de vision contient plusieurs processus de telle sorte que des mesures de dendrites de référence peut être obtenue, pour déterminer si non spécifique en raison de photoblanchiment acquisition se produit.
- Réglez les filtres, sténopé, vitesse de balayage et de gain du détecteur afin de permettre fluorescence maximale de l'excitation laser minimale, mais avec une saturation limitée. Un diamètre de trou d'épingle grande est recommandé, afin de maximiser la collecte de photons (2 pm convient pour épines et les dendrites ternaires). Le gain du détecteur doit être assez fort pour déceler les petites augmentations de fluorescence,de telle sorte que les premières images, avant l'photoblanchiment ne pas dépasser 10% de pixels saturés.
- Enregistrer cette configuration doit être utilisé pour la pré-/ post-eau de Javel et les phases de récupération de l'expérience.
- Suivant définir les régions photoblanchiment; la sélection d'un retour sur investissement pour le photoblanchiment initiale et des régions adjacentes de la phase de photoblanchiment répétitif ultérieure. S'assurer que les régions adjacentes sont suffisamment larges pour empêcher la récupération par diffusion entre les balayages (typiquement 5 um, voir Fig. 2).
- Ajustez les paramètres de l'eau de Javel pour ROIs photoblanchiment à la fois. Le photoblanchiment initiale doit être rapide (0,1-0,5 sec) nécessitant entre 1-5 itérations, selon le zoom optique et le volume de la RI. Pour les régions adjacentes, l'excitation laser doit être ajustée pour assurer photoblanchiment continue des régions flanquantes, mais sans dommage phototoxique.
- À titre indicatif, nous utilisons une excitation laser à 100% pour le photoblanchiment initiale, et 10% pour le pH répétitif photoblanchimentase.
- L'acquisition des images
- Une fois tous les paramètres ont été définis, à réaliser l'expérience FRAP-FLIP comme une séquence d'images time-lapse variable, décrites dans les 4 blocs ci-dessous:
BLOC 1: 3-10 images de référence pré-blanchiment, à la puissance laser de faible, pas de délai
BLOC 2: le retour sur investissement photoblanchiment centrale à la puissance du laser complète, 1-5 itérations
BLOC 3: 3-10 images de relèvement post-blanchiment
BLOC 4: photoblanchiment répétitive des régions flanquantes à la puissance du laser moyenne avec capture d'image à un intervalle de temps typique de 1 - 5 secondes, selon le taux de récupération de la protéine à l'étude. - Enfin, remplacer la solution d'enregistrement extracellulaire avec une solution tamponnée à pH 6 d'enregistrement contenant 140 mM NaCl, 5 mM de KCl, 15 mM de glucose, 1,5 mM CaCl 2, 1,5 mM MgCl 2, 20-25 mM de MES (pour étancher la fluorescence) ou complétées avec 50 mM NH4Cl contenant 90 mM de NaCl, 5 mM de KCl, 15 mM de glucose, 1,8 mM de CaCl 2, 0,8 mMMgCl 2, 20-25 mM d'HEPES, pH 7,4 (pour révéler les protéines dans les magasins à bas pH intracellulaire), (voir Fig. 2).
- Collecter au moins 10 à 20 ensembles de données pour chaque protéine recombinante, pour permettre une analyse statistique. Conditions d'imagerie afin d'éviter de biaiser les résultats, assurer sont maintenues conformément à travers répétitions. Se débarrasser de tout les ensembles de données lorsqu'elles sont incomplètes blanchiment, une dérive importante du plan focal ou des dommages aux cellules phototoxique sont observées.
- Une fois tous les paramètres ont été définis, à réaliser l'expérience FRAP-FLIP comme une séquence d'images time-lapse variable, décrites dans les 4 blocs ci-dessous:
3. Analyse des données
- Ouvrez les images avec le logiciel ImageJ.
- Alignez les piles pour tenir compte des petites fluctuations dans le plan xy qui se sont produites tout au long de la série chronologique en utilisant le plugin Stackreg (plugins → → stackreg transformation: corps rigide → ).
- Pour les images prises sur le Zeiss confocal, utilisez le plugin Boîte à outils LSM de rapporter les valeurs de temps dans un fichier texte (plugins → LSM Boîte à outils → Voir LSM Boîte à outils → → ),et d'importer ces valeurs dans une feuille de calcul d'analyse.
- Pour mesurer les fluctuations de fluorescence au cours de l'expérience FRAP-FLIP, il faut diviser le segment photobleached dans les régions de pixels individuels (environ 20pixels) et de mesurer la fluorescence moyenne de ces ROIs à chaque point dans le temps (F). Pour obtenir rapidement ces valeurs, sélectionnez ROIs multiple en utilisant l'outil d'analyse de la ImageJ 'ROI gestionnaire (→ Outils → Analyser le retour sur investissement Manager) et un rapport de la fluorescence moyenne par pixel en utilisant le «Terrain de l'axe Z profil» commande (Image → Stacks → Plot Z le profil d'axe).
- Répétez cette étape pour mesurer l'intensité de fluorescence d'un arrière-plan, la région non fluorescent.
- Normaliser l'intensité de fluorescence à chaque point dans le temps en soustrayant les valeurs de fond pour supprimer le bruit expérimental, et de diviser toutes les valeurs par la mesure de référence pré-blanchi moyenne.
- Mesurer l'intensité de fluorescence des zones adjacentes non-photobleached dendrites d'évaluer le niveau de non-spécifiquephotoblanchiment lors de l'acquisition. Correction pour la non-spécifique photoblanchiment est déconseillé pour l'interprétation de «FRAP-FLIP» des données et devrait être évitée autant que possible.
- Pour calculer si la reprise significative a eu lieu dans un retour sur investissement, il faut soustraire la moyenne des dernières mesures 5-10 de la séquence de la moyenne des premières mesures (5-10 AF) et de déterminer la signification statistique. Catégoriser le ROI de récupération et de non-récupération d'évaluer le modèle de l'exocytose (hotspots exocytose dire ou de récupération d'arbre colonne vertébrale vs).
4. Les résultats représentatifs
Le résultat de type FRAP-FLIP expérience est montré dans la figure. 2. Ici, un neurone exprimant la sous-unité du récepteur AMPA GluA2 glutamate de type, étiqueté avec la SEP a été sélectivement photobleached le long d'une région de dendrite. Fig 2.A illustre la région de dendrite qui a été photographié et indique le ROI qui ont été sélectionnés pour photoblanchiment (régions boîte blanche). The grande zone blanche en carton a été blanchi une fois, suivi par répétitif blanchiment des régions flanquantes en boîte, mis en évidence avec double tête flèches bleues. La flèche rouge indique le retour sur investissement mesuré, montré en fort grossissement dans les panneaux inférieurs.
Fig 2.B, montre l'intensité de fluorescence dans le retour sur investissement mesuré au cours du temps de l'expérience. Dans cet exemple, une période de récupération a été enregistré une minutes après le photoblanchiment initiale pour permettre récepteurs écrus pour entrer dans le retour sur investissement par la diffusion latérale. Lorsque les régions flanquantes sont photobleached, le signal de fluorescence à partir de cette fraction fortement mobiles de récepteurs est occlus de la région centrale, et ceux de la région sont dilués à. L'augmentation de la fluorescence (AF) ont observé au cours de la «FLIP» séquence peut donc être attribué à l'insertion de SEP-GluA2 dans l'arbre dendritique. Le lavage à faible pH et un pH de 7,4 + NH4Cl outre respectivement confirmer que la fluorescence mesurée est dérivée de la surfaceprotéines et révéler la proportion de protéines intracellulaires, séquestrés dans le retour sur investissement mesuré.
Contrairement à FRAP, cette méthodologie de récupération isole en raison de l'exocytose, aboutissant à un niveau considérablement réduit de recouvrement de fluorescence dans la région photobleached. Jusqu'à présent, aucun modèle mathématique fiable a été développé pour s'adapter et d'analyser la reprise traces enregistrées en utilisant cette technique sélective de blanchiment. Il est cependant possible d'adapter la trace de récupération avec une reprise mono exponentielle:
F (t) = A s - Un e 0 (-t / τ)
Où F (t) est la fluorescence au temps t, A, S est la valeur en régime permanent, A 0 est le décalage au temps 0, τ est la constante de temps. La croissance de recouvrement est fixé à un taux donné d'atteindre un équilibre, correspondant à un état stable entre l'insertion et la diffusion. Surtout, la constante de temps extraite de ce unnalyse ne reflète pas la constante de temps de l'exocytose et ne peut être utilisé pour des traitements comparatifs pour une protéine individuelle.
En outre, l'évolution attendue des recouvrement de fluorescence est susceptible d'être observé dans les sous-domaines le long de la région photobleached. Analyse du retour sur investissement dans un segment de petite photobleached peut être essentiel pour révéler l'exocytose "points chauds" et il est conseillé d'analyser les régions de longueurs comparables à celles de la variabilité de la densité de ces taches entre la dendrite aura une incidence sur le taux calculé.
La figure 3 montre une extension de ce protocole, l'application de la photoblanchiment de ROI grande partie avec des dendrites multiples dans le champ de vision, suivie par répétitif sélective de blanchiment d'un seul dendrite. Cette approche permet traditionnelle «FRAP» et «FRAP-FLIP» des données devant être acquises en parallèle. Dans cet exemple, neurones de l'hippocampe ont été infectées par une sous-unité du récepteur du glutamate de la classe kaïnate; SEP-étiqueté GluK2. Prior à l'imagerie, ces neurones ont été traités avec des cylcohexamide (2h à 200μg/ml), pour bloquer la synthèse des protéines. En tant que tel, de recouvrement de fluorescence dans le ROI correspondant mesurée (figure 3.B) révèle que la proportion de la reprise en raison de la diffusion latérale et le recyclage dans la dendrite FRAP standard et le recyclage seul dans la dendrite soumis à la «FRAP-FLIP" protocole. En comparant les valeurs Af à partir de courbes de récupération par rapport à la FRAP »FRAP-FLIP», les contributions relatives de recyclage (AF rec = 11,05%) par rapport à la diffusion latéraux (AF diff = 9,35%) peut être déduite. Contrairement à la figure 2, la reprise n'est pas de maintenir un niveau stable, mais plutôt, en raison de l'inhibition de la synthèse des protéines, montre une augmentation transitoire et après débarquement dans le signal, ce qui correspond à l'épuisement de la piscine du récepteur disponible (environ baisse de 20% observée au cours de la période d'enregistrement).
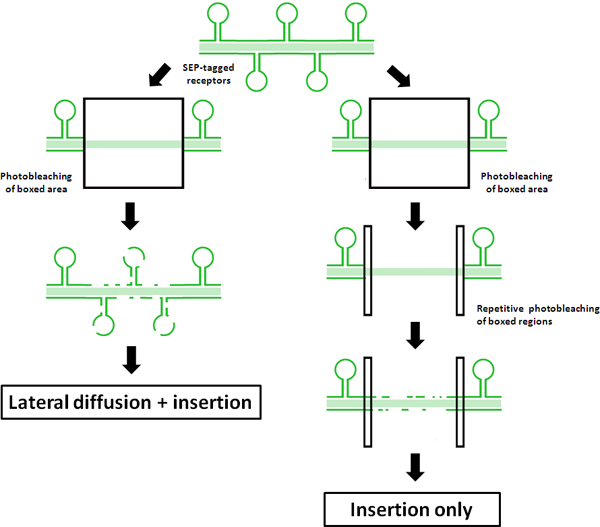
Figure 1. Schéma des principes de FRAP vs FRAP-FLIP protocoles Ce schéma illustre les résultats d'un rapport régulier FRAP protocole un «FRAP-FLIP», en utilisant les tags SEP-récepteurs. Recouvrement de fluorescence dans le FRAP traditionnelle est indiquée sur le côté gauche. Mesuré recouvrement de fluorescence dans le centre ROI est attribuée à une combinaison de diffusion latérales f non-photobleached récepteurs SEP-étiqueté à partir de l'extérieur de la ROI photobleached et l'insertion des récepteurs à travers le recyclage et / ou de novo exocytose dans l'arbre dendritique. En revanche, le photobleached répétitif du ROI d'accompagnement illustré dans droite, montre comment cette mise à jour «FRAP-FLIP« protocole de récupération silences due à la diffusion latérale. En tant que tel, toute récupération de fluorescence mesurée peut être attribuée à une insertion directe dans le retour sur investissement.
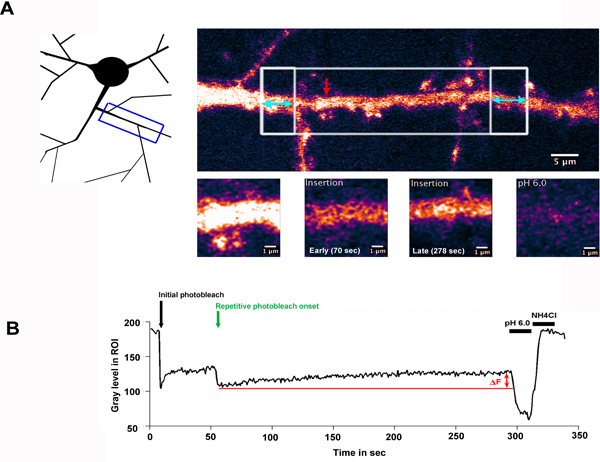
Figure 2.Insertion de SEP-GluA2 dans la membrane plasmique sur l'arbre dendritique
A) Un neurone hippocampique exprimer SEP-GluA2, sélectivement photobleached long d'une région de la dendrite. Le schéma illustre la région de dendrite qui a été imagée, tandis que le panneau supérieur gauche met en évidence le ROI qui ont été sélectionnés pour photoblanchiment. La grande zone blanche en carton a été blanchi une fois, suivi par répétitif blanchiment des régions flanquantes en boîte, mis en évidence avec double tête flèches bleues. Ce panneau montre la dendrite avant photoblanchiment. La flèche rouge indique le retour sur investissement mesuré, montré en fort grossissement dans les panneaux inférieurs. B) montre l'intensité de fluorescence dans le retour sur investissement mesuré au cours du temps de l'expérience, représentée en niveau de gris dans le retour sur investissement (non normalisée). La flèche noire mettre en évidence le point de temps de l'agent de photoblanchiment initiale et flèche verte indique le début de la photoblanchiment répétitif. AF indique èmeaugmentation de la fluorescence e observée au cours de la période de récupération, due à l'insertion de la SEP-GluA2 dans l'arbre dendritique. Après un pH faible et un pH de 7,4 + lavages de NH 4 Cl confirmer que la fluorescence recouvrée se rapporte à la surface des récepteurs exprimés.
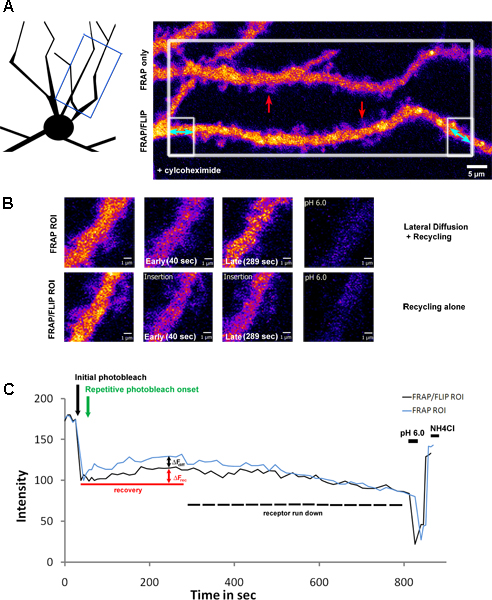
Figure 3. Recyclage & latérale Recyclage vs diffusion de SEP-GluK2 sur l'arbre dendritique après le traitement cyclohexamide
A) Un neurone hippocampique exprimer SEP-GluK2, de manière sélective avec photobleached FRAP parallèle et protocoles de récupération »FRAP-FLIP» effectuées le long ROIs dendritique séparée. Ce neurone a fait l'objet d'un prétraitement avec cyclohexamide, pour bloquer la synthèse des protéines (2 heures à 200 pg / ml). Le schéma illustre la région de dendrite qui a été imagée, tandis que le panneau de gauche mettant en évidence le ROI qui ont été sélectionnés pour photoblanchiment. The grande zone blanche en carton a été blanchie fois, suivie par répétitif de blanchiment des régions flanquant en boîte, de la partie inférieure de dendrites que, mis en évidence avec doubles dirigés flèches bleues. Ce panneau montre les dendrites avant photoblanchiment. Les flèches rouges souligner le ROI indiqué dans un fort grossissement en B) illustrant le recouvrement de fluorescence dans le FRAP traditionnel et le protocole du «FRAP-FLIP». Les comparaisons des niveaux d'intensité de fluorescence dans le stade tardif de la récupération (panneaux tiers) montrent la contribution de la diffusion latérale et le recyclage par rapport recyclage seul. C) montre l'intensité de fluorescence dans le ROI mesuré au cours du temps de l'expérience, représentée en intensité normalisée les valeurs. La flèche noire mettre en évidence le point de temps de l'agent de photoblanchiment initiale et flèche verte indique le début de la photoblanchiment répétitif. AF rec indique la reprise passagère due au recyclage des récepteurs, déterminée à partir de la dendrite FRAP / FLIP tout AFdiff mesure la contribution de la diffusion latérale de la SEP-GluK2 dans l'arbre dendritique dans le «FRAP seulement" retour sur investissement. L'augmentation transitoire est suivie d'un déclin progressif du signal, correspondant à la course vers le bas de récepteurs disponibles à la suite du traitement cyclohexamide. Le pH ultérieure faible et un pH de 7,4 + lavages de NH 4 Cl confirmer que la fluorescence recouvrée se rapporte à la surface des récepteurs exprimés.
Discussion
Nous décrivons une stratégie novatrice de visualiser les composants de la traite plasma protéine de la membrane. L'approche combinatoire de photoblanchiment techniques avec des protéines SEP-étiqueté permet sélectivement les événements plasma membrane d'insertion à être évaluée. En permanence photoblanchiment des protéines membranaires dans des régions adjacentes lors de la récupération, la méthode du «FRAP-FLIP» évalue la contribution du trafic vésiculaire à la récupération de fluorescence. Cette nouvelle approche permet l'enregistrement direct de l'insertion des protéines membranaires, permettant à la fois le nombre de sous-compartiments dont le recouvrement est observé et l'amplitude de la reprise (AF) à l'état stationnaire à déterminer. En outre, la comparaison de PAF avec et sans FLIP permet la proportion de recouvrement attribuable à la diffusion latérale à être calculée.
En outre, dans la même expérience, les régions de non-photobleached dendrite adjacente aux régions flanquantes photobleached peut êtreune évaluation qualitative lors de la reprise, la perte de fluorescence observée dans ces régions sera en raison de la diffusion latérale des récepteurs photobleached dans ces segments non-photobleached de la dendrite.
Ce protocole sélective photoblanchiment peut être utilisée pour étudier une variété de processus cellulaires tels que le trafic caractérisant excocytosis dans la membrane plasmique dans les sous-zones définies (par exemple, les dendrites ou épines) FRAP ou d'évaluer la contribution de l'insertion de diffusion vs latérale en effectuant en parallèle et des FRAP -FLIP »le long des dendrites protocoles adjacents (Fig. 3).
De toute évidence, tandis que les directives spécifiques ont été présentés, chaque laboratoire devra optimiser les paramètres d'imagerie selon les spécimens spécifiques et des équipements. Important, tous les récepteurs de surface dans la ROI doivent être photobleached, indépendante du plan z-axe focal, mais sans endommager phototoxique significative ou non spécifique photoblanchiment. NousERS devrait faire preuve de prudence lorsque l'on tente ce protocole à le corps cellulaire, comme le pourcentage élevé de compartiments intracellulaires de pH relativement faible se traduit généralement par fluorescence de fond élevé dans ces régions. En outre, tandis que nous avons montré comment cette technique peut être appliquée de diverses manières, avant de commencer les expériences de photoblanchiment sélectifs sur une nouvelle SEP-étiqueté de construire, nous vous informons que la caractérisation initiale des récepteurs marqués est d'abord menée, tel que décrit par Ashby et al 2.
Dans l'ensemble, cette méthode est une adaptation puissante et polyvalente du protocole FRAP standard, permettant des événements d'insertion dans la membrane plasmique à être évalués en temps quasi réel.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous sommes reconnaissants à la Wellcome Trust et l'ERC pour un soutien financier. IMGG est un Fellow EMBO. KLH est un étudiant BBSRC financé par un doctorat. Nous remercions Philip Rubin et Patrick Tidball pour le soutien de la culture technique et la cellule et le Dr Andrew Doherty pour l'entretien et l'assistance avec les microscopes.
matériels
Nom du réactif Société Commentaires (optionnel) libre accès. Tous les plugins décrits ci-après sont disponibles à Http://rsbweb.nih.gov/ij/plugins/
| Name | Company | Catalog Number | Comments |
| Des lamelles de verre 24mm | VWR International | 631-0161 | |
| Poly-L-lysine | Sigma | P2636 | 1mg/ml dans du tampon borate à lamelles manteau |
| Moyen Neurobasal | Invitrogen | 21103 | |
| B27 | Invitrogen | 17504-044 | 2% en placage neuronale et d'alimentation moyenne |
| Streptomycine Pénicilline | Sigma | P0781 | Moyenne 1% en placage neuronale et l'alimentation |
| L-glutamine | Invitrogen | 25030 | 2 mM / 0,8 mM dans le placage / alimentation moyennes |
| Sérum de cheval | Biosera | DH-291H | 10% dans les médias de placage neuronales ne |
| Psin ReP5 vecteur de clonage | Invitrogen | K75001 | Pour la production de virus Sindbis |
| LSM510 META confocale système | Zeiss | ||
| Image J Software | NIH |
Références
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- Ashby, M. C., Ibaraki, K., Henley, J. M. It's green outside: tracking cell surface proteins with pH-sensitive GFP. Trends Neurosci. 27, 257-261 (2004).
- Swaminathan, R., Hoang, C. P., Verkman, A. S. Photobleaching recovery and anisotropy decay of green fluorescent protein GFP-S65T in solution and cells: cytoplasmic viscosity probed by green fluorescent protein translational and rotational diffusion. Biophys. J. 72, 1900-1907 (1997).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophys. J. 73, 2782-2790 (1997).
- Wiedenmann, J., Oswald, F., Nienhaus, G. U. Fluorescent proteins for live cell imaging: opportunities, limitations, and challenges. IUBMB Life. 61, 1029-1042 (2009).
- Ashby, M. C. Removal of AMPA receptors (AMPARs) from synapses is preceded by transient endocytosis of extrasynaptic AMPARs. J. Neurosci. 24, 5172-5176 (2004).
- Bouschet, T., Martin, S., Henley, J. M. Receptor-activity-modifying proteins are required for forward trafficking of the calcium-sensing receptor to the plasma membrane. J. Cell. Sci. 118, 4709-4720 (2005).
- Ashby, M. C., Maier, S. R., Nishimune, A., Henley, J. M. Lateral diffusion drives constitutive exchange of AMPA receptors at dendritic spines and is regulated by spine morphology. J. Neurosci. 26, 7046-7055 (2006).
- Martin, S., Bouschet, T., Jenkins, E. L., Nishimune, A., Henley, J. M. Bidirectional regulation of kainate receptor surface expression in hippocampal neurons. J. Biol. Chem. 283, 36435-36440 (2008).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent membrane drift recruits AMPA receptors to dendritic spines. J. Biol. Chem. 284, 12491-12503 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon