Method Article
集束イオンビームを用いて低温電子顕微鏡標本の準備
要約
クライオ電子顕微鏡、走査型(SEM)のいずれか、または送信(TEM)は、広く高含水率1を有する生物学的試料または他の材料の特徴付けのために使用される。 SEM /集束イオンビーム(FIB)は、試料中の関心対象の特徴を識別し、クライオTEMへの転送のために薄い電子透過性のラメラを抽出するために使用される。
要約
ここでは、 アスペルギルス·ニガー胞子の低温TEMサンプルを調製するために使用されるプロトコルを提示したが、容易に微生物または溶液の任意の数に適合させることができる。私たちは、特注のクライオ乗換駅と修正されたクライオSEMの準備室2を利用する。胞子を液体窒素スラッシュ内プランジ凍結し、関心領域を選択するためにクライオSEMで観察され、培養物から採取する。薄いラメラ次に、FIBを使用して抽出され、TEM格子に付着し、その後、電子透過まで薄く。グリッドは、クライオTEMホルダに、高分解能TEM研究のために転送される。冷却されたナノマニピュレータの先端とクライオ搬送ステーションの導入のおかげで、このプロトコルは、TEM試料の日常的に使用されるFIBの準備の極低温に簡単で最適化したものです。このように、既存の機器、セットアップおよび手順への修正に少量を必要とするという利点を有する。それをI実装するのは簡単。それは原則クライオTEMサンプル調製と同様に、広範囲の用途を有する。一つの制限は、汚染を回避又は最小限にするために重要なステップで標本の取り扱い熟練を必要とすることである。
概要
このプロトコルでは、以前はcryo-FIB/SEM SEM分析によって高精度に同定された試料の特定領域からのTEM試料を作製するために使用される。生体試料の電子顕微鏡(走査または透過)分析は研究および診断のために使用されるルーチン的な技術である。 SEMはかなり早く採用し、解釈が容易であるが、情報は、試料表面から1.5 nmの範囲の解像度が得られる。 TEMは、より高い解像度を有するが、実装がより困難であり、画像解析はあまり簡単であり、大容量情報が取得されるのに対し、サンプル(約500nm未満の厚さ)の透明性を電子を薄くする必要がある。さらなる問題は、それらの機器の真空要件はほとんど水を含有する試料によって許容されないことである。ほとんどの場合、生物学的サンプルを化学的に固定(例えば、水に代えて、ポリマー)又は乾燥させるのいずれかがある。両方の場合において、有意な変化試料の形態および構造が生じやすい。水和した試験片のTEMクライオ調製物は、最小限の化学的変化を誘発し、それは氷のガラス化が1-6が得られる場合は特に、それらの天然の状態にできるだけ近いサンプルを生成する。
FIBは広く、その多くの利点のために7 TEMサンプルを調製するために使用される。少数を示すために:近垂直入射での高エネルギーイオンの使用は、材料関連の差動ミリング速度の影響を最小限に抑える。バルクサンプルから抽出された領域は、サブミクロンの精度で選択することができる;材料の非常に少量を抽出する。最近の技術開発は、極低温2,8-10でTEM試料調製のためにも、FIBを使用可能にした。このようなスライスされたラメラの機械的変形の欠如などのソフトマターのサンプルのために主に使用クライオミクロトーム11,12の伝統的な製造法に比べていくつかの利点がありますが、ナイフマークとハード/ソフトのインターフェイスやコンポーネントとコンポジット試料を調製する可能性がないこと。
プロトコル
注:このプロトコルで指定されたすべてのパラメータは、ここに示されている楽器やモデルに有効です。他のメーカーやモデルが使用されている場合(本文中に*でマーク)これらのパラメータの一部が異なる場合があります。
FIB / SEMの1。スタートアップ
- anticontaminator(AC)に銅編組を結び付けずに、特注の冷たいナノマニピュレータ(NM)チップをマウントします。代わりに三つ編みが先鋭化ステップ(1.2)中に電荷を防止するための絶縁点以上のNMの残りの部分に接続されていることを確認してください。
- 高真空と画像のNM先端にポンプ、SEMチャンバーを閉じます。
- 先端は、鈍曲がったり、前の使用によって汚染されている場合には、イオンビームを用いて削り:先端部の側面に沿って、多角形フライスパターンを選択し、粉砕後、先端が1μm以下にまで先細りになるようにします。
- 先端の辺が離れてミリングされたら、手動で全体NMロッド90°だけ回転SEM室の外から。
- 別の角度から回転先端を繰り返しフライス加工に適応するために、多角形フライスパターンを調整します。
- 先端は、1ミクロン未満であるNMを後退させるとガス注入システム(GIS)の針を挿入するために鋭利された後; (代わりに、通常の175μmの)作動距離より約1ミリメートルになるように針の位置を変更。
- 白金前駆体を用いた場合は、(代わりに通常の40℃)24〜26℃にその動作温度を変更してください。これらのステップは、Ptを低温堆積13のために必要とされる。
- SEM室を開き、クライオ試料ステージと交流を装着することにより、低温モード用のFIB / SEMを準備します。
- 挿入された位置に、NMを切り替えて、ACにその銅編組を接続してください。誤っNM先端には手を触れないようにしてください。システムは、極低温で銅編組の柔軟性の喪失は、NMの動きを妨げないことを確認するために挿入されたNMで冷却されるMENT。
- 数分間乾燥窒素ガスを冷却するためのパイプをパージします。
- クライオ準備室と高真空に主試料室ポンプ。
- 両室を冷却するためにデュアーに液体窒素を追加します。所望の温度に到達するまでお待ちください。
2。サンプル凍結
- SEMの転写ホルダーのFIB試料について2 TEMグリッドをマウントします。ドライバーで対応するネジを締めて固定します。
- 検体のサンプルスタブ適切にマウントし、試料の一部を追加します。試料の種類に応じて、試料は、低温接着剤で又はクランプで固定することができる。最適な凍結を確実にするために、できるだけ少量を使用する。
- 真空搬送装置(VTD)に、SEMの転写ホルダーを取り付けます。
- 流し込みステーションに液体窒素を加え、窒素スラッシュを得るために、ポンプダウン。
- SLを開く駅やプランジ凍結のSEM転写ホルダーをushing。沸騰が完了し、スラッシュが再び得られるまで再びポンプダウン。それは、エタン又はプロパンスラッシュまたは高圧凍結試料のガラス化を得るためにより適した技術であることに留意されたい。
- VTDの真空チャンバ内にSEM転送ホルダを後退させると、それを密封する。
- 流し込み駅やクライオ準備室のエアロックベント。
- クライオ準備室とポンプのエアロックとVTDシールを一致させる。
- 良好な真空レベルに達すると、VTDおよび外側エアロックのシールを開くために、エアロックピンが係合する。 SEMの転写ホルダーを挿入します。スパッタリング及び破砕のためのサンプル位置を示す準備チャンバ内で摺動接点上のマーキングがある。
- 必要であれば、サンプルができます冷たいナイフを骨折。より高い温度(通常は-100を設定することにより、昇華6、C);冷たいスパッタリング装置を用いてのAu / Pd又はPtを被覆(300 V、10ミリアンペア、2〜3ナノメートルのAu / Pdのキャップは60秒)*。昇華は彼らの再結晶化を回避するために、ガラス化したサンプルには使用しないでください。
- TEM格子スロットの保護蓋を開くために冷たいナイフを使用してください。
- 受信の高さ(16ミリメートル*)に試料室中のコールドステージを持参してください。
- FIB / SEMにHTを切り、内側のエアロックを開きます。
- 試料室にSEMホルダーを転送するVTDを使用する。部屋の照明の調光は、このステップで役立つことがあります。
- SEMホルダーがコールドステージになると、押し、回転させることによって、VTDを外す。
- VTDの真空チャンバ内にVTD棒を奥まで後退させ、内側エアロック、アウターエアロックとVTDシールを閉じます。外側のエアロックは現在、VTDシールを除去して排出することができます。この最後のステップは必要ありませんが、VTD棒が簡単に誤って外れることがありますようにそれが損傷を引き起こす可能性がある、お勧めしますVTDまたはエアロックへ。
3。イオンミリング
- 両方の列にハイテンションの電源をオンにして、適切な撮像パラメータ(加速電圧設定:電子ビームのための10 kVの、イオンビームのための30 kVの、スポットサイズ:3;作動距離:5ミリメートル、イオンビーム電流:10〜100をイメージングのためのPA、フライス加工用1-3 NA)*。
- 関心対象の特徴を見つけるためにラメラの抽出前の試料の状態を記録するために画像を取得するために電子ビームを使用する。
- 抽出のための関心領域(ROI)が識別されると、サンプル自体の地形でもPtの堆積後のROIを簡単に識別するために許可しない限り、イオンビームパターニングによってそれをマーク。増加精度を、Pettersson氏らの方法を使用します。14マーキングは、深く広く、非SELであるクライオ白金蒸着(でカバーされた後、まだ目に見えるであることが十分でなければならないectiveと試料表面の数mm 2)をカバーする。
- 24〜26℃に前駆体ガスを加熱し、試料表面の上方約1mmの高さGIS針を挿入する(工程1.3も参照)。
- 電子ビームをイメージしながら、数秒間ガス弁を開く。クライオのPt堆積速度は、GIS針、試料粗さおよびユーザーのシステムの距離に依存し、100〜500Å/秒以上である。これは、最適なパラメータを決定するために、いくつかのテストの堆積を実行することをお勧めします。
- 生のクライオ-PT堆積は非常に粗く、不均一である。低倍率(例えば、2,000 X)で1000 pAのイオンビームを用いてROIの上に堆積物を硬化させる。クライオ沈着とは異なり、この硬化は、サイト選択的であり、ROIのみで実行する必要があります。この第低温堆積の目的は、イオンビーム損傷から試料の表面を保護するために、イオン間引き13の間カーテニングを低減することである。
- にサンプルを傾けて52℃の表面がイオンビームに対して垂直になるように。離れてミルROIの両側に2段々のトレンチ。トレンチのための典型的な寸法は、抽出すべきラメラ、垂直方向(Y)における可変で10〜15ミクロンの方向(X)に並列に20〜30μmであり、最深点で、深さ(Z)を傾斜投資収益率に近い。傾斜は45〜55℃である必要があります。いくつかの楽器では、棚田のトレンチは上部の最深部に粉砕することができる。このような場合には、投資収益率の下でミル1は、イメージ180°、ミル、他側の第1回転させます。材料のスパッタ速度が既知であれば、ミリングの深さを選択することができる。ほとんどの凍結水和試料については、氷のスパッタ速度は、07を使用することができる。
- 戻って0°にサンプルを傾け、ラメラの側面および下面を切り取るためにイオンビームを使用し、必ずカットマークが全体のラメラを通過させる(これらは棚田の斜面ミルで製粉跡を残す必要があります前のステップでのED)。サンプルの残りの部分にラメラを接続するだけ2小さな橋を残す。
- (これは少しのサンプルをシフト可能)、GIS針を挿入します。その先端は、好ましくは側で、ラメラと物理的に接触するまでNMを操縦。 NMは2小さい接続ブリッジのイオンビームビューを妨げていないことを確認します。
- 数秒のためのGISバルブを開いて、電子ビームを連続撮影によってクライオ沈着を監視します。
- Ptをさらに1〜2ミクロンの層がクライオ寄託されている場合には、バルブを閉じてください。
- 唯一のNMはラメラと接触している点の周りの数μmでPT(ステップ2.6を参照)を硬化。
- 無料のラメラをカットする高いイオンビーム電流を使用してください。 2接続するブリッジは離れて粉砕されただけでなく、ラメラとサンプルの残りの部分との間の新たな接点を形成した可能性のPtの余分する必要があります。まだ、GIS針を撤回しないでください。
- 慎重にトレンチからラメラを抽出し、少なくとも500μmの試料表面の上に移動し、NMを操縦。唯一のこのステップの後、GIS針を後退させる。
- 試料ステージの数mmを下げ、TEMグリッドの1が表示されているまでそれを移動します。作業位置にグリッド上の取り付け領域を移動して、GIS針を挿入します。
- 慎重にTEMグリッド上に取付け領域と物理的に接触添付ラメラを持って来るために、NMを操縦。ラメラ、TEMグリッドとNMの間には圧力や緊張があってはならない。
- 数秒と低温堆積物のPtのさらに1〜2ミクロンの層のためのガスのバルブを開きます。
- 唯一のラメラとTEMグリッドとの間の接触点の周りの数μmでPT(ステップ2.6を参照)を硬化。
- メキシコの自由ラメラをカットする高いイオンビーム電流を使用してください。これは、NMチップまたはサンプルのいずれかの側に離れて粉砕することによって達成することができる。 T中彼最初のケースは、先端部が、ステップ1.2で説明したように、次回の使用の前に再び先鋭化する必要があります。
- OPTIONAL:この段階では、SEMの転写ホルダーを取り、液体窒素で満たされたデュワーでO / Nに格納するVTDを使用することが可能である。液体窒素は空気中の湿気にさらされると、氷の結晶が既に存在しているおよび/または場合は、この転写及びO / Nストレージは、ラメラの表面上の氷の形成を引き起こす可能性があり;しかし、このような汚染は、比較的短時間で次の工程によって除去される。前の手順が完了するまでに数時間を取っている可能性がある次のステップの後に、ストレージ·O / Nが推奨されていないので(昇華により除き、氷の汚染を除去する方法はないだろうとして、それは、これを行うことが適切で可能性がある試料のガラス化が維持される場合)を行うことができない。
- 52℃にサンプルを傾け、透明度7を電子薄いそれにイオンビームを使用しています。それは、より高い、rougで始めることをお勧めします彼女のビーム電流は、大部分を除去し、最終的にも、加速電圧を低減し、低ビーム電流で表面を研磨微に進みます。ラメラの最終的な厚さはサンプル組成に応じて、100〜200 kVのTEMでの超微細構造解析のための100〜200 nm以下または300 kVのTEMでの断層撮影では最大500程度にする必要があります。間伐時には、サンプルの内部応力がカールするラメラや曲がりの原因となります。このような場合には、薄くなった領域が制限されるべきである。これは、 図11および12に、例えば、起こった。
TEMに4。クライオトランスファー
- 数分間乾燥窒素ガスをクライオ乗換駅をフラッシュします。
- TEM交流のデュワーへとクライオトランスファーステーションに液体窒素を追加します。
- クライオ搬送ステーションの適切なスロットにクライオトランスファーTEMホルダーを挿入し、同様にそのデュワーを埋める。各コンプまで待ってonentは、所望の温度(約15分)に達した。可能であれば、クライオ転写TEMホルダのコントローラは、転写時の温度を監視するために接続されるべきである。これは、(温度センサが配置されている)TEMホルダの先端がクライオ搬送ステーションと接触するので、TEMホルダの残りの部分よりもはるかに速くを冷却することを認識することが重要である。したがって、冷却する全体クライオトランスファーTEMホルダーのために必要な時間は、予め測定し、システムは時間の少なくともその量のために熱化を許可されていることをお勧めします。
- 液体窒素で極低温カップを満たし、その中に浸す。所望の温度にそれらの先端を冷却するために、TEM試料クランプツール、ドライバーとピンセットを。操作者の手に冷たい火傷を引き起こさないように、すべてのツールが正しく他端に絶縁されるべきである。
- 外側のエアロックにVTDと一致する。冷たいクワガタをもたらす搬送高(16ミリメートル*)へのE。ハイテンションの電源をオフにします。
- VTDシール、外側と内側のエアロックエアロックを開きます。
- 時計回りに押し、回転させることで、SEM転送ホルダーにロックするVTDロッドを使用してください。
- クライオ準備室に、SEMの転写ホルダーを撤回。
- TEMグリッドの保護蓋を閉じるように冷たいナイフを使用してください。これは、転送中の可能な氷の汚染を低減する必要がある。
- VTDの真空チャンバー内に試料を移動するためにVTDロッドを使用してください。
- エアロックを閉じて密閉する。
- 外側のエアロックをベントし、VTDを切り離す。クライオ乗換駅のSEMポートにVTDと一致する。乾燥窒素でフラッシュしながら、VTDのシールを開き、クライオ乗換駅のデュワーへのSEM転写ホルダーをスライドさせるステーションでピンを使用しています。
- クライオ搬送ステーションでのレベルが十分に高いように、十分な液体窒素を入れるサンプルのみを沈めた。
- 蓋の1を開いて、所定の位置にTEMグリッドを保っている、対応するネジを緩めるために、以前に冷却されたドライバーを使用しています。
- TEMグリッドを選択し、TEMホルダーにそれを置くために、以前に冷却されたピンセットを使用してください。
- TEMホルダーにTEMグリッドを固定するために冷却hexringを使用しています。
- クライオトランスファーTEMホルダーのシャッターを閉じます。サンプル移送工程が重要であり、小型のTEM試料の可視性を減少させる窒素ガスによって妨げられるかもしれない。
- 一緒クライオトランスファーTEMホルダーのヒータコントローラと、ポンプシステムからクライオ搬送ステーションを取り外し、TEMの近くにそれを輸送。
- TEMのエアロックにバッキングラインを送り出す、TEMのターボ分子ポンプを起動します。
- -70°のチルト*へのTEM試料ステージを設定します。
- 乾燥窒素ガスでパージの1サイクルのみで、エアロック(30〜60秒)のための最短のポンピング時間を設定します。
- クライオトランスファーTEMホルダーの保護シャッターが閉じていることを確認してください。クライオ乗換駅からのTEMホルダーを外し、傾いた角度計(液体窒素は、TEMホルダーデュワーからこぼれん)に挿入します。ポンピングサイクルが開始されます。サイクルが完了すると、0°に戻って傾斜するゴニオメータを設定し、それはゴニオメーターで回転しないようにし、同時に、TEMホルダを保持する。 TEMの中に完全に挿入します。このステップの間に、クライオ転写TEMホルダは、温度を監視するためのヒーターコントローラに接続されるべきである。 TEM内に試料ホルダーを挿入する手順が異なるのTEM間で異なる場合があります。したがって、適切な手順を取得するために、TEMの製造元に連絡することをお勧めします。
- クライオトランスファーTEMホルダーデュワーを補充します。許容可能なレベルに到達するために、TEMの真空を待つ。
結果
本研究では、の使用なさ:ナノマニピュレータと低温準備室を搭載したデュアルビームFIB / SEMで;クライオ転写ホルダーとTEM;プロトタイプクライオ乗換駅。 anticontaminator(AC)クライオ準備室のブレードおよびナノマニピュレータ(NM)の先端がガタンによって変更された。標準的な凍結準備チャンバに対して、ACブレードは、NM先端より大きなヒートシンクを提供することが大きい。また、ACは、NMチップとの熱交換のための銅編組を接続するためのクランプが取り付けられている。 FIB / SEMの空気圧はNMがあることや、試料室をガス抜きしても、挿入されたままにできるように変更された。なお、この研究で使用されるパラメータは、最良上記機器に適していることに留意すべきである。これらのパラメータは、他のタイプの装置を操作するときに調整する必要もよい。このプロトコルを使用するには、極低温の液体窒素や真空システムを処理するための通常の予防措置をすべき続くこと。
この方法は、ナノ粒子を含有する溶液またはポリマーマトリックスから、線虫の単細胞生物に至るまで、良好な結果が得られ、異なるタイプのサンプル上でテストされている。手順の様々な工程の例は、A.に、図1-12に示されているニガー胞子は、四酸化オスミウム、および過マンガン酸カリウムで染色した。胞子は最初の抽出のための部位を同定するためにSEM( 図1)によって画像化される。この場合、任意の胞子の断面は十分であったが、それは、例えば、細胞膜からの特定の距離で特定のセルをスライスするサブマイクロメートルの精度で抽出用ROIを位置決めすることができる。関心対象の特徴が識別されると、低温のPt堆積の最初の工程は、イオンミリングからのビームによる損傷からサ ンプルを保護するために、( 図2)に実装される。サンプルは、最初のステップOを続行し52°に傾いているfはミリング( 図3):ラメラの両側の2つのトレンチのスパッタリング。次に、試料を倒し、さらにバルクに接続するだけ2小さな橋( 図4)を残すように粉砕される。冷却されたナノマニピュレータは、ラメラと接触する( 図5)とPtの他の低温堆積を一緒に半田付けする( 図6)にされる。小さ な接続ブリッジは離れて粉砕し、次いで、NMは、それが白金( 図8)の最終クライオ沈着に半田付けされるTEMグリッド( 図7)の取付領域の近傍にラメラを移動している。 NMは、その後、イオンビーム( 図10および11)を用いて、透明性を電子ために薄くされるラメラ( 図9)から分離される。ラメラは、最終的に高解像度イメージング、分光法、断層撮影および他の技術を約TEM( 図12)に転送されるN採用する。

図1。Aの胞子のクライオSEM像白金堆積前ニジェール 、。

図2。白金を堆積した後、図1にあるが、硬化前の同じ領域。

【図3】図2の同じ面積のクライオSEM像は、進行中のトレンチミリングして、Ptを蒸着および硬化後に、52度傾い(ステップ3.7を参照)。

図4。ラメ ラ、リフトアウトの準備ができて。

図5。冷たいナノマニピュレータの先端がラメラと接触する。

図6。第2PT低温堆積は、ナノマニピュレータとラメラを一緒にはんだ付けするために使用されます。
図7コールドナノマニピュレータはTEMグリッドの取り付け領域にラメラを転送するために使用される。

図8。クライオ堆積は、TEMグリッドにラメラを取り付けるためにもう一度使用されています。

図9。ラメ ラは、ナノマニピュレータの自由カットし、現在ではストレージや透明性を電子ために間伐いずれかの準備ができている。

図10。間伐の中間工程を、断面が見える少数の胞子で。

最終的な間伐後の試料の図11クライオSEM像;他の胞子のほとんどはラメラがカールし始めていたので、すぐに粉砕しなければならなかった。
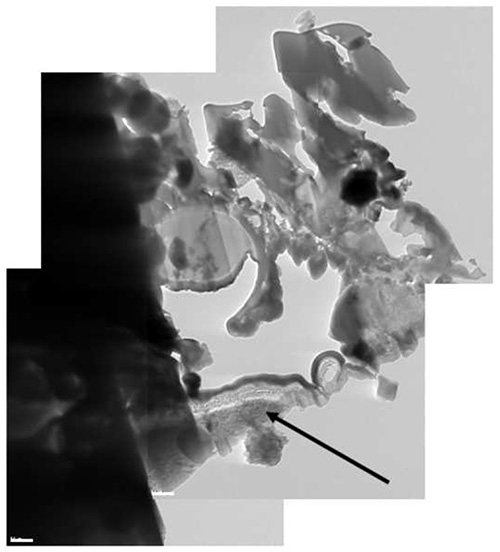
図12。ラメ ラの複合クライオTEM写真。アル·スタブの一部が含まれていますラメラ(黒矢印)にある。
ディスカッション
このプロトコルは、室温での材料科学で使用される標準的なFIB / TEM試料作製の極低温にかなり単純化したものです。試料表面が不均一である場合カーテニングが発生することがありますがこの方法は、機械的変形とナイフマーク(切片作成の主な欠点)の自由なTEMサンプルを生成します。これは、13滑らかで特徴となるまで硬化さキャッピング層(この研究でPtを使用した)の低温堆積によって減少させることができる。非常に異なる硬さの成分を有する試料は、それらが製造の間に応力下壊す危険性なしに同様に調製することができる。内部応力は依然として薄いラメラ部のサイズが縮小されなければならない場合には、曲げたり、カールさせることができる。他の方法と比較して欠点は、イオンビームと試料中のイオンの注入を可能に曝露する生物学的構造を変化させる可能性がある。これらの欠点は、試料た準備のためにRTで起こる材料科学15でATION。彼らは、イオン(500〜1,000 V)の最低加速電圧での最終研磨工程で間伐を完了することによって低減することができる。この非常に穏やかな研磨工程は、ラメラのダメージ層を除去します。
原因クライオ成長(3.5、3.10および3.13ステップ)の性質上、サンプルの大部分は、それによって、元の表面の表示を妨げる、カバーされます。これは、ステップ3.3で提案されているように、複数のマーキングが使用されない限り、それが困難な、ROIを追跡することができる。
ステップ4.5と4.7の間に薄いラメラリスクは、空気と接触する。これはおそらく重要な特徴を不明瞭にする点まで、試料の表面上の氷の結晶を形成するために、空気中の水分を引き起こすとして避けなければならない。これらのステップは、可能な限り迅速に行われるべきであるが、同時に転送中の誤操作は、試料の損失をもたらす可能性があるit自己。これは、ユーザーが実際の試料上での試行が行われる前に、空のTEMグリッドを使用してこれらのステップを実践することをお勧めします。
材料科学では、FIB装置は、その商業化の10年以内に、TEM試料作製のチーフ方法となっている。それは実質的に任意の試料で使用することができるので、試料の種類に調製技術を調整する必要性を除去する。私たちは強く同じことが、極低温で、ここで詳述した手順のおかげで発生する可能性が信じている。より大きなサンプルへの応用はまだクライオ保持するガラス化状態にして能力の対象となりますが、3,5の凍結などプランジ凍結や高圧のような技術は、この問題に対する最適なソリューションであることを証明することができます。
開示事項
著者らは、開示することは何もありません。
謝辞
本研究では、FP7の容量計画(認可番号インフラ2010から262163)の下で欧州共同体研究インフラによって賄われているQNanoプロジェクトhttp://www.qnano-ri.euから支援を受けた。
我々はまた、財政支援のための研究協議会Formasに感謝。
資料
| Name | Company | Catalog Number | Comments |
| Strata DB 235 | FEI | FIB/SEM | |
| Omniprobe 100 | Oxford Instruments | Nanomanipulator | |
| Alto 2500 | Gatan | Cryo preparation chamber | |
| Cryo-holder model 626 | Gatan | Cryo transfer TEM holder | |
| Tecnai F30 | FEI | TEM |
参考文献
- Echlin, P. . Low Temperature Microscopy and Analysis. , (1992).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. J. Struct. Biol. 180, 572 (2012).
- Studer, D., et al. A new approach for cryofixation by high-pressure freezing. J. Microsc. 203, 285 (2001).
- Umrath, W. Cooling bath for rapid freezing in electron microscopy. J. Microsc. 101, 103 (1974).
- Walther, P. Recent progress in freeze-fracturing of high-pressure frozen samples. J. Microsc. 212, 34 (2003).
- Elder, H. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Cryo fixation. Techniques in Immunocytochemistry. , (1989).
- Giannuzzi, L. A., Stevie, F. A. . Introduction to Focused Ion Beams. , (2005).
- Marko, M., et al. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryoelectron microscopy. Nat. Methods. 4, 215 (2007).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. J. Struct. Biol. 172, 180 (2010).
- Rigort, A. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. J. Struct. Biol. 109, 4449-44 (2012).
- Hsieh, C., et al. Towards high-resolution three-dimensional imaging of native mammalian tissue: electron tomography of frozen-hydrated rat liver sections. J. Struct. Biol. 153, 1 (2006).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. J. Microsc. 131, 1 (1983).
- Hayles, M. F., et al. A technique for improved focused ion beam milling of cryo-prepared life science specimens. J. Microsc. 226, 263 (2007).
- Pettersson, H., et al. A method for producing site-specific TEM specimens from low contrast materials with nanometer precision. Microsc. Microanal. 19 (1), 73 (2013).
- Wätjen, J. T., et al. Cu out-diffusion in kesterites—A transmission electron microscopy specimen preparation artifact. Appl. Phys. Lett. Appl. Phys. Lett, 051902 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved