Method Article
Cryo-Microscopia Eletrônica de Preparação de Amostras por meio de um Focused Ion Beam
Neste Artigo
Resumo
Cryo Electron Microscópios, ou de varredura (MEV) ou de transmissão (TEM), são amplamente utilizados para a caracterização de amostras biológicas ou outros materiais com alto teor de água 1. A SEM / Focused Ion Beam (FIB) é usado para identificar características de interesse em amostras e extrair, uma lamela elétron-fina e transparente de transferência para um crio-TEM.
Resumo
Aqui é apresentado um protocolo utilizado para preparar amostras de crio-MET de esporos de Aspergillus niger, mas que pode ser facilmente adaptado a qualquer número de micro-organismos ou soluções. Nós fazemos uso de uma estação de transferência de crio personalizado construído e uma crio-SEM preparação câmara modificado 2. Os esporos são tomadas a partir de uma cultura, mergulham-congelado numa lama de azoto líquido e observadas no crio-SEM para seleccionar uma região de interesse. Uma lamela fina é então extraída usando o FIB, ligado a uma rede de MET e subsequentemente eliminadas até electrões transparência. A grade é transferido para um suporte de crio-MET e para uma ETM para estudos de alta resolução. Graças à introdução de uma ponta nanomanipulator resfriado e uma estação de transferência de crio, este protocolo é uma adaptação simples de temperatura criogênica da preparação FIB usado rotineiramente de amostras TEM. Como tal, tem as vantagens de se exigir uma pequena quantidade de modificações para instrumentos, instalações e procedimentos existentes; ele is fácil de implementar; que tem uma ampla gama de aplicações, em princípio, a mesma que para a preparação da amostra de crio-MET. Uma limitação é que requer tratamento eficiente dos espécimes em passos críticos para evitar ou minimizar as contaminações.
Introdução
Neste protocolo de um cryo-FIB/SEM é usado para produzir as amostras de MET a partir de uma região específica da amostra, previamente identificada com elevada precisão por análise MEV. A microscopia eletrônica (varredura e transmissão) a análise de amostras biológicas é uma técnica de rotina usados para pesquisa e diagnóstico. SEM é fácil de empregar e interpretar bastante rápido e, mas a informação só é obtida a partir da superfície da amostra e com uma resolução na faixa de 1,5 nm. TEM tem uma resolução maior, mas é mais difícil de implementar, a análise de imagem é menos simples e que a informação é obtida a granel, as amostras devem ser diluídas a elétron transparência (menos de cerca de 500 nm de espessura). Um problema adicional é que os requisitos de vácuo desses instrumentos raramente são toleradas por amostras que contêm água. Na maioria dos casos, as amostras biológicas devem ser quer quimicamente fixo (substituindo a água com, por exemplo, polímeros) ou seca. Em ambos os casos, mudanças significativas nomorfologia e estrutura das amostras são susceptíveis de ocorrer. Preparação Cryo TEM de espécimes hidratados induz alterações químicas mínimas e produz amostras o mais próximo possível do seu estado nativo, especialmente se vitrificação de gelo é obtido 1-6.
O FIB é amplamente usado para preparar amostras para TEM suas numerosas vantagens 7. Para citar alguns: o uso de íons de alta energia a incidência quase normal minimiza o efeito das taxas de moagem diferenciais relacionadas com as matérias-; a região extraído a partir da amostra a granel pode ser escolhida com uma precisão sub-mícron; uma quantidade muito pequena de material é extraído. Alguns desenvolvimentos técnicos recentes tornaram possível usando o FIB também para preparação de amostras TEM em temperaturas criogênicas 2,8-10. Há várias vantagens em relação ao método tradicional de preparação de crio-micrótomo 11,12 utilizado principalmente para amostras de matéria macia, tais como a ausência de deformação mecânica da lamela cortado,a ausência de marcas de faca ea possibilidade de preparar amostras compostas com interfaces de disco / macios ou componentes.
Protocolo
Nota: Todos os parâmetros indicados no presente protocolo são válidas para os instrumentos e modelos aqui indicados. Alguns desses parâmetros (marcadas com * no texto) pode ser diferente, se um outro fabricante ou modelo é usado.
1. Start-up da FIB / SEM
- Monte o nanomanipulator frio custom-built (NM) dica sem anexar as tranças Cu ao anticontaminator (AC). Em vez disso, faz-se que as tranças são ligados ao resto do NM acima do ponto de isolamento para impedir a carga durante o passo de afiar (1.2).
- Feche a câmara de SEM, bomba para alto vácuo e imagem a ponta NM.
- Se a dica é sem corte, curvado ou contaminado pelo uso anterior, apontá-lo por meio do feixe de íons: selecionar padrões de fresagem poligonais ao longo dos lados da ponta, de modo que após a moagem, a ponta se reduzirá para 1 m ou menos.
- Uma vez que os lados da ponta ter sido moído de distância, rodar manualmente por 90 ° de toda a haste NMdo lado de fora da câmara de MEV.
- Ajustar os padrões de fresagem poligonais para se adaptar à extremidade girado e repetir moagem a partir de um ângulo diferente.
- Uma vez que a ponta foi melhorado para ser inferior a 1 mícron, retraia o NM e inserir a agulha do sistema de injeção de gás (GIS); reposicionar a agulha estar em cerca de 1 mm acima da distância de trabalho (em vez dos habituais 175 um).
- Se estiver usando um precursor Pt, mudar sua temperatura de funcionamento de 24-26 ° C (em vez dos habituais 40 ° C). Estes passos são necessários para crio-deposição 13 do Pt.
- Abra a câmara de SEM e preparar o FIB / SEM para modo crio montando o palco amostra crio eo AC.
- Desligue o NM para a posição inserido e conectar suas tranças Cu para o AC. Certifique-se de não tocar acidentalmente a ponta NM. O sistema é arrefecido com a MN inserido para certificar-se de que a perda de flexibilidade da trança de Cu a temperaturas criogénicas não irá dificultar o movimento NMmento.
- Purgar os tubos de arrefecimento com azoto gasoso seco durante alguns minutos.
- Bomba da câmara preparação crio ea principal câmara de amostra de alto vácuo.
- Adicionar nitrogênio líquido para os Dewars esfriar ambas as câmaras. Aguardar até que a temperatura desejada seja atingida.
2. Congelação Amostra
- Monte duas grades TEM para amostras FIB no suporte transferência do SEM. Prenda-os, apertando os parafusos correspondentes, com uma chave de fenda.
- Montar um topo apropriado de amostra para amostra e adiciona uma porção do espécime. Dependendo do tipo de amostra, a amostra pode ser fixada com cola criogénico ou com uma pinça. Use quantidades tão pequenas quanto possível assegurar o congelamento ideal.
- Monte o suporte de transferência do SEM para o dispositivo de transferência de vácuo (VTD).
- Adicionar nitrogênio líquido na estação slushing e bombear até obter lama nitrogênio.
- Abra o slestação ushing e mergulhar-congelar titular transferência do SEM. Bomba para baixo novamente até ferver é completada e lama é obtido novamente. Deve notar-se que uma etano ou propano lama ou congelamento de alta pressão são as técnicas mais adequadas para obter a vitrificação da amostra.
- Recolha porta-a transferência de SEM para a câmara de vácuo do VTD e selá-lo.
- Alivie a estação slushing ea câmara preparação câmara crio.
- Combine o selo VTD com a câmara da câmara de preparação crio e bomba.
- Quando um bom nível de vácuo é alcançado, envolver o pino câmara para abrir o selo do VTD ea câmara externa; insira o suporte de transferência do SEM. Há marcas nos contatos deslizantes nas câmaras de preparação que indicam a posição da amostra para pulverização e fratura.
- Se necessário, a amostra pode ser: fraturado com a faca frio; sublimada, definindo uma temperatura mais elevada (geralmente -1006: C); revestido com Au / Pd ou Pt por meio do sputterer frio (300 V, 10 mA, 60 seg de 2-3 nm Au / Pd a tampa) *. Sublimação não deve ser utilizado para amostras de faiança para evitar a sua recristalização.
- Use a faca fria para abrir as tampas de proteção das ranhuras da grade de TEM.
- Traga o estágio frio na câmara de amostra para a altura de recepção de 16 mm (*).
- Desligue o HT na FIB / SEM e abrir a câmara interior.
- Use o VTD para transferir o suporte do SEM para a câmara de amostra. Escurecer a iluminação no quarto pode ajudar nesta etapa.
- Uma vez que o titular do SEM está na fase fria, desengatar o VTD, empurrando e girando.
- Recolha a haste VTD todo o caminho para a câmara de vácuo VTD e fechar a câmara interior, a câmara exterior eo selo VTD. A câmara exterior agora pode ser ventilado para remover o selo VTD. Este último passo não é obrigatório, mas é recomendado como a vara VTD podem ser facilmente retirados por acidente, o que pode causar danosà VTD ou a câmara.
3. Ion Milling
- Ligue a alta tensão em ambas as colunas e definir os parâmetros de imagem apropriados (tensão de aceleração: 10 kV para o feixe de elétrons de 30 kV para o feixe de íons; tamanho spot: 3; distância de trabalho: 5 mm, feixe de íons atuais: 10-100 pA para imagens, 1-3 nA para fresamento) *.
- Use o feixe de elétrons para encontrar uma característica de interesse e para a aquisição de imagens para documentar o estado da amostra antes da extração da lamela.
- Depois de uma região de interesse (ROI) para extracção tem sido identificado, marcá-lo por padrões de feixe de iões, a menos que a topografia da amostra em si permite uma fácil identificação da ROI, mesmo após a deposição de Pt. Para uma maior precisão, utilizar o método descrito por 14 Pettersson et al. As marcações deve ser profunda, ampla e longe o suficiente para ser ainda visível após ter sido coberto pela deposição de crio-Pt (que é não-selectivo e vai cobrir vários mm2 da superfície da amostra).
- Aquecer o gás precursor de 24-26 ° C, e introduzir a agulha SIG para uma altura de cerca de 1 mm acima da superfície da amostra (ver também o passo 1.3).
- Enquanto imagem com o feixe de elétrons, abra a válvula de gás por alguns segundos. A taxa de deposição de crio-Pt é 100-500 nm / seg ou mais, dependendo da distância da agulha SIG, a rugosidade da amostra e do sistema do utilizador. É aconselhável executar alguns depoimentos de teste para determinar os parâmetros ideais.
- A deposição crio-Pt-prima é muito áspera e não homogênea. Cure o depósito sobre o ROI por meio de um feixe de íons de 1.000 pA em baixa ampliação (por exemplo 2.000 X). Ao contrário da deposição de crio, esta cura é local e selectiva deve ser efectuada apenas a ROI. A finalidade deste primeiro crio-deposição é proteger a superfície da amostra de danos do feixe de iões e para reduzir curtaining durante o desbaste de iões 13.
- Inclinar a amostra para52 °, de modo que a superfície é perpendicular ao feixe de iões. Moinho de distância duas trincheiras em socalcos de ambos os lados do ROI. As dimensões típicas para as trincheiras são 20-30 mM na direcção (X) paralelo à lamela que ser extraído, 10-15 mM na direcção perpendicular (Y) e com uma variável, inclinada de profundidade (Z), com o ponto mais profundo fechar para o ROI. A inclinação deverá ser de 45-55 °. Em alguns instrumentos, terraços trincheiras só pode ser moído com o ponto mais profundo no topo. Nesse caso, uma usina sob o ROI, em seguida, girar a imagem 180 ° e moinho a segunda do outro lado. A profundidade de moagem pode ser seleccionada, se a taxa de pulverização catódica do material é conhecido. Para a maior parte da amostra congelada-hidratado, a taxa de pulverização catódica de gelo pode ser utilizado 7.
- Incline a amostra de volta para 0 ° e use o feixe de íons para cortar as laterais e inferior da lamela, certificando-se as marcas de corte passar por toda a lamela (possivelmente eles deixarão marcas moagem no moinho socalcosed no passo anterior). Deixar apenas duas pequenas pontes de ligação a lamela com o resto da amostra.
- Insira a agulha GIS (pode mudar um pouco da amostra). Manobra do NM até sua ponta está em contato físico com a lamela, de preferência ao lado. Verifique se o NM não está obstruindo a visão feixe de íons das duas pequenas pontes de ligação.
- Abra a válvula de GIS por alguns segundos e monitorar a deposição crio por imagem contínua com o feixe de elétrons.
- Quando uma camada de 1-2 mM adicional de Pt foi crio-depositado, fechar a válvula.
- Curar o Pt (ver passo 2.6) apenas em poucos mM em torno do ponto onde o NM está em contacto com a lâmina.
- Use uma corrente de feixe de iões de alta para cortar a lamela livre. As duas pontes de ligação devem ser moídos de distância, bem como o excesso de Pt, que podem ter sido formados novos pontos de contacto entre a lâmina e o resto da amostra. Não retirar a agulha GIS ainda.
- Manobrar cuidadosamente o NM para extrair a lamela das trincheiras e movê-la, pelo menos, 500 mm acima da superfície da amostra. Só após esta etapa, retrair a agulha GIS.
- Abaixe o estágio da amostra alguns mm e movê-lo até que um dos grades TEM está em vista. Movimente a área de fixação no grid para a posição de trabalho e inserir a agulha GIS.
- Manobrar cuidadosamente o NM para trazer a lamela anexado em contato físico com a área de fixação da grelha TEM. Não deve haver qualquer pressão ou tensão entre a lamela, a grelha TEM e o NM.
- Abra a válvula de gás para alguns segundos e crio-depósito de uma camada de 1-2 mM adicional de Pt.
- Cure a Pt (veja o passo 2.6) somente em poucos mM em torno do ponto de contato entre a lamela ea grade TEM.
- Use uma corrente de feixe de íons de alta para cortar a lamela livre do NM. Isto pode ser realizado por moagem de distância ou a ponta NM ou do lado da amostra. Em tele primeiro caso, a ponta terão de ser afiada de novo antes que a próxima utilização, tal como descrito na etapa 1.2.
- OPCIONAL: nesta fase, é possível usar o VTD levar titular transferência do SEM e guarde-O / N em um Dewar preenchido com nitrogênio líquido. Esta transferência e armazenagem de O / N é susceptível de provocar a formação de gelo sobre a superfície da lamela se cristais de gelo são já presente e / ou se o azoto líquido é exposto a ar húmido; mas tal contaminação serão removidos pelo passo seguinte num relativamente curto espaço de tempo. À medida que as etapas anteriores pode ter levado várias horas para completar, pode ser apropriado para o fazer, uma vez que após o passo seguinte tal armazenamento O / N não é recomendado, pois não haveria nenhuma maneira de remover a contaminação de gelo, exceto por sublimação (que não pode ser realizado se a vitrificação da amostra deverá ser mantida).
- Incline a amostra a 52 ° e use o feixe de íons de fina que a do elétron transparência 7. Recomenda-se começar com mais elevado, rougsuas correntes de feixe para remover a maior e proceder à multa polimento da superfície com correntes de feixes inferiores, eventualmente reduzindo também a tensão de aceleração. A espessura final da lamela deverá ser de 100-200 nm ou menos, para a análise de uma ultra-estrutura de 100-200 kV ou MET-se a 500 nm para a tomografia de 300 kV TEM, dependendo da composição da amostra. Durante o desbaste, as tensões internas da amostra pode causar a lamela para enrolar ou dobrar. Em tal caso, a região diluído deve ser restrito. Isto aconteceu por exemplo, nas Figuras 11 e 12.
4. Cryo Transferência para TEM
- Lave a estação de transferência de crio com gás nitrogênio seco por alguns minutos.
- Adicionar nitrogênio líquido para o Dewar do TEM AC e para a estação de transferência de crio.
- Insira o suporte TEM a transferência crio no slot apropriado da estação de transferência de crio e encher sua Dewar também. Espere até que cada amostraonent atingiu a temperatura desejada (cerca de 15 min). Se possível, o controlador de suporte de MET a-transferência de crio deve ser ligada para controlar a temperatura durante a transferência. É importante perceber que a ponta do suporte da ETM (onde o sensor de temperatura encontra-se) estarão em contacto com a estação de transferência de crio e, por conseguinte, irá arrefecer mais rapidamente do que o resto do suporte de MET. Por conseguinte, recomenda-se que o tempo necessário para que todo o suporte de transferência MET-crio para arrefecer é medida previamente, e que o sistema é permitido thermalize para, pelo menos, a mesma quantidade de tempo.
- Encha um copo criogênico com nitrogênio líquido e mergulhar nele: a ferramenta TEM amostra de fixação, uma chave de fenda e uma pinça, a fim de esfriar suas dicas para a temperatura desejada. Todas as ferramentas devem ser devidamente isoladas na outra extremidade de modo a não causar queimaduras de frio para a mão do operador.
- Combine o VTD para a câmara externa. Traga o veado frioe à altura de transferência (16 milímetros *). Desligue a alta tensão.
- Abra o selo VTD, a câmara externa ea câmara interior.
- Use a vara VTD para travar no suporte transferência do SEM, empurrando e girando no sentido horário.
- Recolha porta-a transferência de SEM para a câmara de preparação crio.
- Use a faca fria para fechar as tampas de proteção das grades TEM. Isto é necessário para reduzir a possibilidade de contaminação de gelo durante a transferência.
- Utilizar a haste VTD para mover a amostra para a câmara de vácuo do VTD.
- Feche as câmaras pressurizadas e selo.
- Alivie a câmara exterior e retire o VTD. Combine o VTD à porta SEM da estação de transferência de crio. Enquanto a lavagem com nitrogênio seco, use o pino na estação para abrir o selo do VTD e deslize o suporte a transferência de SEM no Dewar da estação de transferência de crio.
- Adicionar azoto líquido suficiente para que o nível na estação de transferência de crio seja suficientemente elevadaapenas para submergir a amostra.
- Use a chave de fenda previamente arrefecido a abrir uma das tampas e solte o parafuso correspondente que está mantendo a grade de TEM no lugar.
- Use a pinça previamente refrigerado para escolher a grade de TEM e colocá-lo no porta-TEM.
- Utilizar a hexring arrefecida para prender a grade no suporte MET MET.
- Feche o obturador do titular TEM a transferência crio. O passo de transferência de amostras é essencial e pode ser dificultada por azoto gasoso reduzir a visibilidade da pequena amostra MET.
- Desligue a estação de transferência de crio a partir do sistema de bombeamento e transportá-lo perto do MET, em conjunto com o controlador de aquecedor de titular TEM a transferência crio.
- Ligue a bomba turbomolecular do TEM para bombear a linha de apoio para a câmara TEM.
- Defina o estágio da amostra TEM a uma inclinação de -70 ° *.
- Defina o tempo de bombeamento mais curto para a câmara de vácuo (30-60 seg), com apenas um ciclo de purga com gás nitrogênio seco.
- Certifique-se de que a tampa de protecção no suporte TEM a transferência crio é fechada. Retire o suporte do TEM a partir da estação de transferência de crio e inseri-lo no goniômetro inclinado (nitrogênio líquido vai derramar fora do Dewar titular TEM). O ciclo de bombeamento será iniciado. Uma vez que o ciclo é completado, definir o goniómetro para inclinar para trás a 0 ° C e, ao mesmo tempo, manter o suporte do TEM de modo que ele não roda com o goniómetro. Inseri-lo totalmente dentro do TEM. Durante este passo, o suporte de MET de transferência de crio deve ser ligado ao seu controlador de aquecedor para controlar a temperatura. O procedimento para inserir o suporte da amostra no TEM podem variar entre diferentes TEMs. Portanto, é recomendável entrar em contato com o fabricante TEM obter o procedimento adequado.
- Encher a transferência crio titular TEM Dewar. Aguarde até que o vácuo na TEM para chegar a um nível aceitável.
Resultados
Neste trabalho fez uso de: a dupla viga FIB / SEM equipado com um nanomanipulator e uma câmara de crio-preparação; TEM um com um suporte de transferência de crio; uma estação de transferência de crio protótipo. O anticontaminator (AC) lâminas da câmara de crio-preparação e a ponta do nanomanipulator (NM) foram modificados por Gatan. Com relação a uma câmara de crio-preparação padrão, as lâminas AC são maiores para proporcionar uma maior dissipador de calor para a ponta NM. Além disso, o AC está equipada com grampos para ligar as tranças Cu para a troca de calor com a ponta NM. Os pneumáticos do FIB / SEM foram modificados para permitir que o NM ser e permanecer inserido, mesmo quando a câmara da amostra foi ventilado. Deve notar-se que os parâmetros utilizados neste trabalho são os mais adequados para o equipamento acima listadas; os parâmetros podem ser ajustados para necessário ao trabalhar com outros tipos de equipamentos. Para trabalhar com este protocolo, as precauções normais para a manipulação de criogenia, sistemas de nitrogênio e vácuo líquido deveser seguidas.
O método foi testado em diferentes tipos de amostras, com bons resultados, que varia a partir de soluções ou de matrizes poliméricas contendo nanopartículas, ao organismo unicelular para nemátodes. Exemplos dos vários passos do processo estão ilustrados nas Figuras 1-12 em A. esporos niger corados com tetróxido de ósmio e permanganato de potássio. Os esporos são primeiro fotografada por SEM (Figura 1) para identificar o local de extracção. Neste caso, uma secção transversal de qualquer esporo era suficiente, mas é possível posicionar o ROI para extracção com precisão sub-micrométrico de, por exemplo, uma fatia de uma célula específica, a uma distância específica a partir da membrana celular. Uma vez que a característica de interesse foi identificada, a primeira etapa da deposição de crio-Pt é implementada (Figura 2), para proteger a amostra de danos a partir da moagem de feixe de iões. A amostra é inclinada a 52 ° para prosseguir com os primeiros passos Sf de moagem (figura 3): a pulverização de duas trincheiras em ambos os lados da lamela. A amostra é então inclinada para trás e ainda triturada para deixar apenas duas pequenas pontes de ligação que para a maior parte (Figura 4). O nanomanipulator arrefecido é trazido em contacto com a lamela (Figura 5) e outro de crio-deposição de Pt soldas juntos (Figura 6). As pequenas pontes de ligação são, em seguida, moído de distância e o NM move a lamela perto da área de fixação da grelha TEM (Figura 7), onde é soldado com um crio-deposição final Pt (Figura 8). O NM é então separado da lamela (Figura 9), a qual é diluída para baixo a transparência de electrões com o feixe de iões (Figura 10 e 11). A lamela é finalmente transferido para a ETM (Figura 12) onde imagens de alta resolução, espectroscopia, a tomografia e outras técnicas can ser empregues.

Figura 1. Imagem Cryo-SEM de esporos de A. niger, antes de deposição de Pt.

Figura 2. A mesma área na Figura 1, após a deposição de Pt, mas antes da cura.

Imagem Figura 3. Cryo-SEM da mesma área na figura 2, inclinado 52 °, após a deposição de Pt e de cura, com a moagem trincheira curso(Veja o passo 3.7).

Figura 4. A lamela, pronto para elevador-out.

Figura 5. A ponta nanomanipulator frio faz contato com a lâmina.

Figura 6. Um segundo Pt crio-deposição é usado para soldar conjuntamente o nanomanipulator e a lamela.

Figura 7. Nanomanipulator O frio é utilizado para transferir a lamela para a área de fixação da grelha TEM.

Cryo-deposição Figura 8. For usado mais uma vez, para fixar a lâmina à grelha TEM.

Figura 9. A lamela é cortado livre do nanomanipulator e agora está pronto para armazenamento ou diluindo a elétron transparência.

Figura 10. Um passo intermediário de adelgaçamento, com poucos esporos visíveis em secção transversal.

Figura 11 imagem Cryo-SEM da amostra após o desbaste final.; a maior parte dos outros esporos tinha que ser moído para longe porque a lamela começaram a enrolar.
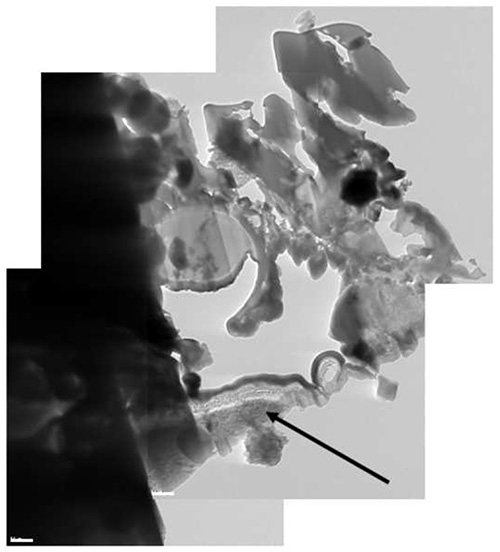
Figura 12. Uma imagem crio-TEM composto da lamela. Parte do stub Al foi incluídona lamela (seta preta).
Discussão
Este protocolo é uma adaptação bastante simples a temperaturas criogênicas da preparação padrão da amostra FIB / TEM utilizada em ciências de materiais em temperatura ambiente. O método produz amostras TEM livres de deformação mecânica e marcas de faca (a grande desvantagem de microtomia), embora curtaining pode ocorrer se a superfície da amostra é heterogênea. Este pode ser reduzido por crio-deposição de uma camada de nivelamento (neste trabalho de Pt foi usado), curado até que seja lisa e sem traços 13. As amostras com componentes de dureza muito diferente pode ser preparado também sem o risco de que iria quebrar sob o esforço durante a preparação. As tensões internas podem ainda fazer com que a lâmina fina de dobrar ou enrolar, caso em que o tamanho da secção tem de ser reduzida. A desvantagem em comparação com outro método é a possibilidade de alterar a estrutura biológica devido a exposição ao feixe de iões e possível implantação de iões na amostra. Estas desvantagens também ocorrer à TA durante amostra preparção em ciência dos materiais 15. Eles podem ser reduzidos através do preenchimento do desbaste com um passo final de polimento ao menor tensão de aceleração de iões (500-1.000 V). Esta etapa de polimento muito suave irá remover a camada danificada da lamela.
Devido à natureza do crio-deposição (passos 3.5, 3.10 e 3.13), grandes partes da amostra irá ser coberto, obstruindo assim a vista da superfície original. Isso pode torná-lo difícil de acompanhar o ROI, a menos que várias marcas são usadas como sugerido no passo 3.3.
Durante as etapas 4.5 e 4.7 os riscos lamelas finas que entram em contacto com o ar. Isto tem que ser evitada, pois causaria a humidade no ar para formar cristais de gelo na superfície da amostra, possivelmente, para o ponto de obscurecer características importantes. Essas etapas devem ser realizadas tão depressa quanto possível, mas ao mesmo tempo um manuseamento incorrecto durante a transferência é susceptível de provocar a perda da amostra eleself. Recomenda-se que o usuário pratica esses passos usando grades TEM vazios antes for feita uma tentativa em uma amostra real.
Na ciência dos materiais, o instrumento FIB tornou-se o principal método de preparação de amostras TEM dentro de uma década de sua comercialização. Uma vez que pode ser utilizado em praticamente qualquer amostra, que elimina a necessidade de adaptar a técnica de preparação para o tipo de amostra. Acreditamos firmemente que o mesmo poderia acontecer em temperaturas criogênicas, graças ao procedimento detalhado aqui. A sua aplicação a amostras maiores ainda está sujeita à capacidade de crio-preservação-los em um estado vitrificados, mas técnicas como mergulhar-congelamento ou de alta pressão de congelamento de 3,5 pode revelar-se as soluções ótimas para o problema.
Divulgações
Autores têm nada a revelar.
Agradecimentos
Esta pesquisa recebeu apoio do Projeto QNano http://www.qnano-ri.eu que é financiado pelas infra-estruturas da Comunidade Europeia de Investigação no âmbito do Programa Capacidades FP7 (Grant No. INFRA-2010-262163).
Agradecemos também o conselho de pesquisa Formas de apoio financeiro.
Materiais
| Name | Company | Catalog Number | Comments |
| Strata DB 235 | FEI | FIB/SEM | |
| Omniprobe 100 | Oxford Instruments | Nanomanipulator | |
| Alto 2500 | Gatan | Cryo preparation chamber | |
| Cryo-holder model 626 | Gatan | Cryo transfer TEM holder | |
| Tecnai F30 | FEI | TEM |
Referências
- Echlin, P. . Low Temperature Microscopy and Analysis. , (1992).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. J. Struct. Biol. 180, 572 (2012).
- Studer, D., et al. A new approach for cryofixation by high-pressure freezing. J. Microsc. 203, 285 (2001).
- Umrath, W. Cooling bath for rapid freezing in electron microscopy. J. Microsc. 101, 103 (1974).
- Walther, P. Recent progress in freeze-fracturing of high-pressure frozen samples. J. Microsc. 212, 34 (2003).
- Elder, H. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Cryo fixation. Techniques in Immunocytochemistry. , (1989).
- Giannuzzi, L. A., Stevie, F. A. . Introduction to Focused Ion Beams. , (2005).
- Marko, M., et al. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryoelectron microscopy. Nat. Methods. 4, 215 (2007).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. J. Struct. Biol. 172, 180 (2010).
- Rigort, A. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. J. Struct. Biol. 109, 4449-44 (2012).
- Hsieh, C., et al. Towards high-resolution three-dimensional imaging of native mammalian tissue: electron tomography of frozen-hydrated rat liver sections. J. Struct. Biol. 153, 1 (2006).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. J. Microsc. 131, 1 (1983).
- Hayles, M. F., et al. A technique for improved focused ion beam milling of cryo-prepared life science specimens. J. Microsc. 226, 263 (2007).
- Pettersson, H., et al. A method for producing site-specific TEM specimens from low contrast materials with nanometer precision. Microsc. Microanal. 19 (1), 73 (2013).
- Wätjen, J. T., et al. Cu out-diffusion in kesterites—A transmission electron microscopy specimen preparation artifact. Appl. Phys. Lett. Appl. Phys. Lett, 051902 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados