Method Article
Cryo-microscopia elettronica Preparazione del campione per mezzo di un Focused Ion Beam
In questo articolo
Riepilogo
Cryo Electron Microscopi, sia a scansione (SEM) o trasmissione (TEM), sono ampiamente utilizzati per la caratterizzazione di campioni biologici o di altri materiali con un elevato contenuto di acqua 1. A SEM / Focused Ion Beam (FIB) viene utilizzato per identificare le caratteristiche di interesse in campioni ed estrarre una lamella sottile elettrone-trasparente per il trasferimento ad un crio-TEM.
Abstract
Qui vi presentiamo un protocollo utilizzato per preparare i campioni crio-TEM di spore di Aspergillus niger, ma che può essere facilmente adattato per qualsiasi numero di microrganismi o soluzioni. Noi facciamo uso di una stazione di crio-transfer personalizzato costruito e modificato crio-SEM camera di preparazione 2. Le spore sono presi da una cultura, immergersi, congelato in una granita azoto liquido e osservato nel crio-SEM per selezionare una regione di interesse. Un sottile lamella viene poi estratto utilizzando il FIB, attaccato ad una griglia TEM e successivamente diluito all'elettrone trasparenza. La griglia viene trasferito a un titolare crio-TEM e in un TEM per studi ad alta risoluzione. Grazie all'introduzione di una punta nanomanipulator raffreddato e una stazione di crio-transfer, questo protocollo è un adattamento semplice a temperatura criogenica del preparato FIB utilizzato di routine di campioni TEM. Come tale, ha il vantaggio di richiedere una piccola quantità di modifiche agli strumenti esistenti, le impostazioni e le procedure; sono ios facile da implementare; ha una vasta gamma di applicazioni, in linea di principio lo stesso che per la preparazione del campione crio-TEM. Una limitazione è che richiede una gestione sapiente dei campioni a passaggi critici per evitare o minimizzare contaminazioni.
Introduzione
In questo protocollo una cryo-FIB/SEM viene utilizzato per produrre campioni TEM da una regione specifica del campione, precedentemente identificato con elevata precisione mediante analisi SEM. Microscopia elettronica (scansione o trasmissione) analisi di campioni biologici è una tecnica di routine utilizzato per la ricerca e diagnostica. SEM è piuttosto veloce e facile da utilizzare e interpretare, ma le informazioni vengono ottenute solo dalla superficie del campione e con una risoluzione nell'intervallo 1.5 nm. TEM ha una risoluzione più alta, ma è più difficile da attuare, l'analisi delle immagini è meno semplice e che si ottiene informazione di massa, i campioni devono essere diluiti a elettroni trasparenza (meno di circa 500 nm di spessore). Un ulteriore problema è che i requisiti per vuoto di tali strumenti sono raramente tollerati da campioni contenenti acqua. Nella maggior parte dei casi, i campioni biologici devono essere fisso chimicamente (acqua con sostituzione, per esempio, polimeri) o secchi. In entrambi i casi, le modifiche significative allamorfologia e struttura del campione sono suscettibili di verificarsi. Crio TEM preparazione dei campioni idratati induce cambiamenti chimici minime e produce campioni più vicino possibile al loro stato nativo, soprattutto se vetrificazione di ghiaccio si ottiene 1-6.
Il FIB è ampiamente utilizzato per preparare i campioni TEM per i suoi numerosi vantaggi 7. Per citarne alcuni: l'uso di ioni ad alta energia ad incidenza quasi normale riduce al minimo l'effetto dei tassi di fresatura differenziali legati ai materiali; la regione estratto dal campione globale può essere scelto con una precisione sub-micron; una piccola quantità di materiale viene estratto. Alcuni recenti sviluppi tecnici hanno reso possibile con il FIB anche per la preparazione del campione TEM a temperature criogeniche 2,8-10. Ci sono diversi vantaggi rispetto al metodo tradizionale di preparazione crio-microtomia 11,12 utilizzato principalmente per campioni materia soffice, come la mancanza di deformazione meccanica della lamella affettato,l'assenza di segni di coltello e la possibilità di preparare campioni compositi con hard / interfacce o componenti morbide.
Protocollo
NOTA: tutti i parametri indicati nel presente protocollo sono validi per gli strumenti ei modelli qui indicati. Alcuni di questi parametri (contrassegnati con * nel testo) possono variare se si utilizza un altro fabbricante o il modello.
1. Start-up del FIB / SEM
- Montare il nanomanipulator freddo custom-built (NM) punta senza associare le trecce Cu al anticontaminator (AC). Invece assicurarsi che le trecce sono collegate al resto della NM sopra del punto di isolante per impedire carica durante la fase di affilatura (1.2).
- Chiudere la camera di SEM, pompa ad alto vuoto e l'immagine della punta NM.
- Se la punta è smussata, piegato o contaminata dall'uso precedente, affinare mediante il fascio di ioni: selezionare motivi fresatura poligonali lungo i lati della punta, in modo che dopo la fresatura, la punta si cono fino a 1 micron o meno.
- Una volta che i lati della punta sono stati fresati distanza, ruotare manualmente di 90 ° l'intera asta NMdall'esterno della camera di SEM.
- Regolare le sagome di fresatura poligonali di adattarsi alla punta ruotato e ripetere fresatura da una diversa angolazione.
- Una volta che la punta è stata affilata per essere inferiore a 1 micron, ritrarre il NM e inserire l'ago del sistema di iniezione del gas (GIS); riposizionare l'ago di essere a circa 1 mm sopra la distanza di lavoro (invece del solito 175 micron).
- Se si utilizza un precursore Pt, modificare la temperatura di esercizio a 24-26 ° C (invece dei soliti 40 ° C). Sono necessari questi passaggi per crio-deposizione 13 del Pt.
- Aprire la camera di SEM e preparare il FIB / SEM per crio-mode montando il palco del campione crio e l'aria condizionata.
- Passare il NM in posizione inserito e collegare le sue trecce Cu all'AC. Assicurarsi di non toccare accidentalmente la punta NM. Il sistema viene raffreddato con l'NM inserito per assicurarsi che la perdita di flessibilità della treccia Cu a temperature criogeniche non ostacolare il movimento NMmento.
- Spurgare i tubi per il raffreddamento con azoto secco per qualche minuto.
- Pompare la camera di preparazione crio e la principale camera del campione per alto vuoto.
- Aggiungere azoto liquido per le Dewars raffreddare entrambe le camere. Attendere fino al raggiungimento della temperatura desiderata.
2. Congelamento del campione
- Montare due griglie TEM per i campioni FIB sul supporto di trasferimento SEM. Fissarli serrando le corrispondenti viti con un cacciavite.
- Montare un campione stub appropriato per il campione e aggiungere una parte del campione. A seconda del tipo di campione, il campione può essere fissato con colla criogenico o con un morsetto. Utilizzare gli importi piccoli quanto possibile per garantire il congelamento ottimale.
- Montare il supporto di trasferimento SEM sul dispositivo di trasferimento a vuoto (VTD).
- Aggiungi azoto liquido nella stazione slushing e pompa giù per ottenere granita di azoto.
- Aprire la slStazione ushing e tuffo-congelare il titolare di trasferimento SEM. Pompare giù di nuovo fino a ebollizione è completato e fango si ottiene di nuovo. Va notato che un etano o propano granite o congelamento ad alta pressione sono tecniche più adatte per ottenere la vetrificazione del campione.
- Ritrarre il supporto di trasferimento SEM nella camera a vuoto del VTD e sigillarla.
- Vent la stazione slushing e la crio camera stagna camera di preparazione.
- Far corrispondere il sigillo VTD con la camera di compensazione della camera di preparazione crio e la pompa.
- Quando un buon livello di vuoto viene raggiunto, innestare il perno di camera di compensazione per aprire il sigillo del VTD e la camera di equilibrio esterno; inserire il supporto di trasferimento SEM. Ci sono indicazioni sui contatti striscianti nelle camere di preparazione indicano la posizione del campione per sputtering e fratturazione.
- Se necessario, il campione può essere: fratturato con il coltello freddo; sublimata impostando una temperatura più alta (solitamente -1006, C); rivestito con Au / Pd o Pt mediante il sputterer freddo (300 V, 10 mA, 60 sec per un 2-3 nm tappo Au / Pd) *. Sublimazione non deve essere usato per i campioni vetrificati per evitare la loro ricristallizzazione.
- Usare il coltello freddo per aprire i coperchi di protezione degli slot della griglia TEM.
- Portare la fase fredda nella camera del campione all'altezza ricevente (16 mm *).
- Spegnere l'HT sul FIB / SEM e aprire la camera di equilibrio interiore.
- Utilizzare il VTD per trasferire il titolare SEM nell'apposita camera. Oscuramento l'illuminazione nella stanza può aiutare in questo passaggio.
- Il vano SEM è in fase di freddo, disinnestare la VTD premendo e ruotando.
- Ritrarre l'asta VTD fino in camera a vuoto VTD e chiudere la camera di equilibrio interiore, la camera di compensazione esterna e la guarnizione VTD. La camera di equilibrio esterno può ora essere scaricata per rimuovere il sigillo VTD. Questo ultimo passaggio non è obbligatorio, ma è consigliato come l'asta VTD può essere facilmente sloggiato da incidenti, che possono causare dannial VTD o la camera di equilibrio.
3. Fresatura Ion
- Accendere l'alta tensione su entrambe le colonne e impostare i parametri di imaging appropriati (tensione di accelerazione: 10 kV per il fascio di elettroni, 30 kV per il fascio di ioni; dimensioni posto: 3; distanza di lavoro: 5 millimetri, attuali fascio ionico: 10-100 pA per l'imaging, 1-3 nA per la fresatura) *.
- Utilizzare il fascio di elettroni per trovare una caratteristica di interesse e per acquisire immagini per documentare lo stato del campione prima dell'estrazione della lamella.
- Una volta identificato una regione di interesse (ROI) per l'estrazione, segnare da fascio ionico patterning, a meno che la topografia del campione stesso permette una facile identificazione del ROI anche dopo Pt deposizione. Per una maggiore precisione, utilizzare il metodo descritto da Pettersson et al. 14 Le marcature devono essere profonda, ampia e abbastanza lontano da essere ancora visibile dopo essere stato coperto dalla deposizione crio-Pt (che è non-selcace e coprirà diversi mm 2 della superficie del campione).
- Riscaldare il gas precursore di 24-26 ° C e inserire l'ago GIS ad una altezza di circa 1 mm al di sopra della superficie del campione (vedi anche punto 1.3).
- Mentre l'imaging con il fascio di elettroni, aprire la valvola del gas per alcuni secondi. Il tasso di crio-Pt deposizione è 100-500 nm / sec o più, a seconda della distanza dell'ago GIS, la rugosità campione e sistema dell'utente. È consigliabile eseguire alcune deposizioni di prova per determinare i parametri ottimali.
- La prima crio-Pt deposizione è molto agitato e disomogeneo. Curare il deposito sul ROI utilizzando un fascio di ioni di 1.000 pA a basso ingrandimento (per esempio 2.000 X). A differenza della deposizione crio, questo indurimento è sito selettiva e deve essere eseguita solo sul ROI. Lo scopo di questa prima crio-deposizione è proteggere la superficie del campione da danni fascio di ioni e di ridurre curtaining durante ione assottigliamento 13.
- Inclinare il campione52 ° in modo che la superficie è perpendicolare al fascio di ioni. Mill distanza di due trincee a schiera su entrambi i lati del ROI. Dimensioni tipiche per le trincee sono 20-30 micron di direzione (X) parallelo alla lamella da estrarre, 10-15 micron in direzione perpendicolare (Y) e con una variabile, pendenza profondità (Z), con il punto più profondo vicino alla ROI. La pendenza deve essere 45-55 °. In alcuni strumenti, trincee a schiera possono essere fresati solo con il punto più profondo sulla parte superiore. In tal caso, un mulino sotto la ROI, quindi ruotare l'immagine di 180 ° e il mulino secondo sull'altro lato. La profondità di fresatura può essere selezionato se il tasso di polverizzazione del materiale è noto. Per la maggior parte campione congelato-idratato, il tasso sputter di ghiaccio può essere utilizzato 7.
- Inclinare il campione torna a 0 ° e utilizzare il fascio di ioni di tagliare via i lati e la parte inferiore della lamella, assicurandosi che i segni di taglio passare attraverso l'intero lamella (dovrebbero lasciare segni di fresatura sul mulino pendii terrazzatiDE al passaggio precedente). Lasciare solo due piccoli ponti che collegano la lamella al resto del campione.
- Inserire l'ago GIS (puo 'spostare leggermente il campione). Manovrare la NM finché la punta è in contatto fisico con la lamella, preferibilmente sul lato. Assicurarsi che il NM non ostruisca la vista del fascio ionico due piccoli ponti di collegamento.
- Aprire la valvola GIS per pochi secondi e monitorare la deposizione crio da imaging continuo con il fascio di elettroni.
- Quando un ulteriore strato di 1-2 micron di Pt è stato crio-depositato, chiudere la valvola.
- Curare il Pt (vedi passo 2.6) solo in pochi micron intorno al punto in cui il NM è in contatto con la lamella.
- Utilizzare una corrente elevata fascio di ioni di tagliare la lamella libera. I due ponti di collegamento devono essere fresati distanza, nonché qualsiasi eccesso di Pt che possono essersi formate nuovi punti di contatto tra le lamelle e il resto del campione. Non ritrarre ancora l'ago GIS.
- Manovrare con cautela la NM per estrarre la lamella dalle trincee e spostarlo almeno 500 micron sopra la superficie del campione. Solo dopo questa fase, retrarre l'ago GIS.
- Abbassare la fase del campione di pochi mm e portarlo a una delle griglie TEM è in vista. Spostare l'area di attacco sulla griglia in posizione di lavoro e inserire l'ago GIS.
- Manovrare con cautela la NM per portare la lamella divisoria in contatto fisico con la superficie di attacco sulla griglia TEM. Non ci dovrebbe essere pressione o tensione tra la lamella, la griglia TEM e il NM.
- Aprire il rubinetto del gas per pochi secondi e crio-deposito di un ulteriore strato di 1-2 micron di Pt.
- Curare il Pt (vedi passo 2.6) solo in pochi micron attorno al punto di contatto tra la lamella e la griglia TEM.
- Utilizzare una corrente elevata fascio di ioni di tagliare la lamella libera del NM. Questo può essere ottenuto dalla macinazione di distanza sia la punta NM o il lato del campione. In tegli primo caso, la punta dovrà essere affilati nuovamente prima dell'uso successivo, come descritto al punto 1.2.
- OPTIONAL: in questa fase è possibile utilizzare il VTD per prendere il titolare trasferimento SEM e memorizzarlo O / N in un Dewar contenente azoto liquido. Questo trasferimento e la memorizzazione O / N sia tale da provocare la formazione di ghiaccio sulla superficie della lamella se cristalli di ghiaccio sono già presenti e / o se l'azoto liquido è esposto all'aria umida; ma tale contaminazione verrà rimosso dalla fase successiva in un tempo relativamente breve. Poiché i passaggi precedenti possono aver preso diverse ore per completare, potrebbe essere opportuno farlo, dal momento che dopo il passo successivo tale ammasso O / N non è raccomandato, in quanto non ci sarebbe alcun modo per rimuovere la contaminazione di ghiaccio se non per sublimazione (che non può essere eseguita se la vetrificazione del campione deve essere mantenuta).
- Inclinare il campione a 52 ° e utilizzare il fascio di ioni sottile al di elettroni trasparenza 7. Si consiglia di cominciare con una maggiore, rougle correnti dei fasci per rimuovere la massa e procedere alla lucidatura fine la superficie con correnti dei fasci inferiori, eventualmente anche riducendo la tensione di accelerazione. Lo spessore finale della lamella dovrebbe essere 100-200 nm o meno per l'analisi ultrastruttura in un TEM 100-200 kV o fino a 500 nm per tomografia in un TEM 300 kV, a seconda della composizione del campione. Durante diradamento, le sollecitazioni interne del campione possono causare la lamella arricciamento o piegarsi. In tal caso, la regione assottigliato deve essere limitato. Ciò avvenne per esempio nelle figure 11 e 12.
4. Cryo Trasferimento a TEM
- Lavare la stazione crio-transfer con azoto secco per qualche minuto.
- Aggiungere azoto liquido alla Dewar del TEM AC e alla stazione crio-transfer.
- Inserire il supporto TEM crio-transfer nello slot appropriato della stazione di crio-trasferimento e riempire il suo Dewar pure. Attendere che ogni bozzettoonent ha raggiunto la temperatura desiderata (circa 15 min). Se possibile, il controllore del titolare TEM crio-trasferimento deve essere collegato per monitorare la temperatura durante il trasferimento. È importante rendersi conto che la punta del titolare TEM (la posizione del sensore di temperatura) sarà in contatto con la stazione crio-transfer e verrà raffreddano pertanto molto più velocemente rispetto al resto del titolare TEM. Pertanto si raccomanda che il tempo necessario per l'intera titolare TEM crio-transfer per raffreddare è misurata in anticipo, e che il sistema è consentito thermalize per almeno tale quantità di tempo.
- Riempire una tazza criogenico con azoto liquido e immergere in esso: lo strumento campione serraggio TEM, un cacciavite e pinzette, al fine di raffreddare le loro estremità alla temperatura desiderata. Tutti gli strumenti devono essere adeguatamente isolati su l'altra estremità in modo da non causare ustioni alla mano dell'operatore.
- Far corrispondere il VTD per la camera di equilibrio esterno. Portare il cervo freddoe l'altezza di trasferimento (16 mm *). Spegnere l'alta tensione.
- Aprire il sigillo VTD, la camera di equilibrio esterno e la camera di equilibrio interiore.
- Utilizzare l'asta VTD per bloccare nel supporto di trasferimento SEM premendo e ruotando in senso orario.
- Ritrarre il supporto di trasferimento SEM nella camera di preparazione crio.
- Usare il coltello fredda per chiudere i coperchi di protezione delle griglie TEM. Ciò è necessario per ridurre la contaminazione ghiaccio possibile durante il trasferimento.
- Utilizzare l'asta VTD per spostare il campione nella camera a vuoto del VTD.
- Chiudere le sacche d'aria e di tenuta.
- Vent la camera di compensazione esterna e staccare il VTD. Far corrispondere il VTD alla porta SEM della stazione di crio-transfer. Durante il lavaggio con azoto secco, usa il perno sulla stazione per aprire il sigillo del VTD e far scorrere il supporto di trasferimento SEM nel Dewar della stazione di crio-transfer.
- Aggiungere abbastanza azoto liquido in modo che il livello nella stazione crio-transfer è abbastanza altoimmergere solo il campione.
- Utilizzare il cacciavite in precedenza raffreddato ad aprire uno dei coperchi e allentare la corrispondente vite che sta tenendo la griglia TEM a posto.
- Utilizzare le pinzette precedentemente raffreddati a raccogliere la griglia TEM e inserirlo nel supporto TEM.
- Utilizzare il hexring raffreddato per fissare la griglia TEM sul supporto TEM.
- Chiudere l'otturatore del titolare TEM crio-transfer. La fase di trasferimento del campione è fondamentale e potrebbe essere ostacolato da gas azoto riducendo la visibilità del piccolo campione TEM.
- Scollegare la stazione crio-trasferimento dal sistema di pompaggio e trasportarlo vicino al TEM, insieme con il controller di riscaldamento del titolare TEM crio-transfer.
- Avviare la pompa turbomolecolare del TEM per pompare la linea di appoggio per la camera di equilibrio TEM.
- Impostare la fase del campione TEM ad una inclinazione * di -70 °.
- Impostare il breve tempo di pompaggio per la camera di compensazione (30-60 sec), con un solo ciclo di lavaggio con gas di azoto secco.
- Assicurarsi che l'otturatore di protezione sul supporto TEM crio-transfer è chiuso. Rimuovere il supporto TEM dalla stazione di crio-transfer e inserirlo nel goniometro inclinato (azoto liquido fuoriuscire del Dewar titolare TEM). Il ciclo di pompaggio inizierà. Una volta che il ciclo è completato, impostare il goniometro per inclinare di nuovo a 0 ° e, allo stesso tempo, mantenere il supporto del TEM in modo che non ruoti con il goniometro. Inserire completamente all'interno della TEM. Durante questa fase, il titolare TEM crio-trasferimento deve essere collegato ad un regolatore di riscaldamento per controllare la temperatura. La procedura per inserire il supporto del campione nella TEM può variare tra i diversi TEM. Si raccomanda pertanto di contattare il produttore TEM avere la procedura appropriata.
- Riempire il crio-transfer titolare TEM Dewar. Attendere il vuoto nella TEM per raggiungere un livello accettabile.
Risultati
In questo lavoro abbiamo fatto uso di: un doppio fascio FIB / SEM dotato di nanomanipulator e una camera di crio-preparazione; un TEM con un supporto crio-transfer; una stazione di crio-transfer prototipo. Il anticontaminator (AC) lame della camera di crio-preparazione e la punta del nanomanipulator (NM) sono stati modificati da Gatan. Rispetto ad una camera di crio-preparazione standard, le lame AC sono più grandi di fornire una maggiore dissipatore di calore per la punta NM. Inoltre, l'AC è dotato di morsetti per il collegamento delle trecce Cu per lo scambio termico con la punta NM. I pneumatici della FIB / SEM sono state modificate per consentire al NM di essere e restare inseriti anche quando la camera del campione è stato sfiatato. Va notato che i parametri utilizzati in questo lavoro sono più adatti per l'apparecchiatura di cui sopra; tali parametri possono essere regolati necessaria quando si lavora con altri tipi di apparecchiature. Per lavorare con questo protocollo, le normali precauzioni per la manipolazione di criogenia, sistemi di azoto e vuoto liquido deveda seguire.
Il metodo è stato testato su diversi tipi di campioni con buoni risultati, che vanno da soluzioni o matrici polimeriche contenenti nanoparticelle, di organismo unicellulare ai nematodi. Esempi delle varie fasi della procedura sono illustrati nelle figure 1-12 su A. spore niger colorate con tetrossido di osmio e permanganato di potassio. Le spore vengono prima esposte mediante SEM (Figura 1) per identificare il sito per l'estrazione. In questo caso, una sezione trasversale di qualsiasi spora era sufficiente, ma è possibile posizionare il ROI per estrazione con sub-micrometrica precisione, per esempio, tagliare una cella specifica ad una distanza determinata dalla membrana cellulare. Una volta individuata la caratteristica di interesse, il primo passo della deposizione crio-Pt è implementato (Figura 2), per proteggere il campione da danni fascio dalla macinazione ione. Il campione è inclinato a 52 ° per procedere con i primi passi of la fresatura (Figura 3): lo sputtering di due trincee su entrambi i lati della lamella. Il campione viene quindi inclinato indietro e in seguito lavorato a lasciare solo due piccoli ponti che collegano alla rinfusa (Figura 4). Il nanomanipulator raffreddata viene portato a contatto con la lamella (Figura 5) e un altro crio-deposizione di Pt loro saldature insieme (Figura 6). I ponticelli di collegamento vengono poi macinati distanza e la NM sposta la lamella in prossimità della zona di fissaggio della griglia TEM (Figura 7), dove viene saldato con un finale crio-deposizione di Pt (Figura 8). Il NM viene poi separato dal lamella (Figura 9), che viene ridotto alla elettroni trasparenza con il fascio di ioni (Figura 10 e 11). La lamella è finalmente trasferito al TEM (Figura 12) dove imaging ad alta risoluzione, spettroscopia, tomografia e altre tecniche can essere impiegati.

Figura 1. Cryo-SEM immagine di spore di A. niger, prima di Pt deposizione.

Figura 2. La stessa area in Figura 1 dopo Pt deposizione ma prima dell'indurimento.

Figura 3. Cryo-SEM immagine della stessa area in Figura 2, inclinato 52 °, dopo Pt deposizione e polimerizzazione, con trincea fresatura corso(Vedi passo 3.7).

Figura 4. La lamella, pronto per lift-out.

Figura 5. La punta nanomanipulator fredda entra in contatto con la lamella.

Figura 6. A seconda Pt crio-deposizione è usato per saldare insieme le nanomanipulator e la lamella.

Figura 7. L'nanomanipulator freddo viene utilizzato per trasferire la lamella alla zona di attacco della griglia TEM.

Figura 8. Cryo-deposizione viene utilizzato ancora una volta per fissare la lamella alla rete TEM.

Figura 9. La lamella viene tagliata del nanomanipulator ed è ora pronto per l'archiviazione o diradamento di elettroni trasparenza.

Figura 10. Una fase intermedia del diradamento, con alcune spore visibili in sezione trasversale.

Figura 11 Cryo-SEM immagine del campione dopo diradamento finale.; la maggior parte degli altri spore doveva essere lavorato via perché la lamella aveva cominciato ad arricciarsi.
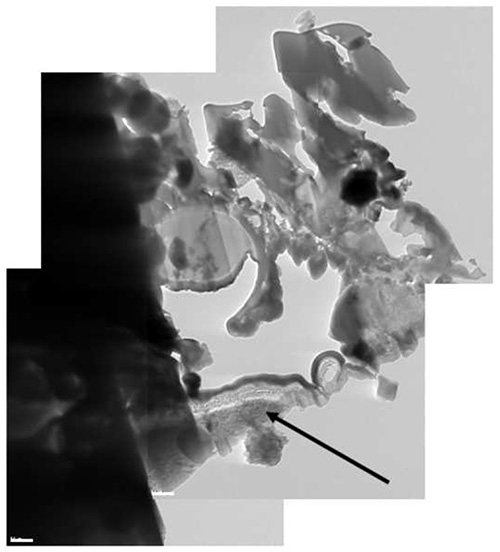
Figura 12. Una foto crio-TEM composito della lamella. Parte del Al stub è stato inclusonella lamella (freccia nera).
Discussione
Questo protocollo è un adattamento piuttosto semplice a temperature criogeniche della preparazione del campione FIB / TEM standard utilizzato in scienze dei materiali a temperatura ambiente. Il metodo produce campioni TEM gratuitamente deformazione meccanica e segni di coltello (il grave inconveniente di microtomia), anche se tendaggi si può verificare se la superficie del campione è disomogeneo. Questo può essere ridotto crio-deposizione di uno strato di incappucciamento (in questo lavoro è stata utilizzata Pt), curato finché è liscio e informe 13. I campioni con componenti di durezza molto diversi possono essere preparate anche senza il rischio che si rompono sotto stress durante la preparazione. Sollecitazioni interne possono ancora provocare il sottile lamella di curvarsi o piegarsi, nel qual caso la dimensione della sezione deve essere ridotto. Un inconveniente rispetto ad altro metodo è la possibilità di modificare la struttura biologica a causa di esposizione al fascio di ioni e possibile impianto degli ioni del campione. Questi inconvenienti si verificano anche a TA per campione prepazione nella scienza dei materiali 15. Essi possono essere ridotte completando il diradamento con un passo lucidatura finale alla tensione più bassa per accelerare gli ioni (500-1000 V). Questo passaggio di lucidatura molto delicato rimuove lo strato danneggiato della lamella.
A causa della natura del crio-deposizione (punti 3.5, 3.10 e 3.13), gran parte del campione saranno coperti, ostacolando così la vista della superficie originale. Questo può rendere difficile tenere traccia del ROI, a meno che non si utilizzano più marcature come suggerito al punto 3.3.
Durante le fasi 4.5 e 4.7 i rischi lamelle sottili che entrano in contatto con l'aria. Questo è da evitare in quanto provocherebbe l'umidità nell'aria per formare cristalli di ghiaccio sulla superficie del campione, possibilmente fino al punto di oscurare caratteristiche importanti. Tali procedure devono essere eseguite più velocemente possibile, ma allo stesso tempo un maltrattamento durante il trasferimento può comportare la perdita del campione cheauto. Si raccomanda che l'utente esercita tali passaggi utilizzando griglie TEM vuoti prima di un tentativo su un campione reale è fatta.
In scienza dei materiali, lo strumento FIB è diventato il metodo principale di preparazione del campione TEM entro un decennio della sua commercializzazione. Poiché può essere utilizzato praticamente su qualsiasi campione, elimina la necessità di adattare la tecnica di preparazione al tipo di campione. Crediamo fermamente lo stesso potrebbe accadere a temperature criogeniche, grazie alla procedura qui dettagliata. La sua applicazione ai campioni più grandi è ancora soggetta alla possibilità di crio-conservazione loro in uno stato vetrificato, ma tecniche come tuffo congelamento o ad alta pressione di congelamento 3,5 può dimostrare di essere le soluzioni ottimali a questo problema.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca ha ricevuto il sostegno del Progetto QNano http://www.qnano-ri.eu che è finanziato dalle infrastrutture di ricerca della Comunità Europea nell'ambito del programma Capacità del 7 ° PQ (Grant No. INFRA-2010-262163).
Ringraziamo anche il consiglio di ricerca Formas per il sostegno finanziario.
Materiali
| Name | Company | Catalog Number | Comments |
| Strata DB 235 | FEI | FIB/SEM | |
| Omniprobe 100 | Oxford Instruments | Nanomanipulator | |
| Alto 2500 | Gatan | Cryo preparation chamber | |
| Cryo-holder model 626 | Gatan | Cryo transfer TEM holder | |
| Tecnai F30 | FEI | TEM |
Riferimenti
- Echlin, P. . Low Temperature Microscopy and Analysis. , (1992).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. J. Struct. Biol. 180, 572 (2012).
- Studer, D., et al. A new approach for cryofixation by high-pressure freezing. J. Microsc. 203, 285 (2001).
- Umrath, W. Cooling bath for rapid freezing in electron microscopy. J. Microsc. 101, 103 (1974).
- Walther, P. Recent progress in freeze-fracturing of high-pressure frozen samples. J. Microsc. 212, 34 (2003).
- Elder, H. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Cryo fixation. Techniques in Immunocytochemistry. , (1989).
- Giannuzzi, L. A., Stevie, F. A. . Introduction to Focused Ion Beams. , (2005).
- Marko, M., et al. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryoelectron microscopy. Nat. Methods. 4, 215 (2007).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. J. Struct. Biol. 172, 180 (2010).
- Rigort, A. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. J. Struct. Biol. 109, 4449-44 (2012).
- Hsieh, C., et al. Towards high-resolution three-dimensional imaging of native mammalian tissue: electron tomography of frozen-hydrated rat liver sections. J. Struct. Biol. 153, 1 (2006).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. J. Microsc. 131, 1 (1983).
- Hayles, M. F., et al. A technique for improved focused ion beam milling of cryo-prepared life science specimens. J. Microsc. 226, 263 (2007).
- Pettersson, H., et al. A method for producing site-specific TEM specimens from low contrast materials with nanometer precision. Microsc. Microanal. 19 (1), 73 (2013).
- Wätjen, J. T., et al. Cu out-diffusion in kesterites—A transmission electron microscopy specimen preparation artifact. Appl. Phys. Lett. Appl. Phys. Lett, 051902 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon