Method Article
Cryo-Elektronen-Mikroskopie-Probenvorbereitung mit Hilfe eines Focused Ion Beam
In diesem Artikel
Zusammenfassung
Cryo Elektronenmikroskope, entweder Scanning (SEM) oder Transmission (TEM), werden häufig für die Charakterisierung von biologischen Proben oder anderen Materialien mit einem hohen Wassergehalt 1 verwendet wird. Eine SEM / Focused Ion Beam (FIB) wird verwendet, um Merkmale von Interesse in Proben zu identifizieren und extrahieren eine dünne, elektronentransparenten Lamellen für die Übertragung auf eine Kryo-TEM.
Zusammenfassung
Hier präsentieren wir ein Protokoll zur Kryo-TEM-Proben von Aspergillus niger Sporen vorzubereiten, aber die leicht für eine beliebige Anzahl von Mikroorganismen oder Lösungen angepasst werden kann. Wir machen Gebrauch von einem speziell angefertigten Kryo-Übergabestation und einem modifizierten Kryo-SEM Vorbereitung Kammer 2. Die Sporen werden aus einer Kultur entnommen, in flüssigem Stickstoff eingefroren Slush-tauchen und in der Kryo-SEM beobachtet, um einen interessierenden Bereich auszuwählen. Eine dünne Lamelle wird dann mit Hilfe der FIB extrahiert, auf ein TEM-Gitter befestigt und anschließend ausgedünnt, um Transparenz Elektronen. Das Raster ist mit einem Kryo-TEM Halter und in ein TEM-Studien für Hochauflösung übertragen. Durch die Einführung einer gekühlten Nanomanipulator Spitze und einer Kryo-Übertragungsstation ist dieses Protokoll eine einfache Anpassung an die kryogene Temperatur der routinemäßig verwendet FIB Herstellung der TEM-Proben. Als solche hat die Vorteile die eine kleine Menge von Änderungen an bestehenden Instrumenten-Setups und-verfahren; es is einfach zu implementieren; es hat eine Vielzahl von Anwendungen im Prinzip die gleichen wie für Cryo-TEM-Probenvorbereitung. Eine Einschränkung ist, dass es erfordert geschickte Handhabung der Proben bei kritischen Schritte zu vermeiden oder zu minimieren Kontaminationen.
Einleitung
In diesem Protokoll ein cryo-FIB/SEM wird verwendet, um TEM-Proben aus einem bestimmten Bereich der Probe mit hoher Genauigkeit vorher durch SEM-Analyse identifiziert erzeugen. Elektronenmikroskopie (Rasterelektronenmikroskop-oder Transmissions-) Analyse von biologischen Proben ist eine Routinetechnik für Forschung und Diagnostik eingesetzt. SEM ist recht schnell und einfach zu verwenden und zu interpretieren, aber Informationen werden nur von der Probenoberfläche und einer Auflösung in der 1,5-nm-Bereich erhalten. TEM eine höhere Auflösung hat, ist jedoch schwierig zu realisieren, ist die Bildanalyse weniger einfach und dass Großinformation erhalten, müssen die Proben verdünnt, um Transparenz Elektron (weniger als etwa 500 nm dick) werden. Ein zusätzliches Problem ist, dass die Vakuumanforderungen dieser Instrumente werden nur selten von wasserhaltigen Proben vertragen. In den meisten Fällen haben die biologischen Proben entweder chemisch fixiert werden (Substitution mit Wasser, z. B. Polymere) oder getrocknet. In beiden Fällen erhebliche Änderungen derMorphologie und Struktur der Probe möglich sind. Cryo TEM Herstellung von hydrierten Proben induziert minimalen chemischen Veränderungen und es produziert Proben so nah wie möglich an ihrem nativen Zustand, vor allem, wenn die Verglasung von Eis erhalten 1-6.
Das FIB wird häufig zur TEM-Proben für seine zahlreichen Vorteile 7 vorzubereiten. Um einige zu nennen: die Verwendung von Hochenergie-Ionen an fast senkrechten Einfall die Wirkung von materialbedingten Differenz Fräsen Raten minimiert; der Bereich von der Massenprobe extrahiert mit einer Sub-Mikron-Genauigkeit gewählt werden; eine sehr kleine Menge an Material extrahiert wird. Einige neuere technische Entwicklungen möglich gemacht haben, mit der FIB auch für die TEM-Probenvorbereitung bei kryogenen Temperaturen 2,8-10. Es gibt mehrere Vorteile gegenüber der traditionellen Herstellungsverfahren der Kryo-Mikrotomie 11,12 vor allem für weiche Materie Proben, wie das Fehlen von mechanischen Verformung der Lamelle geschnitten verwendet,das Fehlen von Messerspuren und die Möglichkeit, zusammengesetzte Proben mit Hart / Weich-Schnittstellen oder Komponenten vorzubereiten.
Protokoll
Hinweis: Alle in diesem Protokoll angegebenen Parameter gelten für die Instrumente und Modelle hier angezeigt. Einige dieser Parameter (mit * im Text markiert) unterschiedlich sein können, wenn ein anderer Hersteller oder Modell verwendet wird.
1. Inbetriebnahme des FIB / SEM
- Montieren Sie die maßgeschneiderte Kälte Nanomanipulator (NM) Spitze ohne Befestigung der Cu Zöpfe an den anticontaminator (AC). Stattdessen stellen Sie sicher, die Zöpfe sind mit dem Rest der NM über der Dämmung Punkt, um Ladung während des Schärf Schritt (1.2) zu verhindern verbunden.
- Schließen Sie die SEM Kammer zu pumpen, um Hochvakuum-und Bild die NM Spitze.
- Wenn die Spitze ist stumpf, verbogen oder durch vorherigen Gebrauch verunreinigt, schleifen Sie es mit Hilfe des Ionenstrahls: Wählen Sie Polygon Fräsbilder entlang den Seiten der Spitze, so dass nach dem Fräsen wird die Spitze bis 1 um oder weniger nach unten verjüngen.
- Sobald die Seiten der Spitze haben weggefräst wurde, manuell um 90 ° drehen, den gesamten NM Stangevon außerhalb des REM-Kammer.
- Stellen Sie die polygonale Fräsbilder an die Spitze gedreht anpassen und wiederholen Fräsen aus einem anderen Blickwinkel.
- Sobald die Spitze wurde geschärft, um weniger als 1 um, einfahren NM und die Nadel des Gas Injection System (GIS); Neupositionierung der Nadel auf etwa 1 mm über der Arbeitsabstand (anstelle der üblichen 175 &mgr; m) sein.
- Bei Verwendung eines Pt-Vorläufer, ändern ihre Betriebstemperatur zu 24-26 ° C (anstatt der üblichen 40 ° C). Diese Schritte werden für Kryo-Abscheidung 13 der Pt erforderlich.
- Öffnen Sie die SEM Kammer und bereiten die FIB / SEM für Kryo-Modus durch die Montage des Kryo Probenbühne und der AC.
- Schalten Sie die NM auf der eingeschobenen Position und verbinden ihre Cu Zöpfe an den AC. Achten Sie darauf, nicht versehentlich berühren Sie die NM Spitze. Das System ist mit der NM eingesetzt, um sicherzustellen, dass der Verlust der Flexibilität der Cu-Geflecht bei kryogenen Temperaturen nicht die NM Bewegung behindern gekühltment.
- Spülen Sie die Rohrleitungen für die Kühlung mit trockenem Stickstoff für ein paar Minuten.
- Pumpen Sie den Kryo-Präparationskammer und der Hauptprobenkammer zu hohen Unterdruck.
- In flüssigem Stickstoff auf die Dewars, beide Kammern zu kühlen. Warten, bis die gewünschte Temperatur erreicht ist.
2. Proben Freezing
- Montieren Sie zwei TEM-Grids für FIB-SEM-Proben auf der Überführungshalter. Sichere sie durch Anziehen der entsprechenden Schrauben mit einem Schraubendreher.
- Montieren Sie einen geeigneten Proben Stub für die Probe, und fügen Sie einen Teil der Probe. Abhängig von der Art der Probe kann die Probe mit kryogenen Klebstoff oder mit einer Klammer befestigt werden. Einsatzmengen so gering wie möglich, um eine optimale Einfrieren sicherzustellen.
- Montieren Sie den REM-Transfer Halter auf die Vakuumtransfervorrichtung (VTD).
- In flüssigem Stickstoff in die Auflösestation und abpumpen zu Stickstoff Schneematsch zu erhalten.
- Öffnen Sie die slushing Station und Tauch frieren die SEM Transfer Halter. Abpumpen wieder zum Kochen beendet ist und wieder Matsch erhalten wird. Es sei darauf hingewiesen, dass ein Ethan oder Propan-Slush-oder Hochdruckgefrier besser geeignet sind Techniken, um die Verglasung der Probe zu erhalten.
- Fahren Sie den REM-Transfer Halter in die Vakuumkammer des VTD und verschließen.
- Entlüften Sie die Auflösestation und der Kryo-Präparationskammer Luftschleuse.
- Passen Sie die VTD Dichtung mit der Luftschleuse der Kryo-Präparationskammer und Pumpe.
- Wenn eine gute Vakuumniveau erreicht ist, greifen in die Luftschleuse Stift, um das Siegel des VTD und der Außenluftschleuse zu öffnen; setzen Sie die SEM Transfer Halter. Es sind Markierungen auf der Schleifkontakte in den Kammern, die die Vorbereitung Probenposition für das Sputtern und Brechen.
- Wenn nötig, kann die Probe werden: gebrochen mit dem kalten Messer; durch Einstellung einer höheren Temperatur (in der Regel -100 sublimiert6, C); mit Au / Pd oder Pt durch die kalte Sprudler beschichtet (300 V, 10 mA, 60 sec für eine 2-3 nm Au / Pd-Cap) *. Sublimation sollte nicht für verglaste Proben verwendet werden, um ihre Rekristallisation zu vermeiden.
- Nutzen Sie die kalte Messer an der Schutzdeckel der TEM-Startplätze zu öffnen.
- Bringen Sie die Kältestufe in der Probenkammer auf die Empfangshöhe (16 mm *).
- Schalten Sie das HT auf dem FIB / SEM und öffnen Sie die Innenluftschleuse.
- Verwenden Sie die VTD, um die SEM Halter in die Probenkammer zu übertragen. Dimmen der Beleuchtung im Raum kann in diesem Schritt zu helfen.
- Sobald die SEM Halter in der Kältestufe, lösen Sie die VTD durch Drücken und Drehen.
- Fahren Sie den VTD Stange ganz in der VTD Vakuumkammer und schließen Sie die Innenluftschleuse, die Außenluftschleuse und der VTD-Dichtung. Die Außenluftschleuse kann nun entlüftet werden, um die VTD Dichtung zu entfernen. Dieser letzte Schritt ist nicht erforderlich, aber es wird empfohlen, da die VTD Stange kann leicht durch Unfall verdrängt werden, die Schäden verursachen könnenzu der VTD oder der Luftschleuse.
3. Ion Milling
- Schalten Sie die Hochspannung auf beiden Spalten und die entsprechenden Aufnahmeparameter (Beschleunigungsspannung: 10 kV für den Elektronenstrahl, 30 kV für den Ionenstrahl, Punktgröße: 3; Arbeitsabstand: 5 mm, Ionenstrahlstrom: 10-100 pA für Imaging, 1-3 nA für Fräsen) *.
- Verwenden des Elektronenstrahls, um ein Merkmal von Interesse zu finden und um Bilder zu erfassen, um den Status der Probe vor der Extraktion der Lamelle zu dokumentieren.
- Sobald ein interessierender Bereich (ROI) für die Extraktion identifiziert worden ist, zu kennzeichnen durch Ionenstrahlmuster, es sei denn, die Topographie der Probe selbst erlaubt eine einfache Identifizierung der ROI auch nach Pt-Abscheidung. Für erhöhte Präzision, verwenden Sie die von Pettersson et al. Beschriebenen Methode 14 Die Markierungen sollten tief, breit und weit genug noch sichtbar, nachdem er von der Kryo-Pt-Abscheidung (die nicht-sel ist bedeckt zu seinektive und wird mehrere mm 2 der Probenoberfläche zu bedecken).
- Erhitzen Sie das Vorläufergas auf 24-26 ° C und setzen Sie die GIS-Nadel bis zu einer Höhe von etwa 1 mm über der Oberfläche der Probe (siehe auch Schritt 1.3).
- Während die Abbildung mit dem Elektronenstrahl, öffnen Sie das Gasventil für ein paar Sekunden. Die Rate der Kryo-Pt Abscheidung 100-500 nm / sec oder mehr, abhängig von der Entfernung des GIS Nadel Probe Rauhigkeit und dem System des Benutzers. Es ist ratsam, ein paar Test Ablagerungen ausführen, um die optimalen Parameter zu bestimmen.
- Die rohe Kryo-Pt Ablagerung ist sehr rau und inhomogen. Cure die Anzahlung über die ROI mit Hilfe eines Ionenstrahls 1.000 pA bei geringer Vergrößerung (zB 2000 X). Im Gegensatz zu dem Kryo Abscheidung, ist das selektive Aushärten Ort und sollte nur auf der ROI durchgeführt werden. Der Zweck dieser ersten Kryo-Ablagerung, die Oberfläche der Probe von Ionenstrahlschäden zu schützen und Schleier während Ionendünnung 13 zu reduzieren.
- Kippen Sie die Probe auf52 °, so dass die Fläche senkrecht zum Ionenstrahl ist. Mühle entfernt zwei Reihen Gräben auf beiden Seite der ROI. Typische Abmessungen für die Gräben 20-30 &mgr; m in der Richtung (X) parallel zu den Lamellen zu extrahieren, 10-15 um in der senkrechten Richtung (Y) und mit einem variablen, abfallenden Tiefe (Z), wobei der tiefste Punkt zu schließen, um den ROI. Die Steigung sollte 45-55 ° betragen. Bei einigen Geräten kann Reihen Gräben nur mit dem tiefsten Punkt auf der Oberseite gefräst werden. In einem solchen Fall unter der Mühle ein ROI, und drehen Sie das Bild um 180 ° und Mühle die zweite auf der anderen Seite. Die Frästiefe kann ausgewählt werden, wenn die Sputterrate des Materials bekannt ist. Für die meisten tiefgefrorenen Probe kann der Sputter-Rate von Eis verwendet werden 7.
- Kippen Sie die Probe auf 0 ° und benutzen den Ionenstrahl zu schneiden weg die Seiten und die Unterseite der Lamelle, so dass die Schnittmarken durch die gesamte Lamellen gehen (sie sollten Fräs-Markierungen auf dem terrassierten Hängen Mühle verlassenim vorherigen Schritt ed). Lassen Sie nur zwei kleine Brücken verbinden die Lamelle mit dem Rest der Probe.
- Legen Sie die GIS-Nadel (dies kann leicht verschieben die Probe). Manövrieren des NM, bis seine Spitze in physikalischem Kontakt mit der Lamelle, vorzugsweise auf der Seite. Sicherstellen, dass der NM nicht behindern den Ionenstrahl Ansicht der zwei kleine Verbindungsbrücken.
- Öffnen Sie die GIS Ventil für ein paar Sekunden und Überwachung der Kryo Abscheidung von kontinuierlichen Bilderzeugung mit dem Elektronenstrahl.
- Wenn eine zusätzliche Schicht von 1-2 um Pt wurde Kryo dampft, das Ventil zu schließen.
- Härten des Pt (siehe Schritt 2.6) nur in den wenigen &mgr; m um den Punkt, wo die NM in Kontakt mit der Lamelle.
- Verwenden Sie eine hohe Ionenstrahlstrom, um die Lamellen frei geschnitten. Die beiden Verbindungsbrücken sollten entfernt überschüssiges Pt, die neue Kontaktpunkte zwischen der Lamelle und dem Rest der Probe gebildet haben können gemahlen und werden. Sie noch nicht die GIS Nadel zurückzuziehen.
- Vorsichtig manövrieren die NM, die Lamellen aus den Schützengräben zu extrahieren und verschieben Sie es mindestens 500 um über der Probenoberfläche. Erst nach diesem Schritt einfahren GIS Nadel.
- Senken Sie den Probentisch ein paar mm und verschieben Sie sie, bis einer der TEM-Gitter ist in Sicht. Bewegen Sie den Befestigungsbereich auf dem Gitter in die Arbeitsposition und legen Sie die GIS-Nadel.
- Vorsichtig manövrieren die NM um die angehängte Lamellen in physischen Kontakt mit dem Befestigungsbereich auf der TEM-Gitter zu bringen. Es sollte kein Druck oder Spannung zwischen den Lamellen, der TEM-Gitter und der NM sein.
- Öffnen Sie das Gasventil für ein paar Sekunden, und Kryo-Lagerstätte eine zusätzliche Schicht von 1-2 um Pt.
- Heilt Pt (siehe Schritt 2.6) nur in der wenigen um rund um den Berührungspunkt zwischen den Lamellen und dem TEM-Gitter.
- Verwenden Sie eine hohe Ionenstrahlstrom, um die Lamellen frei von der NM geschnitten. Dies kann durch Mahlen entfernt entweder die NM Spitze oder die Seite der Probe durchgeführt werden. In ter ersten Fall wird die Spitze noch einmal vor der nächsten Verwendung geschärft werden, wie in Schritt 1.2 beschrieben.
- OPTIONAL: zu diesem Zeitpunkt ist es möglich, die VTD verwenden, um die SEM-Transfer Halter nehmen und speichern es O / N in einem Dewar mit flüssigem Stickstoff gefüllt. Diese Übertragung und O / N Speicher wahrscheinlich die Bildung von Eis auf der Oberfläche der Lamelle verursachen Eiskristalle bereits vorhanden sind und / oder wenn der flüssige Stickstoff feuchter Luft ausgesetzt wird; aber solche Verunreinigung wird durch die nächste Stufe in einer relativ kurzen Zeit entfernt werden. Wie die vorherigen Schritte kann mehrere Stunden in Anspruch genommen haben, ist es angebracht sein könnte, dies zu tun, denn nach dem folgenden Schritt solche Speicher O / N wird nicht empfohlen, da gäbe es keine Möglichkeit, um das Eis Kontamination außer durch Sublimation zu entfernen (was sein kann nicht ausgeführt werden, wenn die Verglasung der Probe aufrechterhalten werden).
- Kippen Sie die Probe auf 52 ° und benutzen den Ionenstrahl zu dünn ist, um die Transparenz 7 Elektronen. Es wird empfohlen, mit höheren, roug startenihre Strahlströmen, den Groß entfernen und gehen Sie zur Fein Polieren der Oberfläche mit geringerer Strahlströme, eventuell auch die Verringerung der Beschleunigungsspannung. Die endgültige Dicke der Lamelle ist 100-200 nm oder weniger für die Analyse in einem Ultra 100-200 kV TEM oder bis zu 500 nm für die Tomographie in einem 300-kV-TEM, abhängig von der Probenzusammensetzung. Während Verdünnung können die inneren Spannungen der Probe bewirken, dass die Lamelle zu kuscheln oder sich verbiegen. In einem solchen Fall sollte der Bereich dünner beschränkt. Dies passiert beispielsweise in den Fig. 11 und 12.
4. Cryo TEM-Transfer
- Spülen Sie die Kryo-Übergabestation mit trockenem Stickstoff für ein paar Minuten.
- In flüssigem Stickstoff auf die Dewar der TEM-AC und der Kryo-Übergabestation.
- Legen Sie die Kryo-TEM-Transfer Halter in den entsprechenden Steckplatz des Kryo-Übergabestation und füllen ihre Dewar als gut. Warten Sie, bis jedes Layoutonent die gewünschte Temperatur (ca. 15 min) erreicht hat. Wenn möglich, sollte die Steuerung des Cryo-TEM-Übertragungshalterung, die Temperatur während der Übertragung Monitor angeschlossen werden. Es ist wichtig zu erkennen, dass die Spitze des TEM-Aufnahme (wo der Temperatursensor angeordnet ist) wird in Kontakt mit dem Kryo-Übergabestation und wird daher viel schneller abkühlen als der Rest der TEM Halter. Es wird daher empfohlen, dass die Zeit für die ganze Kryo-TEM-Transfer Halter zum Abkühlen benötigt wird vorher gemessen, und dass das System erlaubt, für mindestens diese Zeit thermalisieren.
- Füllen Sie eine Tasse mit kryogenen flüssigen Stickstoff und tauchen in ihm: die TEM-Probenspannwerkzeug, einen Schraubendreher und Pinzette, um ihre Tipps, um die gewünschte Temperatur abkühlen. Alle Werkzeuge werden richtig am anderen Ende isoliert sein, um nicht zu kalt Verbrennungen der Hand des Bedieners führen.
- Passen Sie die VTD auf die Außenluftschleuse. Bringen Sie den kalten Hirsche in die Übergabehöhe (16 mm *). Schalten Sie die Hochspannung.
- Öffnen Sie die VTD-Dichtung, die Außenluftschleuse und der Innenluftschleuse.
- Verwenden Sie die VTD Stange in die SEM-Transfer Halter durch Drücken und Drehen im Uhrzeigersinn verriegeln.
- Fahren Sie den REM-Transfer Halter in die Kryo-Präparationskammer.
- Nutzen Sie die kalte Messer an der Schutzdeckel der TEM-Gitter schließen. Dies ist notwendig, um mögliche Verunreinigungen Eis während der Übertragung zu verringern.
- Verwenden Sie die VTD Stange, um die Probe in die Vakuumkammer des VTD zu bewegen.
- Schließen Sie die Luftschleusen und Siegel.
- Entlüften Sie die Außenluftschleuse und nehmen Sie die VTD. Passen Sie die VTD dem SEM-Port des Kryo-Übergabestation. Während Spülen mit trockenem Stickstoff, verwenden Sie den Pin auf der Station, um das Siegel des VTD öffnen und schieben Sie die SEM Transfer Halter in den Dewar der Kryo-Übergabestation.
- Fügen Sie genug von flüssigem Stickstoff, so dass das Niveau in der Kryo-Übergabestation ist hoch genug,um nur die Probe eintauchen.
- Mit dem zuvor gekühlt Schraubendreher, um einer der Deckel öffnen und die entsprechende Schraube lösen, dass die Beibehaltung der TEM-Gitter an Ort und Stelle.
- Verwenden Sie die zuvor gekühlt Pinzette, um die TEM-Gitter holen und es in der TEM-Halter.
- Verwenden Sie die hexring gekühlt, um die TEM-Gitter auf der TEM-Halter zu befestigen.
- Schließen des Verschlusses des Cryo-TEM-Übertragungshalter. Die Probenübertragungsschritt ist entscheidend und kann durch Stickstoffgas behindert die Verringerung der Sichtbarkeit der kleinen TEM Probe.
- Trennen Sie das Kryo-Übergabestation aus dem Pumpsystem und transportieren sie in der Nähe des TEM, zusammen mit der Heizungssteuerung der Kryo-TEM-Transfer Halter.
- Starten der Turbomolekularpumpe der TEM, um die Trägerleitung zu dem TEM Schleusen pumpen.
- Stellen Sie die TEM Probenbühne zu einer Neigung von -70 ° *.
- Gesetzt den kürzesten Pumpzeit für die Luftschleuse (30-60 sec), mit nur einem Zyklus von Spülen mit trockenem Stickstoffgas.
- Stellen Sie sicher, dass die Schutzklappe an der Kryo-TEM-Transfer Halter ist geschlossen. Entfernen Sie die TEM Halter aus dem Kryo-Übergabestation und legen Sie sie in der gekippten Goniometer (flüssiger Stickstoff wird aus der TEM Halter Dewar verschütten). Der Pumpzyklus beginnt. Sobald der Zyklus beendet ist, stellen Sie den Winkelmesser auf 0 ° nach hinten neigen und in der gleichen Zeit, halten Sie den TEM-Halter, so dass es nicht mit dem Goniometer drehen. Setzen Sie ihn ganz in der TEM. Bei diesem Schritt sollte der Kryo-TEM-Übertragungshalter seine Heizungssteuerung verbunden sein, um die Temperatur zu überwachen. Das Verfahren, um den Probenhalter in die TEM einfügen kann zwischen verschiedenen TEMs variieren. Es wird daher empfohlen, die TEM-Hersteller wenden, um die entsprechenden Verfahren zu erhalten.
- Füllen Sie den Cryo-TEM-Transfer Halter Dewar. Warten, bis das Vakuum in der TEM einen akzeptablen Level zu erreichen.
Ergebnisse
In dieser Arbeit haben wir den Einsatz von: einem Zweistrahl-FIB / SEM mit einem Nanomanipulator und ein Kryo-Präparationskammer ausgestattet; eine TEM mit einem Kryo-Transfer-Halterung; ein Prototyp Kryo-Übergabestation. Die anticontaminator (AC) Schaufeln der Kryo-Präparationskammer und die Spitze des Nanomanipulators (NM) wurden durch Gatan modifiziert. In Bezug auf eine Standard-Kryo-Präparationskammer, sind die AC Schaufeln größer, um eine größere Kühlkörper für die NM Spitze bereitzustellen. Darüber hinaus ist der AC mit Klemmen für den Anschluss der Cu-Litzen für den Wärmeaustausch mit der NM Spitze ausgestattet. Die Pneumatik des FIB / SEM wurden so modifiziert, dass die NM zu sein und zu bleiben, auch wenn die eingesetzten Probenkammer entlüftet wurde. Es sei darauf hingewiesen, daß die in dieser Arbeit verwendeten Parameter sind am besten für die oben genannten Einrichtungen geeignet sein; jene Parameter erforderlich, wenn mit anderen Arten von Geräten angepasst werden. Um mit diesem Protokoll arbeiten, die normalen Vorsichtsmaßnahmen beim Umgang mit Kryotechnik, sollte flüssigen Stickstoff und Vakuumsystemeverfolgt werden.
Das Verfahren ist auf verschiedene Typen von Proben mit guten Ergebnissen getestet, die von Lösungen oder Polymermatrizes enthaltend Nanopartikel, um einzellige Organismus Nematoden. Beispiele der verschiedenen Schritte des Verfahrens sind in den Fig. 1-12 dargestellten A. niger Sporen mit Osmiumtetroxid und Kaliumpermanganat gefärbt. Die Sporen werden zuerst von SEM abgebildet (Abbildung 1), um die Website für die Extraktion zu identifizieren. In diesem Fall ist ein Querschnitt eines jeden Sporen war ausreichend, aber es ist möglich, den ROI für die Extraktion mit Sub-Mikrometer-Genauigkeit zu positionieren, beispielsweise Scheiben eine bestimmte Zelle in einem bestimmten Abstand von der Zellmembran. Nachdem das Merkmal von Interesse identifiziert worden ist, wird der erste Schritt des Cryo-Pt-Abscheidung durchgeführt (Fig. 2), um die Probe von Strahlschäden aus der Ionenfräsen zu schützen. Die Probe wird auf 52 º geneigt werden, um mit den ersten Schritten o gehenf die Schleif (Abbildung 3): das Sputtern von zwei Gräben auf beiden Seiten der Lamelle. Die Probe wird dann nach hinten geneigt und weiter gemahlen, um nur zwei kleine Brücken zum Groß verbinden (Fig. 4) verlassen. Die abgekühlte Nanomanipulator in Kontakt mit der Lamelle (5) und einem anderen Kryo-Abscheidung von Pt lötet sie zusammen (Abbildung 6) gebracht wird. Die kleine Verbindungsbrücken werden dann weggefräst und die NM bewegt die Lamellen in der Nähe der Befestigungszone der TEM-Gitter (7), wo sie mit einer letzten Kryo-Abscheidung von Pt (8) verlötet ist. Die NM wird dann von der Lamelle (9), die nach unten ausgedünnt wird, um die Transparenz mit dem Ionenstrahl (10 und 11) Elektronen getrennt. Die Lamelle wird schließlich dem TEM (Fig. 12) übertragen, wo eine hochauflösende Abbildung, Spektroskopie, Tomographie und andere Techniken can verwendet werden.

Fig. 1 ist. Cryo-SEM-Bild von Sporen von A. niger, vor Pt-Abscheidung.

Abbildung 2. Gleiches Bereich in Abbildung 1 nach Pt Abscheidung, aber vor der Aushärtung.

3. Cryo-SEM-Bild des gleichen Bereichs in Fig. 2, 52 º geneigt, nach Abscheidung von Pt und Härtung mit Grabenfräsen Gange(Siehe Schritt 3.7).

Abbildung 4. Die Lamelle, bereit für Lift-out.

Abbildung 5. Die kalte Nanomanipulator Spitze in Kontakt mit der Lamelle.

Abbildung 6. Eine zweite Pt Kryo-Abscheidung wird verwendet, um zusammen löten die Nanomanipulator und die Lamelle.

Figur 7. Die kalte Nanomanipulator wird verwendet, um die Lamelle mit dem Befestigungsbereich des TEM-Gitter übertragen.

Figur 8. Cryo-Abscheidung wird noch einmal auf die Lamelle auf die TEM-Gitter befestigen verwendet.

Abbildung 9. Die Lamelle ist frei von der Nanomanipulator geschnitten und sie nun bereit ist, die entweder gespeichert oder Ausdünnung der Transparenz Elektronen.

Fig. 10. Zwischenschritt der Verdünnung mit wenigen Sporen im Querschnitt sichtbar.

Fig. 11 Kryo-SEM-Bild der Probe nach der endgültigen Verdünnung. die meisten anderen Sporen musste weggefräst werden, weil die Lamellen begonnen hatte zu kräuseln.
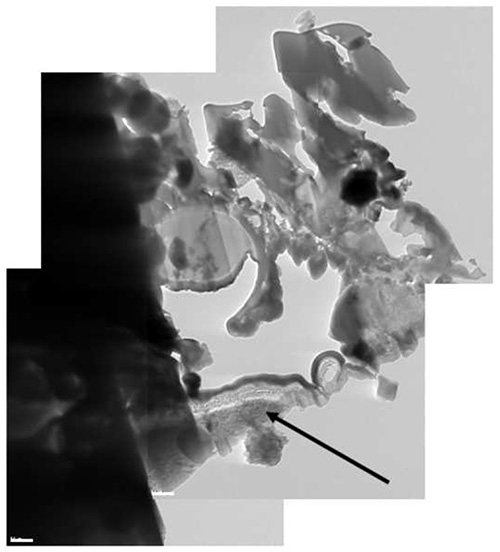
Abbildung 12. Ein Verbund Cryo-TEM-Bild der Lamelle. Teil der Al-Stub wurde aufgenommenin der Lamelle (schwarzer Pfeil).
Diskussion
Dieses Protokoll ist eine ziemlich einfache Anpassung an die tiefen Temperaturen der Norm FIB / TEM Probenvorbereitung in den Materialwissenschaften bei RT verwendet. Das Verfahren erzeugt TEM-Proben frei von mechanischen Verformung und Messerspuren (der größte Nachteil Mikrotomie), obwohl Stores kann auftreten, wenn die Probenoberfläche inhomogen ist. Dies kann durch Kryo-Abscheidung einer Deckschicht (die in dieser Arbeit verwendet wurde, Pt), gehärtet reduziert werden, bis sie glatt und strukturlos 13 ist. Proben mit Komponenten von sehr unterschiedlichen Härte kann auch hergestellt werden, ohne die Gefahr, dass sie unter Stress während der Vorbereitung brechen würde. Innere Spannungen können noch bewirken, daß die dünne Lamelle zu wölben, wobei die Größe des Abschnitts reduziert werden muss. Ein Nachteil im Vergleich zu anderen Verfahren ist die Möglichkeit, um die biologische Struktur durch Einwirkung des Ionenstrahls und mögliche Implantation der Ionen in der Probe zu verändern. Diese Nachteile treten auch bei RT für die Proben preparation in der Materialwissenschaft 15. Sie können durch Ausfüllen der Verdünnung mit einem letzten Polierschritt zum niedrigsten Beschleunigungsspannung für die Ionen (500-1000 V) reduziert werden. Diese sehr sanfte Polierschritt wird die beschädigte Schicht von der Lamelle entfernen.
Aufgrund der Natur des Cryo-Abscheidung (Schritte 3.5, 3.10 und 3.13), werden große Teile der Probe bedeckt werden, wodurch der Blick auf die ursprüngliche Oberfläche zu behindern. Dies kann es schwierig machen, den Überblick über den ROI zu halten, es sei denn, mehrere Markierungen verwendet werden, wie in Schritt 3.3 vorgeschlagen.
Während der Schritte 4.5 und 4.7 die dünnen Lamelle Risiken kommen in Kontakt mit Luft. Dies muss vermieden werden, da sie die Feuchtigkeit in der Luft führen, um Eiskristalle auf der Oberfläche der Probe, die möglicherweise bis zu dem Punkt verdeckt wichtige Merkmale bilden werden. Diese Schritte so schnell wie möglich durchgeführt werden, aber zur gleichen Zeit eine falsche Handhabung während der Übertragung wahrscheinlich zum Verlust der Probe führen sieSelbst. Es wird empfohlen, dass der Benutzer übt diese Schritte mit Hilfe leer TEM-Gitter, bevor ein Versuch auf eine echte Probe gestellt.
In der Materialwissenschaft, hat das FIB-Instrument werden die Hauptmethode der TEM Probenvorbereitung innerhalb von zehn Jahren von ihrer Vermarktung. Da es auf nahezu allen Probe verwendet werden, entfernt es die Notwendigkeit, die Herstellungstechnik der Art der Probe anzupassen. Wir glauben fest daran, das gleiche könnte bei kryogenen Temperaturen passieren, dank der Verfahren ist hier beschrieben. Seine Anwendung auf größere Stichproben steht noch unter Vorbehalt der Fähigkeit, Kryo-bewahren sie in einem verglasten Zustand, aber Techniken wie Sprung-Gefrier-oder Hochdruckgefrier 3,5 nachweisen kann, die optimalen Lösungen für dieses Problem sein.
Offenlegungen
Autoren haben nichts zu offenbaren.
Danksagungen
Diese Forschung erhielt Unterstützung von der Projekt QNano http://www.qnano-ri.eu, die durch die Europäische Gemeinschaft Forschungsinfrastrukturen unter dem RP7-Programm Kapazitäten (Grant No INFRA-2010-262163) finanziert wird.
Wir danken auch der Forschungsgemeinschaft Formas für finanzielle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Strata DB 235 | FEI | FIB/SEM | |
| Omniprobe 100 | Oxford Instruments | nanomanipulator | |
| Alto 2500 | Gatan | cryo preparation chamber | |
| cryo-holder model 626 | Gatan | cryo transfer TEM holder | |
| Tecnai F30 | FEI | TEM | |
Referenzen
- Echlin, P. . Low Temperature Microscopy and Analysis. , (1992).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. J. Struct. Biol. 180, 572 (2012).
- Studer, D., et al. A new approach for cryofixation by high-pressure freezing. J. Microsc. 203, 285 (2001).
- Umrath, W. Cooling bath for rapid freezing in electron microscopy. J. Microsc. 101, 103 (1974).
- Walther, P. Recent progress in freeze-fracturing of high-pressure frozen samples. J. Microsc. 212, 34 (2003).
- Elder, H. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Cryo fixation. Techniques in Immunocytochemistry. , (1989).
- Giannuzzi, L. A., Stevie, F. A. . Introduction to Focused Ion Beams. , (2005).
- Marko, M., et al. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryoelectron microscopy. Nat. Methods. 4, 215 (2007).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. J. Struct. Biol. 172, 180 (2010).
- Rigort, A. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. J. Struct. Biol. 109, 4449-44 (2012).
- Hsieh, C., et al. Towards high-resolution three-dimensional imaging of native mammalian tissue: electron tomography of frozen-hydrated rat liver sections. J. Struct. Biol. 153, 1 (2006).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. J. Microsc. 131, 1 (1983).
- Hayles, M. F., et al. A technique for improved focused ion beam milling of cryo-prepared life science specimens. J. Microsc. 226, 263 (2007).
- Pettersson, H., et al. A method for producing site-specific TEM specimens from low contrast materials with nanometer precision. Microsc. Microanal. 19 (1), 73 (2013).
- Wätjen, J. T., et al. Cu out-diffusion in kesterites—A transmission electron microscopy specimen preparation artifact. Appl. Phys. Lett. Appl. Phys. Lett, 051902 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten