Method Article
Крио-электронной микроскопии Изготовление образцов с помощью электронного луча, сфокусированного
В этой статье
Резюме
Крио электронные микроскопы, либо сканирования (СЭМ) или передачи (ПЭМ), которые широко используются для характеристики биологических образцов или других материалов с высоким содержанием воды 1. SEM / электронного луча, сфокусированного (FIB) используется для идентификации особенности интерес в пробах и извлечь тонкую, электронно-прозрачным ламель для перевода к крио-TEM.
Аннотация
Здесь мы приводим протокол, используемый для приготовления образцов крио-ПЭМ из Aspergillus Niger спор, но который может быть легко адаптирован для любого количества микроорганизмов или растворов. Мы используем построения своей крио-передаточной станции и модифицированной крио-SEM подготовки камеры 2. Споры взяты из культуры, окунуться заморозки в жидком слякоть азота и наблюдается в крио-SEM, чтобы выбрать интересующую область. Тонкая пластинка затем экстрагируют с помощью FIB, прикреплен к ТЕМ сетке и затем прореживают электрон прозрачности. Сетка передается держателю крио-TEM и в ПЭМ для исследований с высоким разрешением. Благодаря введению охлажденного оконечности наноманипулятора и крио-передаточной станции, этот протокол является прямым адаптация к криогенной температуре используемого регулярно подготовки FIB образцов ПЭМ. Как таковая, она имеет преимущества требуя небольшое количество модификации существующих инструментов, установок и процедур; это яс легко реализовать; он имеет широкий спектр применения, в принципе так же, как для пробоподготовки крио-TEM. Одним из ограничений является то, что она требует умелого обращения из образцов при критических шагов, чтобы избежать или свести к минимуму загрязнения.
Введение
В этом протоколе cryo-FIB/SEM используется для производства образцов ПЭМ от конкретного региона образца, ранее идентифицированного с высокой точностью с помощью анализа СЭМ. Электронная микроскопия (сканирование или передача) анализ биологических образцов является рутинной техника, используемая для исследований и диагностики. SEM довольно быстро и легко использовать и интерпретировать, но информация получается только с поверхности образца и с разрешением в диапазоне 1,5 нм. ТЕМ имеет более высокое разрешение, но сложнее в реализации, анализ изображения не столь очевидна и в то время как основная информация получается, образцы должны разбавлять электрон прозрачности (менее 500 нм). Дополнительная проблема состоит в том, что требования вакуумные из этих инструментов, редко переносится водосодержащих образцов. В большинстве случаев, биологические образцы должны быть либо химически фиксированных (заменив воду с, например, полимеры) или высушивают. В обоих случаях существенных изменений вморфология и структура образца могут произойти. Подготовка Крио ТЕМ гидратированных образцов вызывает минимальные химические изменения, и это производит образцы как можно ближе к их нативном состоянии, особенно если витрификация льда получается 1-6.
FIB широко используется для приготовления образцов ПЭМ своими многочисленными преимуществами 7. Чтобы назвать несколько: использование высокоэнергетических ионов в ближней нормальном падении минимизирует влияние материальных, связанных с дифференцированным ставкам фрезерных; область извлекается из объемного образца может быть выбран с точностью субмикронного; очень небольшое количество материала извлекается. Некоторые недавние технические разработки сделали возможным использованием FIB также для подготовки проб ПЭМ при криогенных температурах 2,8-10. Есть несколько преимуществ по сравнению с традиционным методом подготовки крио-приготовление гистологических срезов 11,12 используется в основном для образцов мягкой материи, таких, как отсутствие механической деформации нарезанный ламель,отсутствие ножа знаков и возможностью подготовить композитные образцы с жесткий / мягкий интерфейсов или компонентов.
протокол
ПРИМЕЧАНИЕ: все параметры, указанные в этом протоколе действительны для приборов и моделей, указанных здесь. Некоторые из этих параметров (помеченные знаком * в тексте) могут отличаться, если используется другой производитель или модель.
1. Запуск из FIB / SEM
- Установите специально построенный холодной наноманипулятор (Нью-Мексико) наконечник без крепления косы Cu в anticontaminator (переменного тока). Вместо этого убедитесь, что косы подключены к остальной части NM выше точки изоляции, чтобы предотвратить заряд во время стадии заточки (1.2).
- Закройте камеру SEM, насос высокого вакуума и изображения наконечника Н.М..
- Если кончик тупой, не изогнутые или загрязнены предыдущего использования, резкость его с помощью ионного пучка: выберите полигональные модели фрезерных вдоль сторон наконечника, так что после фрезерования, кончик будет сужаться до 1 мкм или менее.
- После того, как стороны наконечника быть удалена фрезерованием, вручную вращаться на 90 ° всего NM стержняснаружи камеры SEM.
- Отрегулируйте полигональных моделей фрезерных адаптироваться к повернутой наконечника и повторите фрезерование под другим углом.
- Как только верхушка была заточена, чтобы быть менее 1 мкм, убрать нм и вставить иглу газовой системы впрыска (ГИС); переместить иглу быть около 1 мм над рабочей дистанции (вместо обычного 175 мкм).
- При использовании предшественника Pt, изменить его рабочую температуру до 24-26 ° C (вместо обычного 40 ° C). Эти шаги необходимы для крио-осаждения 13 Pt.
- Откройте камеру SEM и подготовить FIB / SEM для крио-режиме за счет установки на сцену образец крио и AC.
- Переключите NM на введенном положении и соединить свои косы Cu к AC. Убедитесь, что не случайно коснуться кончиком нм. Система охлаждения с NM вставлен, чтобы убедиться, что потеря гибкости оплетки Cu при криогенных температурах не будет препятствовать Н.М. ходМент.
- Продуть трубы для охлаждения с сухим газообразным азотом в течение нескольких минут.
- Насос препарат камеру крио и основную камеру с образцом в высоком вакууме.
- Добавить жидкий азот с сосудами Дьюара для охлаждения обеих палат. Подождите, пока желаемая температура не будет достигнута.
2. Образец Замораживание
- Установите два ПЭМ сетки для образцов FIB на держателе передачи SEM. Закрепите их, затянув соответствующие винты с помощью отвертки.
- Установите образец заглушки, подходящие для образца и добавить часть образца. В зависимости от типа образца, образец может быть установлена с криогенной клея или с помощью зажима. Используйте суммы как можно меньше, чтобы обеспечить оптимальную замерзания.
- Установите держатель передачи SEM на вакуумного переноса устройства (VTD).
- Добавить жидкий азот в промывочные станции и откачивают для получения азота слякоть.
- Откройте слushing станции и погружные заморозить держатель передачи SEM. Насос снова до кипения, пока не завершится и слякоть получается снова. Следует отметить, что этан или пропан шуга или замораживание высокого давления лучше подходят методы, чтобы получить витрификации образца.
- Уберите держатель передачи SEM в вакуумной камере ВТД и запечатать его.
- Удалить воздух из промывочные станции и крио подготовка камеры шлюз.
- Подходим печать VTD с шлюза на подготовку камеры крио и насосом.
- При достижении хороший уровень вакуума, участвовать в шлюзовую булавку, чтобы открыть печать ВТД и внешней шлюз; вставьте держатель передачи SEM. Есть маркировки на скользящих контактов в подготовке камер, обозначающих положение образца для распыления и трещин.
- При необходимости, образец может быть: перелом с холодным ножом; сублимированный, установив более высокую температуру (обычно -1006, С); покрыты Au / Pd или Pt путем холодной распылител (300 В, 10 мА, 60 сек в течение 2-3 нм Au / Pd крышки) *. Сублимация не должны использоваться для глазурованных образцов, чтобы избежать их перекристаллизации.
- Используйте холодную нож, чтобы открыть защитные крышки из пазов сетки ТЕА.
- Принесите холодной этап в камере пробы на высоту приемной (16 мм *).
- Выключите HT на FIB / SEM и откройте внутреннюю воздушную пробку.
- С помощью Vtd передавать держатель SEM в отборную камеру. Затемнение освещения в помещении может помочь в этом шаге.
- Как только держатель SEM находится в холодной стадии, расцепить Vtd, нажав и вращение.
- Уберите стержня Vtd всю дорогу в вакуумную камеру VTD и закрыть внутренний шлюз, внешний шлюз и печать VTD. Внешний шлюз теперь может выходить снять пломбу VTD. Этот последний шаг не требуется, но рекомендуется как стержень ВТД можно легко смещаются случайно, что может привести к повреждениюк ВТД или шлюза.
3. Ион фрезерные
- Включите высокой напряженности с обеих колонн и установить соответствующие параметры изображения (ускоряющее напряжение: 10 кВ для электронного пучка, 30 кВ для ионного пучка; размер пятна: 3; рабочее расстояние: 5 мм, текущие ионного пучка: 10-100 пА для работы с изображениями, 1-3 нА для фрезерования) *.
- С помощью электронного луча, чтобы найти функцию интереса и получать изображения для документирования состояния образца до экстракции пластинки.
- После того, как область интереса (ROI) для добычи был определен, отметьте его на ионного пучка паттерна, если топография самого образца не позволяет легко идентификации ROI даже после нанесения Pt. Для повышения точности, используйте метод, описанный Петтерссон и др. 14. Маркировка должна быть глубокой, широкой и достаточно далеко, чтобы быть до сих пор видны после того, покрываются осаждения крио-Pt (который не является Сельective и будет охватывать несколько мм 2 поверхности образца).
- Нагрейте газ предшественника до 24-26 ° С и вставьте ГИС иглу в высоту около 1 мм над поверхностью образца (см. также шаг 1.3).
- Хотя визуализации с электронным пучком, открыть газовый вентиль в течение нескольких секунд. Скорость осаждения крио-СТ 100-500 нм / сек или более, в зависимости от расстояния от ГИС иглы, образца шероховатости и системе пользователя. Желательно, чтобы запустить несколько тестовых показания для определения оптимальных параметров.
- Сырой осаждения крио-Pt очень грубо и неоднородным. Лечение депозита по ROI с помощью ионного пучка 1000 Па при малом увеличении (например 2000 X). В отличие от осаждения крио, это отверждения сайт селективный и должна быть выполнена только на рентабельности инвестиций. Цель этого первого крио-осаждения заключается в защите поверхности образца от повреждений ионного пучка и снизить curtaining в процессе ионного истончение 13.
- Наклоните образец52 ° так, чтобы поверхность была перпендикулярна ионного пучка. Mill далеко две террасы траншеи по обе стороны от ROI. Типичные размеры для окопах 20-30 мкм в направлении (X), параллельной пластинки, предназначенных для извлечения, 10-15 мкм в перпендикулярном направлении (Y) и с переменной, склоняя глубину (Z), с самой глубокой точке близко к ROI. Наклон должен быть 45-55 °. В некоторых инструментов, террасные траншеи можно измельчить только с самой глубокой точке на вершине. В таком случае, мельница один под ROI, затем поверните изображение на 180 ° и мельницы второй на другой стороне. Глубина фрезерования может быть выбран, если скорость распыления материала известно. Для большинства замороженных гидратированных образца, скорость распыления льда можно использовать 7.
- Наклоните образец обратно в 0 ° и использовать ионный пучок, чтобы срезать стороны и нижней стороне пластинки, убедившись, что вырезать знаки пройти весь ламели (они должны оставить фрезерные следы на террасах склонов мельницыред в предыдущем шаге). Оставьте только два маленьких мосты, соединяющие ламель с остальной частью образца.
- Вставьте иглу ГИС (это могут незначительно сдвинуть образец). Маневр NM, чтобы его конец не находится в физическом контакте с пластинки, предпочтительно на стороне. Убедитесь, что Н.М. не препятствуя при этом вид ионного пучка из двух небольших соединительных мостов.
- Откройте клапан ГИС в течение нескольких секунд и контролировать отложение крио непрерывной съемки с электронным пучком.
- Если дополнительный 1-2 мкм слой Pt был крио-хранение, закрыть клапан.
- Вылечить Pt (см. шаг 2.6) только в нескольких мкм вокруг точки, где Н.М. находится в контакте с пластинки.
- Используйте большой ток ионного пучка, чтобы сократить ламель бесплатно. Два соединительных мостов следует фрезерованием, а также любой избыток Pt, которые могут быть сформированы новые точки контакта между пластинки и остальной частью образца. Не убрать иглу ГИС еще.
- Осторожно маневрировать нм для извлечения ламель из траншей и переместить его по меньшей мере 500 мкм над поверхностью образца. Только после этого шага, убрать иглу ГИС.
- Опустите предметный столик несколько мм и не двигаться, пока один из ТЕМ сеток в поле зрения. Переместить область прикрепления на сетке в рабочее положение и вставить иглу ГИС.
- Тщательно маневрировать NM принести прилагаемый ламель в физический контакт с области крепления на ТЕА сетки. Там не должно быть никакого давления или трения между пластинки, ТЕА сеткой и Нью-Мексико.
- Откройте газовый вентиль в течение нескольких секунд и крио-депозита дополнительный 1-2 мкм слой Pt.
- Вылечить Pt (см. шаг 2.6) только в нескольких мкм вокруг точки контакта между ламелей и ТЕА сетки.
- Используйте большой ток ионного пучка, чтобы сократить ламель свободным от Нью-Мексико. Это может быть достигнуто путем измельчения в сторону либо наконечник нм или стороне образца. В тон первый случай, наконечник должны быть заточены снова до следующего использования, как описано на стадии 1.2.
- ДОПОЛНИТЕЛЬНО: на данном этапе можно использовать Vtd взять держатель передачи SEM и хранить его O / N в Дьюара с жидким азотом. Эта передача и O / N хранение может вызвать образование льда на поверхности пластинки, если кристаллы льда уже присутствуют и / или, если жидкий азот подвергается воздействию влажного воздуха; но такое загрязнение будут удалены следующий шаг в относительно короткий период времени. Как предыдущие шаги, возможно, взяли несколько часов, это может быть уместно сделать это, так как после следующей стадии такое хранение O / N не рекомендуется, так как не было бы никакой возможности, чтобы удалить загрязнения льда исключением сублимацией (который не может быть выполнена, если стеклования образца должна поддерживаться).
- Наклоните образец до 52 ° и использовать ионный пучок, чтобы он тонкий электрон прозрачности 7. Рекомендуется начать с высшего, Rougее токи пучка для удаления основной массы и перейти к тонкой полировки поверхности с более низкими токах пучка, в конечном счете также снижения ускоряющего напряжения. Конечная толщина пластинки должны быть 100-200 нм или меньше для анализа ультраструктуры в кВ ТЭМ 100-200 или до 500 нм для томографии в кВ ТЭМ 300, в зависимости от состава образца. Во время прореживания, внутренние напряжения образца может привести ламели свернуться или изгиб. В таком случае область разбавленной должен быть ограничен. Это произошло, например, в рисунках 11 и 12.
4. Крио Трансфер в TEM
- Промойте крио-передачи станции с сухим азотом в течение нескольких минут.
- Добавить жидкий азот в сосуд Дьюара ТЕА AC и в крио-передаточной станции.
- Вставьте держатель ПЭМ крио-передачи в соответствующий слот в крио-передаточной станции и заполнить его Дьюара, а также. Подождите, пока каждый компonent достигла желаемой температуры (около 15 мин). Если это возможно, контроллер держателя ПЭМ крио-передачи должен быть подключен для контроля температуры в процессе передачи. Важно понимать, что кончик держателя ТЕА (где датчик температуры расположен) будет находиться в контакте с крио-передаточной станции и, следовательно, будет остывать гораздо быстрее, чем остальной части держателя ПЭМ. Поэтому рекомендуется, что время, необходимое для всей крио-передачи держателя ПЭМ остынет есть предварительно измерить, и что система разрешается термализовать, по крайней мере, что количество времени.
- Заполните криогенную чашку с жидким азотом и погрузиться в нее: ТЕА образец зажимного инструмента, отвертки и пинцет, для того, чтобы остыть свои советы до нужной температуры. Все инструменты должны быть надежно изолированы на другом конце, чтобы не вызвать холодные ожоги руки оператора.
- Матч Vtd к внешнему шлюзу. Принесите холодной оленяэ с высотой переноса (16 мм *). Выключите высокую напряженность.
- Откройте печать VTD, внешний шлюз, а внутренний шлюз.
- Используйте стержень VTD заблокировать в держатель передачи SEM, нажав и вращая по часовой стрелке.
- Уберите держатель передачи SEM в крио подготовки камеры.
- Используйте холодную нож, чтобы закрыть защитные крышки ТЕА сетей. Это необходимо для уменьшения возможного загрязнения льда во время передачи.
- Используйте стержень VTD для перемещения образца в вакуумной камере ВТД.
- Закройте шлюзы и уплотнение.
- Vent внешний шлюз и отсоедините Vtd. Матч Vtd к порту SEM в крио-передаточной станции. В то время как промывка сухим азотом, используйте булавку на станции, чтобы открыть печать ВТД и сдвиньте держатель передачи SEM в дьюаре крио-передаточной станции.
- Добавьте достаточно жидкого азота так, чтобы уровень жидкости в крио-передаточной станции достаточно высокапросто погрузить образец.
- Используйте предварительно охлажденный отвертку, чтобы открыть одну из крышек и ослабить соответствующий винт, который держит ПЭМ сетку на месте.
- Используйте предварительно охлажденный пинцет, чтобы забрать ТЕА сетки и поместить его в держатель ПЭМ.
- Используйте охлажденного hexring для крепления ТЕА сетки на держатель ПЭМ.
- Закройте затвор держателя ПЭМ крио-передачи. Шаг передачи образец имеет решающее значение и может быть затруднено азота снижения заметности небольшой выборке ПЭМ.
- Отключите крио-передачи станции из насосной системы и транспортировать его рядом ТЕА вместе с нагревателем контроллера держателя ПЭМ крио-передачи.
- Запустите турбомолекулярным насос ТЕА накачать защитную линию к шлюзу ПЭМ.
- Установите этап образец ТЭМ к наклона * от -70 °.
- Установите наименьшее время накачки для шлюза (30-60 сек), и только один цикл продувки сухим азотом.
- Убедитесь, что защитная шторка на держателе ТЕМ крио-передачи закрыта. Снимите держатель ПЭМ от крио-передаточной станции и вставить его в наклонной гониометра (жидкий азот будет высыпался из держателя ПЭМ Дьюара). Цикл откачки начнется. После завершения цикла, установить гониометра, чтобы наклонить назад до 0 ° и, в то же время, удерживая держатель ПЭМ так, что она не вращается с гониометра. Вставьте ее полностью внутри ТЕА. На этом этапе, владелец ТЕМ крио-передачи должен быть подключен к ее контроллера нагревателя для контроля температуры. Процедура вставить держатель образца в ТЕА может варьироваться от различных TEMS. Поэтому рекомендуется обратиться к производителю ПЭМ получить соответствующую процедуру.
- Заполните крио-передачи держатель ТЕМ Дьюара. Подождите вакуума в ТЕА достичь приемлемого уровня.
Результаты
В этой работе мы использовали: двойной луч FIB / SEM, оснащенного наноманипулятора и крио-подготовки камеры; ТЕМ с держателем крио-передачи; прототип крио-передачи станции. Anticontaminator (АС) Лопасти крио-подготовки камеры и верхушка наноманипулятора (Нью-Мексико) были изменены Gatan. Что касается стандартного препарата крио-камеры, лопасти переменного тока больше, чтобы обеспечить больший теплоотвод для наконечника нм. Кроме того, AC оснащен зажимами для подключения косы Cu для теплообмена с наконечником нм. В пневматика о FIB / SEM были изменены, чтобы позволить Н.М. быть и оставаться вставленным даже когда образец камера вентилируется. Следует отметить, что параметры, используемые в данной работе лучше всего подходят для указанному выше оборудованию; эти параметры могут необходимо скорректировать при работе с другими типами оборудования. Для работы с этим протоколом, нормальные меры предосторожности при обращении криогенику, жидкий азот и вакуумные системы должныпоследует.
Метод был испытан на различных типах образцов с хорошими результатами, начиная от растворов или полимерных матрицах, содержащих наночастицы, чтобы одноклеточного организма к нематод. Примеры различных этапах процедуры показаны на рисунках 1-12 на А. Нигер споры окрашивали осмия и перманганата калия. Споры сначала изображается SEM (рис. 1), чтобы определить место для извлечения. В этом случае поперечное сечение любой спор был достаточен, но можно позиционировать ROI для экстракции суб-микронных точностью до, например, ломтик конкретную ячейку на определенном расстоянии от клеточной мембраны. После того, как функция представляет интерес был идентифицирован, первый этап осаждения крио-Pt реализуется (рис. 2), чтобы защитить образец от повреждений пучка от ионного травления. Наклона образца до 52 °, чтобы продолжить первых шагов Oе фрезерование (рис. 3): распыление двух траншей по обе стороны пластинки. Затем образец наклонена назад и дополнительно измельчить, чтобы оставить только два маленьких мосты, соединяющие его с навалом (рис. 4). Охлажденный наноманипулятора приводят в контакт с пластинкой (рис. 5), а другой крио-осаждени платины припои их вместе (рис. 6). Маленькие соединительные мосты затем измельчают, а до Н.М. перемещает ламель около области крепления ТЕА сетки (рис. 7), где она спаяна с окончательным крио-осаждения Pt (рис. 8). Н.М. затем отделяют от пластинки (рис. 9), который похудел с электрон прозрачности с ионного пучка (рис. 10 и 11). Пластинка, наконец, перевели в ТЕА (рис. 12), где высокое разрешение изображений, спектроскопии, томография и другие методы чан быть использованы.

Рисунок 1. Крио-РЭМ изображение спор А. Нигер, перед нанесением Pt.

Рисунок 2. Та же самая область на рисунке 1 после нанесения Pt но до отверждения.

Рисунок 3. Крио-РЭМ изображение той же области на рисунке 2, наклонена 52 º, после осаждения Pt и отверждения, с позиционной фрезерования ведутся(См. шаг 3.7).

Рисунок 4. Ламель, готов к подъемной отъезда.

Рисунок 5. Наконечник холодной наноманипулятора вступает в контакт с пластинки.

Рисунок 6. Вторая Pt крио-осаждения используется для пайки вместе наноманипулятор и ламель.
На рисунке 7. Холодный наноманипулятора используется для передачи ламель к области прикрепления ТЕА сетки.

Рисунок 8. Крио-осаждения используется еще раз, чтобы прикрепить ламель для ТЕА сетки.

На рисунке 9. Ламель разрезают свободным от наноманипулятора и он готов к любой хранения или истончение электронов прозрачности.

Рисунок 10. Промежуточный этап прореживания, с несколькими спорами видимых в поперечном сечении.

Рисунок 11 Крио-РЭМ-изображение образца после окончательного прореживания.; большинство других спор был быть фрезерованием, поскольку ламель начали скручиваться.
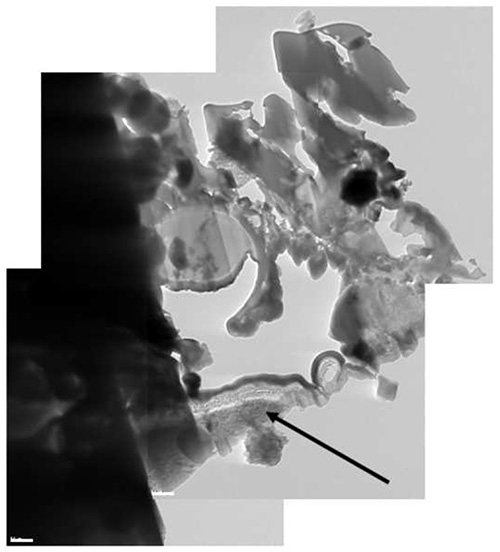
Рисунок 12. Составной крио-ПЭМ картину пластинки. Часть Аль заглушки был включенв ламели (черная стрелка).
Обсуждение
Этот протокол является довольно простой адаптации до криогенных температур стандартной пробоподготовки FIB / TEM, используемого в материаловедении при комнатной температуре. Метод производит образцы ПЭМ без механических деформаций и ножевых марок (Основным недостатком приготовление гистологических срезов), хотя curtaining может возникнуть, если поверхность образца неоднородна. Это может быть уменьшена путем крио-осаждения слоя (укупорки в этой работе был использован Pt), Обработанная, пока не будет гладкой и невыразительный 13. Образцы с компонентами очень различной твердости, могут быть получены также без риска, что они будут разрушить в условиях стресса в процессе приготовления. Внутренние напряжения могут вызвать еще тонкий пластинчатый согнуть или локон, и в этом случае размер секции должен быть уменьшен. Недостатком по сравнению с другими метода является возможность изменять биологическую структуру в результате воздействия ионного пучка и возможной имплантации ионов в образце. Эти недостатки также происходить при комнатной температуре в течение образца подгоAtion в материаловедении 15. Они могут быть снижены путем заполнения истончение с конечной стадии полировки на самом низком ускоряющем напряжении для ионов (500-1000 В). Это очень нежный шаг полировки удалит поврежденный слой из пластинки.
Из-за характера крио-осаждения (шаги 3,5, 3,10 и 3,13), большие части образца будет покрыта, тем самым препятствуя вид исходной поверхности. Это может затруднить отслеживать ROI, если несколько маркировка не используются, как это предлагается в пункте 3.3.
Во время шагов 4,5 и 4,7 тонкие пластинчатые рисков, которые соприкасаются с воздухом. Это должно быть избегать, так как это вызвало бы влагу в воздухе с образованием кристаллов льда на поверхности образца, возможно до точки скрывая важные особенности. Эти шаги должны быть выполнены как можно быстрее, но в то же время неправильное обращение во время передачи может привести к потере образца онсамостоятельно. Рекомендуется, чтобы пользователь практикует эти шаги, используя пустые ПЭМ сетки перед попыткой на реальном образце производится.
В материаловедения, FIB инструмент стал основным методом подготовки образца ТЕА в течение десятилетия ее коммерциализации. Поскольку он может быть использован практически на любого образца, это устраняет необходимость адаптировать технику подготовки к типу образца. Мы твердо верим, то же самое может произойти при криогенных температурах, благодаря методике, подробно описанной здесь. Его применение в более крупные образцы все еще является предметом способности крио-сохранить их в керамической государства, но методы, такие как погружной замораживания или высокого давления морозильные 3,5 может оказаться оптимальные пути решения этой проблемы.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Это исследование получило поддержку от Проекта QNano http://www.qnano-ri.eu который финансируется Европейским сообществом исследовательских инфраструктур в рамках Программы FP7 емкость (грант № INFRA-2010-262163).
Мы также благодарим исследовательский совет Formas за финансовую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Strata DB 235 | FEI | FIB/SEM | |
| Omniprobe 100 | Oxford Instruments | nanomanipulator | |
| Alto 2500 | Gatan | cryo preparation chamber | |
| cryo-holder model 626 | Gatan | cryo transfer TEM holder | |
| Tecnai F30 | FEI | TEM | |
Ссылки
- Echlin, P. . Low Temperature Microscopy and Analysis. , (1992).
- Rubino, S., et al. A site-specific focused-ion-beam lift-out method for cryo Transmission Electron Microscopy. J. Struct. Biol. 180, 572 (2012).
- Studer, D., et al. A new approach for cryofixation by high-pressure freezing. J. Microsc. 203, 285 (2001).
- Umrath, W. Cooling bath for rapid freezing in electron microscopy. J. Microsc. 101, 103 (1974).
- Walther, P. Recent progress in freeze-fracturing of high-pressure frozen samples. J. Microsc. 212, 34 (2003).
- Elder, H. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Cryo fixation. Techniques in Immunocytochemistry. , (1989).
- Giannuzzi, L. A., Stevie, F. A. . Introduction to Focused Ion Beams. , (2005).
- Marko, M., et al. Focused-ion-beam thinning of frozen-hydrated biological specimens for cryoelectron microscopy. Nat. Methods. 4, 215 (2007).
- Hayles, M. F., et al. The making of frozen-hydrated, vitreous lamellas from cells for cryo-electron microscopy. J. Struct. Biol. 172, 180 (2010).
- Rigort, A. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. J. Struct. Biol. 109, 4449-44 (2012).
- Hsieh, C., et al. Towards high-resolution three-dimensional imaging of native mammalian tissue: electron tomography of frozen-hydrated rat liver sections. J. Struct. Biol. 153, 1 (2006).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. J. Microsc. 131, 1 (1983).
- Hayles, M. F., et al. A technique for improved focused ion beam milling of cryo-prepared life science specimens. J. Microsc. 226, 263 (2007).
- Pettersson, H., et al. A method for producing site-specific TEM specimens from low contrast materials with nanometer precision. Microsc. Microanal. 19 (1), 73 (2013).
- Wätjen, J. T., et al. Cu out-diffusion in kesterites—A transmission electron microscopy specimen preparation artifact. Appl. Phys. Lett. Appl. Phys. Lett, 051902 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены