Method Article
エンジニアリング3D細胞化血管組織再生のためのコラーゲンゲル
要約
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
要約
合成材料は、血管の代替物として移植した場合、炎症、狭窄、および感染症のような臨床的合併症を開始することが知られています。コラーゲンは、広範囲の生物医学的用途の広い範囲で使用されていると、その固有の生体適合性( すなわち 、低い抗原性、炎症、および細胞傷害性応答)の合成材料への有効な代替手段と考えられています。しかし、限られた機械的特性およびコラーゲンゲルの関連低手能力は、血管組織工学のための足場材料としてのそれらの使用を妨げてきました。したがって、この作品の背後にある論理的根拠を扱うことに十分に硬い組織を得るために、コラーゲンマトリックスの再編成を駆動平滑筋細胞を強化するために管状幾何形状と第二に細胞化コラーゲンゲルを設計した最初の。
ここで説明する戦略は、3D cyli中のコラーゲンや平滑筋細胞の直接組み立て(構築)に基づいています成形技術を用いてndricalジオメトリ。このプロセスは、構築物は、1または2週間(印加された外部の動的な機械的な制約なしに)静的な条件下でバイオリアクターにおいて培養される間、成熟期間を必要とします。 「静的なバイオリアクターは、「構築物監視、制御無菌環境(pH、温度、ガス交換、栄養素の供給と廃棄物の除去)を提供します。培養期間の間に、厚さの測定は、コラーゲンマトリックスのセル駆動型リモデリングを評価するために行った、グルコース消費量および乳酸産生速度、細胞代謝活性をモニターするために測定しました。最後に、機械的および粘弾性特性は、得られた筒状の構築物について評価しました。この目的のために、特定のプロトコルおよび集束ノウハウ(ように操作、把持、水和環境で作業、および)が操作された組織を特徴付けるために開発されました。
概要
血管組織工学は、合成足場に基づいて移植片を含む操作された船の製造を目的とした様々な戦略、細胞シートベースの組織工学血管(TEBVs)、および細胞外マトリックス(ECM)成分をベースTEBVsを想定しています。これらのアプローチのうち、合成ポリマーは、良好な機械的特性を示すが、これらは生物活性を欠いている1として共通の欠点を共有します。細胞シートベースの方法は、高い機械的特性を有する操作された血管の代替物の生産を可能にするが、そのような移植片を生成するために必要な時間は、約28週2です。例えば、コラーゲン、エラスチン、フィブリン3またはそれらの組み合わせ、などのECMの天然の生体高分子は、組織工学の足場のためのゴールドスタンダード材料のまま。これは、主に機能的な細胞応答4-5を誘導することができながら、これらの材料は一般に良好な生体適合性を有することが理由です。これらの生体高分子のうち、S、I型コラーゲンは、皮膚、血管や腱などの多くの組織におけるECMの最も豊富で優勢な耐荷重タンパク質の一つです。大規模な作業は、コラーゲン6の機械的性質に行われている- 8が、静的な成熟中のコラーゲンゲルの細胞リモデリングにのみ少数の研究が行われています。細胞リモデリングは、コラーゲン原線維網9の安定性に影響を与える可能性が細胞によって誘発されるコラーゲンマトリックスの構造的修飾を指します。天然の骨格としては、I型コラーゲンの比較的大量には、ラット尾の腱10などの異なる供給源から単離され、滅菌および保存することができます。コラーゲンと細胞の相互作用と細胞化コラーゲン足場(構築物)の関連全体的な機械的挙動を理解することは、組織の構築に不可欠なステップです。コラーゲンベースTEBVs直接コラーゲンと細胞を混合することによって処理することができますゲル調製時に、さらに、このような筒状および平面11のような特定の形状に成形しました。ゲル内の血管細胞が増殖し、改造型は、私が12コラーゲン 。したがって、この方法は、組織工学用途のための足場の開発における重要な問題の一つを表し、特定のマクロ多孔性の必要性をバイパスします。しかし、コラーゲンゲルの主な欠点はそれらの低い機械的特性は、合成材料13と比較されます。
この研究では、細胞の均一な分布を有する生存組織は、1工程プロセスにおいて細胞とコラーゲンの直接混合することによって操作しました。 「静的バイオリアクター」は、(印加された外部動的機械的な制約なし)細胞化コラーゲンゲルの静的な成熟の1または2週間のために使用しました。培養中、コラーゲンマトリックスのリモデリングは、このように構築物の構造的補強を提供し、発生しました。また、これらの構築物は、rましたeady回転壁バイオリアクターに転送すると、均質な内皮を達成しました。また、この研究で特定の機械的試験のプロトコルは、管状の軟組織の機械的特性を特徴付けるに適切な新規のアプローチを提供することが提案されています。
要約すると、この作業は非常に重要であると考えられる生物学的および機械的特性評価のためだけでなく、動的なバイオリアクターのさらなる機械的条件付けのためだけでなく、取り扱いが十分強い血管組織のin vitroでの急速な製造および成熟のための方法を提示します組織の再生のステップ。
プロトコル
静的バイオリアクターの1作製とアセンブリ
- 貯水池の作製
- バイオリアクターのための培養培地リザーバーとして50mlの遠心チューブを準備します。
- それぞれ20底部からミリ、容器の上部にある2つの5ミリメートル径の穴を穿孔することによって2つのポートを作成します。その後、5ミリメートルの長さのシリコンチューブ内の2つのルアーフィッティングを挿入します。これらの貫通孔ルアーフィッティングを圧入し、医療グレードのシリコーン接着剤ですべての接続をシールします。
- リザーバ( 図1A)の上部ポートに、0.22μmのフィルターを挿入します。
- リザーバ( 図1A)の下部ポートにルアー隔壁を挿入します。
- マンドレルキャップアセンブリ
- 通気穴をカバーするフィルター膜を損傷することなく貯留管の換気キャップの中央に4.5ミリメートル径の穴を開けます。
- 攪拌棒(直径= 4.5ミリメートル、長さ= 100ミリメートルの準備)構築のためのマンドレルとして。
- 2シリコーン円錐ストッパー(長さ= 10ミリメートル、中央の穴の直径= 4.5 mm)を用意します。
- 図1Bに記載されているようにマンドレルとキャップ(マンドレルキャップ複合体)をアセンブルします。
- 穴にマンドレルを圧入。キャップはそれらの間に装着されているように、マンドレル上2ストッパーを挿入します。その有効長さが78ミリメートルであるように、マンドレルの位置を調整します。
- 一緒にキャップとシリコーンコニカルストッパーに参加する前に接触することになる表面にプライマー、その後、医療グレードのシリコーン接着剤を適用します。キャップ上の余分な接着剤を除去します。
- 1-3日間室温でそれが乾燥してみましょう。
- ガーゼ·グリップの作製
- 3シリコーンチューブ(:;:直径= 6.4ミリメートル、長さ= 10ミリメートル、チューブ3:直径= 3.1ミリメートル、長さ= 12ミリメートル管2の内径= 6.4ミリメートル、長さ= 5ミリメートル管1)を準備します。
- 説明するようにガーゼグリップを組み立て図1C中のd。
- カット管1長手方向に、チューブ2の上に、それを開いて、シリコーン接着剤で一緒にスティック。
- ×7センチシート5 cmの滅菌手術用ガーゼをカットし、その後、ガーゼの最も長い辺に沿ってチューブ3の上にしっかりとガーゼをロールバックします。ガーゼオーバーチューブ1チューブ2複合体を挿入します。
- 8mmの長さで一緒にガーゼ、チューブ1チューブ2複合体とチューブ3カットガーゼを固執するシリコーン接着剤を追加します。
- 組立と滅菌
- 図2で説明したようにマンドレルキャップ錯体とガーゼグリップを組み立てます。
- コート医療グレードグリース( 図2A)とマンドレル。マンドレル( 図2B)の上にガーゼグリップを置きます。互いから35ミリメートルの固定値でグリップを距離。
- (テーブルソー(最終長= 8 mm)を用いて10 mlシリンジの底部を除去することにより、筒状の金型を準備します図2B)。
- ガーゼグリップ付きマンドレルキャップアセンブリ(ハウジング金型複合体)を介して金型を挿入し、スナップフィット金型をシリコーン栓( 図2C)に。
- リザーバとハウジングモールド複合体をオートクレーブ。
注:その離脱を回避するために金型を挿入するときにしっかりとシリコン栓に保持するように注意してください。
- 図2で説明したようにマンドレルキャップ錯体とガーゼグリップを組み立てます。
2.エンジニアリング平滑筋細胞コラーゲンゲルベースの構築物および静的成熟
- エンジニアリング構築
- ダルベッコ改変イーグル培地からなる完全培養培地20mlを充填した175cm 2の培養フラスコ中で展開したブタ大動脈平滑筋細胞(pSMCs)を10%(v / v)のブタ血清(PS)、10%(V / Vを補っ)ウシ胎児血清(FBS)、1%(v / v)のペニシリン - ストレプトマイシン(ペニシリン - ストレプトマイシン)。
- ≈90%コンフルエンスで、から培地を除去することによりpSMCs(継代2-4)デタッチpSMCsのフラスコに、トリプシン溶液5ml(リン酸緩衝生理食塩水、PBS中に1×)を添加し、そして10分間(T = 37℃、5%CO 2、100%湿度)インキュベート。
- 完全培養培地中の4×10 6細胞/ mlの濃度で再懸濁しpSMCs。
- 以前に10を説明したように、コラーゲン溶液を調製します。
- 抽出し、PBS溶液中でラット尾の腱からコラーゲン束を集めます。
- 続いてアセトン(5分)にコラーゲン繊維を転送、イソプロパノール70%(v / v)の(5分)および酢酸(0.02 N、48時間、4℃)ソリューション。
- 3日間、-20℃で粘性液と凍結をブレンド。
- コラーゲンスポンジを得るために、凍結溶液を凍結乾燥。
- 45分間29581グラムの力で4グラム/ Lと遠心分離機の濃度の酢酸溶液(0.02 N)にコラーゲンスポンジを可溶化します。
- 後続のに対して透析プロセスを介してコラーゲン溶液を滅菌酢酸olutions(0.02 N、1時間)、クロロホルム、1%(v / v、1時間)および酢酸(0.02 N、滅菌溶液は、1週間ごと、2日に変更しました)。
- 滅菌細胞培養フードに無菌コラーゲン溶液(4グラム/ L)を収集します。
- 図3に示すように、セル化コラーゲンゲルを準備します。
- 滅菌脱イオン水8mlにDMEM(5×)35mlの、HEPES(N 1)4mlを、水酸化ナトリウム(1N)を3mlを混合することにより滅菌緩衝溶液50mlを調製します。
- 25%(v / v)の緩衝液、25%の無菌のコラーゲン溶液(酢酸を4g / L 0.02 N)から(v / v)の50%を混合し、氷中に入れ、容器内の細胞とコラーゲンゲル混合物を調製します(v / v)の完全培地中でpSMCsの懸濁液の。
- 混合物のpHを測定し、それが7.0と7.4の間であることを確認してください。
- 前述した住宅/金型複合体(ステップ1.4.3、 図3A-Bへの細胞·アンド·コラーゲン混合物の穏やか9ミリリットルを注ぎます)。
- それは、細胞培養フード( 図3B)の下で1時間、室温でゲル化してみましょう。
- 静的バイオリアクターでの成熟
- 培地( 図3D)の35ミリリットルを含む、金型( 図3C)を取り外し、リザーバーに慎重に構築物を転送します。
- 静的成熟の1又は2週間の垂直位置における構築物(T = 37℃、5%CO 2、100%湿度)でインキュベートします。
- 構築の前に、インキュベーター内の(絶縁性を確保するために密封された)ウェブカメラをインストールしてください。
- ルアーセプタムポートから古い培地を吸引し、新鮮な培養培地等量のリザーバを再充填することにより、2日ごとに培地を変更します。
- 静的培養中のSMC-コラーゲンゲルベースの構築物の厚さと代謝活性の測定
- 細胞cultuに走査型レーザー干渉計を配置フード再と精神レベルを使用して水平位置に対して垂直からそれを反転。
- 細胞培養フード内にバイオリアクターを移し、容器から構造体を除去します。
- レーザービームの経路に構築物(まだマンドレルに装着)を転送し、( 図4に示されるように)ビーム軸に対して厳密に直角に配置。
- 構築物の外径に対応する走査レーザ干渉計の画面に表示される値を読み取ります。
- (マンドレル直径すなわち )その外部と内部の直径に基づいて、構造物の壁の厚さを計算します。
注:最初の12時間2.3.5に2.3.1時間ごとに手順を繰り返して、その後、24時間ごと。 - 血液ガス分析器を用いて乳酸およびグルコース濃度を測定するために(培地を変更する際にサンプリングし、ステップ2.2.4)古い培養培地1mlを使用してください。
- 1mlのを使用しますグルコースおよび乳酸濃度の測定14のベースラインレベルとして新鮮な培養培地。
注:2日ごとに培地を交換した後、ステップ2.3.6と2.3.7を繰り返します。
- また機械的および生物学的Ccharacterizationsのための収穫を構築
- 静的成熟期間の1又は2週間後、細胞培養フードに静的バイオリアクターに移します。
- 新鮮な培養液の40ミリリットル( 図5と図7(a))を含む直径100mmのペトリ皿に静かにそのマンドレル( 補足ビデオ1)からの成熟コンストラクトを転送します。
縦方向および円周方向における構築物の3機械特性
- 5または10 NロードセルとAのサンプルを維持するための37℃でのPBSを含む浴を備えたマイクロメカニカルテスターからなる実験の設定をインストールしますT擬似生理的条件( 図6)。
- ロードセルと伸びのバランスをとります。
注:バランスには、サンプルを機械に搭載されていない中に表示拡張値と表示された荷重値をリセットすることからなるマイクロメカニカルテスターに統合機能です。この機能は、両方の測定のための基準を定義することができます。 - 縦方向:機械装置の上に筒状の構造をマウント。
注:直接全体の管状構築物の長手方向疲労試験を行います。ロードセルにし、PBS浴のベースに構築物のガーゼグリップを接続するために、社内で構築された把持装置を使用します。- 収穫手順(セクション2.4)以下、把持装置( 図7B)上に構築した管状をマウントします。
- テスト中にガーゼグリップの滑りを防止するために、テフロンテープと一緒に把持デバイスやガーゼグリップを包みます。マイクロメカニカルテスター( 図7C)上にサンプルをマウントします。
- 周方向:機械装置の上にリング状の構造体をマウント。
注:管状構築物から切断したリング状試験片の円周疲労試験を行います。試験片を保持するためにグリップのように2つのステンレス鋼棒を使用してください。- 管状の収穫(セクション2.4)は、次の5ミリメートルのギャップ( 図7B)、でマークされた支持体としてのプラスチックパイプの上に構築マウントします。
- 管状構造物から10mmのリングをカットします。
- さらなる分析のために、ノギスを用いて、試験片の長さを測定します。
- マイクロメカニカルテスター( 図7C)のステンレス鋼棒の上にリング状試験片をマウントします。バーの中央に試料を配置することを確認します。
注:プラスチックパイプをステップ3.4.1および切断システムの図7(b)に示すように切断時に構造物への損傷を回避するために使用されます。
- 長手方向又は周方向の構築物の疲労試験。
- その最初のゲージ長さに構築物をストレッチ。
- 擬似生理的環境下で10分間、この位置に構築物を維持します。
- 5%/秒のひずみ速度で構築への初期ゲージ長さ(30サイクル)の10%の環状の歪みを適用します。
- サンプルの失敗まで、10%の環状ひずみの増分ステップでステップ3.5.3を繰り返します。
注:擬似生理的環境の使用を考慮に浮力と負荷荷重の測定に影響を与える把持システムの慣性を取る必要があります。 - 次のように背景を記録します。
- 初期ゲージ長にロードフレームを移動します。
- マウントされているすべてのサンプルなしのステップ3.5.3と3.5.4を繰り返し、(唯一の1サイクルがrequiがあるロードセルに接続された把持装置を保ちます赤)。
構築物の4管腔内皮化
注:収穫プロトコル(セクション2.4)を実行した後、構築物はさらに内皮ための回転壁バイオリアクターに搭載されるの取り扱いに耐えます。
- 回転壁バイオリアクターデザイン
- 通気穴をカバーするフィルター膜を損傷することなく貯留管の換気キャップの中央に4.5ミリメートル径の穴を開けます。
- 穴にマンドレル(直径= 4.5ミリメートル、長さ= 40 mm)を押して、セットして、ステップ1.1.2で説明したようにマンドレルを修正します。
- コンストラクト外径= 14ミリメートルのための2つのC字型シリコーンサポートを準備し;内径= 8ミリメートル)。
- 位置、回転壁バイオリアクタの一端で回転モータともう一方の端の軸受( 図8B)。
- ルーメン内皮化
- 人間umbilicを展開10%(v / v)のPS、10%(v / v)のFBS、1%(v / v)のペニシリン-ストレプトマイシンを補充したM199培地5mlで25cm 2の培養フラスコ中のAl静脈内皮細胞(HUVEC) 90%のコンフルエンスまで培養器(T = 37℃、5%CO 2、100%湿度)の内部ペトリ皿中。
- 無血清内皮細胞培養培地中10.5 ng / mlでの濃縮タンパク質混合物を希釈することによって、最適な細胞接着のために必要な構築物あたりタンパク質コーティング溶液1.5mlを調製します。
- ノギスを使用して、構造物の長さを測定します。
- 管腔容積V及び構築物の管腔表面積Aを計算します のように:V =それぞれD、L 2、L / 4、A = D で ( 中 Dはマンドレル径に対応する内径であり、Lは、構造物の長さです)。
- 収穫手順(セクション2.4)以下の容器の中心に構造体を配置します。リザーバ( 図8A)に両端の構築物を固定するために使用するC字型シリコーンサポート。
- 培養液の35ミリリットルを有するリザーバを埋めます。
- ステップ4.2.2で調製したタンパク質コーティング溶液を用いて構築物(V)の計算された管腔体積の75%を満たします。タンパク質コーティング溶液( 図8A)の漏れを回避するために、構築物の末端の両方を閉じます。
- 細胞培養フードの内側に回転壁バイオリアクターシステムを組み立てます。
- 37℃のインキュベーターにバイオリアクターを配置し、 図8(b)に示すように管腔コーティングを可能にするために1時間4.02×10 -5グラムの力でバイオリアクターの回転を開始します。
- コンストラクトの上肢を開き、内腔からのタンパク質塗布液を吸引除去します。
- HUVECのフラスコから培地を除去し、トリプシン溶液(PBS中の1×)を3mlを添加することによりたHUVEC(継代2-3)を外し。私5分間(T = 37℃、5%CO 2、100%湿度)がncubate。
- 補充M199培地中に4×10 6細胞/ mlの濃度で再懸濁したHUVECを。
- 細胞培養フードの内部には、1,000細胞/ cm 2の15の密度を有する構築物の内腔にHUVECをシード。HUVECを液の漏れを回避するために、構築物の上肢を閉じます。
- 構築物をインキュベートする(T = 37℃、5%CO 2、100%湿度)4.02×10 -5グラムの力の一定の回転で2日間回転壁バイオリアクター( 図8B)、および培養物中にホストされています。
- 無菌状態での培養の2日後に構築物を収穫し、2.4節で説明したように、生物学的特徴付けのために準備をします。
結果
この作品は、血管細胞を含む操作された筒状のコラーゲンベースの構築物の製造を説明しています。すでに初期のゲル化の1時間後に、細胞 - 及び - コラーゲン混合物を直接(14ミリメートル程度)に対応する金型の直径に等しい外径を有する、3次元管状幾何形状に組み立てました。すべての静的成熟沿って、測定結果を表1に示すように、静置培養の1日後にその初期値の約60%の収縮細胞化コラーゲンゲルの直径を管状細胞化構造体の外径の急激な減少を明らかにし、そして7日( 補足動画2)内のほぼ85%。この現象は、非細胞化コラーゲン足場では発生しませんように構築物内のSMCは、縮小観察し、関連する機械的補強のために責任があります。任意のタイプ(熱的、生化学的、機械的、またはその他)のない勾配を適用しなかったことに注意してください。細胞ドライブnは圧縮は処理され、機械的な要請に征服され得るより大きなコラーゲン密度の材料が得られた( 補足動画3および4)。
全体的な機械的及び粘弾性特性に対する細胞ドリブン改造を関連付けるために、疲労試験は、構築物( 補足ビデオ5,6)上で実施しました。これらの試験は、異なる一定の株で構築物(30回)(10%、20%、及び初期のゲージ長さの30%)を循環し、経時的機械的要請にコンストラクトの応答としての応力を記録するために構成されていました。 1つの構築物のための代表的な結果を図9に示されている。同じひずみ範囲(30%歪み)を受けたとき構築物は、周方向(16キロパスカル)よりも長手方向(75キロパスカル)で高い応力に耐えました。一方、各サイクルにおいて、応力のピーク値がtaに達したためにrgeted最大ひずみは、時間の経過とともに減少しました。この現象は、これらのコラーゲンベースの構築物によって示される高い粘弾性特性の典型的なものです。
細胞化構築物の生物学的活性は、静的な成熟の間に評価しました。したがって、平滑筋細胞の代謝活性は、静置培養中にグルコース消費量と乳酸産生を測定することにより評価しました。培地を2日ごとに採取し、グルコース及び乳酸の濃度は、血液ガス分析装置を用いて測定しました。グルコース消費および構築物の重要な縮小に合わせた乳酸生産の一定の増加は、すべての静的培養物( 図10)に沿って平滑筋細胞の活性を証明します。
による細胞駆動改造に増加した機械的安定性は、構築物の操作およびその後の内皮プロセスを可能にしました。マッソンの三重染色は、内皮の構築物で実行しました非常に均質な内皮を示しました。 SMCのは、スピンドル状の形態を示し、HUVECををよく腔側( 図11)に広がって登場しながら均一に、壁を通って分散されたようでした。
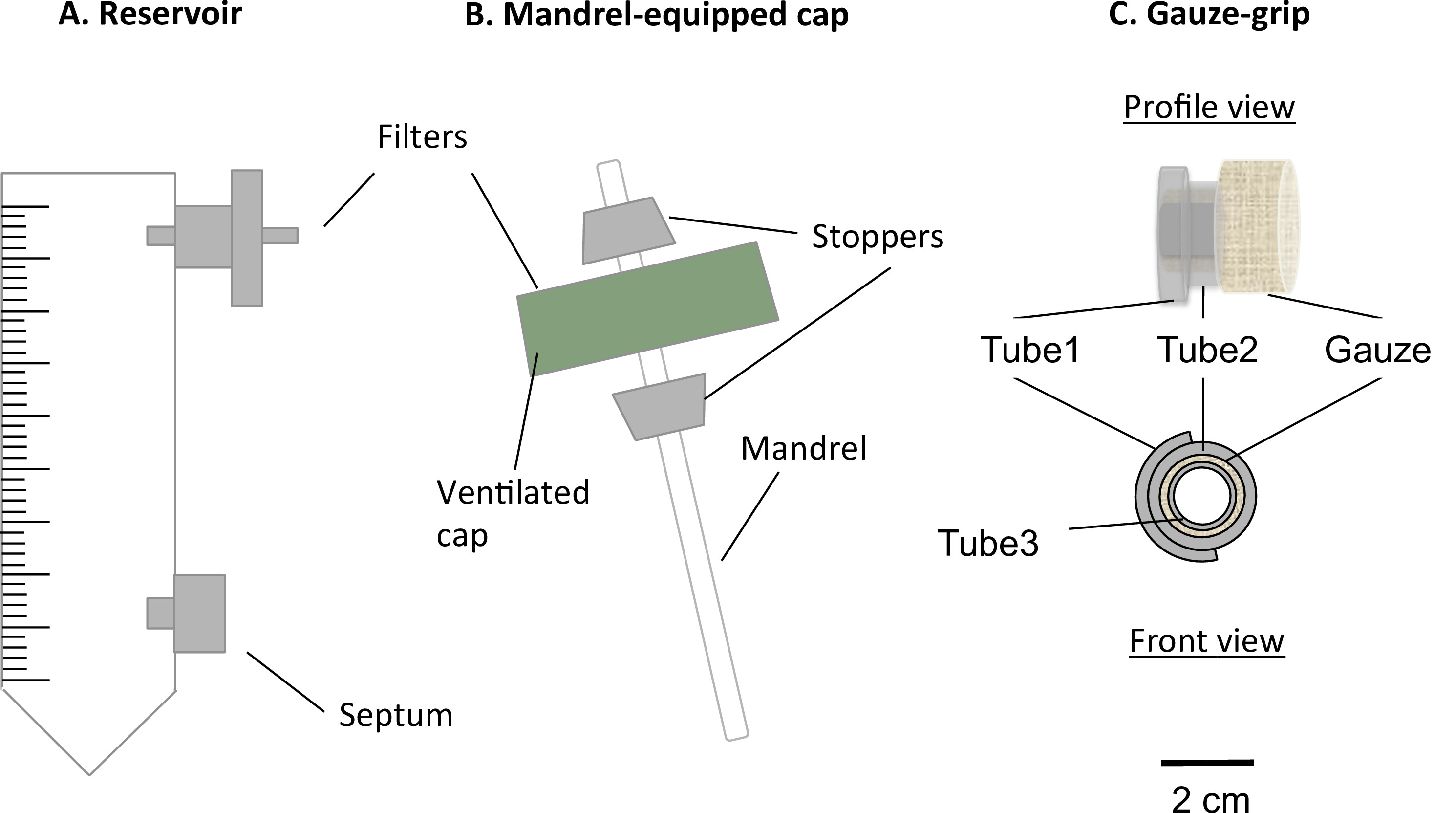
図1:静的バイオリアクターの構成要素は、静的バイオリアクターは、修正された50ml遠心チューブ(A)とマンドレル付きキャップ(B)から成ります。チューブは、媒体貯蔵を務め、中サンプリングおよび変更するため、ガス交換のための0.22μmのフィルター用のポート、および隔壁を備えました。換気キャップ内に存在するマンドレルは、筒状に構成物の製造を可能にしました。ガーゼ·グリップ(C)は、設計され、マンドレル上に構築物のゲル化をサポートするために作製しました。また、これらのグリップは、構築物は、静的な成熟後処理すると、機械的装置に固定することができました。マンドレルの外径4.7 mmでした。
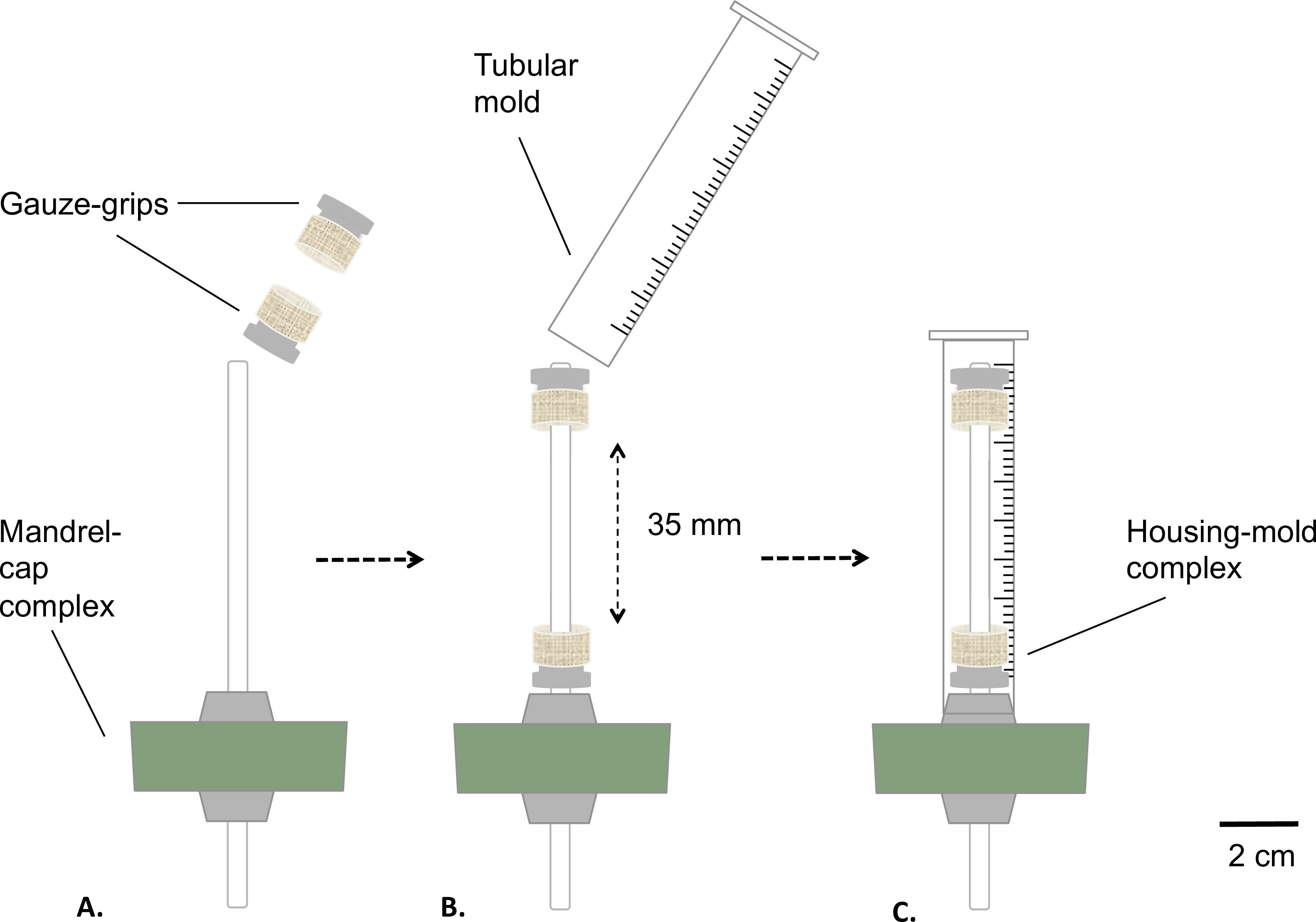
図2:静的バイオリアクターの組み立て滅菌前のバイオリアクターの位相を組み立てます。ガーゼ·グリップは固定された距離にマンドレル(A)上に載せました。金型は、(B)を挿入し、しっかりとシリコン栓(C)に固定しました。マンドレルの外径4.7 mmでした。
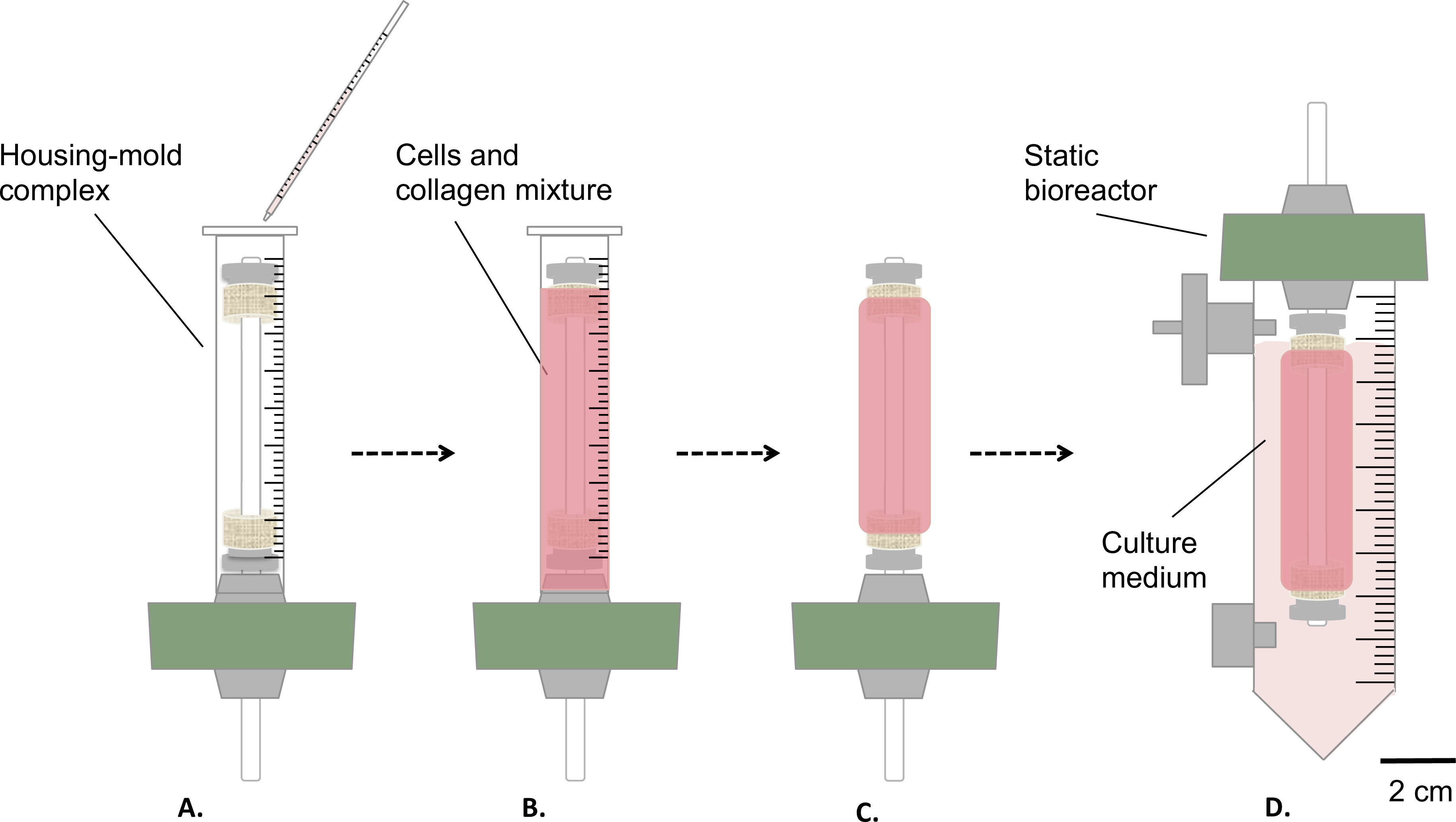
図3:無菌条件下での構築物の作製 、細胞およびコラーゲンの混合物をハウジング鋳型複合体に注ぎ (A)、室温(B)で1時間ゲルをしましょう。その後、金型は、(C)を除去し、静的なバイオリアクターは、(D)組み立てられ、インキュベーター内での構築物の静的成熟(T = 37℃、5%CO 2、湿度100%)のために、リザーバの内側に移しました。マンドレルの外径4.7 mmでした。

図4:構築物の厚さ/外径の測定はレーザー走査干渉計は、構築物の外径の測定を行いました。構築物は、レーザービームの経路に配置され、影を生成しました。影の幅は、構造物の外径に対応し、測定され、画面上に表示されました。

図5:2週間の静的成熟の間の細胞主導の再構築後の形態学的右ゲル化後に収穫し、構築物の外観(A)と(B)。

図6:機械的特性評価のための実験設定で5または10 Nロードセル擬似生理的条件下でサンプルを維持するために37℃でPBSを含有する浴を備えたマイクロメカニカルテスターから成ります。
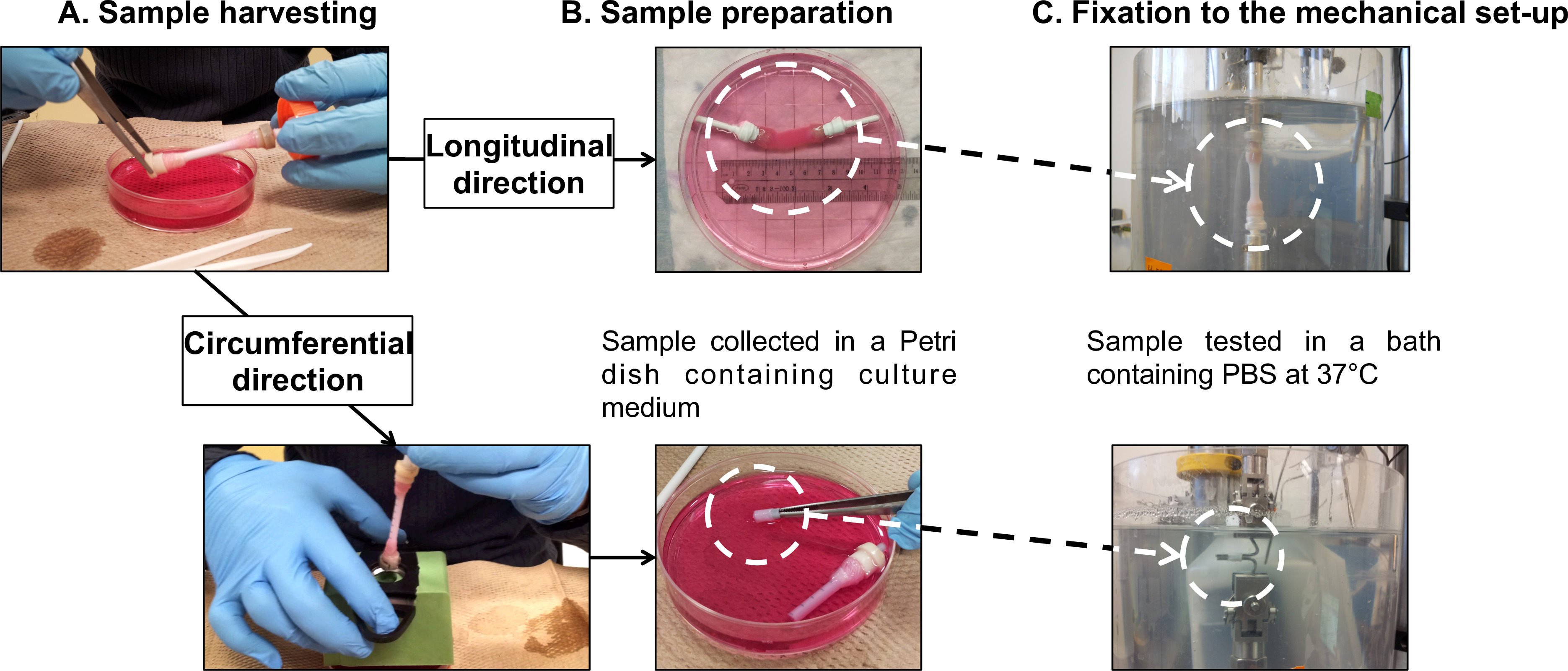
図7:サンプル調製のFまたは機械的な特徴付け。サンプル採取(A)及び疲労縦に実施された試験および円周方向(C)の準備(B)。マンドレルの外径4.7 mmでした。
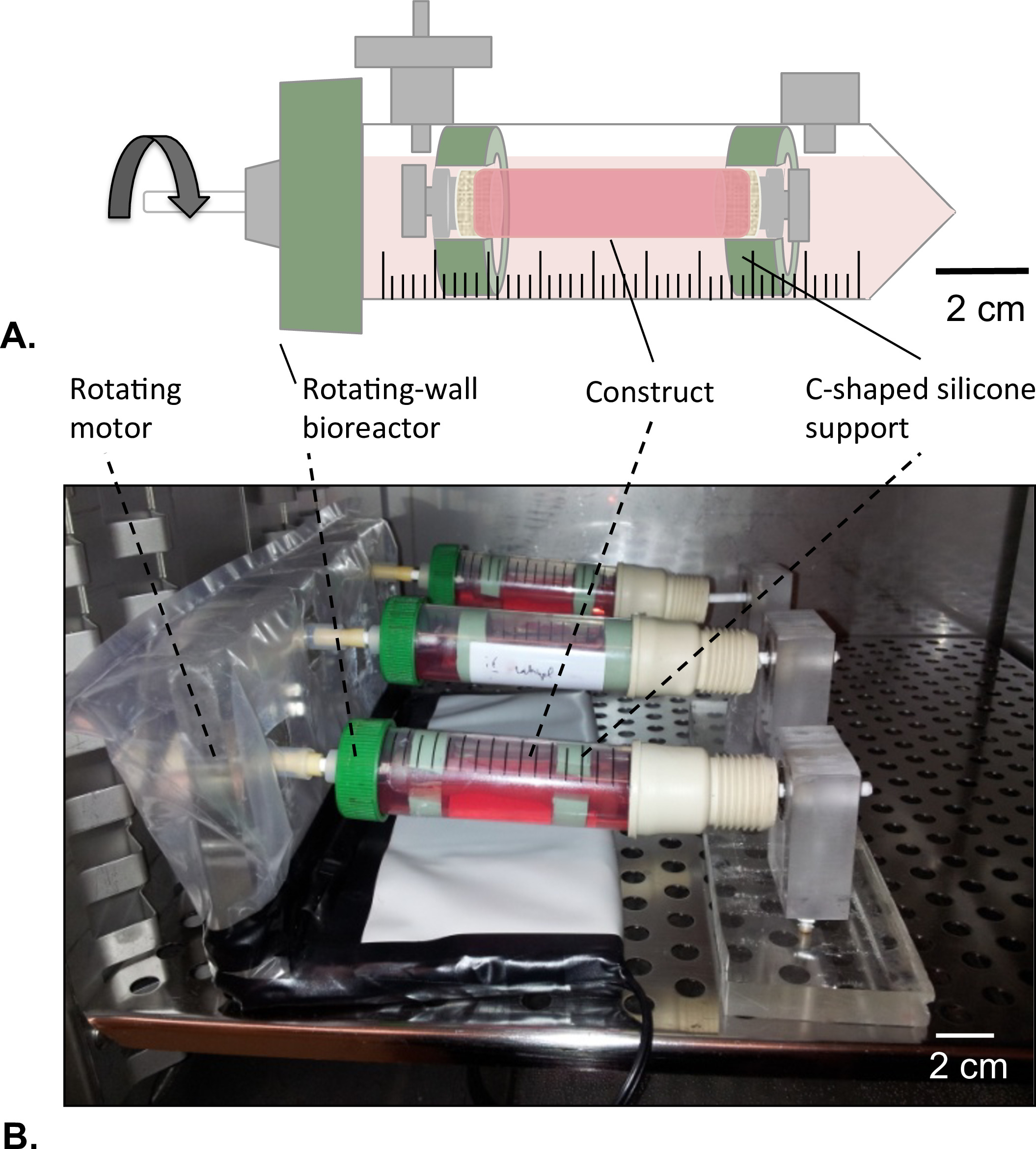
図8:回転壁バイオリアクタ(A)の管状構築物は、C字型シリコーンサポートの助けを借りて、リザーバの中心に組み立てました。構築物の末端の両方がHUVECを溶液の漏れを回避するために閉鎖されました。 (B)の構築物は、2日間4.02×10 -5 gの力で回転培養器(T = 37℃、5%CO 2、100%湿度)で培養しました。
2 / 52812fig9highres.jpg "幅=" 700 "/>
図9:機械的特性評価細胞駆動改造後の縦(A)中の構築と周(B)方向に行っ疲労試験の結果、この図の拡大版を表示するには、こちらをクリックしてください。
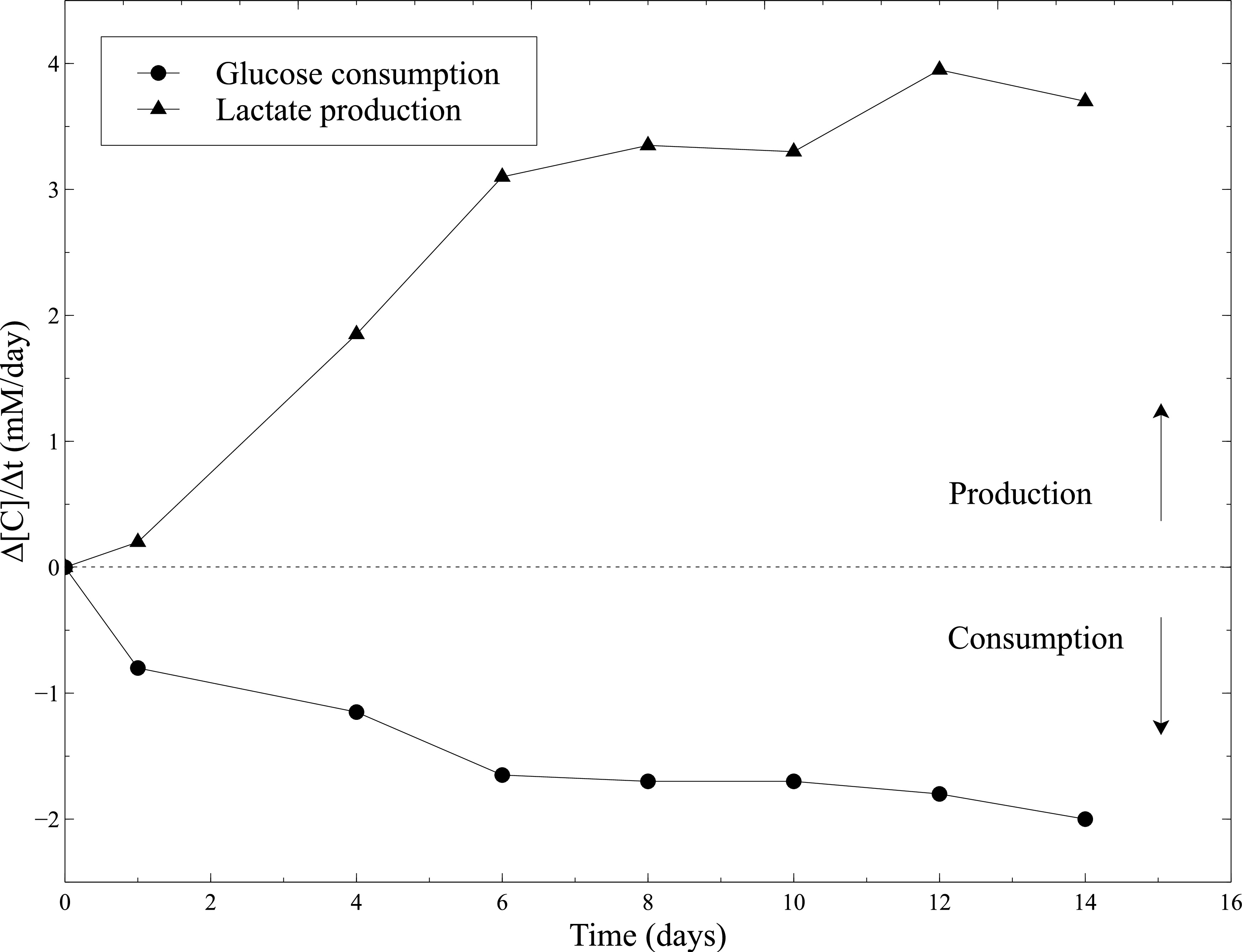
図10:コラーゲンゲル内でのSMCの代謝活性グルコース消費速度および乳酸生産速度の測定は、培地交換した後、2日ごとに血液ガス分析装置を用いて実施しました。新鮮な培養培地は、グルコースおよび乳酸の濃度測定のための基準レベルとして使用しました。
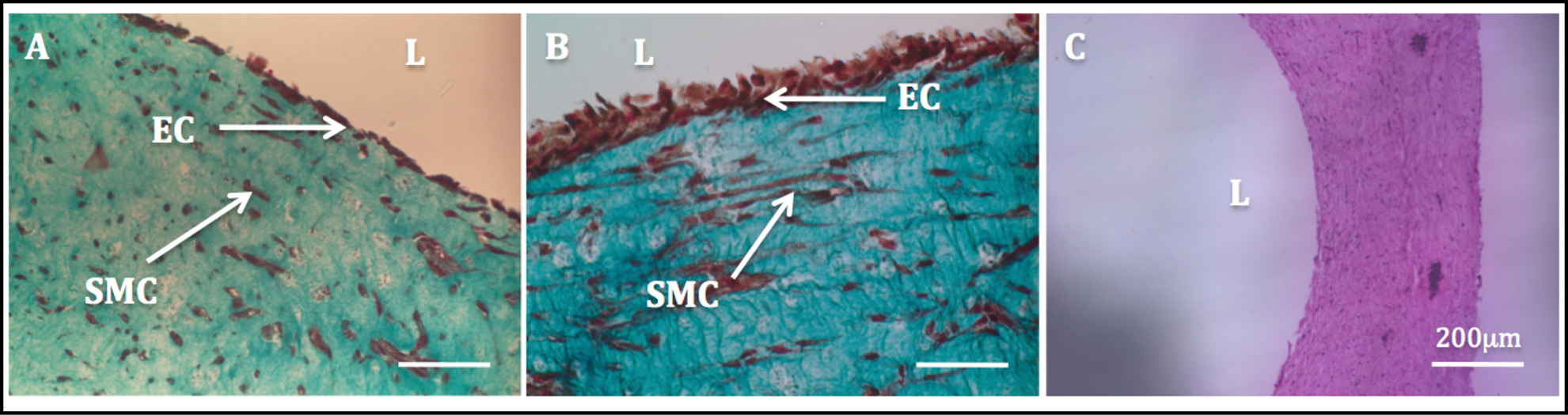
図11:ルーメンの内皮チューブ状構造体の径方向の断面の組織学的画像。管状構造体のマッソントライコーム染色は1週間(A)のために静的に培養し、2週間後(B)。管状構造体(C)のH&E染色。
| 時間 | 厚さ(mm) | 圧縮(%) |
| 0時間 | 4.83±0.02 | 0±0 |
| 2時間 | 4.26±0.02 | 12±0 |
| 4時間 | 4.21±0.03 | 13±1 |
| 6時間 | 4.06±0.10 | 16±2 |
| 12時間R | 3.16±0.07 | 35±1 |
| 1日 | 2.08±0.11 | 57±2 |
| 1週間 | 0.68±0.07 | 86±1 |
| 2週間 | 0.36±0.00 | 93±0 |
表1:静的な成熟の間の構造物の直径の急速圧密構築物の壁の厚さと静置培養の時間の関数としての圧縮率。圧縮は、走査型レーザ干渉計(シリーズ183B、LaserMike 136)を有する管状コンストラクトの外径を決定することによって測定しました。 24時間後、構築物は、57%への成形寸法の±2%に圧縮さ。データが表現され、平均±SD(n = 3)です。存在感とリビング平滑筋細胞の活性は、このような大きな変化のための唯一の責任がありました。
蘇pplementalビデオ1:非改造管状コラーゲンゲルの収穫は、 このビデオを見るにはこちらをクリックしてください。
補足ビデオ2:筒状のコラーゲンゲルの細胞主導の圧縮は、 このビデオを見るにはこちらをクリックしてください。
補足ビデオ3:非改造管状コラーゲンゲルの操作は、 このビデオを見るにはこちらをクリックしてください。
補足ビデオ4:細胞モデルチェンジ管状コラーゲンゲルの操作。 目を表示するには、こちらをクリックしてくださいビデオがあります。
補足ビデオ5:縦疲労試験(30%)の細胞モデルチェンジ管状コラーゲンゲル上で このビデオを見るにはこちらをクリックしてください。
補足ビデオ6:円周疲労試験(30%)の細胞モデルチェンジ管状コラーゲンゲル上で このビデオを見るにはこちらをクリックしてください。
ディスカッション
血管組織エンジニアのコミュニティの中でも、多大な努力が血管16の機械的安定性を担う中膜層を再現するために行われてきました。ワインバーグとベル17の先駆的研究以来、コラーゲンは広く、その生体適合性、非免疫原性と可用性の血管組織工学のための足場として使用されています。この材料は機械的剛性の固有の欠如に起因する、取り扱いが容易ではないしかし、コラーゲンの使用は、研究者にとって大きな課題です。足場の準備中の操作は、さらなる使用のためにそれらを犠牲に、足場を損傷する恐れがあります。
この作業に記載された技術は可能にする:i)は管状の形状に細胞化コラーゲンゲルを設計すること; ii)短い静的成熟期(1〜2週間)の後に処理されるのに十分に強い生体組織を設計する; III)と2方向のような管状の生体組織のSESの機械的および粘弾性特性。ゲル中の細胞は、コラーゲンマトリックスリモデリングにおいて重要な役割を果たす。熟成期間中、収縮性のSMCは、長手方向及び円周方向に評価することができ、より高い機械的安定性を有する構築物を得たゲルの圧縮をもたらしました。その後、HUVECを、したがって血管組織工学用途のためにコラーゲンゲルの適合性を実証し、均質な、生存内皮細胞を生成した構築物の管腔側に播種しました。
この研究で提示バイオリアクターは、具体的には、静的な成熟の間の細胞増殖のための最適な環境を提供するように設計されました。また、構築物の機械的及び粘弾性の特徴付けのために開発された装置は、操作に固有の任意の潜在的な損傷を低減する目的で設計されましたこのようなデリケートな素材。したがって、静的なバイオリアクターは、キャップの0.22μmフィルターとフィルター膜(ステップ1.1.2、 図1(a)の装備されていました およびB)無菌培養環境を維持しながら、培養リザーバ内の培地と培養器との間のガス交換を可能にしました。下部のルアーセプタムは、培地のサンプリング用ポートとして使用し、静的培養の間に変化しました。いくつかの重要なステップは、構築物の製造および特徴付けの際に考慮されなければなりません。システムの無菌性を変化させる可能性がある(ステップ2.1.1以降で実行される)すべての操作は無菌の生物学的フード内で行いました。細胞とコラーゲンゲル混合物の製造は、ゲル化プロセスを遅らせるために氷の上で処理された(2.1.7と2.1.4ステップ)。ステップ2.1.7では、ゲル化前に混合物中に閉じ込められた任意の気泡がsを損なう可能性が潜在的な応力集中領域であります構築物のtability。したがって、このような気泡の除去がわずかにアセンブリを振るか、無菌状態で脱気、3分間医療真空を使用する必要があります。最後に、グリップは、具体的には、ゲル化の間に筒状の金型内で、中心マンドレルの軸を維持するためと、(マンドレルの除去、セクション2.4)を収穫中の構築物の微妙な操作を可能にするため、内皮のために、およびへの実装を容易にするために設計されました機械システム(縦テスト)。
本プロトコルは、SMCの自然の固有の収縮の可能性に基づいて、コラーゲンゲル構造物の補強の元、簡単にプロセスの代替アプローチを提案しています。 20 -コラーゲンマトリックス強化材の一般的な技術は、細胞-マトリックス相互作用18に有害な影響を持つことができる物理的および化学的架橋剤の使用を含みます。に提示製造技術この作品は、任意の物理的又は化学的な処理をせずにターゲットを絞った機械的特性を有する組織工学構築物を得るために、この細胞主導のリモデリングプロセスを導くことができます。
水和コラーゲンゲルの機械的および粘弾性特性の特徴は、大きな課題です。この観点では、本プロトコルは、管状の軟組織の機械的特性を評価するための元のシンプルかつ効率的な方法を記載しています。この特徴付けは、直接全体管状構造に、周方向にも縦方向だけでなく行うことができます。機械的特性評価、温度、水性環境、pHおよびイオン強度の間大幅に生体組織21の機械的挙動に影響を及ぼすことが知られている環境要因の一部です。そこで、本研究は非常に生体組織の機械的特性評価のためのオリジナルのセットアップおよびプロトコルを提案します再現可能な擬似生理学的環境(37℃、pH7.4の食塩水)。我々の知る限り、特性のこの種は、他の場所で報告されていません。
結論として、本研究で提案された技術は、血管組織工学用途のためのコラーゲンと細胞の直接混合の高い可能性を示しています。機械的特性評価および内皮化プロセスと一緒に、この方法は、高多価のプロトコルを構成しています。したがって、同一の原理を維持しながらセットアップおよびプロトコルのわずかな改変を通して、工学血管組織等価物のための主な要件は、内皮化を含め、そのような迅速かつ単純な処理としてアドレス指定することができ、そして可能性がソフトの広範囲に転置します様々な長さと直径を有する組織。また、別の接着細胞タイプ、ECMタンパク質、成形形状は、標的アプリケーションシートの数を調査することができます例えば、特に工学腱、皮膚移植片、心臓パッチ、神経などのアドオン、。構築物の機械的特性は有望であるが、それらは、天然の組織のものよりも依然として低いです。この文脈において、我々は強く、非常に短い静的熟成期間がより高い構造的完全性および機械的安定性につながる、バイオリアクターへの動的な刺激に向けた重要なステップであると信じています。しかし、可能性は急速に機械的に適した組織工学細胞化コラーゲンベースの構築物を生成することが、組織学的、成長およびリモデリング、さらにはに間に細胞とECMの間の相互作用への洞察を提供するために有用であり、有望なツールは、本明細書に説明した静的バイオリアクターを作る分析します治療および薬物送達システムのためのモデルとして使用することができます。
開示事項
いいえ資金は利益の潜在的な対立を持つ組織や機関から受信されませんでした。
謝辞
この研究は、自然科学とカナダの工学研究評議会、ヘルスリサーチのためのカナダの研究所CHUケベック研究センターによって資金を供給されました。
資料
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
参考文献
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved