Method Article
Vasküler Doku Rejenerasyon için Mühendislik 3D cellularized Kollajen jeller
Bu Makalede
Özet
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
Özet
Sentetik malzemeler vasküler ikame olarak implante bu tür iltihap, stenoz ve enfeksiyonlar gibi klinik komplikasyonları başlatmak bilinmektedir. Kollajen nedeniyle doğal biyouyumluluk için yoğun biyomedikal uygulamalarda geniş bir yelpazede kullanılmaktadır ve sentetik malzemeler için geçerli bir alternatif olarak kabul edilir (yani, düşük antijenikliği, enflamasyon ve sitotoksik tepkiler). Ancak, sınırlı mekanik özellikleri ve kollajen jelleri ile ilgili düşük el becerisi vasküler doku mühendisliği için iskele malzemesi olarak kullanılmasını engellemiştir. Bu nedenle, bu işin arkasındaki mantık düz kas hücreleri ele alınması için yeterince sert dokuları elde etmek için kollajen matriks tahrik yeniden yapılanma geliştirmek için bir boru biçimli geometri ve ikinci içine cellularized kollajen jeller mühendislik için ilk oldu.
Burada tarif edilen bir strateji, bir 3D cyli kolajen ve düz kas hücreleri (yapı) doğrudan montaj dayanırbir kalıplama tekniği ile ndrical geometri. Bu işlem, 1 ya da 2 hafta içinde (uygulanan dış dinamik mekanik kısıtlama olmaksızın) yapılan, statik koşullar altında bir biyoreaktörde kültürlenir ve bu süre zarfında olgunlaşma süresi gerektirir. "Statik biyoreaktör" yapılara izlenen ve kontrol edilen steril ortam (pH, sıcaklık, gaz değişimi, besin temini ve atık uzaklaştırma) sağlar. Kültür döneminde, kalınlık ölçümleri kollajen matriks hücreleri odaklı biçimlenme değerlendirmek için yapıldı ve glukoz tüketim ve laktat üretim oranları hücreler metabolik aktivitesini izlemek için ölçüldü. Son olarak, mekanik ve viskoelastik özellikleri elde edilen boru şeklinde yapılar için değerlendirildi. Bu amaçla, belirli protokoller ve odaklanmış bir know-how (manipülasyon, böylece, kavrama hidrate ortamında çalışan ve) için tasarlanmış dokuları karakterize etmek geliştirilmiştir.
Giriş
Vasküler doku mühendisliği iskeleleri sentetik hücre sac tabanlı doku mühendisliği kan damarları (TEBVs) ve hücre dışı matriks (ECM) dayalı greft dahil mühendislik damarların imalat, amaçlayan farklı stratejiler bileşenleri tabanlı TEBVs öngörülüyor. Bu yaklaşımlar arasında, sentetik polimerler, iyi mekanik özellikler göstermektedir, ancak biyo-1 eksikliği gibi ortak bir dezavantajı paylaşmaktadırlar. Hücre levha esaslı yöntem, yüksek mekanik özelliklere sahip mühendislik damar ikame üretimine izin verir, ama bu tür greft üretmek için gerekli süre yaklaşık 28 hafta 2 olduğunu. Örneğin kolajen, elastin, fibrin 3 ya da bir kombinasyonu gibi ECM doğal biyopolimerler, bunların doku mühendisliği iskeleleri için altın standart malzemelerdir. Bu öncelikle fonksiyonel hücresel yanıtları 4-5 uyardığı mümkün olurken, bu malzemeler genellikle iyi biyouyumluluk sahip bu nedenle içindir. Bu biyopolimeri arasındas, tip I kollajenin, deri, kan damarları ve tendon gibi birçok dokuda ECM'nin en bol ve baskın yük taşıyan protein biridir. Kapsamlı çalışma kollajen 6 mekanik özellikleri üzerinde yapılmıştır - 8, ama statik olgunlaşma sırasında kollajen jeller hücresel yeniden sadece birkaç çalışma olmuştur. Hücresel yeniden şekillenme kollajen fibrilleri ağı 9 istikrarını etkileyebilecek hücreleri tarafından uyarılan kollajen matriks yapısal değişiklikler anlamına gelir. Doğal bir iskele olarak, tip I kolajen, nispeten büyük miktarlarda, izole sterilize edildi ve bu sıçan kuyruğu tendon 10 gibi farklı kaynaklardan saklanabilir. Kollajen ile hücresel etkileşimleri ve cellularized kollajen iskeleleri (yapıları) ilgili genel mekanik davranışları anlama dokuların yapımı için önemli bir adımdır. Kolajen esaslı TEBVs doğrudan kolajen ile hücreleri karıştırılarak işlenebilirJel hazırlanması ve bundan başka, boru şekilli kısım ve düzlemsel 11 gibi belirli şekiller halinde kalıplanır. Jeller içinde Vasküler hücreler çoğalmaya ve şeklini tip I kollajenin 12. Böylece, bu yöntem doku mühendisliği uygulamaları için iskelelerinin gelişiminde önemli konulardan birini temsil belirli Makroboşluk ihtiyacını atlar. Ancak, kolajen jellerin önemli dezavantajları, düşük mekanik özellikleri, sentetik malzeme 13 ile karşılaştırıldığında bulunmaktadır.
Bu çalışmada, hücrelerin homojen dağılımı olan canlı bir doku, bir tek-aşamalı bir işlemde hücreleri ile kollajen doğrudan karıştırılması ile işleme sokuldu. "Statik biyoreaktörler" (uygulanan dış dinamik mekanik kısıtlama olmaksızın) cellularized kollajen jel statik olgunlaşma 1 ya da 2 hafta içinde kullanıldı. Kültür sırasında, kolajen matris yeniden modellenmesi ve böylece yapıların yapısal takviye sağlamaktadır oluştu. Bundan başka, bu yapılar, sırasıyla sağeady bir döner duvar biyoreaktöre transfer edilmesi ve homojen bir endotel elde edilmiştir. Buna ek olarak, bu işin belli bir mekanik test protokolü de boru şekilli yumuşak dokuların mekanik özelliklerini karakterize uygun yeni bir yaklaşım sağlamak için önerilmiştir.
Özet olarak bu çalışma, in vitro, hızlı imalat ve biyolojik ve mekanik özellikler, aynı zamanda, bir çok önemli kabul edilen dinamik biyoreaktör içinde başka bir mekanik havalandırma için sadece ele alınması için yeterince güçlü olan vasküler dokuların olgunlaşma için bir yöntem sunulur dokuların yenilenmesine adım.
Protokol
Statik Bioreactor 1. İmalat ve Montaj
- Rezervuar Fabrikasyon
- Bioreaktör olarak bir kültür ortamı rezervuarı olarak 50 ml santrifüj tüplerine hazırlayın.
- Sırasıyla 20 mm ve alttan rezervuarın üst kısmında iki adet 5 mm çapları delik iki portları olun. Sonra 5 mm uzunluğunda silikon tüpler iki luer parçaları yerleştirin. Deliklerden bu diş tertibatları Basın-sığdırmak ve tıbbi silikon yapıştırıcı ile tüm bağlantıları kapatın.
- Rezervuar (Şekil 1A) üst bağlantı noktasına bir 0.22 mikron filtre yerleştirin.
- Rezervuar (Şekil 1A) alt portuna bir luer septum yerleştirin.
- Mandrel-cap Meclisi
- Havalandırma delikleri kapsayan filtre zarına zarar vermeden rezervuar tüp havalandırmalı kapak merkezinde 4.5 mm çapında bir delik delin.
- Bir karıştırma çubuğu hazırlayın (çap = 4.5 mm, uzunluk = 100 mm) Yapısı için, bir mandrel olarak.
- İki silikon konik tıpa (uzunluk = 10 mm, orta delik çapı = 4.5 mm) hazırlayın.
- Şekil 1B açıklandığı gibi mili ve kapak (mandrel kapak kompleksi) birleştirin.
- Deliğe mandrel basın-uyacak. Kapak aralarında takılmıştır böylece mandrel üzerinde 2 Stoper takın. Onun kullanışlı uzunluğu 78 mm olacak şekilde mandrel konumunu ayarlayın.
- Birlikte kapağı ve silikon tıpa konik katılmadan önce temas olacak yüzeylere bir astar ve ardından tıbbi silikon tutkal sürün. Kap aşırı tutkal çıkarın.
- 1-3 gün boyunca oda sıcaklığında kurumaya bırakın.
- Tül-sardı Fabrikasyon
- 3 silikon tüpleri (:;: çap = 6,4 mm, uzunluk = 10 mm ve tüp 3: çap = 3.1 mm, uzunluk = 12 mm boru iç çapı 2 = 6.4 mm, uzunluk = 5 mm boru 1) hazırlayın.
- Tarif olarak gazlı-saplar birleştirinŞekil 1C, d.
- Kesimli tüp 1 uzunlamasına, tüp 2. üzerinde açmak ve silikon yapıştırıcı ile birbirine yapıştırın.
- 5 cm x 7 cm levha steril cerrahi gazlı bez kesin ve ardından gazlı bez uzun kenarı boyunca tüp üzerinde 3 sıkıca gazlı bez rulo. Gazlı bez üzerine tüp 1 tüp 2 kompleksinin yerleştirin.
- 8 mm'lik bir uzunlukta bir araya gazlı bez, tüp 1 tüp 2 kompleksi ve borusu 3. Kesme gazlı sopa silikon yapıştırıcı ekleyin.
- Montaj ve Sterilizasyon
- Şekil 2'de tarif edildiği gibi mandrel kap kompleksi ve gazlı-kulpları bir araya getirin.
- Coat tıbbi sınıf gres (Şekil 2A) ile mandrel. Mandrel (Şekil 2B) üzerinden gazlı-kulpları yerleştirin. Birbirinden 35 mm sabit değerde kulpları mesafe.
- (Bir tablo gördüm (son uzunluk = 8 mm) kullanılarak 10 ml şırınga alt kısmını kaldırarak bir boru şeklinde kalıp hazırlayın Şekil 2B).
- Gazlı bez sardı donanımlı mandrel kapak takımı (konut-kalıp kompleksi) üzerinde kalıp yerleştirin ek uyan silikon tıpa (Şekil 2C) kalıp.
- Rezervuar ve konut-kalıp kompleksi otoklavlayın.
Not: kendi dekolmanı önlemek için kalıp eklerken sıkı silikon tıpa üzerinde tutmak için dikkatli olun.
- Şekil 2'de tarif edildiği gibi mandrel kap kompleksi ve gazlı-kulpları bir araya getirin.
2. Mühendislik Düz Kas Hücre Kolajen Jel tabanlı Yapılar ve Statik Olgunlaşma
- Mühendislik Yapıları
- Dulbecco Modifiye Edilmiş Eagle Ortamı oluşan tam kültür ortamı içinde, 20 ml dolu 175 cm2 kültürü şişelerinde aç domuz aortik düz kas hücreleri (pSMCs),% 10 (hac / hac), domuz serumu (PS),% 10 (h / h ile desteklenmiş ) cenin sığır serumu (FBS),% 1 (h / h), penisilin-streptomisin (LTR yükseltici) durumunda.
- ≈90% konfluansa de, kültür ortamı kaldırarak pSMCs (geçit 2-4) ayırmakpSMCs bir şişeye, tripsin çözeltisi 5 ml (fosfat tamponlu tuz çözeltisi içinde 1 x PBS) eklenerek ve 10 dakika (T = 37 ° C,% 5 CO2,% 100 nem) inkübe.
- Tam kültür ortamı içinde 4 x 10 6 hücre / ml'lik bir konsantrasyonda yeniden süspanse pSMCs.
- Daha önce açıklandığı gibi 10 kollajen çözeltisi hazırlayın.
- Özü ve bir PBS çözeltisi içinde sıçan kuyruğu tendonları kolajen demetleri toplamak.
- Aseton (5 dakika), izopropanol 70% (v / v) (5 dakika) ve asetik asit içine, daha sonra kolajen liflerinin aktarın (0.02 N, 48 saat, 4 ° C) çözümler.
- 3 gün -20 ° C'de viskoz bir çözelti ve dondurma karıştırın.
- Kollajen sünger elde edilmesi için dondurulmuş çözelti liyofilize.
- 45 dakika boyunca 29.581 g kuvvetinde 4 g / L ve santrifüj bir konsantrasyonda asetik asit solüsyonu (0.02 N) kollajen süngerler çözünürleştirilir.
- Daha sonra s karşı diyaliz işlemi boyunca kollajen solüsyonu sterilizeasetik asit Çözeltileri (0.02 N, 1 saat), kloroform,% 1 (h / h, 1 saat) ve asetik asit (0.02 N, steril bir çözelti, 1 hafta boyunca her 2 günde bir değiştirilmiştir).
- Steril hücre kültürü başlığı içinde steril bir kolajen çözeltisi (4 g / L) toplayın.
- Şekil 3'te gösterildiği gibi, cellularized kolajen jellerin hazırlanması.
- Steril deiyonize su, 8 ml DMEM içinde 35 ml (5x), HEPES (1 H) 4 ml, NaOH (1 N) 'nin 3 ml karıştırılarak steril tampon çözeltisi 50 ml hazırlayın.
- Tampon çözeltisi ve% 25 (hac / hac)% 25 (h / h), steril kolajen çözeltisi (asetik asit 0.02 N 4 g / L),% 50 karıştırarak buz yerleştirilmiş bir kap içinde hücreleri ve kollajen jel karışım hazırlayın (h / h) kadar tam kültür ortamı içinde pSMCs süspansiyon.
- Karışımın pH değeri ölçülür ve bu 7.0 ile 7.4 arasında olmasını sağlar.
- Yukarıda belirtilen konut / kalıp kompleksinin (adım 1.4.3, Şekil 3A-B içine hücreleri ve kollajen karışımı hafifçe 9 ml dökün ).
- Bu hücre kültürü kaputu (Şekil 3B) altında 1 saat süre ile, oda sıcaklığında jel olsun.
- Statik Biyoreaktör içinde Olgunlaşma
- Kültür ortamı (Şekil 3D), 35 ml içeren, kalıp (Şekil 3C) çıkarın ve rezervuar içine dikkatli bir şekilde yapı aktarın.
- Statik olgunlaşma 1 ya da 2 hafta boyunca dikey konumda yapı (T = 37 ° C,% 5 CO2,% 100 nem) inkübe edilir.
- Yapının önündeki inkübatör içinde (yalıtımı sağlamak amacıyla mühürlü) bir web kamera takın.
- Diş septum bağlantı eski ortamın aspire ve taze kültür ortamına ait eşit bir miktarı ile hazne yeniden doldurarak her 2 günde bir kültür ortamı değiştirin.
- SMC'lere-kollajen kalınlığı ve Metabolik Faaliyet ölçümü Statik Kültürü sırasında Constructs Jel bazlı
- Hücre kültürlerdeki içine tarayıcı lazer interferometre yerleştirinKaputu yeniden ve bir su terazisi ile yatay konuma dikey çevirin.
- Hücre kültürü kaputu içine biyoreaktör aktarın ve depodan yapıyı kaldırmak.
- Lazer ışınının yolağına yapı (hala mandrel üzerine monte edilmiş) aktarın ve (Şekil 4'te gösterildiği gibi) ışın eksenine göre sıkı bir şekilde dikey olarak yerleştirin.
- Yapının dış çapına karşılık gelen tarama, lazer interferometrenin ekranda değeri okuyun.
- Dış ve iç çapı (mandrel çapı yani) esaslı yapının duvar kalınlığı hesaplayın.
Not: İlk 12 saat ve daha sonra her 24 saat için her saat 2.3.5 için adımları 2.3.1 tekrarlayın. - Kan basıncı analiz aygıtında laktat ve glukoz konsantrasyonlarının ölçülmesi için (kültür ortamının, aşama 2.2.4 değiştirirken örneklenen) eski kültür ortamının 1 ml kullanın.
- 1 ml kullanınglikoz ve laktat konsantrasyonları ölçümlerde 14 için temel seviyede taze kültür ortamı.
Not: adımları 2.3.6 ve kültür ortamı değişen sonrasında 2.3.7 2 günde tekrarlayın.
- Daha fazla mekanik ve biyolojik Ccharacterizations için Hasat Construct
- Statik olgunlaşma süresinin 1 ya da 2 hafta sonra, hücre kültürü davlumbaz içine statik biyoreaktör aktarın.
- Taze kültür ortamı içinde 40 ml (Şekil 5 ve Şekil 7A) ihtiva eden bir 100 mm çapında Petri kabı yavaşça mandrel (Ek Video 1) olgun yapısı aktarın.
Boyuna ve çevresel Directions Yapıların 3. Mekanik Karakterizasyonu
- Numuneler, bir tutmak için, bir 5 ya da 10 N yük hücresi ve 37 ° C 'de PBS içeren bir banyo ile donatılmış mikromekanik test oluşan deney kurulumu ilet sözde fizyolojik koşullar (Şekil 6).
- Yük hücresi ve ekstansometrenin dengeleyin.
Not: Dengeleme görüntülenen uzatma değeri ve hiçbir örnek makinesine monte ederken görüntülenen yük değerini sıfırlamayı içinde oluşan Mikromekanik test entegre bir işlevdir. Bu işlev hem ölçümler için referans tanımlanmasına olanak verir. - Mekanik aparat üzerine boru şeklindeki yapıları Montaj: boyuna yönde.
Not: doğrudan tüm tübüler yapıların üzerinde uzunlamasına yorulma testleri gerçekleştirin. Yük hücresi ve PBS banyosu tabanına yapılarının gazlı bez sardı bağlamak için in-house inşa kavrama cihazlarda kullanın.- Boru şeklinde hasat prosedürü (bölüm 2.4) takip kavrama cihazlarının (Şekil 7B), üzerine inşa monte edin.
- Test sırasında herhangi bir gazlı bez kulpları kaymasını önlemek için teflon bant ile birlikte tutma cihazları ve gazlı bez sardı sarın.Mikromekanik test (Şekil 7C) üzerine numuneyi bağlayın.
- Mekanik aparat üzerine halka şeklinde yapılar Montaj: çevresel yönü.
Not: boru yapılardan kesitli halka şeklindeki numuneler üzerinde çevresel yorulma testleri gerçekleştirin. Örnekleri tutmak için kulpları iki paslanmaz çelik çubuklarını kullanın.- Bir destek hasat (bölüm 2.4) Aşağıdaki 5 mm boşluk (Şekil 7B) ile işaretlenmiş olarak boru şeklinde plastik bir boru üzerine inşa monte edin.
- Boru şeklindeki yapı 10 mm halkaları kesin.
- Daha fazla analizler için bir vernier kumpas kullanarak numune uzunluğunu ölçün.
- Mikromekanik test (Şekil 7C) paslanmaz çelik çubuklar üzerine halka şeklinde örnek monte edin. Barlarda merkezine örneği yerleştirin emin olun.
Not: plastik boru adımı 3.4.1 ve bir kesme sistemine Şekil 7B'de gösterildiği gibi, kesim esnasında yapı hasarları önlemek için kullanılır.
- Boyuna veya çevresel yönde yapıları üzerinde Yorulma testi.
- Ilk ölçü uzunluğuna yapı gerin.
- Sözde fizyolojik bir ortamda, 10 dakika boyunca bu konumda yapı muhafaza edin.
- % 5 / sn gerilme hızında yapı için ilk ölçü uzunluğunun (30 döngü)% 10 halkalı gerginlik uygulayın.
- Numunenin başarısızlık kadar% 10 halkalı gerginlik artan aşamalarında adımı yineleyin 3.5.3.
Not: pseudo-fizyolojik bir ortamda kullanılması dikkate yüzdürme ve uygulanan yükün ölçümünü etkileyen kavrama sistemi ataleti alarak gerektirir. - Aşağıdaki gibi arka kaydedin:
- İlk ölçü uzunluğuna yük çerçevesini taşıyın.
- Herhangi bir örnek monte etmeden adımlar 3.5.3 ve 3.5.4 tekrarlayın ve yük hücresi bağlı kavrama cihazlarını tutmak (sadece 1 döngü requi olduğunukırmızı).
Yapıların 4. Luminal endotelizasyon
Not: hasat protokolü (bölüm 2.4) izledikten sonra, yapıları daha endotelizas- için döner duvar biyoreaktör monte edilmelidir taşıma dayanabilir.
- Döner duvar Biyoreaktör Tasarımı
- Havalandırma delikleri kapsayan filtre zarına zarar vermeden rezervuar tüp havalandırmalı kapak merkezinde 4.5 mm çapında bir delik delin.
- Deliğe bir mandrel (çap = 4.5 mm, uzunluk = 40 mm) Basın-uyacak ve adım 1.1.2 açıklandığı gibi mandrel düzeltin.
- Yapı, dış çap için iki C şeklinde silikon destek hazırlamak = 14 mm; iç çap = 8 mm).
- Döner duvar biyoreaktör içinde bir ucunda bir döner motor ve diğer ucunda (Şekil 8B) bir yatak yerleştirin.
- Lümen endotelizasyonunun
- İnsan umbilik Expandve arkadaşları,% 10 (h / h) PS,% 10 ile takviye edilmiş M199 kültür ortamı, 5 ml 25 cm2 kültürü şişelerinde endotelyal hücreleri (HUVECler) damar (h / h) FBS,% 1 (h / h) Pen-strep % 90 birleştiği kadar bir kuluçka makinesi (T = 37 ° C,% 5 CO2,% 100 nem) içinde Petri kabındaki.
- Serumsuz endotelyal hücre kültürü ortamı içinde 10.5 ng / ml konsantre protein karışımı seyreltilmesi ile optimum hücre yapışması için gerekli olan bir yapı için, protein kaplama solüsyonu 1.5 ml hazırlayın.
- Bir vernier kumpas kullanarak yapının uzunluğunu ölçün.
- Lümen hacmi V ve yapının lümen alanı A hesaplayın : V =, sırasıyla D, L 2, L / 4 ve A = D (D mandrel çapına karşılık gelen bir iç çapı ve L, bir yapı uzunluğu).
- Hasat prosedürü (bölüm 2.4) aşağıdaki rezervuar merkezinde yapısını yerleştirin.Her iki rezervuar (Şekil 8A) ve uçlarını da yapı düzeltmek için C-şekilli silikon desteği kullanın.
- Kültür ortamında 35 ml ile doldurun.
- Aşama 4.2.2'de hazırlanan protein kaplama çözeltisi ile bir yapı (V) 'in hesaplanan lümen hacminin% 75 doldurun. Protein kaplama solüsyonu (Şekil 8A) arasında herhangi bir sızıntıyı önlemek için yapının uçları iki kapatın.
- Hücre kültürü kaput içinde dönen duvar biyoreaktör sistemi monte edin.
- 37 ° C inkübatör biyoreaktör yerleştirin ve Şekil 8B'de gösterildiği gibi lümen kaplama sağlamak için 1 saat süre ile 4.02 x 10 5 g kuvvetinde biyoreaktör dönüşünü başlar.
- Yapının üst ekstremite açın ve lümen protein kaplama çözümü aspire.
- HUVEC'lerin şişeden kültür ortamının ayrılması ve tripsin çözeltisi 3 ml (PBS içinde 1 x) eklenerek HUVECler (geçit 2-3) çıkarınız. Ben5 dakika (T = 37 ° C,% 5 CO2,% 100 nem) için ncubate.
- Eklenmiş M199 kültür ortamı içinde 4 x 10 6 hücre / ml'lik bir konsantrasyonda yeniden süspanse HUVECler.
- Hücre kültürü başlık içinde,. 1000 hücre / cm2'lik 15 bir yoğunluğa sahip yapının lümenine HUVECler tohum HUVECler çözeltisi herhangi bir sızıntıyı önlemek için yapının üst ekstremite kapatın.
- 4.02 x 10 5 g kuvvetinin sabit bir dönme 2 gün boyunca döner duvar biyoreaktör (Şekil 8B) ve kültür yapıları (T = 37 ° C,% 5 CO2,% 100 nem) barındırılan inkübe edin.
- Steril koşullar altında kültür içinde 2 gün sonra yapı Hasat ve bölüm 2.4'de anlatıldığı gibi diğer biyolojik karakterizasyonu için hazırlayın.
Sonuçlar
Bu çalışma damar hücreleri içeren mühendislik boru şeklindeki kolajen bazlı yapıların imalat açıklar. Zaten, erken jelleşme 1 saat sonra, hücreler-ve-kollajen karışımı doğrudan (14 mm civarında), karşılık gelen kalıp çapına eşit dış çapı olan bir 3 boyutlu boru şekilli geometri içinde monte edilmiştir. Tüm statik olgunlaşması boyunca, ölçümler, Tablo 1 'de gösterildiği gibi. Statik kültür 1 gün sonra başlangıç değerinin yaklaşık% 60 arasında daralmış cellularized kolajen jellerin çapı boru şekilli cellularized yapılar, dış çapı hızlı bir azalma ortaya koymuştur ve 7 gün (Ek Video 2) içinde neredeyse% 85. Bu fenomen olmayan cellularized kolajen iskeleleri oluşmaz olarak yapıları içinde SMC'lere, daralma gözlendi ve ilgili mekanik takviye sorumludur. Herhangi bir tür (termal, biyokimyasal, mekanik ya da diğerleri) bir gradyan uygulandı unutmayın. Hücreler sürücün, sıkıştırma ele mekanik taleplere bastırılmış olabilir büyük kollajen yoğunluklu bir malzeme ile sonuçlanmıştır (Ek video 3 ve 4).
Genel mekanik ve viskoelastik özellikleri hücre kaynaklı biçimlenme ilişkilendirmek için, yorulma testi konstruktları (Ek video 5 ve 6) üzerinde yapıldı. Bu testler, farklı sabit deformasyonlardaki yapıları (30 kez) (% 10,% 20, ve ilk gösterge uzunluğunun% 30) bisiklet ve zaman içinde, mekanik kışkırtma konstruktların yanıt olarak stres kayıt olarak alınmıştır. Bir yapı için temsili sonuçlar, Şekil 9'da gösterilmektedir. oluşumu aynı gerilim aralığında (% 30 suşu) tabi çevre yönünde (16 kPa) daha uzunlamasına yönde (75 kPa) daha yüksek gerilimleri koymuştur. Bu arada, her devirde, stres tepe değeri ta uzandırgeted maksimum gerilme zamanla azalmıştır. Bu davranış, bunlar kolajen-bazlı yapılar sergilediği yüksek viskoelastik özellikler tipik bir örneğidir.
cellularized yapıların biyolojik aktivitesi, statik olgunlaşma sırasında değerlendirilmiştir. Bu nedenle, SMC'lerinin metabolik aktivitesi, statik kültür sırasında glikoz ve laktat üretimi ölçülerek değerlendirildi. Kültür ortamı her 2 saatte bir ve glikoz örneklendi ve laktat konsantrasyonu kan gaz analizörü kullanılarak ölçülmüştür. glikoz tüketimi ve yapılarının önemli daralma kombine laktat üretimi sürekli artış, tüm statik kültürü (Şekil 10) boyunca SMC'lere aktivitesini kanıtlamak.
nedeniyle hücre odaklı yeniden yükselmiştir mekanik stabilite yapıları manipülasyon ve sonraki endotelizasyonunun sürecini izin verdi. Masson trikrom boyama endotelize yapıları üzerinde yapılanBir son derece homojen endotelyumu göstermiştir. SMC'lere a milli şeklinde morfoloji sergiledi ve HUVECler iyi luminal tarafında (Şekil 11) yayılmış çıktı ise homojen, duvar boyunca dağılmış çıktı.
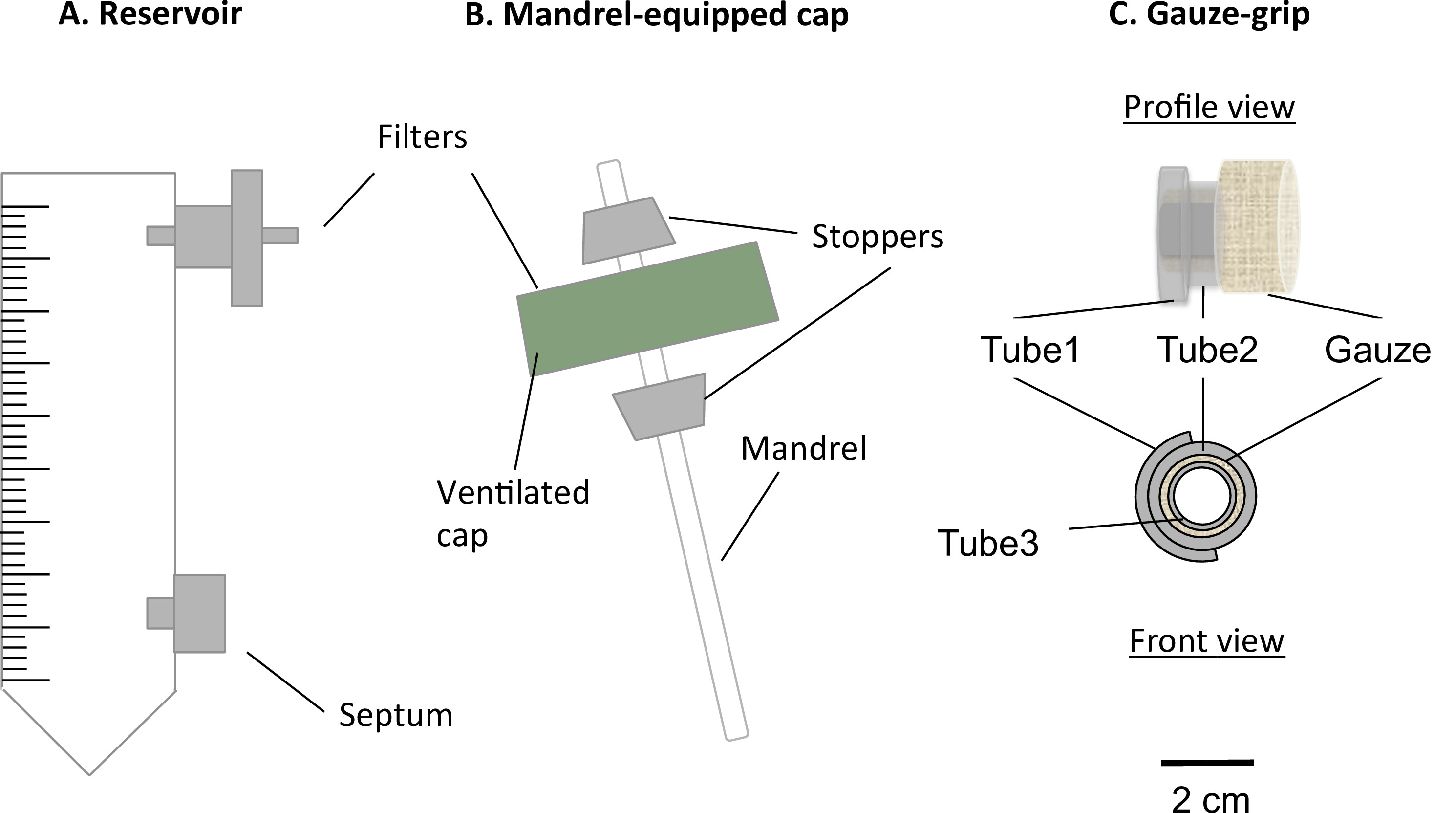
Şekil 1:. Statik biyoreaktör bileşenleri statik biyoreaktör bir tadil edilmiş 50 ml'lik bir santrifüj tüpüne (A) ve bir mil donatılmış kapak (B) oluşmaktaydı. Tüp orta rezervuar olarak görev yaptı ve orta örnekleme ve değiştirmek için, gaz değişimi için 0.22 mikron filtre için bir liman, bir septum ile donatılmıştır. Havalandırılmış kap içinde bir mandrel, bu boru şeklindeki yapıların yapımını sağladı. gazlı bez kulpları (C) olarak tasarlanmış ve mandrel boyunca yapılarının jelleşme desteklemek için imal edilmiştir. Ayrıca, buçeneler konstruktlar, statik olgunlaşmasından sonra ele alınması ve mekanik cihaz ile tespit edilebilir izin verdi. mandrelin dış çapı 4.7 mm idi.
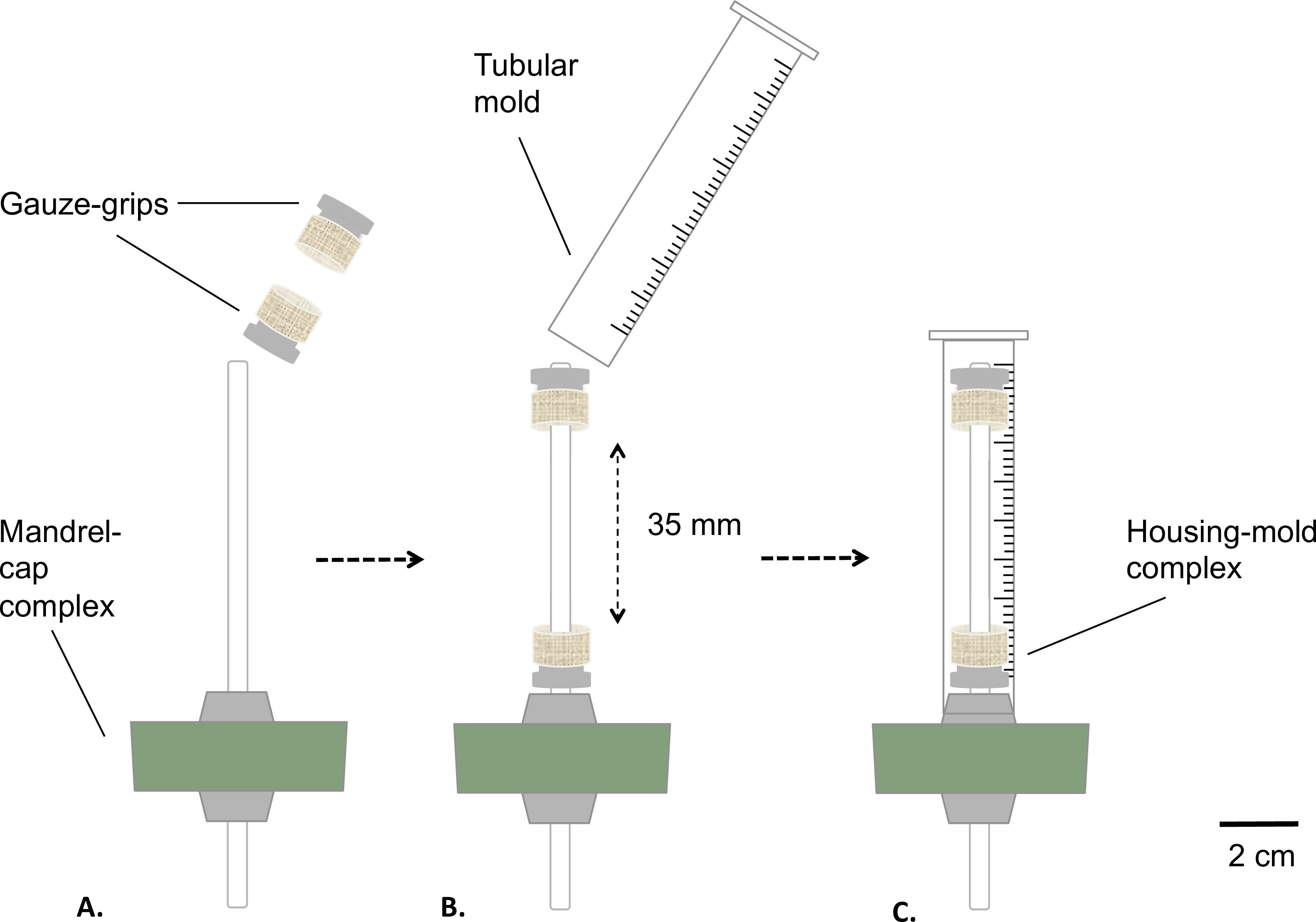
Şekil 2: Statik biyoreaktör monte sterilize edilmeden önce biyoreaktör evrelerini Montaj.. tül-kulpları sabit bir mesafede mandrel (A) üzerine monte edilmiştir. Bir kalıp yerleştirilmiş (B) ve sıkı bir şekilde silikon durdurucu (C) tespit edildi. mandrelin dış çapı 4.7 mm idi.
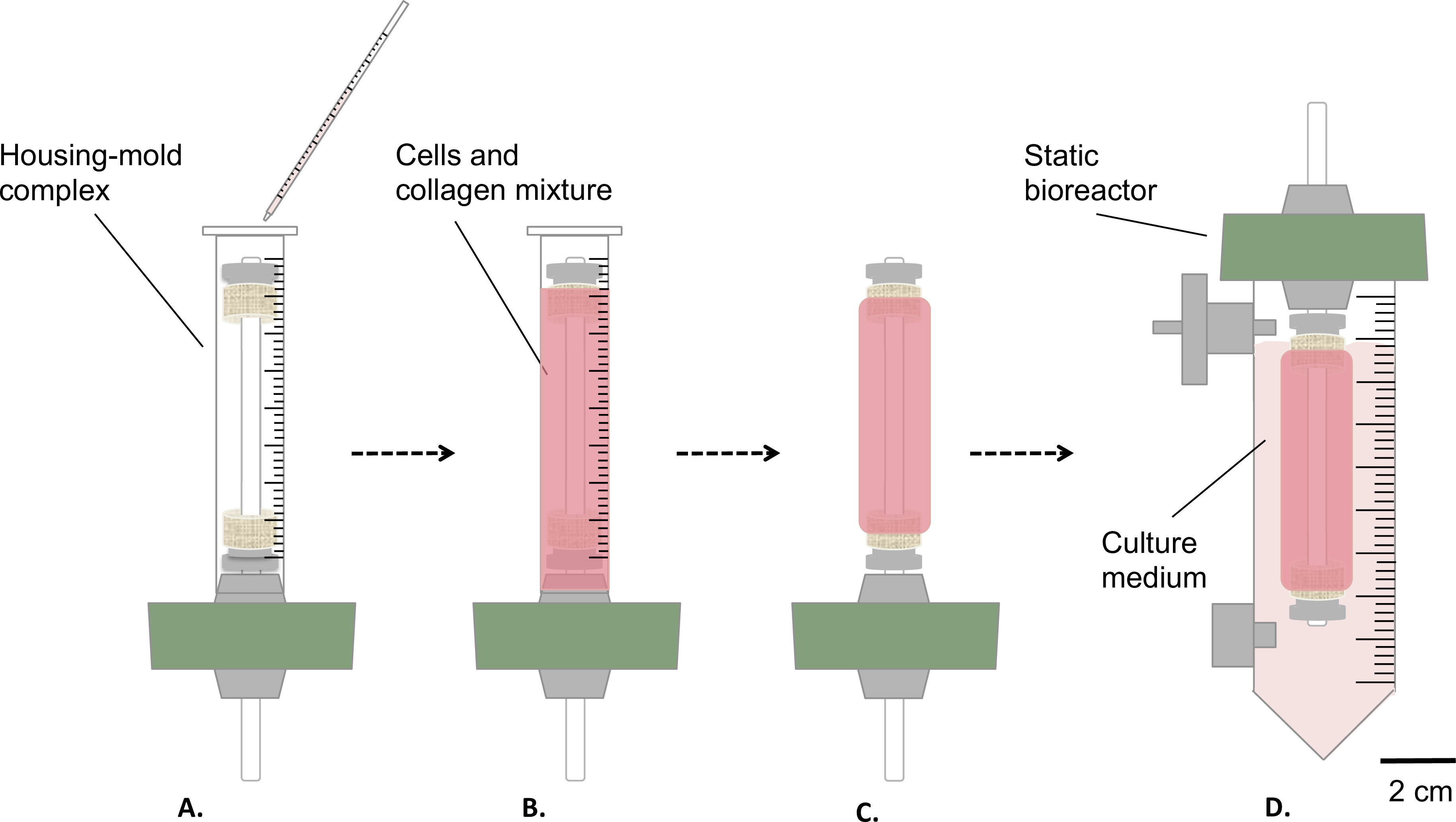
Şekil 3:. Steril şartlarda yapıları Fabrikasyon hücreleri ve kollajen karışımı konut-kalıp kompleksinin döküldü (A) ve oda sıcaklığında (B) 'de 1 saat süre ile jel sağlar. Daha sonra, kalıp (C) uzaklaştırılmıştır statik biyoreaktör (D) monte edilmiş ve kuluçka makinesi içinde yapının statik olgunlaşması (T = 37 ° C,% 5 CO2,% 100 nem) için bir rezervuar içinde transfer edildi. mandrelin dış çapı 4.7 mm idi.

Şekil 4:. Konstruktların kalınlığı / dış çap ölçümü bir lazer tarama interferometre yapıları dış çap ölçümünü gerçekleştirmek için kullanıldı. yapı, lazer ışınının yolu içine yerleştirilir ve bir gölge elde edilmiştir. yapının dış çapına karşılık gelen gölge genişliği, daha sonra ölçüldü ve ekranda edildi.

Şekil 5:. Hasat yapının morfolojik görünüşü (A) sağ 2 hafta içinde, statik olgunlaşma sırasında hücreler odaklı yeniden sonrası jelleşme ve (B) sonra,.

Şekil 6: mekanik özellikler için deneysel kurulum bir 5 ya da 10 N yük hücresi ve yalancı fizyolojik koşullarda örnekleri tutmak için 37 ° C sıcaklıkta PBS içeren bir banyo ile donatılmış mikromekanik test oluşuyordu..
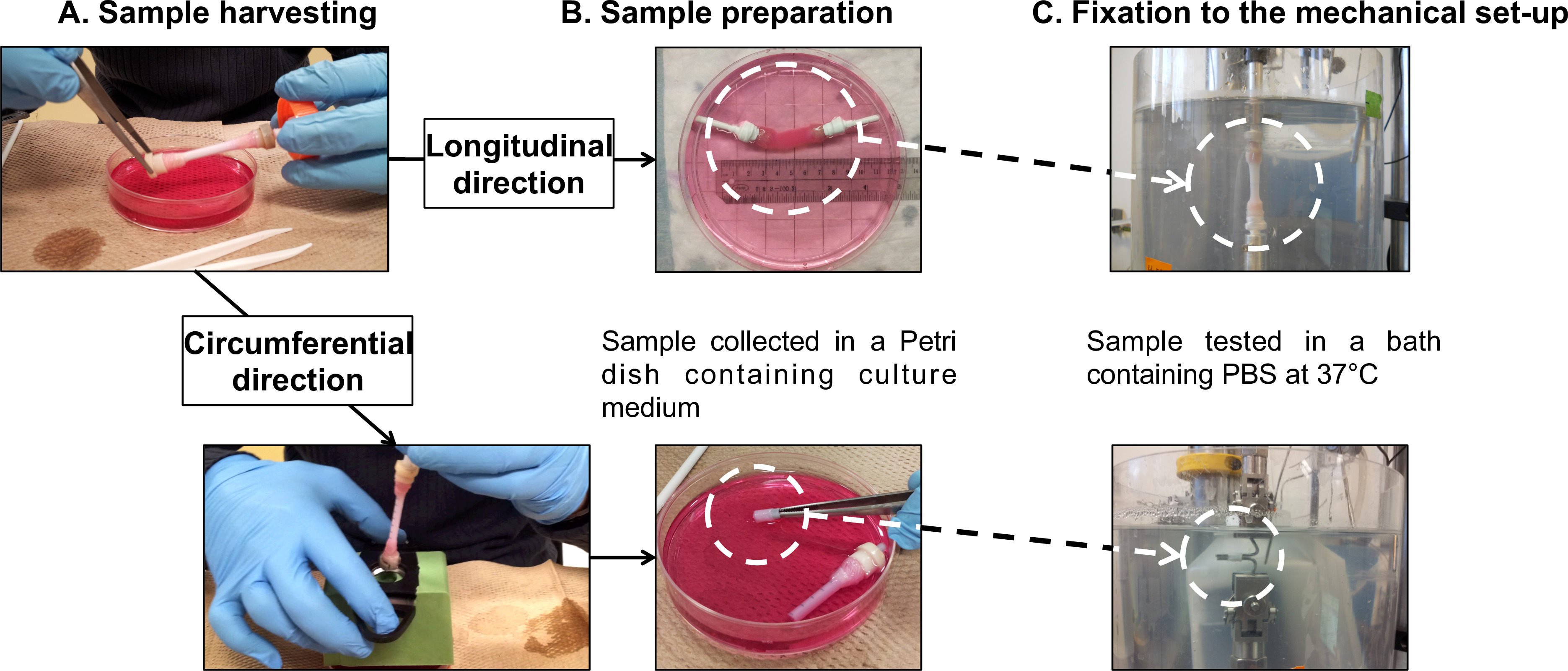
Şekil 7: Örnek hazırlama f ya da mekanik karakterizasyonları. Örnek hasat (A) ve preparasyon (B), yorgunluk, uzunlamasına yapılan testler ve çevresel yönleri (C). mandrelin dış çapı 4.7 mm idi.
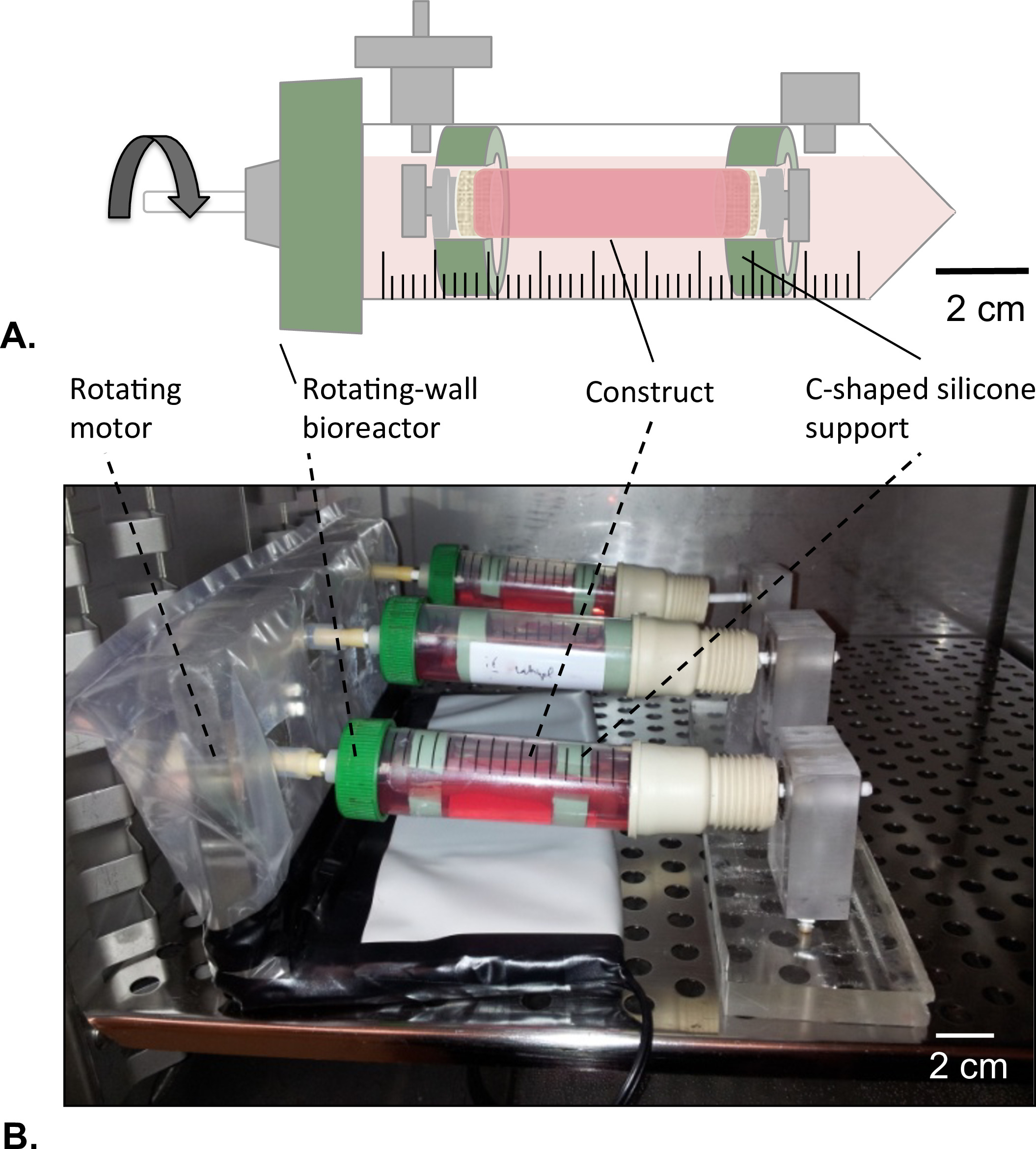
Şekil 8: Döner duvar biyoreaktör (A) tübüler yapılar c-şekilli silikon desteği yardımıyla rezervuar merkezinde monte edildi.. Yapının ekstremitelerin iki HUVECler çözeltisi herhangi bir sızıntıyı önlemek için kapatıldı. (B) yapıları inkübatörde kültürlendi (T = 37 ° C,% 5 CO2,% 100 nem) 2 gün süre ile 4.02 x 10 5 g kuvvetinde dönme.
2 / 52812fig9highres.jpg "width =" 700 "/>
Şekil 9:.. Mekanik karakterizasyonları boyuna (A) yapıları üzerinde yapılan yorulma test ve hücre odaklı yeniden sonrasında çevresel (B) yön sonuçları bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
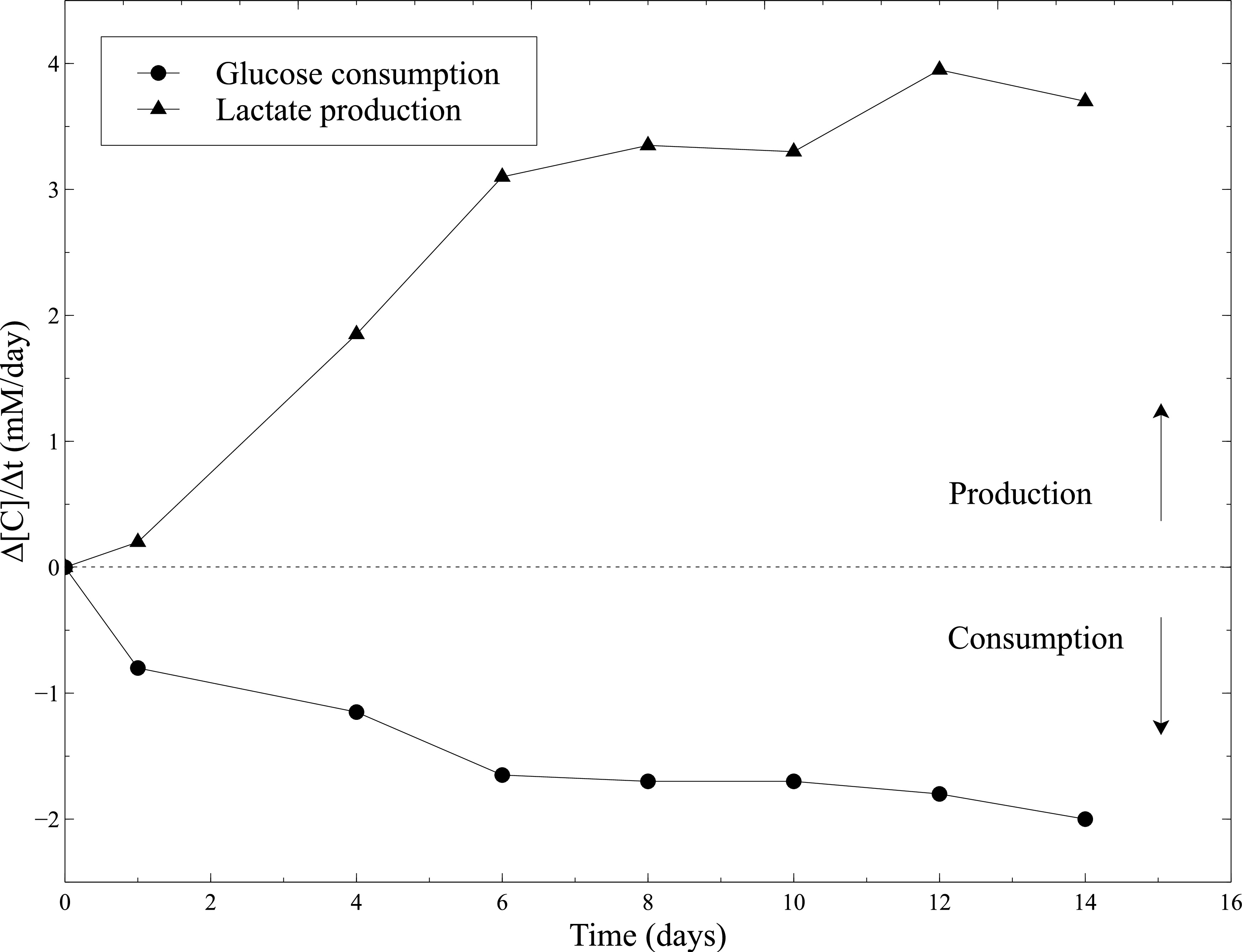
Şekil 10:. Kolajen jellerin içindeki SMC'lerinin metabolik aktivitesi glikoz tüketim oranı ve laktat üretim hızı ölçümleri kültür ortamı değişiklik için, her 2 günde bir kan gaz analizörü ile yapıldı. Taze kültür ortamı, glikoz ve laktat konsantrasyonu ölçümleri için, bir taban çizgisi seviyesi olarak kullanılmıştır.
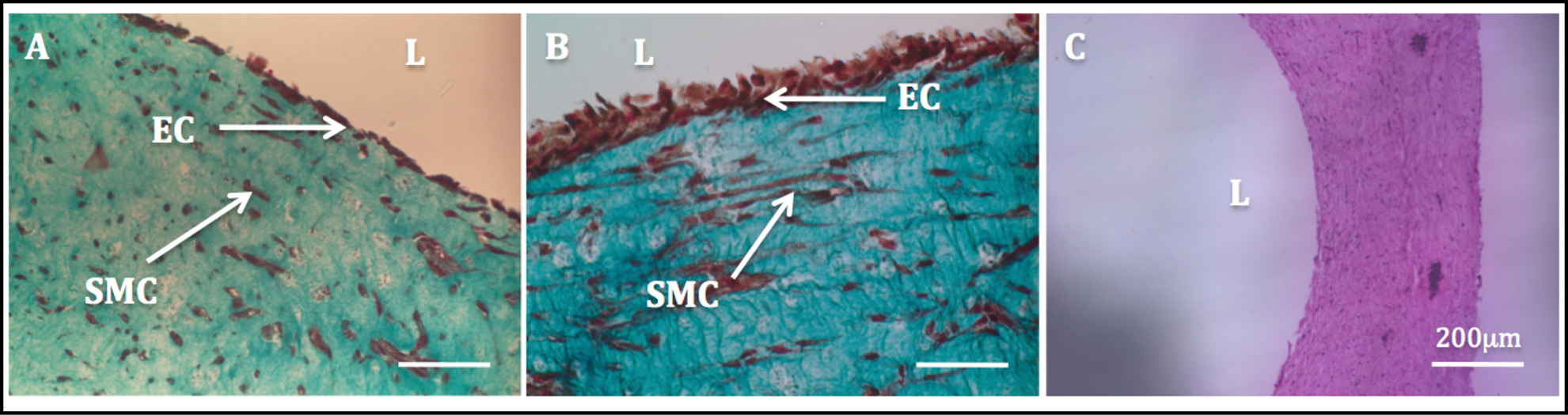
Şekil 11: lümen endotelizasyon boru şekilli yapılar radyal kesitlerinin histolojik ve görüntüler.. Boru şekilli yapıların Masson trikomu boyama 1 hafta (A) ve 2 hafta içinde (B) statik olarak kültürlendi. Boru şeklindeki bir yapının (C) 'nin, H & E boyama.
| Zaman | Kalınlığı (mm) | Sıkıştırma (%) |
| 0 saat | 4.83 ± 0.02 | 0 ± 0 |
| 2 saat | 4.26 ± 0.02 | 12 ± 0 |
| 4 saat | 4.21 ± 0.03 | 13 ± 1 |
| 6 saat | 4.06 ± 0.10 | 16 ± 2 |
| 12 saatr | 3.16 ± 0.07 | 35 ± 1 |
| 1 gün | 2.08 ± 0.11 | 57 ± 2 |
| 1 hafta | 0.68 ± 0.07 | 86 ± 1 |
| 2 hafta | 0.36 ± 0.00 | 93 ± 0 |
Tablo 1: Statik olgunlaşma esnasında yapı çapı hızlı sıkıştırma konstruktlarının duvar kalınlığı ve statik kültür zamanın bir fonksiyonu olarak bir sıkıştırma oranı.. Sıkıştırma, bir tarama laser interferometre (Seri 183b, LaserMike 136) boru biçimli yapılarının dış çapı saptanmasıyla ölçülmüştür. 24 saat sonra, yapılar% 57 kendi kalıp boyutlarının ±% 2 sıkıştırılmış. Veriler ifade olarak ortalama ± SD (n = 3). varlığı ve düz kas hücreleri canlı aktivitesi, büyük değişiklikler için tek sorumlusu oldu.
Supplemental Video 1:. olmayan remodeled boru şeklinde kollajen jellerin Hasat Bu videoyu görmek için lütfen buraya tıklayınız.
Ek Video 2:. Tübüler kollajen jellerin Hücreler odaklı sıkıştırma Bu videoyu görmek için lütfen buraya tıklayınız.
Ek Video 3:. Olmayan remodeled boru şeklinde kollajen jeller Manipülasyon Bu videoyu görmek için lütfen buraya tıklayınız.
Ek Video 4:. Hücreler-remodeled tübüler kollajen jeller Manipülasyon inci görmek için buraya tıklayınızvideo.
Ek Video 5:. Boyuna yorulma testi (% 30) hücreleri remodeled tübüler kollajen jeller üzerinde Bu videoyu görmek için lütfen buraya tıklayınız.
Ek Video 6:. Çevresel yorulma testi (% 30) hücreleri remodeled tübüler kollajen jeller üzerinde Bu videoyu görmek için lütfen buraya tıklayınız.
Tartışmalar
Vasküler doku mühendisleri topluluğu arasında, muazzam çabalar kan damarlarının 16 mekanik stabilite sorumlu tunika medya katmanı çoğaltmak yapılmıştır. Weinberg ve Bell 17 öncü çalışmaları yana kollajen yaygın dolayı biyouyumluluk, immünojenik olmayan özellikleri ve kullanılabilirlik vasküler doku mühendisliği için bir iskele olarak kullanılır olmuştur. Bu malzeme, mekanik sertlik içsel eksikliği, işlemek kolay değil Ancak, kollajen kullanımı, araştırmacılar için büyük bir sorun teşkil etmektedir. Iskele hazırlanması sırasında manipülasyonlar daha sonra kullanmak üzere bunları ödün, iskeleler zarar verebilir.
Bu çalışmada tarif edilen teknik sağlar: i) bir boru biçimli geometri içine cellularized kollajen jel mühendis ii) kısa bir statik olgunlaşma süresi (1 ya da 2 hafta) sonra ele alınması için yeterince güçlü bir biyolojik dokular mühendislik, iii) olarak2 yönde böyle bir boru şekilli biyolojik dokuların nitik mekanik ve viskoelastik özellikleri. Jel hücreler kolajen matris yeniden yapılandırılmasında önemli bir rol oynamaktadır. Olgunlaşması sırasında kasılma SMC'lere boyuna ve çevresel yönde değerlendirilebilir daha yüksek mekanik stabilitesi olan bir yapı elde jellerin sıkıştırma yol açtı. Yapıları dolayısıyla vasküler doku mühendisliği uygulamaları için kollajen jel uygunluğunu gösteren, homojen ve canlı endotel üretilen ve Sonrasında HUVECler lümen tarafında seribaşı.
Bu çalışmada sunulan biyoreaktör spesifik olarak, statik olgunlaşma esnasında hücre büyümesi için uygun bir ortam sağlamak için tasarlanmıştır. Buna ek olarak, yapıları mekanik ve viskoelastik özelliklerinin tanımlanması için geliştirilmiş cihazlar manipülasyonu özgü olası hasarı azaltmak amacıyla tasarlanmışBöyle hassas malzemeler. Bu nedenle, statik biyoreaktör kap, bir 0.22 um filtre ve bir membran filtre (aşama 1.1.2, Şekil 1A donanımlı ve B) bir steril kültür ortamı tutarken, hazne ve inkübatör içinde kültür ortamı arasındaki gaz alışverişi izin verdiği. alt diş septum kültür ortamı örnekleme için bir liman olarak kullanılan ve statik kültür sırasında değişiyordu. Bazı kritik adımlar yapı imalat ve karakterizasyonları sırasında dikkat edilmesi gerekiyor. Sistemin sterilite değiştirebilecek (müteakip aşamalarda aşama 2.1.1 ve yapılan) Bütün manipülasyonlar, steril bir biyolojik başlık yapıldı. Hücrelerin ve kollajen jel karışımı hazırlama jelleşme süreci geciktirmek için buz üzerinde ele alınmıştır (2.1.7 için 2.1.4 adımları). Adım 2.1.7 anda, öncesinde jelleşme için karışımın içinde sıkışıp kalan herhangi bir hava kabarcıkları s tehlikeye düşürebilecek potansiyel stres konsantrasyon alanlarıkonstruktların karlılığı. Bu nedenle, hava kabarcıklarının çıkarılması hafif montaj çalkalama veya steril koşullarda gazdan arındırma için 3 dakika boyunca, tıbbi vakum kullanılarak gerektirir. Son olarak, çeneler özellikle jelasyon esnasında boru şekilli kalıp merkezi mandrel ekseni sağlamak ve endotelizas- için, (mandrelin giderme, Kısım 2.4), hasat sırasında yapıların hassas işleme izin vermek için tasarlanmıştır ve kolaylaştırıcı üzerine monte etmek için edildi Mekanik sistemi (uzunlamasına testleri).
Mevcut protokol SMC'lerinin doğal doğasında kasılma potansiyele dayalı kollajen jeller yapıların takviye özgün kolay süreç alternatif bir yaklaşım önermektedir. 20 - kolajen matrisleri takviye genel teknikler hücre-matris etkileşimlerinin 18 üzerinde zararlı etkileri olabilir fiziksel ve kimyasal çapraz bağlama maddelerinin kullanımını içerir. sunulan imalat tekniğibu çalışma, herhangi bir fiziksel ya da kimyasal işlem olmaksızın hedef mekanik özelliklere sahip olan bir doku mühendisliği yapısı elde etmek için, bu hücreler, odaklı yeniden modelleme süreci yönlendiren sağlar.
Hidrate kolajen jellerin mekanik ve viskoelastik özelliklerinin karakterizasyonu büyük bir sorundur. Bu açıdan, mevcut protokol boru şeklindeki yumuşak dokuların mekanik özelliklerini değerlendirmek için orijinal bir basit ve etkili bir yöntem açıklanır. Bu tasvir, doğrudan tüm boru şekilli yapısı üzerine, çevresel yönde, hem de uzunlamasına yönde, sadece gerçekleştirilebilir. Mekanik karakterizasyonu, sıcaklık, sulu bir ortamda, pH ve iyonik kuvvette sırasında büyük ölçüde biyolojik dokuların 21 mekanik davranışını etkileyen bilinen çevresel faktörlerden bazılarıdır. Bu nedenle, mevcut çalışma son derece biyolojik dokuların mekanik karakterizasyonu için orijinal bir set-up ve protokol önerirtekrarlanabilir sözde fizyolojik bir ortam (37 ° C ve pH 7.4'te tuzlu su çözeltisi). Bizim bilgimize göre, karakterizasyonu bu tür başka hiç bildirilmemiştir.
Sonuç olarak, bu çalışma önerilen tekniği vasküler doku mühendisliği uygulamaları için kolajen hücrelerinin doğrudan karıştırma yüksek bir potansiyel gösterir. Mekanik karakterizasyon ve endotelizasyonunun süreci ile birlikte bu yöntem, yüksek polyvalent protokolleri oluşturmaktadır. Bu nedenle, set-up ve aynı mantığı tutarken protokolleri küçük değişiklikler sayesinde, mühendislik vasküler doku eşdeğerleri için ana gereksinimleri hızlı ve komplikasyonsuz endotelizas- dahil işleme, ve olasılık gibi ele alınabilir yumuşak geniş bir aktarılmamıştır çeşitli uzunluklarda ve çaplarda dokular. Ayrıca, yapışık hücre tipleri, ECM proteinleri ve geometrilerin, farklı hedef uygulaması ve uygulamada bir dizi için araştırılabilirBöyle diğerleri arasında mühendislik tendon, deri grefti, kalp yamalar, sinirler gibi ons. Yapıların mekanik özellikleri umut verici olmasına rağmen, yerel dokuların daha düşük. Bu bağlamda, biz şiddetle çok kısa bir statik olgunlaşma dönemi dolayısıyla daha yüksek bir yapısal bütünlük ve mekanik istikrar lider, bir biyoreaktör içine dinamik uyarılması yönünde önemli bir adım olduğuna inanıyoruz. Ancak, olasılık hızla mekanik uygun doku mühendisliği cellularized kollajen tabanlı yapıları üretmek ve histolojik büyüme ve yeniden yapılanma ya da hatta sırasında hücreleri ve ECM arasındaki etkileşimi içgörü sağlamak için yararlı ve gelecek vaat eden bir araç burada tarif edilen statik biyoreaktör yapar analizleri tedaviler ve ilaç dağıtım sistemleri için bir model olarak kullanılabilir.
Açıklamalar
Finansman çıkarları potansiyel çatışma ile örgütlerin veya acentelerden alındı.
Teşekkürler
Bu araştırma Doğa Bilimleri ve Kanada'nın Mühendislik Araştırma Konseyi, Sağlık Araştırma Kanada Enstitüsü ve MYK de Québec Araştırma Merkezi tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
Referanslar
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır