Method Article
Ingénierie 3D cellularisé collagène Gels pour la régénération tissulaire vasculaire
Dans cet article
Résumé
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
Résumé
Les matériaux synthétiques sont connus pour lancer des complications cliniques tels que l'inflammation, la sténose, et les infections lorsqu'il est implanté en tant que substituts vasculaires. Le collagène a été largement utilisé pour un large éventail d'applications biomédicales et est considéré comme une alternative valable aux matériaux synthétiques en raison de sa biocompatibilité inhérente (par exemple, une faible antigénicité, l'inflammation et les réponses cytotoxiques). Cependant, les propriétés mécaniques limitées et la main basse-capacité connexe de gels de collagène ont entravé leur utilisation comme matériaux d'échafaudage pour l'ingénierie tissulaire vasculaire. Par conséquent, le raisonnement derrière ce travail fut le premier à concevoir des gels de collagène cellularisées dans une géométrie et une deuxième forme tubulaire pour améliorer les cellules musculaires lisses réorganisation menée de matrice de collagène pour obtenir les tissus suffisamment rigide pour être manipulé.
La stratégie décrite ici est basée sur l'assemblage direct de collagène et de cellules musculaires lisses (construction) dans un Cyli 3Dndrical géométrie à l'aide d'une technique de moulage. Ce procédé nécessite une période de maturation, au cours de laquelle les produits d'assemblage sont mises en culture dans un bioréacteur dans des conditions statiques (sans contraintes mécaniques dynamiques appliquées externes) pendant 1 ou 2 semaines. Le "bioréacteur statique" fournit un environnement stérile surveillé et contrôlé (pH, la température, les échanges gazeux, l'apport de nutriments et l'élimination des déchets) pour les constructions. Au cours de la période de culture, des mesures d'épaisseur ont été effectuées pour évaluer les cellules axée remodelage de la matrice de collagène, et la consommation de glucose et les taux de production de lactate ont été mesurées pour surveiller les cellules l'activité métabolique. Enfin, les propriétés mécaniques et viscoélastiques ont été évalués pour les constructions tubulaires résultant. A cet effet, des protocoles spécifiques et un savoir-faire focalisé (manipulation, de préhension, en travaillant dans un environnement hydraté, et ainsi de suite) ont été développées pour caractériser les tissus d'ingénierie.
Introduction
Ingénierie tissulaire vasculaire envisage différentes stratégies visant à la fabrication de navires d'ingénierie, y compris les greffons synthétiques basés sur des échafaudages, des vaisseaux sanguins de l'ingénierie tissulaire à base de feuille de cellules (TEBVs), et de la matrice extracellulaire (MEC) TEBVs par composants. Parmi ces approches, les polymères synthétiques présentent de bonnes propriétés mécaniques, mais part un inconvénient commun qu'elles manquent de bioactivité 1. La méthode basée sur la feuille de cellules permet la production d'ingénierie substituts vasculaires avec des propriétés mécaniques élevées, mais le temps nécessaire pour produire ces greffes est d'environ 28 semaines 2. Biopolymères naturels de l'ECM, tels que le collagène, l'élastine, la fibrine 3 ou une combinaison de ceux-ci, restent les matériaux standard d'or pour les échafaudages d'ingénierie tissulaire. Ceci est principalement pour la raison que ces matériaux possèdent généralement bonne biocompatibilité tout en étant capable d'induire des réponses cellulaires fonctionnelles 4-5. Parmi ceux-ci biopolymères, collagène de type I est une protéine de la porteuse la plus abondante et la dominante de l'ECM dans de nombreux tissus comme la peau, les vaisseaux sanguins et les tendons. Un travail important a été effectué sur les propriétés mécaniques du collagène 6 - 8, mais il ya eu peu d'études sur le remodelage cellulaire de gels de collagène pendant la maturation statique. Le remodelage cellulaire désigne les modifications structurales de la matrice de collagène induite par les cellules qui pourraient affecter la stabilité du réseau de fibrilles de collagène neuf. Comme un échafaudage naturel, des quantités relativement importantes de collagène de type I peuvent être isolés, stérilisées et stockées à partir de différentes sources telles que les tendons de queue de rat 10. Comprendre les interactions cellulaires avec le collagène et les comportements mécaniques globales connexes des échafaudages de collagène cellularisées (des constructions) est une étape essentielle pour la construction des tissus. TEBVs à base de collagène peuvent être traitées en mélangeant directement les cellules avec du collagènelors de la préparation de gel et autre pièce moulée dans des formes spécifiques telles que tubulaire et plane 11. Cellules vasculaires à l'intérieur des gels prolifèrent et le type de remodelage du collagène 12. Ainsi, cette méthode contourne la nécessité de macroporosité spécifique qui représente l'un des problèmes importants dans le développement d'échafaudages pour les applications d'ingénierie tissulaire. Cependant, les principaux inconvénients des gels de collagène sont leurs propriétés mécaniques faibles par rapport aux 13 matières synthétiques.
Dans cette étude, un tissu viable avec une distribution homogène de cellules a été conçu par mélange direct de collagène avec des cellules dans un procédé en une étape. "bioréacteurs" statiques ont été utilisés pour les semaines de maturation statique des gels de collagène cellularisées 1 ou 2 (sans contraintes mécaniques dynamiques externes appliquées). Au cours de la culture, de la matrice de remodelage du collagène produite, offrant ainsi un renforcement structurel des constructions. En outre, ces constructions sont rEady à être transférés dans un bioréacteur rotatif, et une paroi endothélium homogène a été obtenue. En outre, dans ce travail un protocole mécanique spécifique de test est également proposé de fournir une nouvelle approche appropriée pour caractériser les propriétés mécaniques des tissus mous tubulaires.
En résumé, ce travail présente une méthode pour la fabrication et la maturation des tissus vasculaires qui sont assez fort pour être traitées non seulement pour les caractérisations biologiques et mécaniques, mais aussi pour le conditionnement ultérieur mécanique dans un bioréacteur dynamique, qui est considéré comme un élément crucial rapide in vitro l'étape dans la régénération des tissus.
Protocole
1. Fabrication et montage de la statique bioréacteur
- Fabrication du réservoir
- Préparer 50 ml des tubes de centrifugeuse en tant que réservoir de milieu de culture pour le bioréacteur.
- Faire deux ports par le forage de deux trous 5 mm de diamètre à 20 mm du fond et la partie supérieure du réservoir, respectivement. Ensuite, insérez deux raccords Luer dans la longueur des tubes de silicone de 5 mm. Press-Fit ces raccords Luer à travers les trous, et sceller toutes les connexions avec colle silicone de qualité médicale.
- Insérer un filtre dans l'orifice supérieur du réservoir (figure 1A) de 0,22 um.
- Insérer un septum luer dans l'orifice inférieur du réservoir (figure 1A).
- Assemblée mandrin-bouchon
- Forer un trou d'un diamètre de 4,5 mm au centre de la calotte de ventilation du tube-réservoir, sans endommager la membrane filtrante qui recouvre les orifices d'aération.
- Préparer une barre d'agitation (diamètre = 4,5 mm, longueur = 100 mm) Comme un mandrin pour la construction.
- Préparer deux bouchons en silicone coniques (longueur = 10 mm, diamètre du trou du milieu = 4,5 mm).
- Assemblez le mandrin et le capuchon (complexe mandrin-bouchon), comme décrit à la figure 1B.
- Insertion en force le mandrin dans l'orifice. Insérer les deux butées sur le mandrin de sorte que le capuchon est monté entre eux. Ajuster la position du mandrin de sorte que sa longueur utile est de 78 mm.
- Appliquer un apprêt puis colle silicone de qualité médicale pour les surfaces qui seront en contact avant de rejoindre le capuchon et les bouchons en silicone coniques ensemble. Retirer l'excès de colle sur le bouchon.
- Laissez sécher à la température ambiante pendant 1-3 jours.
- Fabrication de la gaze-poignées
- Préparez 3 tubes de silicone (tube 1: diamètre intérieur = 6,4 mm, longueur = 5 mm; tubes 2: diamètre = 6,4 mm, longueur = 10 mm, et de tubes 3: diamètre = 3,1 mm, longueur = 12 mm).
- Assemblez les poignées gaze comme décritd sur la figure 1C.
- 1 tube de Cut longitudinalement, et l'ouvrir sur le tube 2. Collez-les ensemble avec de la colle silicone.
- Couper gaze chirurgicale stérile à 5 cm x 7 cm feuille, puis rouler bien serré la gaze sur le tube 3 le long de la côté le plus long de la gaze. Insérer le tube complexe 1-tube 2 sur la gaze.
- Ajouter la colle silicone à coller ensemble la gaze, le complexe tube 1 tube 2 et le tube de Cut 3. la gaze à une longueur de 8 mm.
- Assemblée et stérilisation
- Assemblez le complexe mandrin-bouchon et les poignées gaze comme décrit dans la figure 2.
- Enduire le mandrin avec de la graisse de qualité médicale (figure 2A). Placez les poignées gaze sur le mandrin (figure 2B). Distance les poignées à la valeur fixe de 35 mm de l'autre.
- Préparer un moule tubulaire en enlevant la partie inférieure d'une seringue de 10 ml à l'aide d'une scie à table (longueur finale = 8 mm) ( Figure 2B).
- Insérer le moule sur l'ensemble mandrin-bouchon gaze poignées équipée (complexe logements-moisissures), encliquetage du moule sur le bouchon de silicone (figure 2C).
- Autoclaver le réservoir et le complexe de logements-moule.
Remarque: Soyez prudent de tenir sur le bouchon de silicone étroitement lors de l'insertion du moule pour éviter son détachement.
- Assemblez le complexe mandrin-bouchon et les poignées gaze comme décrit dans la figure 2.
Construit à base de gel de collagène 2. génie lisse des cellules musculaires et statique Maturation
- Construit Ingénierie
- Développer porcine cellules aortiques de muscle lisse (les pSMCs) dans 175 cm 2 flacons de culture remplis de 20 ml de milieu de culture complet constitué de milieu Eagle modifié de Dulbecco additionné de 10% (v / v) de sérum de porc (PS), 10% (v / v ) de sérum fœtal bovin (FBS), 1% (v / v) de pénicilline-streptomycine (pen-strep).
- A ≈90% de confluence, détacher pSMCs (passage 2-4) en retirant le milieu de culture à partir de lafiole de pSMCs, en ajoutant 5 ml de solution de trypsine (1x dans une solution saline tamponnée au phosphate, PBS), et en incubant pendant 10 min (T = 37 ° C, 5% CO 2, 100% d'humidité).
- Resuspendre les pSMCs à une concentration de 4 x 10 6 cellules / ml dans du milieu de culture complet.
- Préparer la solution de collagène comme décrit précédemment 10.
- Extraire et recueillir des faisceaux de collagène de tendons de queue de rat dans une solution PBS.
- Transférer les fibres de collagène par la suite dans de l'acétone (5 min), de l'isopropanol 70% (v / v) (5 min) et de l'acide acétique (0,02 N, 48 h, 4 ° C) des solutions.
- Mélanger la solution visqueuse et congélation à -20 ° C pendant 3 jours.
- Lyophiliser la solution congelée pour obtenir éponges de collagène.
- Solubiliser les éponges de collagène dans une solution d'acide acétique (0,02 N) à une concentration de 4 g / L et centrifuger à 29 581 g pendant 45 min vigueur.
- Stériliser la solution de collagène à travers le processus de dialyse contre s ultérieuresolutions de l'acide acétique (0,02 N, 1 h), 1% dans le chloroforme (v / v, 1 h) et de l'acide acétique (0,02 N, solution stérile changé tous les deux jours pendant 1 semaine).
- Recueillir la solution de collagène stérile (4 g / L) dans une hotte de culture cellulaire stérile.
- Préparer des gels de collagène cellularisées comme représenté sur la figure 3.
- Préparer 50 ml de solution tampon stérile par mélange de 35 ml de DMEM (5x), 4 ml de HEPES (1 N), 3 ml de NaOH (1 N) dans 8 ml d'eau désionisée stérile.
- Préparation des cellules et le mélange de gel de collagène dans un récipient placé dans de la glace en mélangeant 50% (v / v) d'une solution de collagène stérile (4 g / L d'acide acétique 0,02 N) à 25% (v / v) de solution tampon et 25% (v / v) de la suspension de pSMCs dans un milieu de culture complet.
- Mesurer le pH du mélange et faire en sorte qu'elle soit comprise entre 7,0 et 7,4.
- Verser doucement 9 ml d'un mélange de collagène et de cellules-dans la / le complexe mentionné ci-dessus du logement de moule (étape 1.4.3, la figure 3A-B ).
- Que ce gel à la température ambiante pendant 1 heure sous le capot de culture cellulaire (figure 3B).
- Elevage en statique bioréacteur
- Retirer le moule (figure 3C) et transférer soigneusement le produit d'assemblage dans le réservoir, contenant 35 ml de milieu de culture (Figure 3D).
- Incuber la construction (T = 37 ° C, 5% CO 2, 100% d'humidité) en position verticale pendant 1 ou 2 semaines de maturation statique.
- Installation d'une caméra web (scellée afin d'assurer l'isolation) à l'intérieur de l'incubateur en face de la construction.
- Changer le milieu de culture tous les 2 jours en aspirant l'ancien milieu de l'orifice de septum luer et re-remplissage du réservoir avec une quantité équivalente de milieu de culture frais.
- Mesure de l'épaisseur et Activité métabolique des CML-collagène Gel-fondé constructions Pendant statique Culture
- Placer l'interféromètre laser de balayage dans la cellule de cultunouveau capot et retournez-le à la verticale à la position horizontale à l'aide d'un niveau à bulle.
- Transférer le bioréacteur dans la hotte de culture de cellules et enlever le produit d'assemblage du réservoir.
- Transférer le produit d'assemblage (encore monté sur le mandrin) dans la voie du faisceau laser, et le placer strictement orthogonalement par rapport à l'axe du faisceau (voir figure 4).
- Lire la valeur affichée sur l'écran de l'interféromètre à laser de balayage, correspondant au diamètre externe de la construction.
- Calculer l'épaisseur de paroi de la construction sur la base de son diamètre externe et interne (à savoir le diamètre du mandrin).
Remarque: Répétez les étapes 2.3.1 à 2.3.5 toutes les heures pendant les 12 premières heures, puis toutes les 24 heures. - Utiliser 1 ml de l'ancien milieu de culture (échantillonné lors de la modification du milieu de culture, l'étape 2.2.4) pour mesurer les concentrations de glucose et de lactate avec l'analyseur de gaz sanguin.
- Utiliser 1 ml de lamilieu de culture frais comme un niveau de référence pour les concentrations de glucose et de lactate 14 mesures.
Remarque: Répétez les étapes 2.3.6 et 2.3.7 tous les 2 jours après le milieu de culture changement.
- Construire récolte pour les autres Ccharacterizations mécanique et biologique
- Après une ou deux semaines de la période de maturation statique, transférer le bioréacteur statique dans la hotte de culture cellulaire.
- Transférez doucement la construction maturité de son mandrin (vidéo supplémentaire 1) à une boîte de Pétri de 100 mm de diamètre contenant 40 ml de milieu de culture frais (figure 5 et la figure 7A).
3. Caractérisation mécanique des constructions dans le sens longitudinal et directions circonférentielles
- Installez le dispositif expérimental constitué du testeur micromécanique équipé d'une cellule de 5 ou 10 N charge et un bain contenant PBS à 37 ° C pour garder les échantillons d'unpseudo-t conditions physiologiques (figure 6).
- Équilibrer la cellule de charge et l'extensomètre.
Remarque: L'équilibrage est une fonction intégrée dans le testeur micromécanique consistant à remettre à zéro la valeur de poste affiché et de la valeur de charge affiché alors qu'aucun échantillon est monté sur la machine. Cette fonction permet de définir la référence pour les deux mesures. - Montage des constructions tubulaires sur l'appareil mécanique: sens longitudinal.
Remarque: Effectuer des tests de fatigue longitudinales directement sur l'ensemble des constructions tubulaires. Utiliser en interne construit pour relier des dispositifs de préhension des poignées de gaze des constructions de la cellule de charge et à la base du bain de PBS.- Montez le tubulaire construire sur les dispositifs de préhension (figure 7B), suivant la procédure de récolte (section 2.4).
- Envelopper les dispositifs de préhension et les poignées de gaze avec du ruban téflon pour empêcher tout glissement des poignées de gaze pendant le test.Monter l'échantillon sur le testeur micromécanique (Figure 7C).
- Montage des constructions en forme d'anneau sur l'appareil mécanique: direction circonférentielle.
Remarque: Effectuer des tests de fatigue circonférentielles sur des échantillons en forme d'anneau sectionnés à partir des constructions tubulaires. Utilisez deux barres en acier inoxydable comme poignées pour tenir les spécimens.- Montez le tubulaire construire sur un tuyau en plastique comme un support marqué avec 5 lacunes mm (figure 7b), après la récolte (section 2.4).
- Couper 10 mm des anneaux de la construction tubulaire.
- Mesurer la longueur de l'échantillon en utilisant un pied à coulisse pour les analyses ultérieures.
- Monter le spécimen en forme d'anneau sur les barres du testeur micromécanique (figure 7C) en acier inoxydable. Assurez-vous de placer les échantillons au centre des barres.
Remarque: Le tuyau en plastique dans l'étape 3.4.1 et un système de coupe comme représenté sur la Figure 7B sont utilisés pour éviter tout dommage à la construction pendant la coupe.
- test de fatigue sur les constructions dans la direction longitudinale ou circonférentielle.
- Étirez la construction de sa longueur initiale.
- Maintenir le produit de construction dans cette position pendant 10 min dans un environnement pseudo-physiologique.
- Appliquer 10% de déformation cyclique de la longueur initiale (30 cycles) pour la construction à 5% le taux de déformation / sec.
- Répétez l'étape 3.5.3 à des étapes supplémentaires de 10% de déformation cyclique jusqu'à la rupture de l'échantillon.
Remarque: L'utilisation de l'environnement de pseudo-physiologique nécessite la prise en compte de la flottabilité et de l'inertie du système de préhension qui affecte la mesure de la charge appliquée. - Enregistrez le fond comme suit:
- Déplacez le cadre de charge à la longueur initiale.
- Répétez les étapes 3.5.3 et 3.5.4 sans aucun échantillon monté, et de garder les dispositifs de préhension liés à la cellule de charge (seulement 1 cycle est requirouge).
4. Luminal endothélialisation des constructions
Note: Après avoir suivi le protocole de récolte (section 2.4), les constructions résister à une manipulation à être monté dans le bioréacteur à paroi rotative pour la poursuite de l'endothélialisation.
- Rotation-mur bioréacteur Conception
- Forer un trou d'un diamètre de 4,5 mm au centre de la calotte de ventilation du tube-réservoir, sans endommager la membrane filtrante qui recouvre les orifices d'aération.
- Press-Fit un mandrin (diamètre = 4,5 mm, longueur = 40 mm) dans le trou et fixer le mandrin comme décrit à l'étape 1.1.2.
- Préparer deux support en silicone en forme de C pour le diamètre externe de construction = 14 mm; = diamètre intérieur 8 mm).
- Positionner un moteur rotatif à une extrémité de la paroi bioréacteur rotatif et un palier à l'autre extrémité (Figure 8B).
- Lumen endothélialisation
- Développer ombilic humainal veine cellules endotheliales (HUVEC) dans 25 cm 2 flacons de culture avec 5 ml de milieu de culture M199 supplémenté avec 10% (v / v) de PS, 10% (v / v) de FBS, 1% (v / v) pen-strep en boîte de Pétri à l'intérieur d'un incubateur (T = 37 ° C, 5% CO 2, 100% d'humidité) jusqu'à 90% de confluence.
- Préparer 1,5 ml de la solution de revêtement de protéines par recombinaison nécessaires pour l'adhésion cellulaire optimale par dilution du mélange de concentré de protéine de 10,5 ng / ml dans du milieu de culture endothéliale de cellules sans sérum.
- Mesurer la longueur de la construction en utilisant un pied à coulisse.
- Calculer le volume luminal V et la région luminale du produit d'assemblage A en tant que: V = D dans 2 L / 4 et A = D L, respectivement en (où D est dans le diamètre intérieur correspondant au diamètre du mandrin, et L est la longueur de la construction).
- Placez la construction au centre du réservoir suivant la procédure de récolte (section 2.4).Utilisez le soutien de silicone en forme de C pour fixer la construction aux deux extrémités pour le réservoir (figure 8A).
- Remplir le réservoir avec 35 ml de milieu de culture.
- Remplir 75% du volume calculé luminale du produit d'assemblage (V) avec la solution de revêtement protéique préparée à l'étape 4.2.2. Fermer les deux extrémités de la construction pour éviter toute fuite de la solution de revêtement de protéine (Figure 8A).
- Assembler le système de bioréacteur à paroi rotative à l'intérieur de la hotte de culture cellulaire.
- Placez le bioréacteur dans un incubateur à 37 ° et de démarrer la rotation du bioréacteur à 4,02 x 10 -5 g vigueur pendant 1 heure pour permettre le revêtement luminal, comme illustré sur la figure 8B.
- Ouvrir l'extrémité supérieure de la construction et aspirer la solution de revêtement de protéine à partir de la lumière.
- Détacher HUVEC (passage 2-3) en retirant le milieu de culture à partir de la fiole de cellules HUVEC et en ajoutant 3 ml de la solution de trypsine (1x dans du PBS). JEncubate pendant 5 min (T = 37 ° C, 5% CO 2, 100% d'humidité).
- Resuspendre les cellules HUVEC à une concentration de 4 x 10 6 cellules / ml dans du milieu M199 additionné de culture.
- A l'intérieur du capot culture cellulaire, ensemencer des cellules HUVEC dans la lumière de la construction, avec une densité de 1000 cellules / cm 2 15. Fermer les extrémités supérieures de la construction pour éviter toute fuite de la solution HUVEC.
- Incuber les constructions (T = 37 ° C, 5% de CO 2, 100% d'humidité) hébergé dans le bioréacteur à paroi (figure 8B) et de la culture pendant 2 jours à une rotation constante de 4,02 x 10 -5 g vigueur.
- Récolter la construction après 2 jours de culture dans des conditions stériles et le préparer pour une caractérisation plus poussée biologique tel que décrit dans la section 2.4.
Résultats
Cet ouvrage décrit la fabrication de constructions à base de collagène tubulaires modifiées contenant des cellules vasculaires. Déjà après une heure de début de la gélification, le mélange cellules-et-collagène a été directement monté dans une géométrie tubulaire 3D, avec le diamètre extérieur égal au diamètre du moule correspondant (environ 14 mm). Tout au long de maturation statique, des mesures ont montré une réduction rapide du diamètre extérieur des structures cellularisées tubulaires, comme le montre le tableau 1. Le diamètre des gels de collagène cellularisées rétréci d'environ 60% de sa valeur initiale après 1 jour de culture statique, et de près de 85% dans les 7 jours (Supplemental vidéo 2). CML dans les constructions sont responsables de la diminution observée et le renforcement mécanique lié, en tant que ce phénomène ne se produit pas dans les échafaudages de collagène non-cellularisées. Notez qu'aucun gradient de tout type (thermique, biochimique, mécanique, ou autres) a été appliquée. Le cellules motricesn compactage conduit à un matériau ayant une plus grande densité de collagène pouvant être manipulé et soumis à des sollicitations mécaniques supplémentaires (Vidéos 3 et 4).
Pour relier les cellules axée remodelage aux propriétés mécaniques et viscoélastiques ensemble, des essais de fatigue ont été réalisées sur les constructions (Vidéos supplémentaires 5 et 6). Ces essais ont consisté à vélo les constructions (30 fois) à différentes souches constants (10%, 20%, et 30% de la longueur initiale) et d'enregistrer le stress comme la réponse des constructions à la sollicitation mécanique dans le temps. Les résultats représentatifs pour une construction sont représentés sur la figure 9. Le produit d'assemblage a résisté à des contraintes plus élevées dans la direction longitudinale (75 kPa) que dans la direction circonférentielle (16 kPa) lorsqu'il est soumis à la même gamme de souche (souche 30%). Pendant ce temps, à chaque cycle, la valeur pic de contrainte atteint pour la tadéformation maximale rgeted a diminué au fil du temps. Ce comportement est typique des propriétés visco-élastiques élevées présentées par ces constructions à base de collagène.
L'activité biologique des constructions a été évaluée cellularisées statique pendant la maturation. Par conséquent, l'activité métabolique des CML a été évaluée en mesurant la consommation de glucose et la production de lactate pendant la culture statique. Le milieu de culture a été prélevé tous les 2 jours et les concentrations de glucose et de lactate ont été mesurées en utilisant un analyseur des gaz du sang. L'augmentation constante de la consommation de glucose et la production de lactate combinée au rétrécissement important des constructions, témoignent de l'activité tout au long de CML culture statique (figure 10).
La stabilité mécanique accrue en raison de la entraînée remodelage cellulaire a permis à la manipulation des produits d'assemblage et le processus de l'endothélialisation subséquente. Trichrome de coloration de Masson effectuée sur les constructions endothélialiséesa montré une très homogène endothélium. SMC présentait une morphologie en forme de fuseau et semblait comme dispersé de manière homogène à travers la paroi, tandis que HUVECs apparu bien réparti dans le côté luminal (Figure 11).
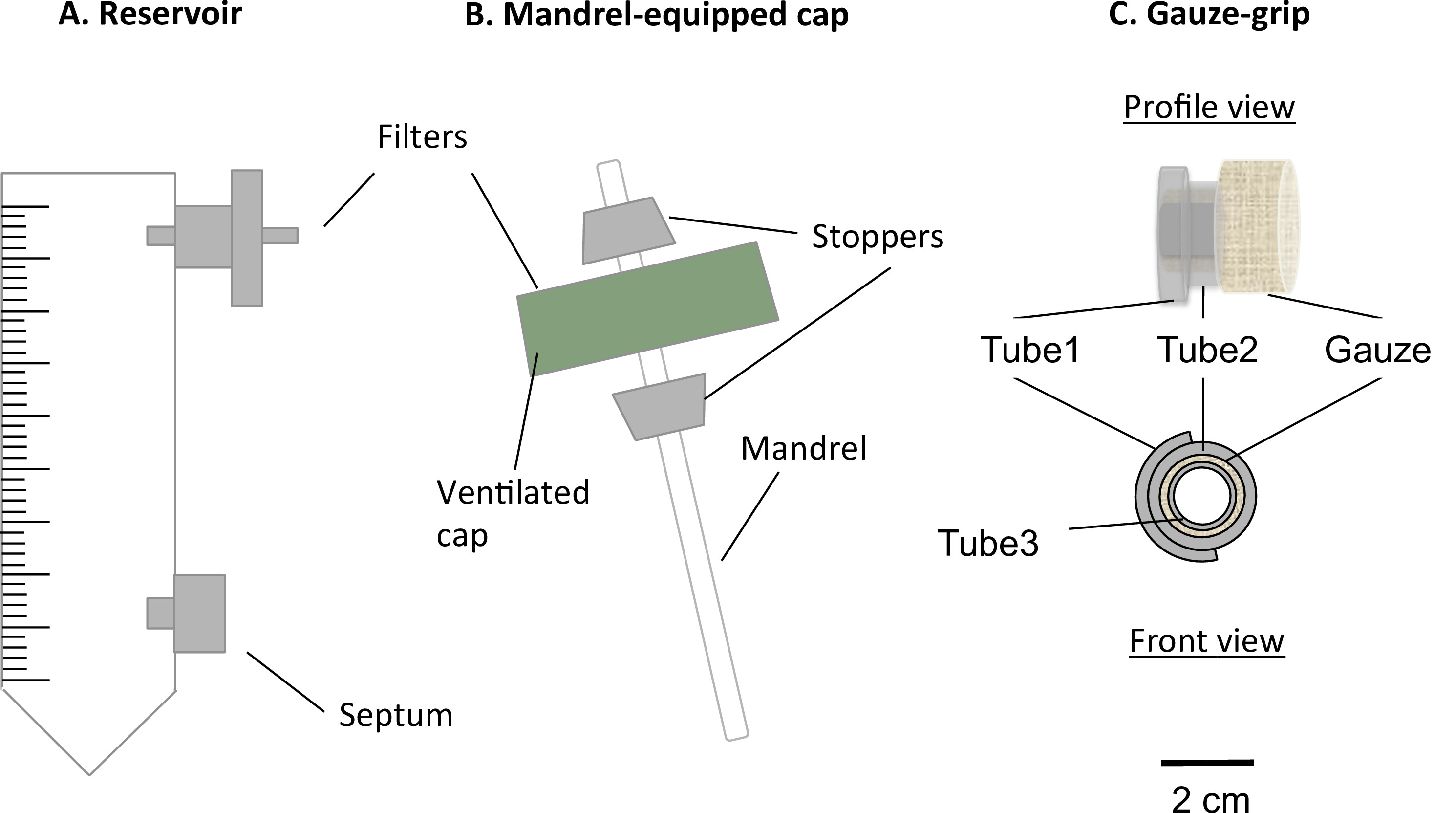
Figure 1:. Des composants du bioréacteur Le bioréacteur statique statique composée d'un tube modifiée centrifuge de 50 ml (A) et un bouchon de mandrin équipée (B). Le tube a servi en tant que réservoir de fluide, et est équipé d'un port pour un filtre de 0,22 um, pour l'échange de gaz, et d'un septum, par le moyen d'échantillonnage et la modification. Un mandrin présente dans le capuchon ventilé a permis la fabrication de constructions en forme tubulaire. Les gaze poignées (C) ont été conçus et fabriqués pour soutenir la gélification des constructions sur le mandrin. En outre, ceux-cipoignées autorisés les constructions à traiter après la maturation statique et à être fixés à l'appareil mécanique. Le diamètre extérieur du mandrin était de 4,7 mm.
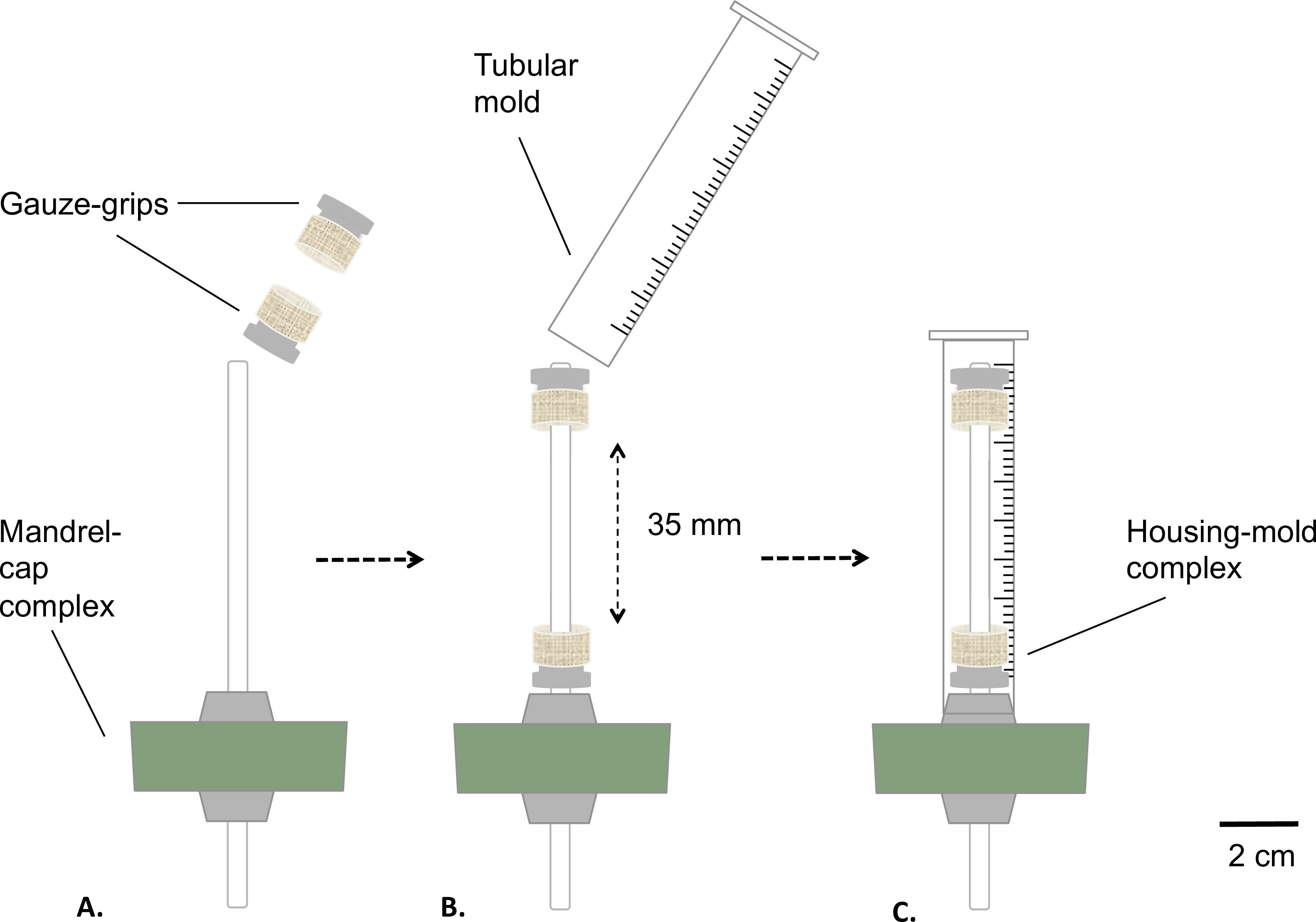
Figure 2: Montage du bioréacteur statique Montage phases du bioréacteur avant la stérilisation.. Les poignées gaze ont été montées sur le mandrin (A) à une distance fixe. Un moule a été inséré (B) et fixé de façon étanche sur le bouchon de silicone (C). Le diamètre extérieur du mandrin était de 4,7 mm.
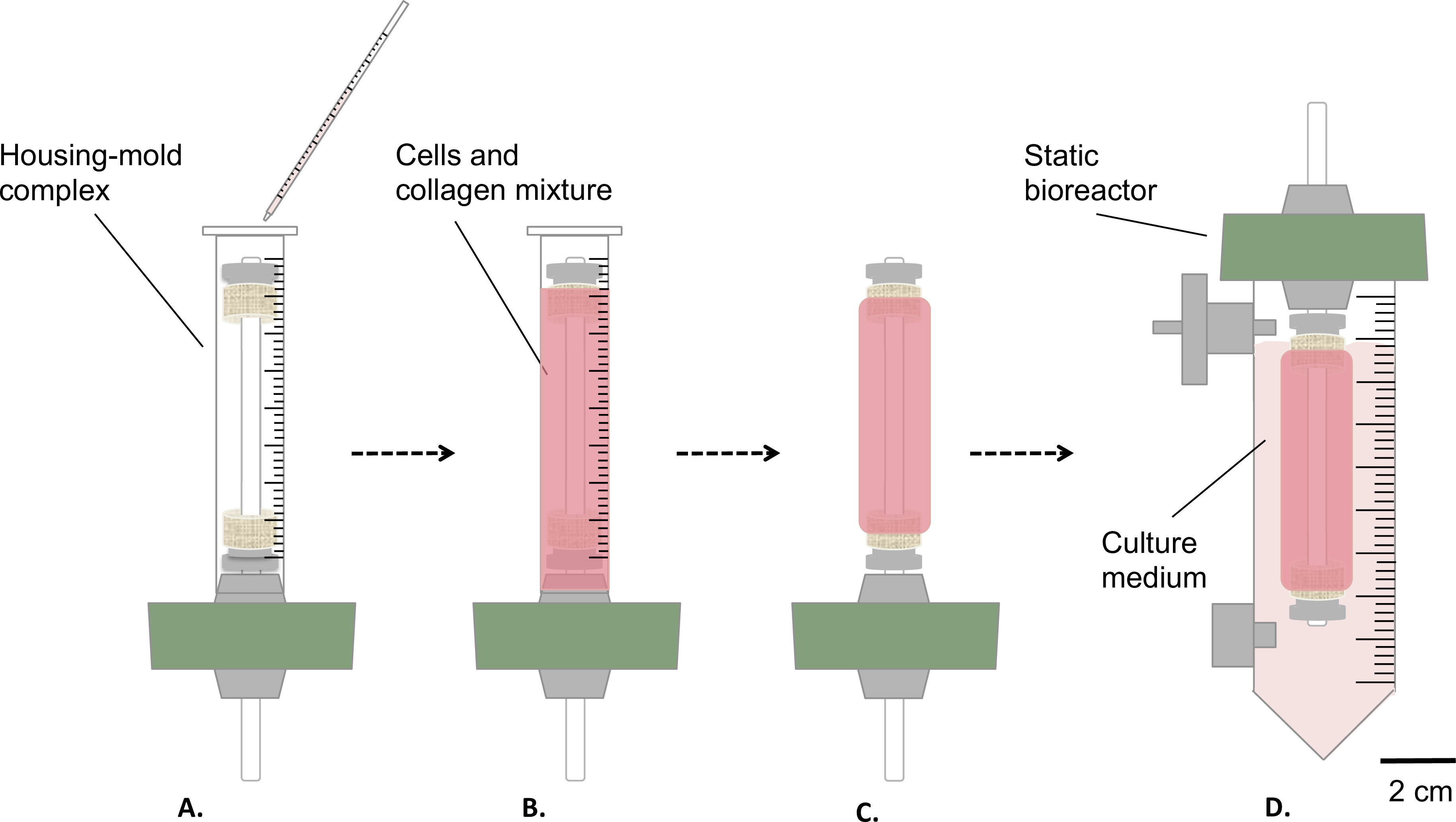
Figure 3:. Fabrication des produits d'assemblage dans des conditions stériles, le mélange de cellules et de collagène a été versé dans le moule complexe logement (A), et laisser le gel pendant 1 heure à température ambiante (B). Ensuite, le moule a été retiré (C), le bioréacteur a été assemblé statique (D) et transféré dans un réservoir statique pour la maturation du produit de construction dans un incubateur (T = 37 ° C, 5% CO 2, 100% d'humidité). Le diamètre extérieur du mandrin était de 4,7 mm.

Figure 4:.: Mesure de l'épaisseur / diamètre extérieur des constructions Un interféromètre à balayage laser a été utilisé pour effectuer la mesure des diamètres extérieurs des constructions. Le produit d'assemblage a été placé dans le trajet du faisceau laser et génère une ombre. La largeur de l'ombre, ce qui correspond au diamètre extérieur de la construction, a ensuite été mesuré et affiché sur l'écran.

Figure 5:. Apparence morphologique de la construction récolté (A) Juste après la gélification et (B) après que les cellules axée remodelage pendant la maturation statique pendant 2 semaines.

Figure 6: Experimental set-up pour les caractérisations mécaniques Elle se composait du testeur micromécanique équipé d'une cellule de 5 ou 10 N charge et un bain contenant du PBS à 37 ° C pour conserver les échantillons dans des conditions de pseudo-physiologique..
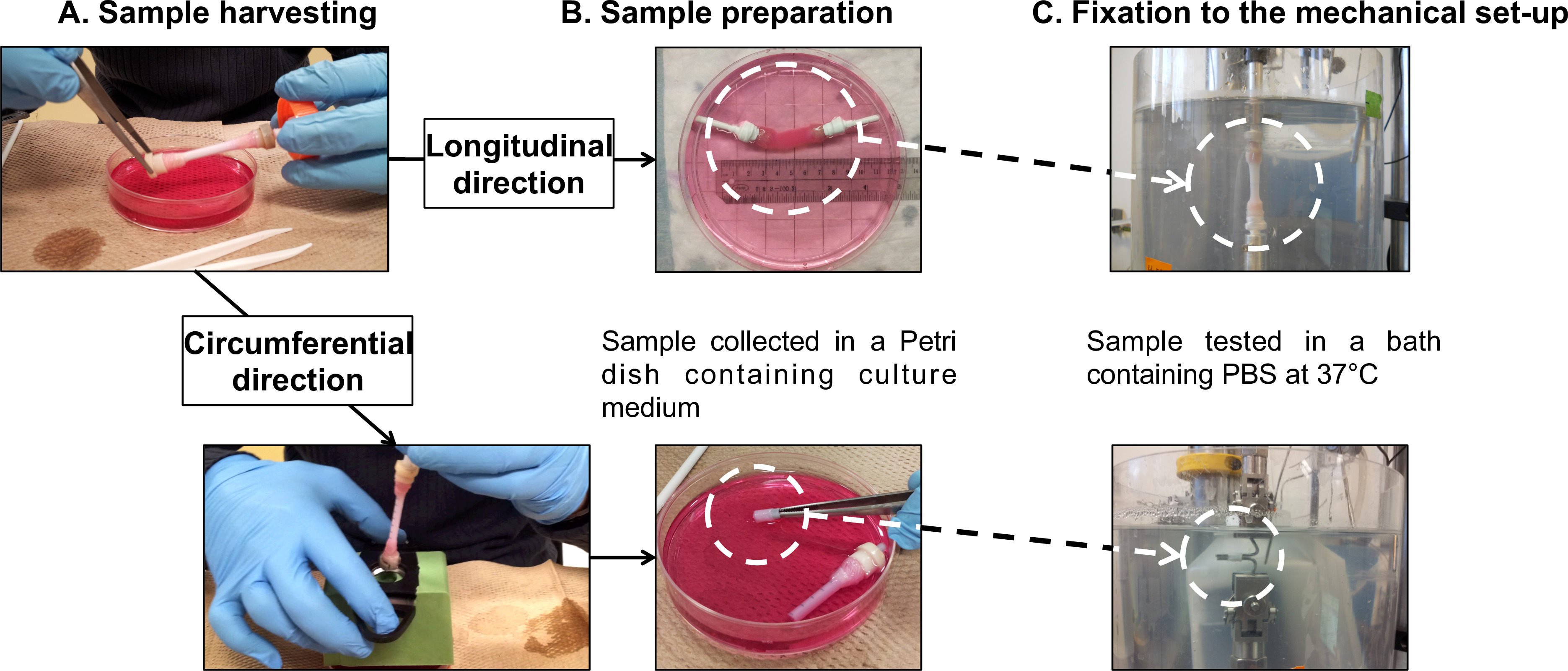
Figure 7: Préparation de l'échantillon f ou caractérisations mécaniques. de récolte de l'échantillon (A) et de la préparation (B) pour des essais de fatigue effectués dans le sens longitudinal et les directions circonférentielles (C). Le diamètre extérieur du mandrin était de 4,7 mm.
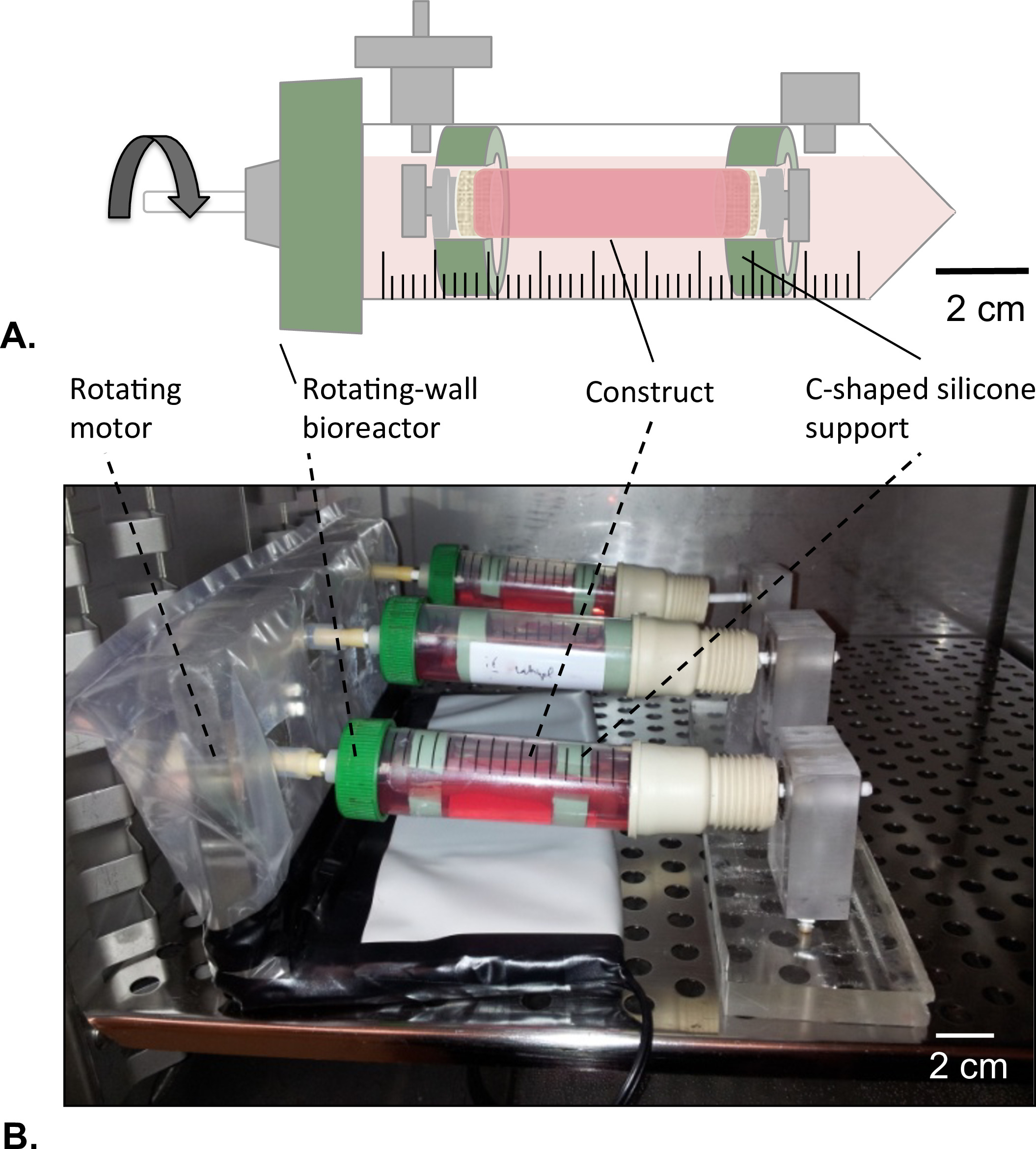
Figure 8: Rotation mur bioréacteur (A) Les constructions tubulaires ont été assemblés dans le centre du réservoir à l'aide d'un soutien de silicone en forme de c.. Les deux extrémités de l'assemblage ont été fermés pour éviter toute fuite de la solution HUVEC. (B) Les produits de construction ont été cultivées dans un incubateur (T = 37 ° C, 5% CO 2, 100% d'humidité) en rotation à 4,02 x 10 -5 g vigueur durant 2 jours.
2 / 52812fig9highres.jpg "width =" 700 "/>
Figure 9:.. Caractérisations mécaniques résultats des essais de fatigue effectués sur des constructions dans le sens longitudinal (A) et (B) des directions circonférentielles après remodelage entraîné de cellules S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
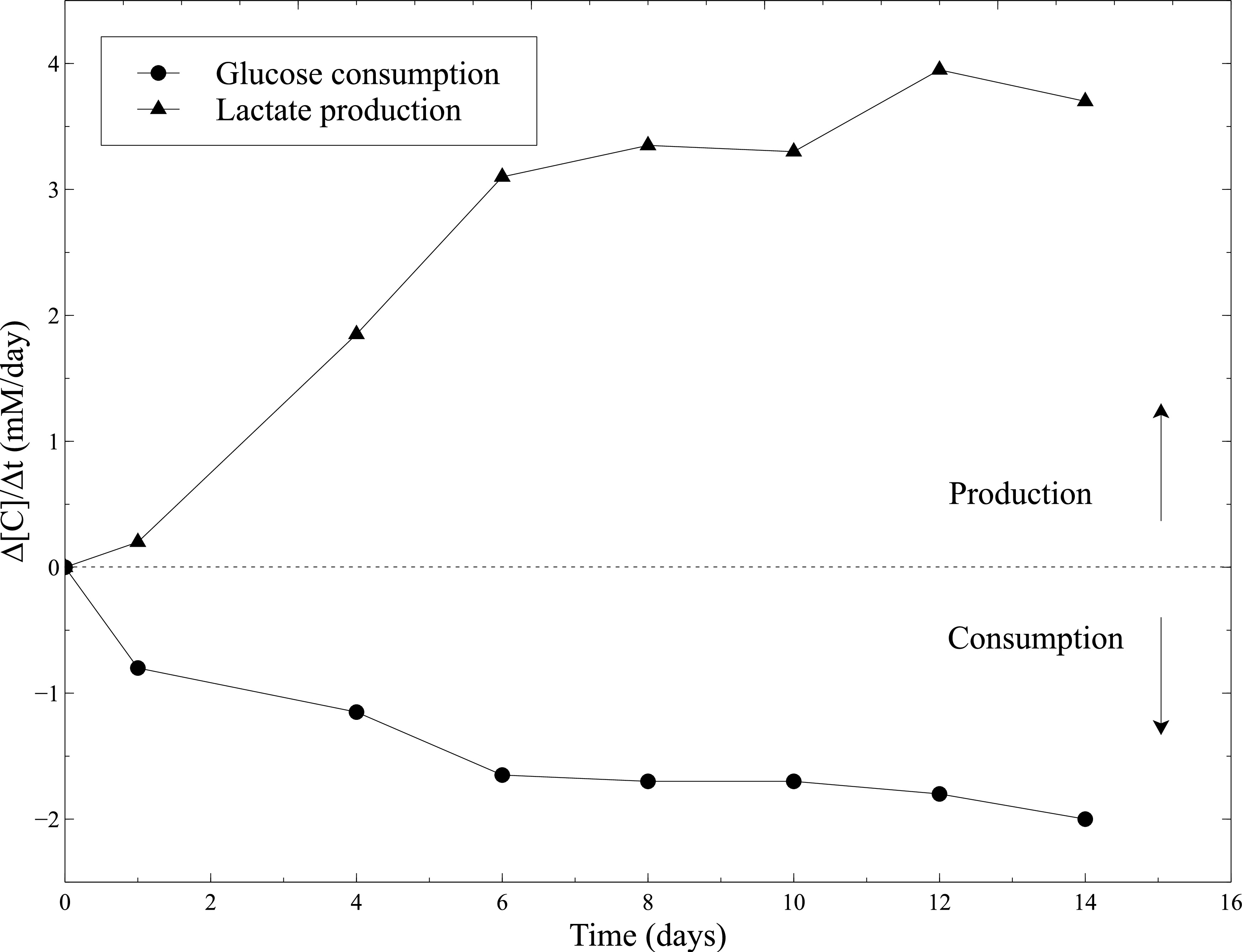
Figure 10:. L'activité métabolique des CML, dans les gels de collagène Les mesures des taux de consommation du glucose et la vitesse de production de lactate ont été réalisées avec l'analyseur de gaz de sang toutes les 2 jours après le changement de milieu de culture. Milieu de culture frais a été utilisé en tant que niveau de référence pour les concentrations de glucose et de lactate mesures.
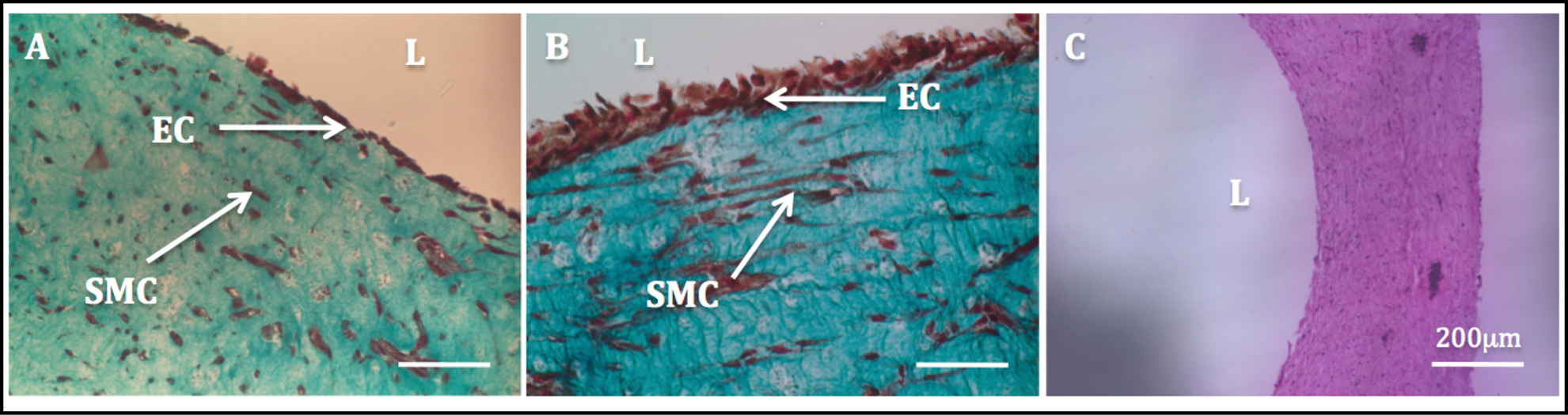
Figure 11: Lumen endothélialisation images histologiques de sections transversales radiales des constructions tubulaires.. Trichome la coloration de Masson de constructions tubulaires en culture statique pendant 1 semaine (A) et 2 semaines (B). Coloration H & E d'une construction tubulaire (C).
| Temps | Epaisseur (mm) | Compactage (%) |
| 0 h | 4,83 ± 0,02 | 0 ± 0 |
| 2 h | 4,26 ± 0,02 | 12 ± 0 |
| 4 h | 4,21 ± 0,03 | 13 ± 1 |
| 6 heures | 4,06 ± 0,10 | 16 ± 2 |
| 12 hr | 3,16 ± 0,07 | 35 ± 1 |
| Un jour | 2,08 ± 0,11 | 57 ± 2 |
| 1 semaine | 0,68 ± 0,07 | 86 ± 1 |
| 2 semaines | 0,36 ± 0,00 | 93 ± 0 |
Tableau 1: tassement rapide du diamètre de la construction au cours de la maturation statique épaisseur de paroi des produits d'assemblage et le taux de compression en fonction du temps de culture statique.. Le compactage a été mesurée en déterminant le diamètre extérieur des constructions tubulaires avec un interféromètre laser de balayage (Série 183B, LaserMike 136). Après 24 heures, les constructions compactés à 57% ± 2% de leurs dimensions moulées. Les données sont exprimées en moyenne ± SD (n = 3). La présence et l'activité des cellules musculaires lisses vivre était la seule responsable de ces changements majeurs.
Supplemental Vidéo 1:. La récolte des gels non rénové de collagène tubulaire S'il vous plaît cliquer ici pour voir cette vidéo.
Supplemental Vidéo 2:. Les cellules axée compactage des gels de collagène tubulaires S'il vous plaît cliquer ici pour voir cette vidéo.
Supplemental Vidéo 3:. Manipulation des gels non rénové de collagène tubulaire S'il vous plaît cliquer ici pour voir cette vidéo.
Supplemental Vidéo 4:. La manipulation des cellules remodelé collagène tubulaire gels S'il vous plaît cliquer ici pour voir èmeest la vidéo.
Supplemental Vidéo 5:. Essai de fatigue longitudinale (à 30%) sur les cellules rénovées collagène tubulaire gels S'il vous plaît cliquer ici pour voir cette vidéo.
Supplemental Vidéo 6:. Essai de fatigue périphérique (à 30%) sur les cellules rénovées collagène tubulaire gels S'il vous plaît cliquer ici pour voir cette vidéo.
Discussion
Parmi la communauté des ingénieurs de tissus vasculaires, d'énormes efforts ont été fait pour reproduire la couche de tunique responsable de la stabilité mécanique des vaisseaux sanguins 16. Depuis les travaux pionniers de Weinberg et Bell 17, le collagène a été largement utilisé comme un échafaudage pour l'ingénierie des tissus vasculaires en raison de ses propriétés de biocompatibilité, non immunogènes et la disponibilité. Cependant, l'utilisation de collagène représente un grand défi pour les chercheurs, car ce matériau est pas facile à gérer, en raison de l'absence intrinsèque de rigidité mécanique. Manipulations pendant la préparation d'échafaudage peuvent endommager les échafaudages, les compromettre pour une utilisation ultérieure.
La technique décrite dans ce travail permet: i) à l'ingénieur des gels de collagène cellularisées dans une géométrie de forme tubulaire; ii) à l'ingénieur tissus biologiques assez fort pour être manipulés après une période de maturation statique courte (1 à 2 semaines); iii) commepropriétés mécaniques et viscoélastiques sess de ces tissus biologiques de forme tubulaire dans 2 directions. Les cellules dans le gel jouent un rôle clé dans le remodelage de la matrice de collagène. Au cours de la période de maturation, SMC contractiles ont conduit à la compaction des gels donnant une construction avec une stabilité mécanique plus élevée pouvant être évalués dans les directions longitudinale et circonférentielle. Ensuite, des cellules HUVEC ensemencées sur le côté luminal des constructions ont généré un endothélium homogène et viable, ce qui démontre l'aptitude des gels de collagène pour des applications d'ingénierie tissulaire vasculaires.
Le bioréacteur présenté dans ce travail a été spécifiquement conçu pour fournir un environnement optimal pour la croissance des cellules en cours de maturation statique. En outre, les dispositifs développés pour la caractérisation des propriétés mécaniques et viscoélastiques des constructions ont été conçues dans le but de réduire tout dommage potentiel inhérent à la manipulation deces matériaux délicats. Par conséquent, le bioréacteur statique a été équipé d'un filtre de 0,22 pm et une membrane de filtre sur le couvercle (étape 1.1.2, Figure 1A et B) qui a permis l'échange de gaz entre le milieu de culture à l'intérieur du réservoir et l'incubateur, tout en maintenant un milieu de culture stérile. La cloison à lumière en bas a été utilisé en tant que port de milieu de culture au cours de l'échantillonnage et la modification culture statique. Certaines étapes critiques doivent être considérées lors de la fabrication et construction caractérisations. Toutes les manipulations effectuées (dans l'étape 2.1.1 et dans les étapes suivantes) qui pourraient altérer la stérilité du système ont été effectuées dans une hotte biologique stérile. Cellules et gel de collagène préparation du mélange a été traité sur la glace afin de retarder le processus de gélification (étapes 2.1.4 à 2.1.7). A l'étape 2.1.7, des bulles d'air emprisonnées dans le mélange avant la gélification sont des zones de concentration des contraintes potentielles qui peuvent compromettre les sla rentabilité des constructions. Par conséquent, l'élimination de ces bulles d'air nécessite légèrement secouer l'ensemble ou en utilisant un vide médical pendant 3 min pour dégazer dans des conditions stériles. Enfin, les pinces ont été spécifiquement conçus pour le maintien de l'axe central du mandrin dans le moule tubulaire au cours de la gélification et pour permettre une manipulation délicate des produits d'assemblage pendant la récolte (enlèvement du mandrin, section 2.4), pour l'endothélialisation, et pour faciliter le montage sur le système mécanique (tests longitudinaux).
Le présent protocole propose une alternative approche originale et facile à processus de renforcement des gels de collagène constructions basé sur le potentiel de contraction inhérente naturelle des CML. Les techniques courantes de matrices de collagène renforcement impliquent l'utilisation d'agents de reticulation physiques et chimiques qui peuvent avoir des effets nuisibles sur les interactions cellules-matrice 18-20. La technique de fabrication présenté dansCe travail permet de diriger ce processus de remodelage cellules axée pour obtenir une construction de génie tissulaire avec des propriétés mécaniques ciblées sans aucun traitement physique ou chimique.
Caractérisation des propriétés mécaniques et viscoélastiques des gels de collagène hydraté est un grand défi. Dans cette perspective, le présent protocole décrit une méthode simple et efficace d'origine pour évaluer les propriétés mécaniques des tissus mous tubulaires. Cette caractérisation peut être effectuée non seulement dans la direction circonférentielle, mais également dans la direction longitudinale, directement sur l'ensemble de la structure tubulaire. Au cours de caractérisation mécanique, température, milieu aqueux, le pH et la force ionique sont certains des facteurs environnementaux qui sont connus pour affecter considérablement le comportement mécanique des tissus biologiques 21. Par conséquent, le présent ouvrage propose une mise en place et le protocole original pour la caractérisation mécanique des tissus biologiques dans un trèsreproductible pseudo-physiologique environnement (solution saline à 37 ° C et pH 7,4). Au meilleur de notre connaissance, ce genre de caractérisation n'a jamais été signalée ailleurs.
En conclusion, la technique proposée dans ce travail démontre le fort potentiel de mélange direct des cellules avec le collagène pour les applications d'ingénierie tissulaire vasculaires. Ce procédé ainsi que le procédé de caractérisation mécanique endothélialisation et constitue protocoles polyvalents élevées. Ainsi, grâce à de légères modifications des set-ups et des protocoles tout en gardant la même logique, les principales exigences pour les équivalents de tissus vasculaires d'ingénierie peuvent être abordés tels que le traitement rapide et simple, y compris endothélialisation, et la possibilité d'être transposé à un large éventail de doux tissus avec différentes longueurs et diamètres. En outre, différents types de cellules adhérentes, les protéines de l'ECM et géométries moulé peut être étudié pour un certain nombre de cibles applications, tels que les tendons d'ingénierie, les greffes de peau, les patchs, les nerfs cardiaques, entre autres. Bien que les propriétés mécaniques des constructions sont encourageants, ils sont encore inférieurs à ceux des tissus natifs. Dans ce contexte, nous croyons fermement que une période très courte statique de maturation est une étape cruciale vers la stimulation dynamique dans un bioréacteur, conduisant ainsi à une intégrité structurelle élevée et la stabilité mécanique. Toutefois, la possibilité de produire rapidement cellularisées constructions à base de collagène de l'ingénierie tissulaire approprié pour mécanique et histologique analyses rend le bioréacteur statique décrit ici un outil utile et prometteuse pour donner un aperçu de l'interaction entre les cellules et ECM pendant la croissance et le remodelage, ou même de être utilisé comme modèle pour des thérapies et des systèmes de délivrance de médicaments.
Déclarations de divulgation
Aucun financement n'a été reçues d'organisations ou agences avec le conflit d'intérêts potentiel.
Remerciements
Cette recherche a été financée par le Centre de recherche du CHU de Québec en sciences naturelles et en génie du Canada, l'Institut canadien de recherche en santé et.
matériels
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
Références
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon