Method Article
혈관 조직 재생을위한 엔지니어링 3D Cellularized 콜라겐 젤
요약
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
초록
합성 물질은 혈관 대용으로 이식 때 염증, 협착, 감염 등의 임상 적 합병증을 시작하는 것으로 알려져있다. 콜라겐 인해 고유의 생체 적합성 광범위 생의학 광범위한 애플리케이션에 사용 된 합성 물질에 유효한 대안으로 간주된다 (즉, 낮은 항원 성, 염증 및 세포 독성 반응). 그러나, 제한된 기계적 특성 및 콜라겐 겔 관련된 낮은 핸드 능력은 혈관 조직 공학용 지지체 물질로서의 용도를 방해했다. 따라서, 본 작업 배후의 이론적 근거는 평활근 세포를 처리하기에 충분히 딱딱한 조직을 얻기 콜라겐 매트릭스 구동의 재구성을 개선하도록 관형 기하 형상 및 제 cellularized에 콜라겐 겔을 엔지니어 제였다.
여기에 설명 된 전략 차원 cyli 콜라겐 및 평활근 세포 (구성)의 직접 조립에 기초성형 기술의 사용과 ndrical 기하학. 이 프로세스는 1 또는 2 주 (외부인가 동적 기계적 제약없이) 구조는 정적 조건에서 생물 반응기에서 배양되는 동안 숙성 기간을 필요로한다. "정적 생물 반응기는"구조에 대한 모니터링하고 제어 무균 환경 (PH, 온도, 가스 교환, 영양 공급 및 폐기물 제거)를 제공합니다. 배양 기간 중, 두께 측정은 콜라겐 매트릭스의 셀 중심 리모델링을 평가하기 위해 수행하였으며, 글루코스 소비와 락트산 생산 속도는 세포 대사 활동을 모니터링하기 위해 측정 하였다. 마지막으로, 기계 및 점탄성 특성 결과 관상 구조에 대해 평가 하였다. 이 때문에, 특정 프로토콜과 집중 노하우 (조작, 등등, 그립 수화 된 환경에서 작업 등)에 엔지니어링 조직을 특성화하기 위해 개발되었다.
서문
혈관 조직 공학 골격 합성, 세포 시트 기반 조직 공학적 혈관 (TEBVs), 및 세포 외 기질 (ECM)에 기초한 설계를 포함 이식편 혈관의 제조, 겨냥한 다른 전략 분계 TEBVs을 계획한다. 이러한 방법 중, 합성 고분자는 기계적 특성을 나타낸다, 그러나 생체 활성 1 부족으로 공통의 단점을 공유 할 수 있습니다. 세포 시트 기반의 방법은, 높은 기계적 특성과 설계 대체 혈관의 생성을 허용하지만, 이러한 그라프 트를 생산하기 위해 필요한 시간은 약 2 28주이다. 콜라겐, 엘라스틴, 섬유소 3 또는 이들의 조합으로 전자 재료의 천연 바이오 폴리머는, 이들의 조직 공학 발판을위한 황금 표준 물질을 남아있다. 이는 주로 기능성 세포 반응 4-5을 유도 할 수있는 동안이 물질은 일반적으로 좋은 생체 적합성을 가지고있는 이유입니다. 이러한 생체 고분자 중S, I 형 콜라겐은 피부 혈관 및 힘줄과 같은 많은 조직에서의 ECM의 가장 풍부하고 주된 하중 단백질 중 하나이다. 광범위한 작업 콜라겐 (6)의 기계적 특성에 실시 된 - 8하지만 정적 숙성 중에 콜라겐 겔 셀룰러 리모델링에서만 몇몇 연구가 있었다. 셀룰러 리모델링 콜라겐 원 섬유 네트워크 (9)의 안정성에 영향을 미칠 수있는 세포에 의해 유도 된 콜라겐 매트릭스의 구조적 변형을 말한다. 자연 발판으로, I 형 콜라겐의 비교적 큰 수량, 고립 된 멸균 쥐 꼬리 힘줄 (10)와 같은 다른 소스에서 저장 될 수있다. 콜라겐과 세포의 상호 작용과 cellularized 콜라겐 지지체 (구조)의 관련 전체 기계적인 행동을 이해하는 것은 조직의 건설을위한 필수적인 단계이다. 콜라겐 기반 TEBVs 직접 세포와 콜라겐을 혼합하여 처리 될 수있다젤 준비하는 동안 추가로 같은 관상 및 평면 (11)과 같은 특정 모양으로 성형. 젤 내부의 혈관 세포 증식 및 리모델링 유형은 내가 12 콜라겐. 따라서,이 방법은 조직 공학 응용을위한 골격의 발달에 중요한 문제 중 하나를 나타내는 특정 거대 다공성의 필요성을 우회. 그러나, 콜라겐 겔의 주요 단점은 낮은 기계적 성질은 합성 물질 (13)과 비교된다.
이 연구에서, 세포의 균일 한 분포를 가진 살아있는 조직은 하나의 단계 과정에서 세포와 콜라겐을 직접 혼합하여 설계 하였다. "정적 바이오 리액터"는 (외부인가 동적 기계적 제약없이) cellularized 콜라겐 겔의 정적 숙성 1 또는 2 주 동안 사용 하였다. 문화 동안, 콜라겐 매트릭스 리모델링 따라서 구조에 구조 보강을 제공 발생했습니다. 또한, 이러한 구조는 R 있었다eady는 회전 벽 생물 반응기로 전송하고 균일 한 내피는 달성되었다. 또한,이 연구에서 특정한 기계적 시험 프로토콜은 또한 관형 연조직의 기계적 성질을 특성화에 적합한 신규 한 접근 방식을 제공하기 위해 제안된다.
요약하면, 본 연구는 체외 신속한 제조 및 생물학적, 기계적 특성 분석 용뿐만 아니라, 결정적으로 간주되는 동적 생물 반응기에서 상기 기계적 조절에 대해뿐만 아니라 취급하기에 충분히 강한 혈관 조직의 성숙을위한 방법을 제시 조직의 재생에 단계.
프로토콜
정적 생물 반응기 1. 제조 및 조립
- 저수지의 제조
- 생물 반응기를위한 배지 저수지로 50 ㎖ 원심 분리기 튜브를 준비합니다.
- 각각 20 바닥에서 MM 및 저수지의 상단에 두 개의 5mm 직경의 구멍을 드릴로 두 개의 포트를 확인합니다. 그런 다음 5mm 길이의 실리콘 튜브에 두 루어 피팅을 삽입합니다. 구멍을 통해이 루어 피팅을 눌러-에 맞게, 의료 학년 실리콘 접착제를 가진 모든 연결을 봉인.
- 저장 (그림 1A)의 상부 포트에 0.22 μm의 필터를 삽입합니다.
- 저장 (그림 1A)의 하부 포트에 루어 격막을 삽입합니다.
- 맨드릴 캡 어셈블리
- 에어레이션 구멍을 덮는 필터 멤브레인을 손상시키지 않고 저장 튜브의 통기성 캡의 중심에 4.5 mm 직경의 구멍을 뚫는다.
- 교반 막대를 준비 (직경 = 4.5 mm, 길이 = 100mm) 구조에 대한 맨드릴있다.
- 이 실리콘 삼각 스토퍼 (길이 = 10mm, 중간 구멍 직경 = 4.5 mm)를 준비합니다.
- 도 1b에 기술 된 바와 같이, 맨드릴과 캡 (캡, 맨드릴 착체)를 조립한다.
- 구멍에 맨드릴을 눌러 - 맞습니다. 캡이 그들 사이에 설치되도록 맨드릴을 통해 2 스토퍼를 삽입합니다. 그 유용한 길이가 78mm가되도록 맨드릴의 위치를 조정합니다.
- 함께 캡과 실리콘 원추형 마개를 결합하기 전에 접촉 할 것이다 표면에 프라이머 다음 의료용 실리콘 접착제를 적용합니다. 캡에 여분의 접착제를 제거합니다.
- 1~3일 실온에서가 건조 보자.
- 거즈 - 그립의 제조
- 3 실리콘 튜브 (:; : 직경 = 6.4 mm, 길이 = 10mm, 튜브 3 : 직경 = 3.1 mm, 길이 = 12mm 관 (2) 내부 직경 = 6.4 mm, 길이 = 5mm 관 (1))를 준비합니다.
- 설명과 거즈 - 그립을 조립그림 1C에서 D.
- 컷 튜브 1 종, 튜브 2 위를 열고 실리콘 접착제와 함께 그들을 스틱.
- 5cm X 7cm 시트를 무균 수술 거즈를 절단 한 다음 거즈의 긴 쪽을 따라 관 (3)을 통해 단단히 거즈 롤. 거즈를 통해 관 1 관 2 단지를 삽입합니다.
- 8mm의 길이에 함께 거즈, 튜브 1 튜브 (2) 복잡하고 튜브 3. 잘라 거즈를 스틱 실리콘 접착제를 추가합니다.
- 조립 및 살균
- 도 2에 기술 된 바와 같이, 맨드릴 캡 복잡하고 거즈 그립을 조립한다.
- 코트 의료용 그리스 (그림 2A)와 맨드릴. 맨드릴 (그림 2B)를 통해 거즈 - 그립을 놓습니다. 서로 35mm의 고정 값으로 그립을 거리.
- (테이블 톱 (최종 길이 = 8 mm)를 사용하여 10 mL의 주사기의 하단 부분을 제거함으로써 통 형상 주형을 준비 그림 2B).
- 거즈 그립 장착 된 맨드릴 캡 어셈블리 (주택 금형 단지)를 통해 금형을 삽입, 스냅 - 피팅 실리콘 마개 (그림 2C)에 금형을.
- 저장조와 하우징 주형 복합체를 압력솥.
참고 : 그것의 분리를 방지하기 위해 금형을 삽입 할 때 단단히 실리콘 마개에 저장하기에주의해야합니다.
- 도 2에 기술 된 바와 같이, 맨드릴 캡 복잡하고 거즈 그립을 조립한다.
2. 엔지니어링 평활근 세포 콜라겐 젤 기반 구축 및 정적 성숙
- 공학를 구축
- 둘 베코 변형 이글 배지 이루어진 완전한 배양 배지 20 ㎖ 충전 175cm 2 배양 플라스크에서 확대 돼지 대동맥 평활근 세포 (pSMCs)는 10 % (v / v)의 돼지 혈청 (PS), 10 % (V / V로 보충 ) 소 태아 혈청 (FBS), 1 % (v / v)의 페니실린 - 스트렙토 마이신 (PEN-연쇄상 구균).
- ≈90 % 합류시에서 배양 배지를 제거함으로써 pSMCs (통로 2-4)를 분리pSMCs의 플라스크에 트립신 용액 5 ㎖ (인산 완충 식염수 (1X)에, PBS)를 첨가하고, 10 분 (T = 37 ° C, 5 % CO 2, 습도 100 %) 동안 배양.
- 완전 배지에서 4 × 106 세포 / ml의 농도로 재현 탁을 pSMCs.
- 이전 10 설명 된대로 콜라겐 솔루션을 준비합니다.
- 추출하고 PBS 용액에 쥐 꼬리 힘줄에서 콜라겐 번들을 수집합니다.
- 아세톤 (5 분), 이소프로판올 70 % (V / V) (5 분) 및 아세트산에이어서 콜라겐 섬유를 트랜스퍼 (0.02 N, 48 시간, 4 ° C) 용액.
- 3 일간 -20 ° C에서 점성 용액과 동결 블렌드.
- 콜라겐 스폰지를 얻는 냉동 용액을 동결 건조.
- 45 분 동안 29,581g 력에서 4g / L 및 원심 분리기의 농도의 아세트산 용액 (0.02 N)로 콜라겐 스폰지를 용해.
- 후속 S에 대해 투석 과정을 통해 콜라겐 용액을 소독아세트산의 olutions (0.02 N, 1 시간), 클로로포름 1 % (V / V, 1 시간), 아세트산 (0.02 N, 무균 용액 1 주일 동안 2 일마다 변경).
- 무균 세포 배양 후드에서 멸균 콜라겐 용액 (4g / L)를 수집합니다.
- 그림 3과 같이 cellularized 콜라겐 젤을 준비합니다.
- 멸균 탈 이온수 8 mL의 DMEM에서 35 ㎖ (5 배), HEPES (1 N) 4 ㎖, 수산화 나트륨 (1 N) 3 ㎖를 혼합하여 멸균 완충 용액 50 ㎖를 준비한다.
- 완충 용액과 25 % (v / v)의 25 %로 (v / v)의 멸균 콜라겐 용액 (아세트산 0.02 N의 4g / L) 50 %를 혼합하여 얼음에 넣고 용기 내의 세포와 콜라겐 겔 혼합물을 제조 (v / v)의 완전한 배지에서 pSMCs의 정지.
- 혼합물의 pH를 측정하고 7.0과 7.4 사이에 있는지 확인합니다.
- 상술 한 하우징 / 주형 착물 (단계 1.4.3,도 3A-B에 셀 - 및 - 콜라겐 혼합물 부드럽게 9 ml에 붓고 ).
- 이 세포 배양 후드 (도 3b) 하에서 실온에서 1 시간 동안 젤하자.
- 정적 생물 반응기에서 성숙
- 배지 (그림 3D)의 35 ml의를 포함, 금형 (그림 3C)를 제거하고 저수지로 조심스럽게 구조를 전송합니다.
- 정적 숙성 1 또는 2 주 동안 수직 위치에서 구조체 (T = 37 ℃에서, 5 % CO 2, 습도 100 %)를 인큐베이션.
- 구조체 앞에 배양기 내부 (절연을 보장하기 위해 밀봉 된) 웹 카메라를 설치한다.
- 루어 격막 포트에서 오래된 배지를 흡인하고, 신선한 배지의 등량 저장조를 다시 작성하여 2 일마다 배지를 변경한다.
- SMCs 콜라겐의 두께 및 신진 대사 활동의 측정은 정적 문화 동안 구조를 젤 기반
- 셀 cultu 내로 주사 레이저 간섭계를 배치후드 Re 및 정신 수준을 사용하여 수평 위치에서 수직 플립.
- 세포 배양 후드로 생물 반응기를 전송하고 저수지에서 구조를 제거합니다.
- 레이저 빔의 경로에 구조체 (여전히 맨드릴에 탑재)를 전송하고 (도 4에 도시 된 바와 같이) 광 축에 대하여 엄격하게 직교 배치.
- 구조체의 외부 직경에 대응하는 주사 레이저 간섭계의 화면에 표시된 값을 읽는다.
- 외부 및 내부 직경에 (즉 맨드릴 직경) 기반 구조의 벽 두께를 계산한다.
참고 : 처음 12 시간 후 매 24 시간 동안 매 시간마다 2.3.5하는 단계 2.3.1를 반복합니다. - 혈액 기체 분석기로 락 테이트 및 포도당의 농도를 측정하기위한 (배지, 단계 2.2.4 변경시 샘플링) 오래된 배지 1 ㎖를 사용한다.
- 1 ㎖를 사용하여포도당, 젖산 농도 측정 (14)에 대한 기준 레벨과 신선한 배지.
참고 : 단계 2.3.6과 문화 매체 변경 한 후 2.3.7 2 일마다 반복합니다.
- 또한 기계와 생물 Ccharacterizations에 대한 수확을 구축
- 정적 숙성 기간의 1 또는 2 주 후, 세포 배양 후드로 정적 생물 반응기를 전송.
- 신선한 배지 40 ㎖ (그림 5, 그림 7A)를 포함 100 mm 직경의 페트리 접시에 부드럽게 맨드릴 (보충 비디오 1)에서 성숙한 구조를 전송합니다.
길이 방향과 원주 방향의 구문 3. 기계적 특성
- 샘플을 유지하는 5 또는 10 N 부하 셀, 37 ° C에서 PBS를 함유하는 욕 구비 마이크로 기계식 테스터 이루어진 실험 장치를 설치T 의사 생리적 조건 (그림 6).
- 로드셀 및 신율 균형.
주 : Balancing이 확장 표시 값과 기준 샘플 기계 상에 장착되지 않은 상태를 표시로드 값을 리셋으로 이루어진 마이크로 기계식 시험기에 통합 된 기능이다. 이 함수는 모두 측정 기준을 정의 할 수있다. - 기계 장치에 관 모양의 구조를 설치 : 길이 방향을.
참고 : 직접 전체 관상 구조에 종 방향 피로 시험을 수행합니다. 로드셀 및 PBS 목욕의베이스 구조의 거즈 그립을 연결하는 자체 내장 그립 장치를 사용합니다.- 관은 수확 과정 (2.4) 다음 파지 장치 (그림 7B)에 건설 마운트합니다.
- 시험 중에 어떤 거즈 그립의 미끄러짐을 방지하기 위해 테프론 테이프와 함께 파지 장치와 거즈 그립을 감싸.마이크로 기계식 시험기 (그림 7C) 상에 샘플을 탑재합니다.
- 기계 장치에 고리 모양의 구조를 설치 : 원주 방향을.
참고 : 관 모양의 구조에서 절단 링 모양의 시편에 원주 피로 시험을 수행합니다. 표본을 잡고 그립으로 두 개의 스테인리스 스틸 막대를 사용합니다.- 지원은 수확 (2.4) 다음 5mm 간격 (그림 7B), 표시로 관이 플라스틱 파이프로 구성 마운트합니다.
- 관 모양의 구조에서 10mm 반지를 잘라.
- 상기 분석에 대한 버니어 캘리퍼스를 이용하여 시편의 길이를 측정한다.
- 마이크로 기계식 시험기 (그림 7C)의 스테인레스 스틸 막대에 고리 모양의 시료를 탑재합니다. 바의 중심에 시료를 배치해야합니다.
주 : 플라스틱 파이프 및 단계 3.4.1 절단 시스템에도 7b에 도시 한 바와 같이 절삭 가공시에 구조물의 손상을 방지하기 위해 사용된다.
- 종 방향 또는 원주 방향으로 구조에 대한 피로 시험.
- 초기 게이지 길이로 구조를 스트레칭.
- 의사 생리 학적 환경에서 10 분 동안이 위치에있는 구조를 유지한다.
- 5 % / 초의 변형 속도로 구조체에 초기 게이지 길이 (30 회)의 10 % 변형시 클릭 적용.
- 샘플의 실패까지 10 % 순환 변형의 증가 단계에서 단계를 반복 3.5.3.
주 : 의사 - 생리적 환경의 이용은 고려 부력 및 하중의 측정에 영향을 파지 시스템의 관성을 가지고 요구한다. - 다음과 같은 배경을 녹음
- 초기 게이지 길이로드 프레임을 이동합니다.
- 임의의 샘플 마운트없이 단계 3.5.3 및 3.5.4을 반복하고,로드 셀에 연결된 파지 장치를 유지하는 (오직 1 사이클이다 requi빨간색).
를 구축 4. 내강에 내피
참고 : 수확 프로토콜 (2.4 절)을 수행 한 후, 구조는 더에 내피 세포에 대한 회전 벽 생물 반응기에 장착되는 처리 견딜.
- 회전 벽 생물 반응기 설계
- 에어레이션 구멍을 덮는 필터 멤브레인을 손상시키지 않고 저장 튜브의 통기성 캡의 중심에 4.5 mm 직경의 구멍을 뚫는다.
- 구멍에 맨드릴 (직경 = 4.5 mm, 길이 = 40 mm)를 눌러-에 맞게 단계 1.1.2에 설명 된대로 맨드릴을 수정합니다.
- 구조 외부 직경이 C 자형 실리콘 지원을 준비 = 14mm; 내경 = 8mm).
- 회전 벽 생물 반응기의 한쪽 끝에서 회전 모터와 다른 쪽 끝 (그림 8B)에 베어링을 배치합니다.
- 루멘에 내피
- 인간의 umbilic를 확장Al을 10 % (v / v)의 PS, 10 %가 보충 된 M199 배지 5 ㎖로 25cm 2 배양 플라스크에서 내피 세포 (HUVEC를)를 정맥 (v / v)의 FBS, 1 % (v / v)의 펜 연쇄상 90 % 합류점까지 배양기 (T = 37 ℃에서, 5 % CO 2, 100 % 습도) 내부 페트리 접시.
- 혈청이없는 내피 세포 배지에서 10.5 ng를 / ㎖로 농축 단백질 혼합물을 희석함으로써 최적의 세포 부착에 필요한 구조체 당 단백질 코팅 용액 1.5 ml를 준비.
- 버니어 캘리퍼스를 이용하여 구조체의 길이를 측정한다.
- 내강 체적 V와 구조체의 내강 영역을 계산 같이 V = D L 각각 2 L / 4, A = D의 (에 D가 맨드릴 직경에 대응하는 내경이며, L은 구조물의 길이 임).
- 수확 절차 (2.4) 다음 저수지의 중심에 구조를 놓습니다.모두 저장 (그림 8A)에 끝의 구조를 해결하기 위해 C 모양의 실리콘 지원을 사용합니다.
- 배지 35 mL로 저수지를 입력합니다.
- 단계 4.2.2에서 제조 한 단백질 용액으로 코팅 구조체 (V)의 산출 내강 용적의 75 %를 채운다. 단백질 도포 액 (도 8A)의 누출을 방지하는 구조의 양쪽 말단을 닫.
- 세포 배양 후드 안쪽 회전 벽 바이오 리액터 시스템을 조립한다.
- 37 ° C의 배양기에서 생물 반응기를 놓고도 8b에 도시 된 바와 같이 내강 코팅을 허용하는 1 시간 동안 4.02 X 10-5 g 력에서 생물 반응기의 회전을 시작한다.
- 구조체의 상지를 열고 루멘에서 단백질 코팅액을 대기음.
- HUVEC를 플라스크로부터의 배지를 제거하고 트립신 용액 3 ㎖ (1X PBS에서)를 첨가하여 된 HUVEC (통로 2-3)를 분리. 나는5 분 (T = 37 ° C, 5 % CO 2, 습도 100 %)에 대한 ncubate.
- 보충 된 M199 배지에서 4 × 106 세포 / ml의 농도로 재현 탁 된 HUVEC.
- 세포 배양 후드 안쪽. 1,000 세포 / cm 2 (15)의 밀도와 구조체의 루멘 HUVEC를 시드 HUVEC를 용액의 누출을 방지하기 위해 구조물의 상부 말단을 닫.
- 4.02 × 10 -5 g의 힘의 일정한 회전에서 2 일 동안 회전 벽 생물 반응기 (그림 8B)와 문화에 대한 구조 (T = 37 ℃, 5 % CO 2, 습도 100 %) 호스팅을 품어.
- 무균 조건에서 배양 2 일 후 구조를 수확하고 2.4 절에 설명 된대로 추가 생물학적 특성에 대한 준비를합니다.
결과
이 작품은 혈관 세포를 포함하는 설계 관 콜라겐 기반 구조의 제조에 대해 설명합니다. 이미 이른 겔화가 1 시간 후, 세포 및 콜라겐 혼합물을 직접 (14mm 정도) 대응하는 금형의 직경과 동일한 외부 직경을 갖는, 3D 관형 형상으로 조립 하였다. 모든 정적 숙성 따라, 측정은 표 1에 나타낸 바와 같이. 정적 배양 1 일 이후에 초기 값의 약 60 % 수축 cellularized 콜라겐 겔의 직경 관형 cellularized 구조물의 외부 직경의 급격한 감소를 계시하고, 칠일 (보충 비디오 2) 내에서의 거의 85 %. 이 현상은 비 cellularized 콜라겐 지지체 발생하지 않는 구조 내에서 SMCs는 축소 관찰과 관련된 기계적 강화에 대한 책임이 있습니다. 모든 종류의 (열, 생화학, 기계, 또는 다른 사람)의 아니 그라디언트가 적용되지 않았 음을 유의하십시오. 세포 드라이브N은 압축 처리 및 기계적 간청에 굴복 할 수 콜라겐 큰 밀도를 갖는 재료로 귀착 (보조 비디오 3 및 4).
전반적인 기계적 및 점탄성 성질 세포 구동 리모델링을 연관시키는, 피로 시험은 구조물 (보조 영상 (5, 6))에서 수행 하였다. 이러한 테스트는 다른 상수 균주에서 구조체 (30 배) (10 %, 20 %, 및 초기 게이지 길이의 30 %)를 순환하고 시간이 지남에 기계적 권유에 구조물의 응답으로서 응력을 기록하도록 이루어져 있었다. 하나의 구조체를위한 대표적인 결과가도 9에 나타낸다. 제물은 동일한 변형률 범위 (30 %의 변형률) 실시 둘레 방향 (16 kPa로)보다 종 방향 (75 kPa로)에서 높은 응력을 견뎌. 한편, 각각의 사이클에서, 응력의 피크 값 (TA)에 대한 도달rgeted 최대 변형은 시간이 지남에 따라 감소 하였다. 이 문제는 이러한 콜라겐 기반 구조에 의해 전시 된 높은 점탄성의 전형이다.
cellularized 구조의 생물학적 활성은 정적 성숙하는 동안 평가 하였다. 따라서, SMCs의 대사 활성은 정적 배양 중에 글루코스 소비와 락 테이트 생산을 측정함으로써 평가 하였다. 배양액을 2 일마다과 포도당을 샘플링하고, 젖산 농도는 혈액 기체 분석기를 사용하여 측정 하였다. 포도당 소비 구조의 중요한 축소에 결합 된 젖산 생산의 지속적인 증가는 모든 정적 문화 (그림 10)을 따라 SMCs 활동을 증명한다.
인해 셀 구동 리모델링에 증가 된 기계적 안정성은 구조물의 조작에 내피 및 후속 처리를 허용했다. 메이슨의 트리 크롬 염색 endothelialized 구조에서 수행고도로 균질 내피를 보였다. SMCs는 스핀들 같은 모양의 형태를 전시하고 HUVECs를 잘 내강면 (그림 11)에 확산 등장하면서 균일하게, 벽을 통해 분산 나타났다.
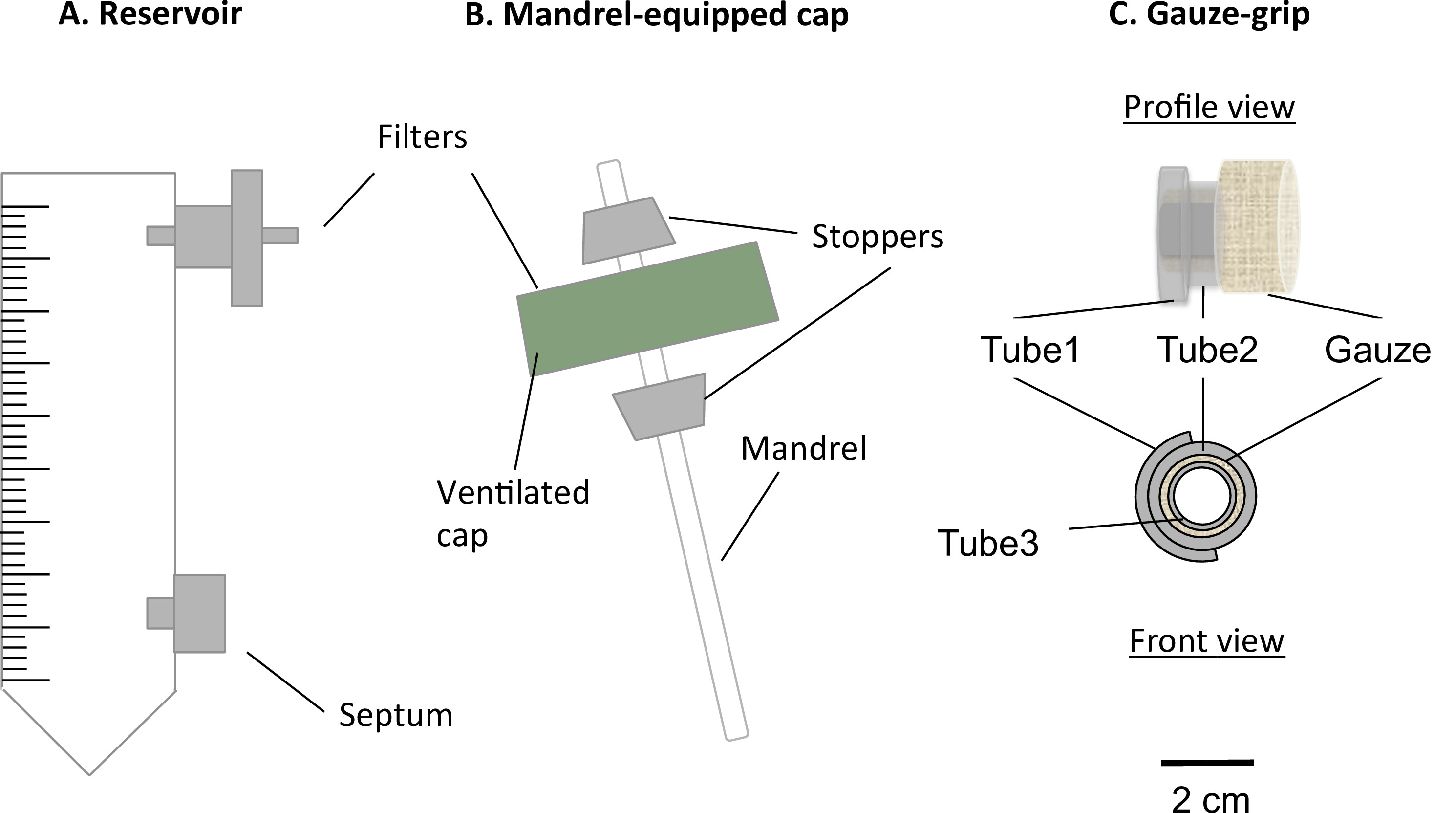
그림 1. 정적 생물 반응기의 구성 요소는 정적 생물 반응기는 변성 50 ㎖ 원심 분리 튜브 (A) 및 맨드릴 갖추어 진 캡 (B)으로 구성되었다. 튜브는 중간 저장소 역할을하고, 중간 샘플링 및 변경을 위해, 가스 교환을 0.22 μm의 필터 포트, 및 셉텀이 장착되었다. 통풍이 모자 맨드릴 존재하는 관 모양의 구조물의 제조를 허용했다. 거즈 그립 (C)은 설계 및 맨드릴 위에 구조의 겔을 지원하기 위해 제작되었다. 또한,이그립 구조가 정적 숙성 후 처리하고, 기계적 장치에 고정시켰다. 맨드릴의 외부 직경은 4.7 mm였다.
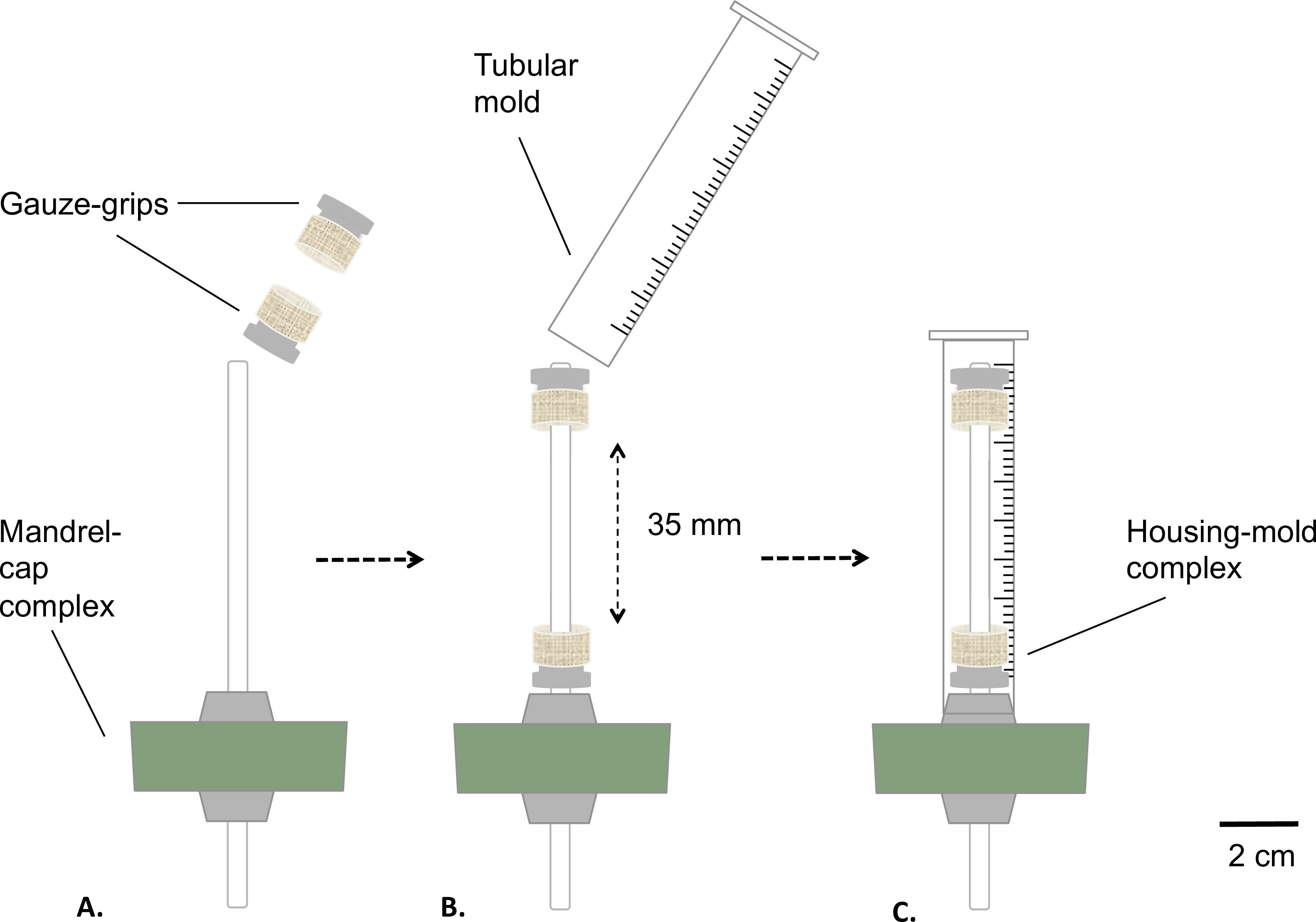
그림 2 : 정적 생물 반응기의 조립 살균하기 전에 생물 반응기의 단계를 조립.. 거즈 - 그립은 고정 된 거리에서 맨드릴 (A)에 장착되었다. 주형 삽입 (B)과 밀접 실리콘 마개 (C)에 고정시켰다. 맨드릴의 외부 직경은 4.7 mm였다.
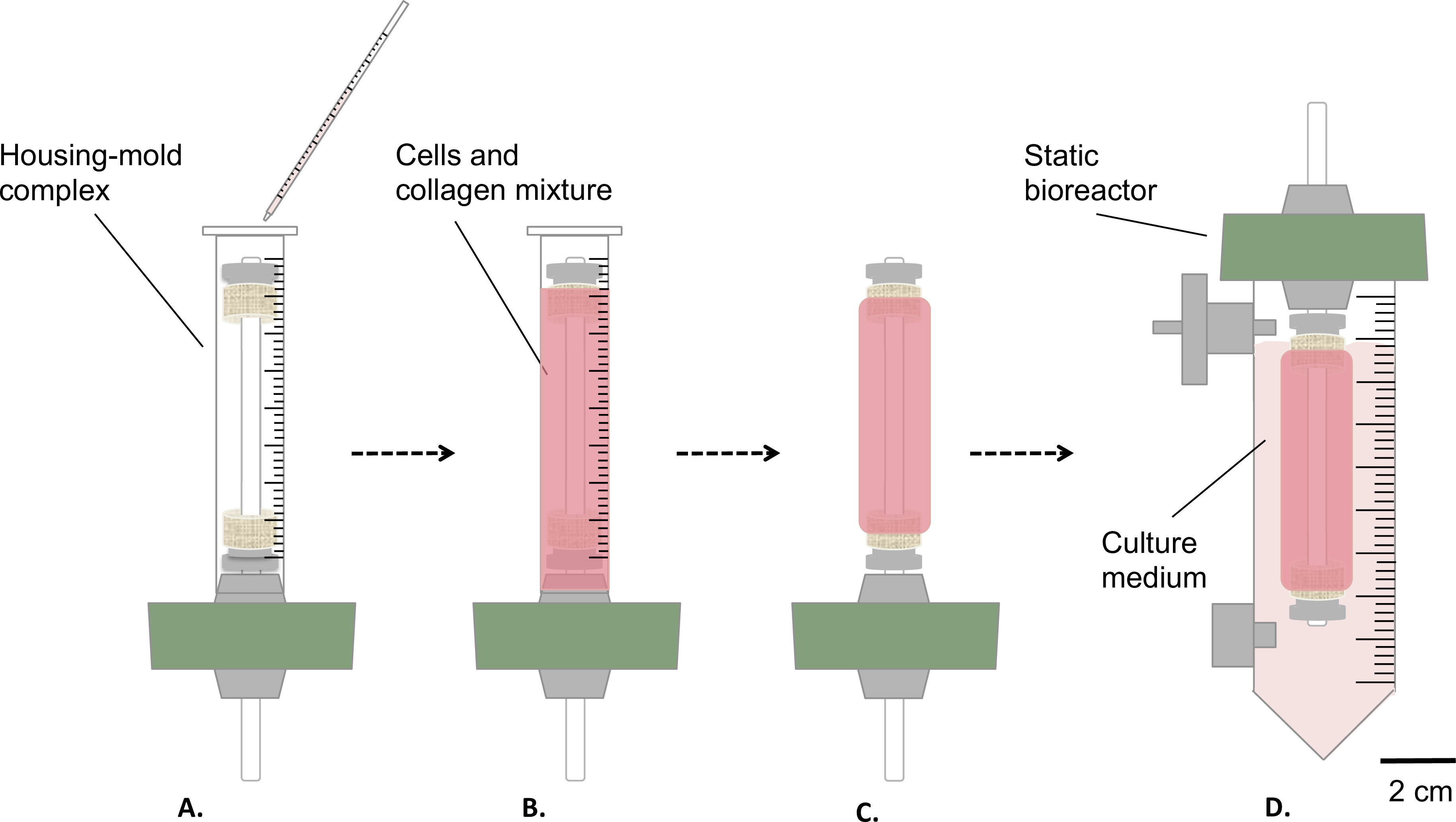
도 3 :. 멸균 조건에서 구조물의 제조는 세포와 콜라겐 혼합물 하우징 주형 착물 붓고 (A), 실내 온도 (B)에서 1 시간 동안 젤을 보자. 그 후, 금형 (C)를 제거하고, 정적 생물 반응기 (D) 조립 인큐베이터 구조체의 정적 숙성 (T = 37 ° C, 5 % CO 2, 습도 100 %)에 대해 저장조 안에 옮겼다. 맨드릴의 외부 직경은 4.7 mm였다.

도 4 :. 제물의 두께 / 외경의 측정은 레이저 스캐닝 간섭계 구조의 외부 직경의 측정을 수행하는 데 사용되었다. 구조는 레이저 빔의 경로에 배치되고, 그림자를 생성 하였다. 구조체의 외부 직경에 대응하는 그림자의 폭은, 다음 측정 화면에 표시 하였다.

그림 5 :. 수확 구조의 형태 학적 모양 ()을 마우스 오른쪽 2 주 정적 성숙하는 동안 셀 중심의 리모델링 후 겔화와 (B) 후.

도 6 : 기계적 특성화를위한 실험 장치 그것은 5 또는 10 N 부하 셀과 의사 - 생리 학적 조건에서 샘플을 유지하기 위해 37 ℃에서 PBS를 함유하는 욕 갖춘 마이크로 기계식 시험기로 구성되었다..
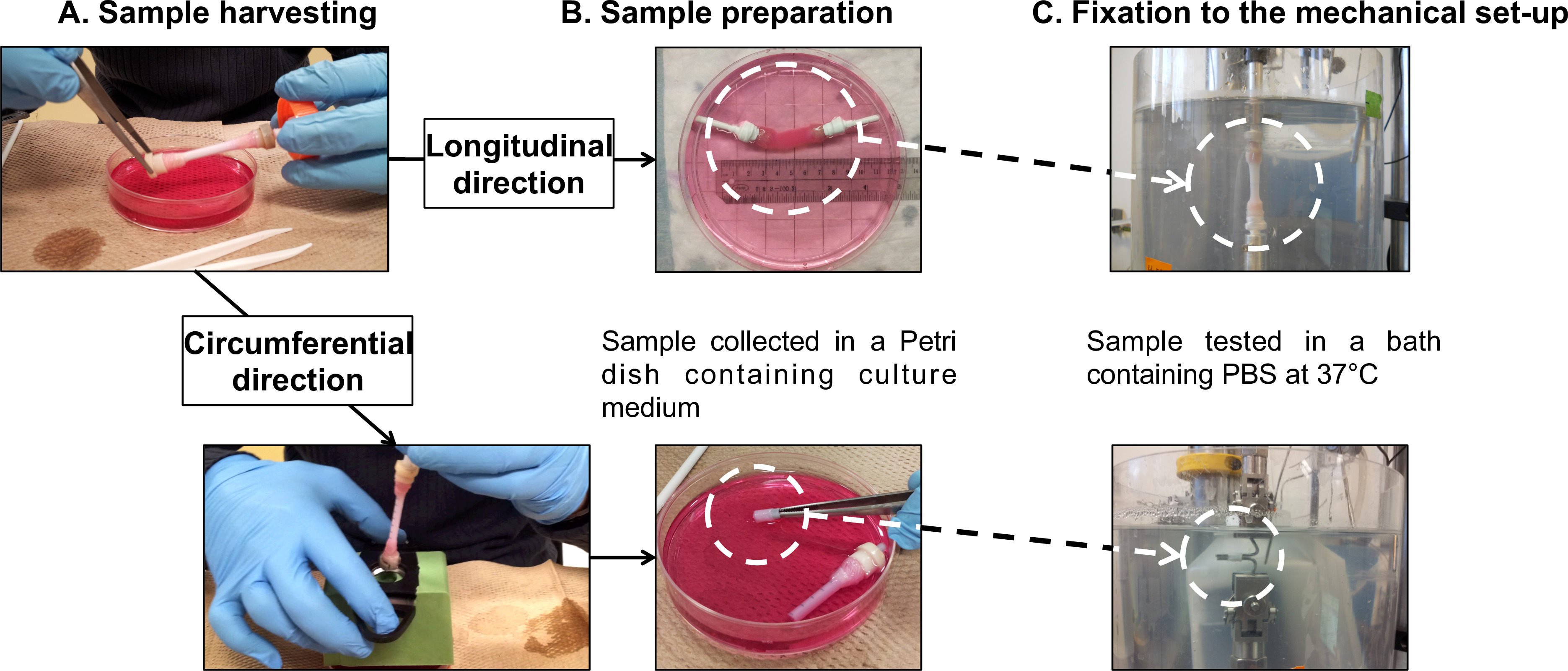
그림 7 : 샘플 준비 F 기계적인 특성화. 샘플 수확 (A)와 조제 (B) 피로 시험 전후에서 수행하고 원주 방향 (C)에 대한. 맨드릴의 외부 직경은 4.7 mm였다.
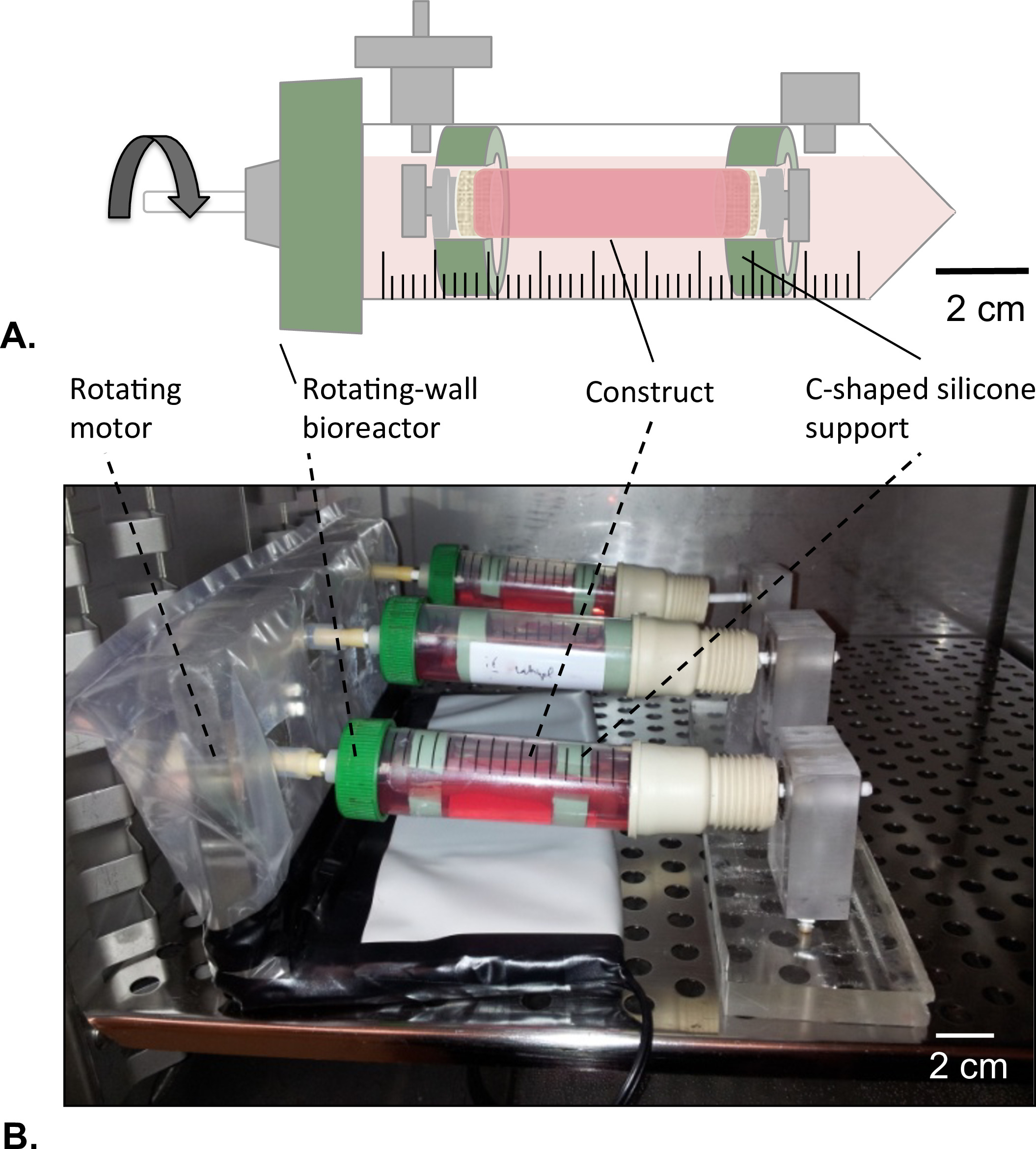
도 8 : 회전 · 벽 생물 반응기 (A)가 관형 구조체 C 자형 실리콘 지지체의 도움으로 저장조의 중앙에 조립 하였다.. 구조의 사지는 모두 HUVEC를 용액의 누출을 방지하기 위해 폐쇄되었다. (B)는 구조체 배양기에서 배양 하였다 (T = 37 ° C, 5 % CO 2, 습도 100 %) 2 일간 4.02 X 10-5 g 힘에서 회전한다.
2 / 52812fig9highres.jpg "폭 ="700 "/>
그림 9 :.. 기계 특성화 종 (A)의 구조에서 수행 피로 시험 및 세포 기반의 리모델링 후 원주 (B) 방향의 결과 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
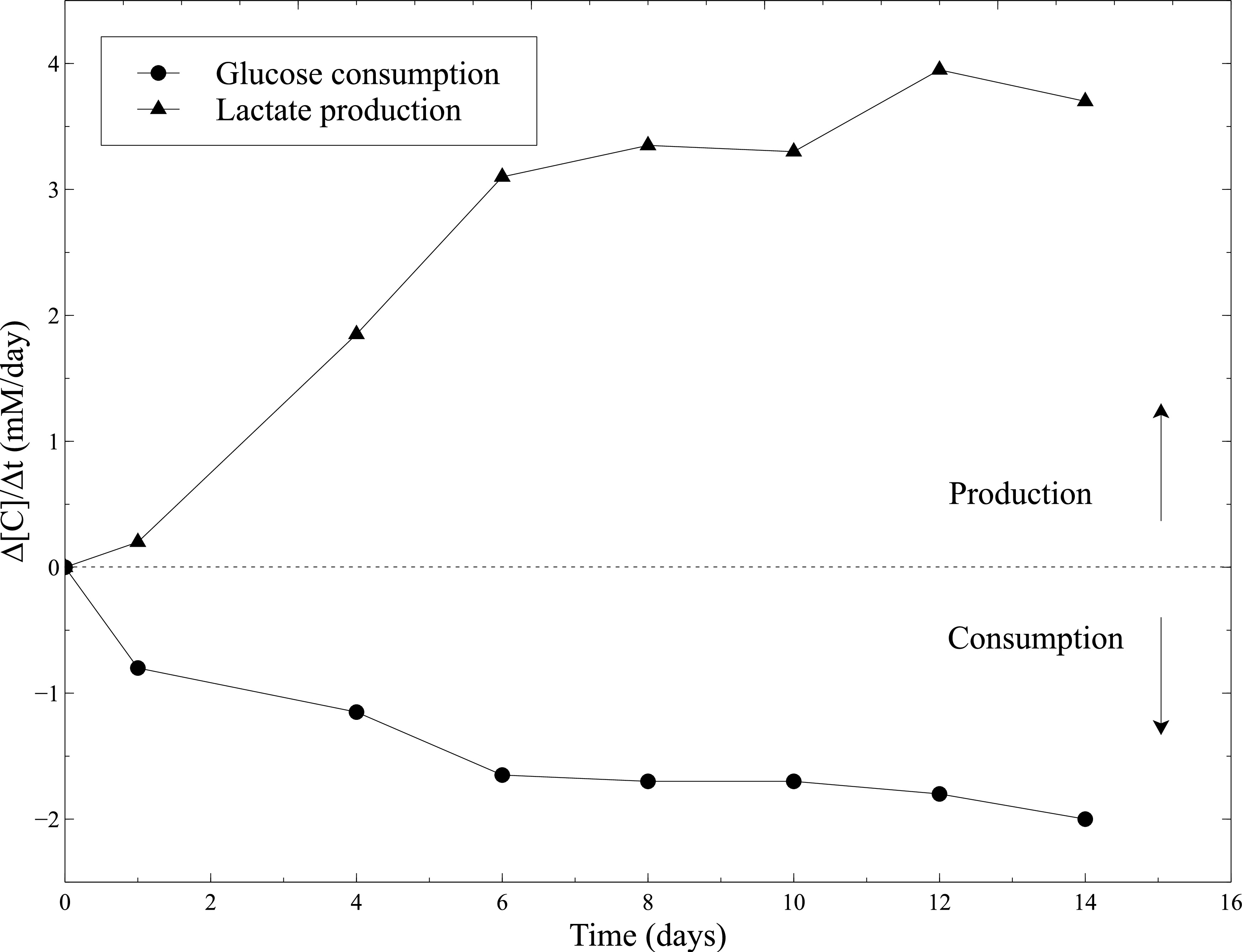
도 10 :. 콜라겐 겔 내에 SMCs의 대사 활성 글루코스 소비 속도 및 락 테이트 생산 속도의 측정은 배양액 변경 한 후, 2 일마다 혈액 기체 분석기로 수행 하였다. 신선한 배양 배지는 글루코스 및 락 테이트 농도의 측정을위한 기준 레벨로서 사용 하였다.
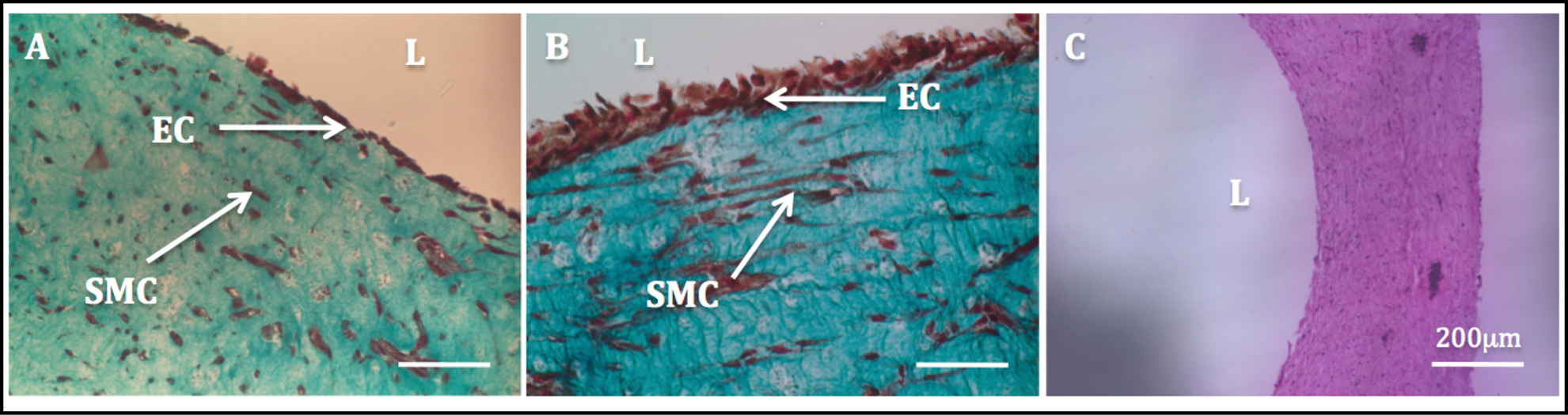
그림 11 : 루멘에 내피 관 구조의 반경 단면의 조직 학적 이미지.. 튜브형 구조의 메이슨의 Trichome 염색 1 주 (A)와 이주 (B)에 대한 정적 배양. 관형 구조체 (C)의 H & E 염색.
| 시간 | 두께 (mm) | 다짐 (%) |
| 0 시간 | 4.83 ± 0.02 | 0 ± 0 |
| 2 시간 | 4.26 ± 0.02 | 12 ± 0 |
| 4 시간 | 4.21 ± 0.03 | 13 ± 1 |
| 6 시간 | 4.06 ± 0.10 | 16 ± 2 |
| 12 시간R | 3.16 ± 0.07 | 35 ± 1 |
| 일일 | 2.08 ± 0.11 | 57 ± 2 |
| 일주 | 0.68 ± 0.07 | 86 ± 1 |
| 이주 | 0.36 ± 0.00 | 93 ± 0 |
표 1 : 성숙 동안 정적 구조체 직경 빠른 압축 구조의 벽 두께 및 정적 배양 시간의 함수로서 압축 레이트.. 다짐은 주사 레이저 간섭계 (183B 시리즈, LaserMike 136)와 관형 구조체의 외부 직경을 측정함으로써 측정 하였다. 24 시간 후, 구조물은 57 %로 그들의 성형 치수 ± 2 % 압축. 데이터 표현과 같은 평균 ± SD (n = 3)를 나타낸다. 존재 및 평활근 살아있는 세포의 활성은 큰 변화에 대한 유일한 책임이었다.
스와pplemental 비디오 1 :. 비 리모델링 관 콜라겐 젤의 수확 이 비디오를 보려면 여기를 클릭하십시오.
보충 비디오 2 :. 관 콜라겐 젤의 셀 기반의 압축은 이 비디오를 보려면 여기를 클릭하십시오.
보충 비디오 3. 비 리모델링 관 콜라겐 젤의 조작은 이 비디오를 보려면 여기를 클릭하십시오.
보충 비디오 4 :. 세포-리모델링 관 콜라겐 젤의 조작 일을 보려면 여기를 클릭하십시오비디오입니다.
보충 비디오 5 :. 세로 피로 시험 (30 %에서) 세포 - 리모델링 관 콜라겐 젤에 이 비디오를 보려면 여기를 클릭하십시오.
보충 비디오 6 :. 원주 피로 시험 (30 %에서) 세포 - 리모델링 관 콜라겐 젤에 이 비디오를 보려면 여기를 클릭하십시오.
토론
혈관 조직 엔지니어의 사회 중에서 엄청난 노력이 혈관 (16)의 기계적 안정성을 담당 중막 층을 재현하기 위해 행해졌 다. 와인버그와 벨 (17)의 선구적인 작업 때문에, 콜라겐 널리 때문에 생체 적합성, 비 면역 원성 및 가용성의 혈관 조직 공학을위한 발판으로 사용되어왔다. 이 물질 때문에 기계적 강성 극한 부족하여 취급이 용이하지 않다하지만, 콜라겐의 사용은 연구자 큰 도전을 나타낸다. 비계 준비하는 동안 조작은 더 사용할 수 있도록 손상, 비계가 손상 될 수 있습니다.
이 연구에서 기술 된 기법은 허용 : i)는 관형 형상의 형상으로 cellularized 콜라겐 겔을 설계하는 단계; ⅱ) 짧은 정적 숙성 기간 (1 ~ 2 주) 후 처리 할 수있을만큼 강한 생체 조직을 설계하는 단계; III)로서 행2 방향 등 관 모양의 생물 조직의 SESS 기계 및 점탄성. 겔에있는 세포는 콜라겐 매트릭스 리모델링에서 중요한 역할을한다. 숙성 기간 동안 수축 SMCs는 종 방향 및 원주 방향으로 평가 될 수있는 높은 기계적 안정성과 구조체를 수득 겔의 압축되었다. 구조 따라서 혈관 조직 공학 응용 프로그램에 대한 콜라겐 젤의 적합성을 입증, 균일하고 가능한 내피 세포 생성의 이후, HUVECs를가 내강 측에 시드.
이 연구에서 제시된 생물 반응기는 특히 정전기 성숙 동안 세포 성장을위한 최적의 환경을 제공하도록 설계되었다. 또한, 구조물의 기계적 및 점탄성 특성의 특성화를 위해 개발 된 장치의 조작에 고유 한 잠재적 인 손상을 감소시키기위한 목적으로 설계되었다이러한 섬세한 재료. 따라서, 정적 인 생물 반응기 뚜껑에 0.22 ㎛의 필터 및 필터 멤브레인 (단계 1.1.2,도 1A의 장착 하였다 및 B) 배양 무균 환경을 유지하면서, 저장조 및 배양기 안에 배양액 사이에서 가스 교환을 사용할 것이다. 하단 루어 격벽은 배양 배지 샘플링 포트로서 이용하고 정적 배양 동안 변화한다. 일부 중요한 단계는 구조의 제조 및 특성 분석에서 고려되어야한다. 무균 시스템을 변경할 수있다 (후속 단계 및 단계 2.1.1에서 수행됨) 모든 조작은 무균 생물학적 후드에서 수행 하였다. 세포를 콜라겐 겔 혼합물 제제 겔화 과정을 지연시키기 위해 얼음에 처리 하였다 (2.1.7 2.1.4 단계). 단계 2.1.7에서, 종래 겔화 혼합물에 갇힌 어떤 공기 기포는 S를 손상시킬 잠재 응력 집중 영역은구조의 tability. 따라서, 공기 거품의 제거는 약간 어셈블리를 흔들어 또는 멸균 조건에서 탈 가스에 대한 3 분 동안 의료 진공을 사용하여 필요합니다. 마지막으로, 그립은 특히 겔화 동안 관 금형 중앙 맨드릴의 축 유지 및 내피 세포 형성을 위해, (맨드릴의 제거, 2.4 절)을 수확하는 동안 구조의 섬세한 조작이 가능하도록 설계 및 촉진에 장착 된 기계 시스템 (종 시험).
본 프로토콜은 SMCs의 자연 고유의 수축 가능성을 기반으로 콜라겐 젤 구조의 강화의 원래 쉬운 과정 대체 방법을 제안한다. 20 - 콜라겐 매트릭스 보강재의 일반적인 기술은 세포 - 매트릭스 상호 작용 (18)에 해로운 영향을 미칠 수있는 물리적, 화학적 가교제의 사용을 포함한다. 제시 제조 기술이 작품은 물리적 또는 화학적 처리없이 대상 기계적 특성을 가진 조직 공학적 구조를 얻을이 세포 중심의 리모델링 과정을 지시하는 허용한다.
수화 콜라겐 젤의 기계 및 점탄성의 특성은 큰 도전이다. 이러한 관점에서, 본 프로토콜은 관형 연조직의 기계적 성질을 평가하기위한 원래의 간단하고 효율적인 방법을 설명한다. 이 특성은 직접 전체 관형 구조체에 원주 방향뿐만 아니라 길이 방향으로뿐만 아니라 수행 할 수있다. 기계적 특성, 온도, 수성 환경, pH 및 이온 강도 동안 격렬 생체 조직 (21)의 기계적 동작에 영향을 미치는 것으로 알려진 환경 요소의 일부이다. 따라서, 본 연구는 매우 생물 조직의 기계적 특성에 대한 원래의 설정과 프로토콜을 제안한다재현성 의사 생리적 환경 (37 ° C 및 pH 7.4의 생리 식염수 용액). 우리가 아는 한, 특성의이 종류는 다른 곳에서보고 된 적이있다.
결론적으로,이 연구에서 제안 된 기술은 혈관 조직 공학 응용을위한 콜라겐 세포의 직접적인 믹싱의 높은 잠재 성을 보여준다. 기계적 특성 및 프로세스에 내피 세포와 함께이 방법은 높은 다가 프로토콜을 구성한다. 따라서, 셋업과 같은 원리를 유지하면서 프로토콜의 약간의 수정을 통해, 엔지니어링 혈관 조직 당량위한 주요 요구는 신속하고 단순한에 내피를 포함하여 처리하고, 가능성 등 해결할 수는 연질의 광범위한 행열 다양한 길이와 직경 어떤 조직이. 또한, 부착 세포 유형, ECM 단백질 성형 형상 다른 타겟이 입학 원서의 수를 조사 할 수있다같은 다른 사람의 사이에서 엔지니어링 힘줄, 피부 이식, 심장 패치, 신경 등의 기능. 구조물의 기계적 성질 고무적이지만, 이들은 기본 조직에 비해 여전히 낮다. 이러한 맥락에서, 우리는 강하게 매우 짧은 정적 성숙 기간이 이렇게 높은 구조적 무결성 및 기계적 안정성을 선도, 생물 반응기에 동적 자극을 향한 중요한 단계라고 생각합니다. 그러나, 가능성은 급격히 기계적 적합한 조직 공학적 cellularized 콜라겐 기반 구조를 제조하고, 조직 학적 성장 및 리모델링, 또는 행 동안 세포와 ECM 사이의 상호 작용에 대한 통찰력을 제공하기 위해 유용하고 유망한 도구는 본원에 기재된 정적 생물 반응기하게 분석 치료 및 약물 전달 시스템을위한 모델로서 이용 될 수있다.
공개
어떤 자금은 이익의 충돌 가능성에 조직이나 기관에서 수신되지 않았다.
감사의 말
이 연구는 자연 과학 및 캐나다의 공학 연구 협의회, 건강 연구의 캐나다 연구소 CHU 드 퀘벡 연구 센터에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
참고문헌
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유