Method Article
Engineering 3D cellularized Kollagengele für Gefäßgeweberegeneration
In diesem Artikel
Zusammenfassung
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
Zusammenfassung
Synthetische Materialien sind dafür bekannt, klinischen Komplikationen wie Entzündungen, Stenose und Infektionen auslösen, wenn sie als Gefäßersatz implantiert. Collagen wurde ausgiebig für eine Vielzahl von biomedizinischen Anwendungen aufgrund seiner inhärenten Biokompatibilität verwendet und wird als eine Alternative zu synthetischen Materialien (dh geringe Antigenität, Entzündung und cytotoxischen Antworten). Allerdings haben die begrenzten mechanischen Eigenschaften und die damit verbundene niedrige Hand-Fähigkeit Kollagengelen ihre Verwendung als Gerüstmaterial für die vaskuläre Gewebezüchtung behindert. Daher ist die Logik hinter dieser Arbeit wurde zum ersten Mal cellularized Kollagengelen in eine rohrförmige Geometrie und zweite Ingenieur glatten Muskelzellen verbessern angetrieben Reorganisation der Kollagenmatrix, um Gewebe steif genug, um gehandhabt werden zu erhalten.
Die hier beschriebene Strategie beruht auf der direkten Montage von Kollagen und glatten Muskelzellen (Konstrukt) in einem 3D cyli basierendndrical Geometrie mit der Verwendung einer Formtechnik. Dieses Verfahren erfordert eine Reifezeit, während der die Konstrukte sind in einem Bioreaktor unter statischen Bedingungen kultiviert (ohne angewendete äußere Dynamik mechanischer Druck) für 1 oder 2 Wochen. Die "statische Bioreaktor" bietet eine Überwachung und Steuerung sterile Umgebung (pH, Temperatur, Gasaustausch, Nährstoffversorgung und Entsorgung), um den Konstrukten. Während der Kulturperiode wurden Dickemessungen durchgeführt, um die Zellen getriebenen Remodellierung der Kollagenmatrix zu bewerten, und Glukoseverbrauch und Lactatproduktion Raten wurden gemessen, um die Zellen zu überwachen metabolischen Aktivität. Schließlich wurden die mechanischen und viskoelastischen Eigenschaften für die resultierenden röhrenförmigen Konstrukte bewertet. Hierzu spezifischen Protokollen und einer fokussierten Know-how (Manipulation, Greifen, die in hydratisierter Umgebung usw.) wurden entwickelt, um die das erzeugte Gewebe zu charakterisieren.
Einleitung
Gefäßgewebetechnik sieht verschiedene Strategien bei der Herstellung von technischen Fahrzeuge, einschließlich Transplantaten auf Basis synthetischer Gerüste Zellage basierte Gewebezüchtung Blutgefäße (TEBVs) und extrazelluläre Matrix (ECM) Zielkomponenten basierende TEBVs. Unter diesen Ansätzen, synthetische Polymere gute mechanische Eigenschaften, aber einen gemeinsamen Nachteil, da sie keine Bioaktivität 1. Die Zellschicht basierenden Verfahren ermöglicht die Herstellung von technisch Gefäßersatz mit hohen mechanischen Eigenschaften, aber die erforderliche Zeit, um solche Transplantate herzustellen ist ungefähr 28 2 Wochen. Natürliche Biopolymere des ECM, wie Kollagen, Elastin, Fibrin 3 oder einer Kombination davon, bleiben die Goldstandardmaterialien für das Tissue Engineering Scaffolds. Dies ist vor allem aus dem Grund, dass diese Materialien besitzen im allgemeinen eine gute Biokompatibilität während in der Lage, um funktionelle zelluläre Reaktionen 4-5 induzieren. Unter diesen Biopolymers, Kollagen Typ I ist eine der häufigsten und vorherrschende tragende Protein der ECM in vielen Geweben wie Haut, Blutgefäße und Sehnen. Umfangreiche Arbeiten wurden auf die mechanischen Eigenschaften von Kollagen 6 durchgeführt worden - 8, aber es wurden nur wenige Untersuchungen über zelluläre Umbildung Kollagengele bei statischer Reifung. Cellular Remodeling bezieht sich auf die strukturelle Modifikationen der Kollagenmatrix durch Zellen, die die Stabilität des Kollagen-Fibrillen-Netzwerk 9 beeinflussen könnten induziert. Als natürliches Gerüst können relativ große Mengen an Kollagen Typ I isoliert, sterilisiert und aus verschiedenen Quellen, wie beispielsweise Ratten-Schwanzsehnen 10 gespeichert. Verständnis zellulärer Wechselwirkungen mit Kollagen und die zugehörigen mechanischen Gesamtverhalten der cellularized Kollagenträger (Konstrukte) ist ein wesentlicher Schritt für den Aufbau von Gewebe. Kollagenbasis TEBVs kann durch direktes Mischen Zellen mit Kollagen verarbeitet werdenwährend Gelzubereitung und weiter in spezifische Formen wie rohrförmig und planar 11 geformt. Gefäßzellen in den Gelen vermehren und umgestalten Kollagen Typ I 12. Somit diese Methode umgeht die Notwendigkeit einer besonderen Makroporosität, die eine der wesentlichen Probleme bei der Entwicklung von Scaffolds für das Tissue Engineering-Anwendungen darstellt. Die Hauptnachteile Kollagengelen durch ihre geringe mechanische Eigenschaften jedoch gegenüber synthetischen Materialien 13.
In dieser Studie wurde ein lebensfähiges Gewebe mit homogener Verteilung der Zellen, die durch direktes Mischen des Kollagens mit Zellen in einer Ein-Schritt-Verfahren ausgelegt. "Static Bioreaktoren" wurden für die 1 oder 2 Wochen der statischen Reifung der cellularized Kollagengelen verwendet (ohne angelegten externen dynamischen mechanischen Einschränkungen). Während der Kultur, Kollagenmatrixumbau aufgetreten ist, wodurch eine strukturelle Verstärkung an den Konstrukten. Außerdem waren r diese Konstrukteeady auf einer sich drehenden Wand Bioreaktor überführt werden, und ein homogenes Endothel erzielt. Zusätzlich wird in dieser Arbeit eine spezifische mechanische Testprotokoll wird auch vorgeschlagen, einen geeigneten neuen Ansatz bei der Charakterisierung der mechanischen Eigenschaften von Rohrweichgewebe bereitzustellen.
Zusammenfassend zeigt diese Arbeit, ein Verfahren zur in vitro Herstellung und schnelle Reifung vaskulären Geweben, die stark genug ist, um nicht nur für die biologische und mechanische Charakteristiken, sondern auch für weitere mechanische Konditionierung in einem dynamischen Bioreaktor, der als eine zentrale gehandhabt werden sollen Schritt bei der Regeneration von Gewebe.
Protokoll
1. Herstellung und Montage des Static Bioreactor
- Herstellung der Reservoir
- Vorbereitung 50 ml Zentrifugenröhrchen als Nährmedium Reservoir für den Bioreaktor.
- Bilden zwei Öffnungen durch Bohren von zwei 5 mm Durchmesser Bohrungen bei 20 mm von dem unteren und dem oberen Ende des Reservoirs verbunden. Dann legen Sie zwei Luer-Armaturen in 5 mm Länge Silikonschläuche. Press-fit diese Luerverbindungen durch die Löcher, und verschließen Sie alle Verbindungen mit medizinischem Silikon kleben.
- Legen Sie eine 0,22 um Filter in die obere Öffnung des Behälters (Abbildung 1A).
- Legen Sie eine Luer-Septum in der unteren Öffnung des Reservoirs (Abbildung 1A).
- Dorn-Cap Assembly
- Bohren Sie ein 4,5 mm Loch in der Mitte des belüfteten Kappe des Reservoirrohr ohne Beschädigung der Filtermembran, die die Belüftungsöffnungen abdeckt.
- Bereiten Sie einen Rührstab (Durchmesser = 4,5 mm, Länge = 100 mm) Als Dorn für das Konstrukt.
- Bereiten Sie zwei Silikon konischen Stopfen (Länge = 10 mm, Mittellochdurchmesser = 4,5 mm).
- Montieren Sie den Dorn und die Kappe (Dorn-cap-Komplex), wie in 1B beschrieben.
- Press-fit der Dorn in das Loch. Stecken Sie die 2 Stopfen über den Dorn, so dass die Kappe zwischen ihnen. Einstellen der Position des Dorns, so dass seine nutzbare Länge beträgt 78 mm.
- Tragen Sie eine Grundierung und dann medizinischem Silikon Leim auf die Flächen, die vor dem Verbinden der Kappe und dem Silikon konischen Stopfen miteinander in Kontakt sein wird. Entfernen Sie den überschüssigen Kleber auf der Kappe.
- Lassen Sie es für 1-3 Tage bei Raumtemperatur trocknen.
- Herstellung der Gaze-Griffe
- Vorbereitung 3 Silikonrohre (Rohr 1: Innendurchmesser = 6,4 mm, Länge = 5 mm; Röhre 2: Durchmesser = 6,4 mm, Länge = 10 mm, und das Rohr 3: Durchmesser = 3,1 mm, Länge = 12 mm).
- Montieren Sie die Gaze-Griffe wie beschreibend in 1C.
- Cut Rohr 1 in Längsrichtung, und öffnen Sie sie über Rohr 2. Haften Sie sie zusammen mit dem Silikonkleber.
- Schneiden Sie sterilen chirurgischen Gaze bis 5 cm x 7 cm Blatt, und dann rollen dicht die Gaze über das Rohr 3 entlang der längsten Seite der Gaze. Setzen Sie die Röhre 1-Rohr-2-Komplex über die Gaze.
- In Silikonkleber zusammen auf einer Länge von 8 mm bleiben die Gaze, das Rohr 1-Rohr-2-Komplex und das Rohr 3. Schneiden Sie die Gaze.
- Montage und Sterilisation
- Montieren Sie den Dorn-cap-Komplex und die Gaze-Griffe wie in Abbildung 2 beschrieben.
- Mantel der Dorn mit Mittelfett medizinische (2A). Platzieren der Gaze Griffe über den Dorn (2B). Entfernung der Griffe an festen Wert von 35 mm voneinander.
- Bereiten Sie eine röhrenförmige Form, indem das Unterteil einer 10-ml-Spritze mit einer Tischkreissäge (endgültige Länge = 8 mm) ( 2B).
- Legen Sie die Form über die Gaze Griffen ausgestatteten Dorn-Kappenbaugruppe (Gehäuse-Form-Komplex), Einrasten der Form auf dem Silikonstopper (2C).
- Autoklaven dem Behälter und dem Gehäuse-Form komplex.
Hinweis: Achten Sie auf die Silikonstopper fest halten Sie beim Einsetzen der Form, um seine Ablösung zu vermeiden.
- Montieren Sie den Dorn-cap-Komplex und die Gaze-Griffe wie in Abbildung 2 beschrieben.
2. Ingenieur glatte Muskelzelle Collagen Gel-basierte Konstrukte und Static Reifung
- Engineering Konstrukten
- Erweitern der Schweineaorta glatte Muskelzellen (pSMCs) in 175 cm 2 Kulturflaschen mit 20 ml vollständigem Kulturmedium, bestehend aus Dulbeccos modifiziertem Eagle Medium gefüllt, das mit 10% (v / v) Schweineserum (PS), 10% (v / v ) fötalem Rinderserum (FBS), 1% (v / v) Penicillin-Streptomycin (Pen-Strep).
- Bei ≈90% Konfluenz, trennen pSMCs (Passage 2-4) durch Entfernen des Kulturmediums aus derKolben pSMCs, Zugabe von 5 ml Trypsin-Lösung (1x in phosphatgepufferter Kochsalzlösung, PBS) und Inkubieren für 10 min (T = 37 ° C, 5% CO 2, 100% Feuchtigkeit).
- Resuspendieren pSMCs bei einer Konzentration von 4 x 10 6 Zellen / ml in vollständigem Kulturmedium.
- Kollagenlösung herzustellen, wie zuvor beschrieben 10.
- Zu extrahieren und zu sammeln Kollagenbündel aus Rattenschwanzsehnen in einer PBS-Lösung.
- Übertragen die Kollagenfasern anschließend in Aceton (5 min), 70% Isopropanol (v / v) (5 min) und Essigsäure (0,02 N, 48 h, 4 ° C) Lösungen.
- Mischung der viskosen Lösung und bei -20 ° C für 3 Tage.
- Lyophilisieren der gefrorenen Lösung, um Kollagenschwämme zu erhalten.
- Solubilisierung der Kollagenschwämme in Essigsäure-Lösung (0,02 N) bei einer Konzentration von 4 g / l und die Zentrifuge bei 29.581 g für 45 min Kraft.
- Sterilisieren Sie die Kollagenlösung durch Dialyseverfahren gegen spätere solutions Essigsäure (0,02 N, 1 h), Chloroform 1% (v / v, 1 h) und Essigsäure (0,02 N, sterilen Lösung Wechsel alle 2 Tage für 1 Woche).
- Sammeln Sie die sterile Kollagenlösung (4 g / L) in einem sterilen Zellkultur Kapuze.
- Vorbereitung cellularized Kollagengele wie in Abbildung 3 dargestellt.
- Vorbereitung 50 ml sterile Pufferlösung durch Vermischen von 35 ml DMEM (5x), 4 ml HEPES (1 N), 3 ml NaOH (1 N) in 8 ml sterilem deionisiertem Wasser.
- Vorbereitung der Zellen und Kollagen-Gel-Mischung in einem Behälter, in Eis gestellt, indem 50% (v / v) von sterilen Kollagenlösung (4 g / l Essigsäure 0,02 n) mit 25% (v / v) von Pufferlösung und 25% (v / v) der Aufhängung pSMCs in komplettem Kulturmedium.
- Messung des pH-Werts des Gemisches und sicherzustellen, dass sie zwischen 7,0 und 7,4 ist.
- Pour sanft 9 ml Zellen-and-Kollagen-Mischung in dem oben genannten Gehäuse / Schimmel Komplex (Schritt 1.4.3, 3A-B ).
- Ließ sie bei Raumtemperatur gelieren, für 1 h unter Zellkulturhaube (3B).
- Reifung in Static Bioreactor
- Entfernen Sie die Form (3C) und übertragen Sie sorgfältig das Konstrukt in das Reservoir, mit 35 ml Kulturmedium (3D).
- Inkubieren des Konstruktes (T = 37 ° C, 5% CO 2, 100% Feuchtigkeit) in vertikaler Lage für 1 oder 2 Wochen nach der statischen Reifung.
- Installieren Sie einen Web-Kamera im Inkubator vor dem Konstrukt (um Isolierung zu gewährleisten versiegelt).
- Ändern des Kulturmediums alle 2 Tage durch Absaugen des alten Mediums von der Dorn Septumöffnung und Wieder Füllen des Reservoirs mit einer äquivalenten Menge von frischem Kulturmedium.
- Messung der Dicke und Stoffwechselaktivität von SMCs-Kollagen-Gel-basierte Konstrukte Während Static Kultur
- Legen Sie das Scanning-Laser-Interferometer in die Zelle culture Kapuze und drehen Sie sie von der vertikalen in die horizontale Position mit einer Wasserwaage.
- Übertragen Sie den Bioreaktor in die Zellkultur Kapuze und entfernen Sie das Konstrukt aus dem Reservoir.
- Zu übertragen, die das Konstrukt (immer noch auf dem Dorn montiert) in den Weg des Laserstrahls, und legen es strikt orthogonal zu der Strahlachse (wie in 4 gezeigt).
- Lesen den Wert auf dem Bildschirm des Scanning-Laser-Interferometer dargestellt, entsprechend dem Außendurchmesser des Konstrukts.
- Berechnen der Wanddicke des Konstrukts basierend auf der Außen- und Innendurchmesser (dh der Dorndurchmesser).
Hinweis: Wiederholen Sie die Schritte 2.3.1 bis jede Stunde für die ersten 12 Stunden und dann alle 24 Stunden 2.3.5. - Verwenden 1 ml des alten Kulturmedium (abgetastet bei einem Wechsel des Kulturmediums, Schritt 2.2.4) zur Messung der Lactat und Glucose-Konzentrationen mit dem Blutgasanalysegerät.
- Verwenden Sie 1 ml derfrisches Kulturmedium als Ausgangsniveau für die Glukose und Laktat-Konzentrationen Messungen 14.
Hinweis: Wiederholen Sie die Schritte 2.3.6 und 2.3.7 alle 2 Tage nach dem Kulturmedium Wechsel.
- Baue Ernten für weitere mechanische und biologische Ccharacterizations
- Nach 1 oder 2 Wochen der statischen Reifezeit, übertragen Sie die statische Bioreaktor in die Zellkultur Kapuze.
- Transfer sanft das reife Konstrukt von seinem Dorn (Supplemental Video 1) auf einen Durchmesser von 100 mm Petrischale mit 40 ml frischem Kulturmedium (Abbildungen 5 und 7A).
3. Mechanische Charakterisierung der Konstrukte in der Längs- und Umfangsrichtung
- Installieren Sie den Versuchsaufbau, bestehend aus mikromechanischen Testgerät mit einem 5 oder 10 N Wägezelle und einem Bad mit PBS bei 37 ° C ausgestattet, um die Proben a haltent Pseudo physiologischen Bedingungen (Abbildung 6).
- Gleichgewicht der Wägezelle und der Dehnungsmesser.
Hinweis: Balancing ist ein in den mikromechanischen Tester aus in das Zurücksetzen der angezeigten Erweiterung Wert und die angezeigte Ladewert während keine Probe auf der Maschine montiert integrierte Funktion. Diese Funktion ermöglicht es, welche die Referenz für beide Messungen. - Montage der Rohr Konstrukte auf den mechanischen Apparat: Längsrichtung.
Hinweis: Führen Längsermüdungstests direkt auf die gesamte Rohrkonstrukte. Verwenden Inhouse gebauten Greifvorrichtungen, um die Gaze Griffe der Konstrukte auf die Lastzelle und an die Basis des PBS-Bad verbinden.- Montieren Sie die Schlauch bauen auf die Greifvorrichtungen (7B), im Anschluss an die Ernteverfahren (Abschnitt 2.4).
- Wickeln Sie die Greifeinrichtungen und die Gaze Griffe zusammen mit Teflon-Band ein Verrutschen der Gaze Griffe während der Prüfung zu verhindern.Montieren Sie die Probe auf die mikromechanischen Tester (7C).
- Montage der ringförmigen Konstrukte auf den mechanischen Apparat: Umfangsrichtung.
Hinweis: Führen Umfangsermüdungsprüfungen an Ringproben aus der rohrförmigen Konstrukte geschnitten. Verwenden Sie zwei Edelstahlstäben als Griffe, um die Proben zu halten.- Montieren Sie die Schlauch bauen auf ein Kunststoffrohr als ein Träger mit 5 mm Lücken (7B), nach der Ernte (Abschnitt 2.4) markiert.
- Schneiden 10 mm Ringe aus dem röhrenförmigen Konstrukts.
- Messen Sie die Länge der Probe mit einem Messschieber für die weiteren Analysen.
- Montieren Sie die ringförmige Probe auf den Stahlstangen des mikromechanischen Tester (7C) Edelstahl. Stellen Sie sicher, um die Probe in der Mitte der Stäbe zu platzieren.
Hinweis: Das Kunststoffrohr in dem Schritt 3.4.1 und einem Schneidsystem, wie in 7B gezeigt, werden verwendet, um eine Beschädigung des Konstrukts während des Schneidens zu vermeiden.
- Ermüdungstest auf Konstrukte in der Längs- oder Umfangsrichtung.
- Dehnen Sie das Konstrukt in die Ausgangsmesslänge.
- Pflegen Sie das Konstrukt in dieser Position für 10 Minuten in pseudo-physiologischen Umgebung.
- Übernehmen 10% zyklische Belastung der Anfangsmesslänge (30 Zyklen) mit dem Konstrukt bei 5% / sec Verformungsgeschwindigkeit.
- Wiederholen Sie Schritt 3.5.3 an inkrementellen Schritten von 10% zyklische Belastung bis zum Versagen der Probe.
Anmerkung: Die Verwendung des Pseudo-physiologischen Umgebung erfordert Berücksichtigung der Auftrieb und die Trägheit des Greifsystem, das die Messung der angelegten Last zu beeinflussen. - Notieren Sie den Hintergrund, wie folgt:
- Bewegen Sie den Lastrahmen auf die Anfangsmesslänge.
- Wiederholen Sie die Schritte 3.5.3 und 3.5.4 ohne Proben angebracht und halten die Greifeinrichtungen an der Lastzelle verbunden ist (nur 1 Zyklus requirot).
4. Luminal Endothelialisierung Konstrukte
Hinweis: Nach dem Anschluss an die Ernte-Protokoll (Abschnitt 2.4), die Konstrukte zu widerstehen, um in der Handhabung der rotierenden Wandbioreaktor für die weitere Endothelialisierung montiert werden.
- Drehende-Wand Bioreactor Entwurf
- Bohren Sie ein 4,5 mm Loch in der Mitte des belüfteten Kappe des Reservoirrohr ohne Beschädigung der Filtermembran, die die Belüftungsöffnungen abdeckt.
- Press-fit einen Dorn (Durchmesser = 4,5 mm, Länge = 40 mm) in das Loch und befestigen Sie den Dorn, wie in Schritt 1.1.2 beschrieben.
- Bereiten Sie zwei C-förmigen Silikon-Unterstützung für das Konstrukt Außendurchmesser = 14 mm; Innendurchmesser = 8 mm).
- Positionieren einer sich drehenden Motor in einem Ende der rotierenden Wand Bioreaktor und ein Lager am anderen Ende (8B).
- Lumen Endothelialisierung
- Erweitern menschlichen Nabelal Venenendothelzellen (HUVECs) in 25 cm 2 Kulturflaschen mit 5 ml M199-Kulturmedium mit 10% (v / v) PS, 10% ergänzt (v / v) FBS, 1% (v / v) Pen-Strep in Petrischalen im Inneren eines Inkubators (T = 37 ° C, 5% CO 2, 100% Luftfeuchtigkeit), bis 90% Konfluenz.
- Vorbereitung 1,5 ml der Proteinbeschichtungslösung pro Konstrukt für eine optimale Zelladhäsion erforderlich durch Verdünnen des Konzentrats Proteinmischung auf 10,5 ng / ml in serumfreies Kulturmedium von Endothelzellen.
- Messen Sie die Länge des Konstrukts mit einem Messschieber.
- Berechnung der Lumenvolumen V und der luminalen Fläche A des Konstrukts als: V = D in 2 L / 4 und A = D L jeweils (wobei D in der Innendurchmesser entsprechend der Dorndurchmesser ist, und L die Länge des Konstrukts).
- Positionieren Sie das Konstrukt in der Mitte des Behälters nach dem Ernteverfahren (Abschnitt 2.4).Mit C-förmigen Silikonträger um das Konstrukt zu befestigen an beiden Enden mit dem Behälter (8A).
- Füllen Sie den Behälter mit 35 ml Kulturmedium.
- Füllen 75% der berechneten Lumenvolumen des Konstrukts (V) mit dem in Schritt 4.2.2 protein Beschichtungslösung. Schließen beide der Enden des Konstrukts, um jede Leckage des Proteins Beschichtungslösung (8A) zu vermeiden.
- Montieren Sie den rotierenden Wandbioreaktorsystem im Inneren der Zellkultur Kapuze.
- Setzen Sie den Bioreaktor in einem 37 ° C Inkubator und starten Sie die Drehung der Bioreaktor bei 4,02 × 10 -5 g Kraft für 1 Stunde, um die luminale Beschichtung wie in 8B gezeigt, zu ermöglichen.
- Öffnen des oberen Endes des Konstrukts und Aspiration des Proteinbeschichtungslösung aus dem Lumen.
- Lösen HUVECs (Passage 2-3) durch Entfernung des Kulturmediums von den Kolben der HUVECs und Zugabe von 3 ml der Trypsin-Lösung (1x in PBS). ICHncubate für 5 min (T = 37 ° C, 5% CO 2, 100% Feuchtigkeit).
- Resuspendieren der HUVECs mit einer Konzentration von 4 x 10 6 Zellen / ml in ergänztem M199 Kulturmedium.
- Im Inneren des Zellkulturhaube, Samen HUVECs in das Lumen des Konstrukts mit einer Dichte von 1.000 Zellen / cm 2. 15 schließen die oberen Extremitäten des Konstrukts, um jede Leckage des HUVECs Lösung zu vermeiden.
- Die Konstrukte (T = 37 ° C, 5% CO 2, 100% Feuchtigkeit) gehostet in den rotierenden Wandbioreaktor (8B) und die Kultur für 2 Tage Inkubieren bei einer konstanten Drehung des 4,02 x 10 -5 g Kraft.
- Zu ernten, die das Konstrukt nach 2 Tagen Kultur unter sterilen Bedingungen und bereiten sie für die weitere biologische Charakterisierung, wie in Abschnitt 2.4 beschrieben.
Ergebnisse
Diese Arbeit beschreibt die Herstellung von technischen Rohr Kollagen-basierten Konstrukten, die Gefäßzellen. Bereits nach 1 Stunde der frühen Gelierung wurde Zellen-and-Kollagen-Mischung direkt in einer 3D-röhrenförmige Geometrie montiert, mit dem Außendurchmesser gleich dem Durchmesser der entsprechenden Form (etwa 14 mm). Entlang statischen Reifung zeigten Messungen der raschen Reduzierung des Außendurchmessers der rohrförmigen cellularized Strukturen, wie in Tabelle 1 gezeigt ist. Der Durchmesser der cellularized Kollagengele von etwa 60% des Ausgangswertes nach dem 1. Tag der statischen Kultur geschrumpft und von fast 85% innerhalb von 7 Tagen (Supplemental Video 2). SMCs innerhalb der Konstrukte für die beobachtete Schrumpfung und die damit verbundene mechanische Verstärkung verantwortlich ist, da dieser Vorgang nicht in nicht-zellularen Kollagenträger auftreten. Man beachte, daß kein Gradient von jeder Art (thermisch, biochemische, mechanischen oder anderen) aufgetragen. Die Zellen-Laufwerkn Verdichtung führte zu einem Material mit höherer Dichte, die Kollagen gehandhabt und gegen mechanische Bitten gedämpft werden könnte (Supplemental Videos 3 und 4).
Um die Zellen getriebene Umbau der gesamten mechanischen und viskoelastischen Eigenschaften beziehen, wurden Ermüdungsprüfungen an den Konstrukten (Supplemental Videos 5 und 6) durchgeführt wird. Diese Versuche bestanden in Radfahren den Konstrukten (30-mal) bei unterschiedlichen konstanten Stämme (10%, 20% und 30% der ursprünglichen Messlänge), und um die Spannung als Antwort der Konstrukte zur mechanischen Aufforderung über die Zeit aufzuzeichnen. Die repräsentativen Ergebnisse Pro Konstrukt werden in 9 gezeigt. Das Konstrukt widerstanden höheren Belastungen in Längsrichtung (75 kPa) als in Umfangsrichtung (16 kPa) bei dem gleichen Dehnungsbereich (30% Dehnung) unterzogen. Inzwischen bei jedem Zyklus der Spannungsspitzenwert für die ta erreichtrgeted maximale Dehnung sank im Laufe der Zeit. Dieses Verhalten ist typisch für die Hoch viskoelastischen Eigenschaften durch diese Kollagen-basierten Konstrukten ausgestellt.
Die biologische Aktivität der cellularized Konstrukte wurde bei statischer Reifung beurteilt. Daher wurde die Stoffwechselaktivität der SMCs durch Messung der Glukoseverbrauch und Laktatproduktion während der statischen Kultur ausgewertet. Das Kulturmedium wurde alle 2 Tage und Glukose abgetastet und Laktatkonzentrationen wurden mit Hilfe eines Blutgasanalysegerät gemessen. Die ständige Zunahme der Glukoseverbrauch und Laktatproduktion kombiniert, um die wichtige Schrumpfen der Konstrukte, bezeugen die SMCs Aktivität entlang statische Kultur (Abbildung 10).
Die erhöhte mechanische Stabilität aufgrund der Zellgetriebenen Umbau erlaubt die Manipulation der Konstrukte und die anschließende Endothelialisierung Prozess. Trichrom-Färbung nach Masson auf den endothelialisiert Konstrukte durchgeführtzeigte eine sehr homogene Endothel. SMCs zeigte eine spindelartige förmige Morphologie und erschien homogen durch die Wand verteilt sind, während HUVECs erschien in der luminalen Seite (Figur 11) gut verteilt.
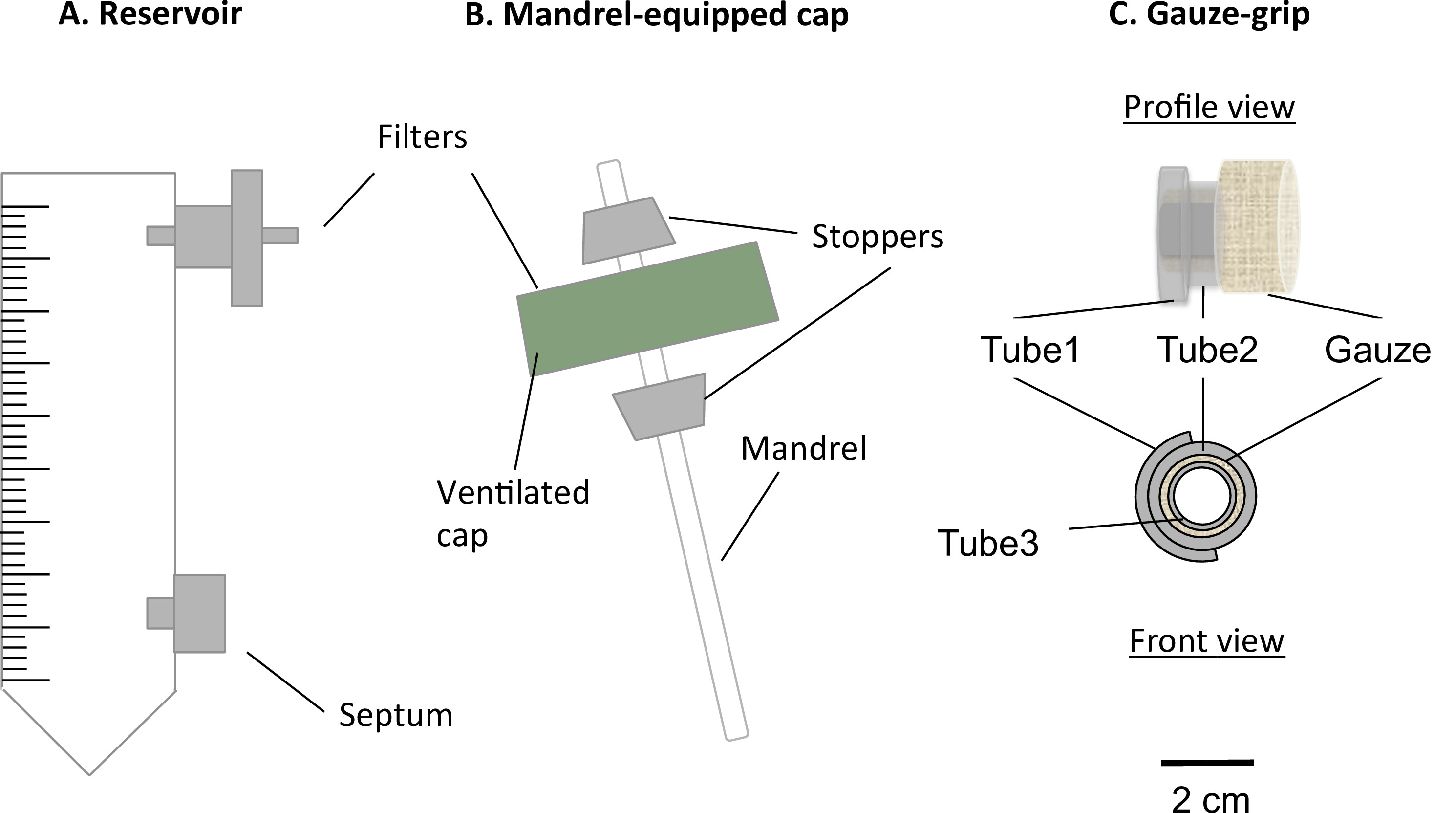
Abb. 1: Die Komponenten des statischen Bioreaktor Die statische Bioreaktor bestand aus einem modifizierten 50 ml Zentrifugenröhrchen (A) und einem Dorn ausgestatteten Kappe (B). Das Röhrchen diente als Medienspeicher, und mit einem Port für ein 0,22 um-Filter, für den Gasaustausch und einem Septum ausgestattet ist, für die mittlere Abtastung und Wechsel. A in der belüfteten Kappe vorhanden Dorn erlaubt die Herstellung von Konstrukten in Röhrenform. Die Gaze-Griffe (C) wurden entworfen und hergestellt, um die Gelierung der Konstrukte über den Dorn unterstützt. Darüber hinaus sind dieseGriffe erlaubt die Konstrukte nach dem statischen Reifung behandelt werden und auf die mechanische Vorrichtung befestigt werden. Der Außendurchmesser des Dorns war 4,7 mm.
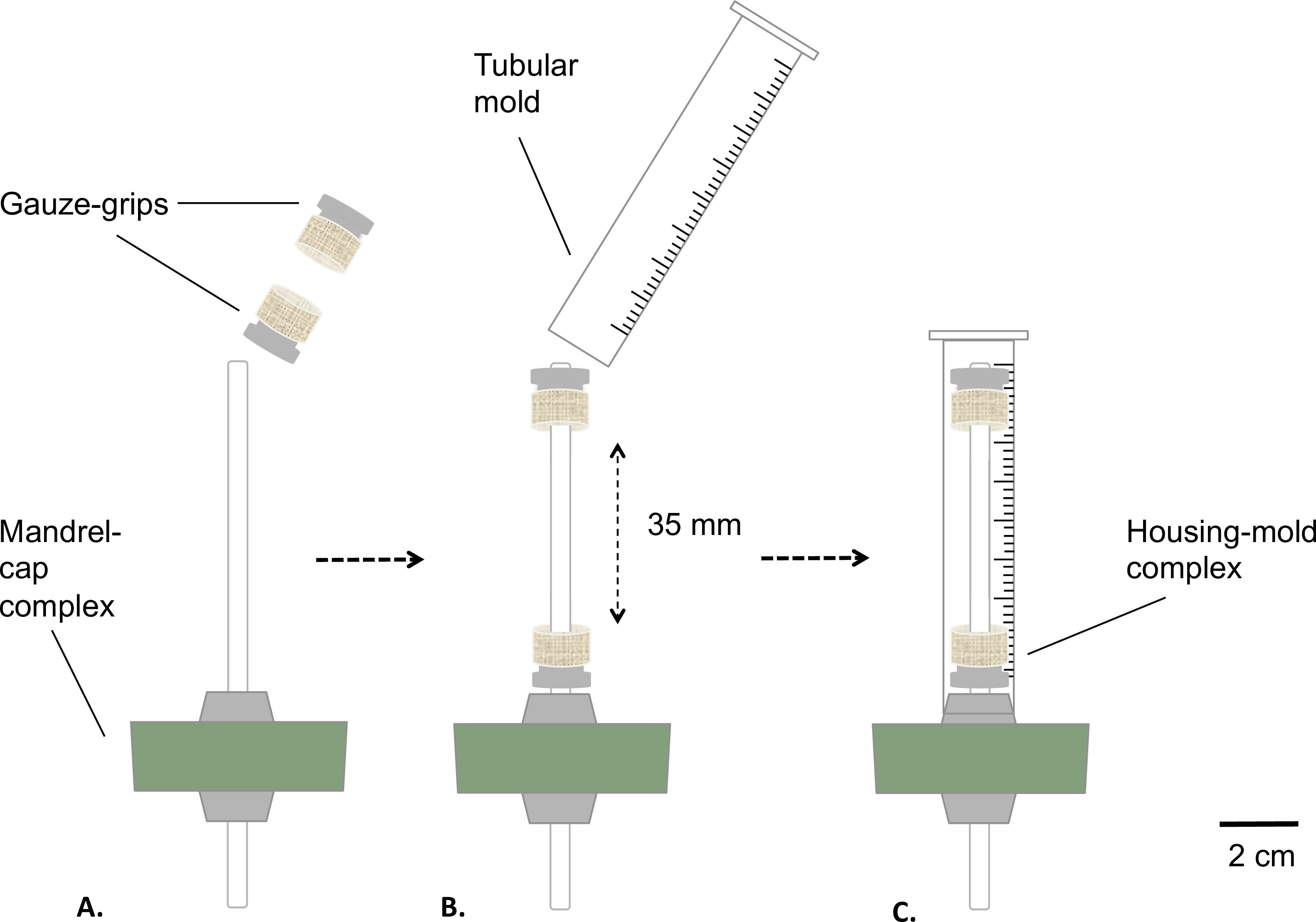
Figur 2: Montage der statischen Bioreaktor Montagephasen des Bioreaktors vor der Sterilisierung.. Die Gaze-Griffe wurden auf dem Dorn (A) in einem festen Abstand angeordnet. Es wurde eine Form eingelegt (B) und dicht an den Silikonstopfen (C) befestigt ist. Der Außendurchmesser des Dorns war 4,7 mm.
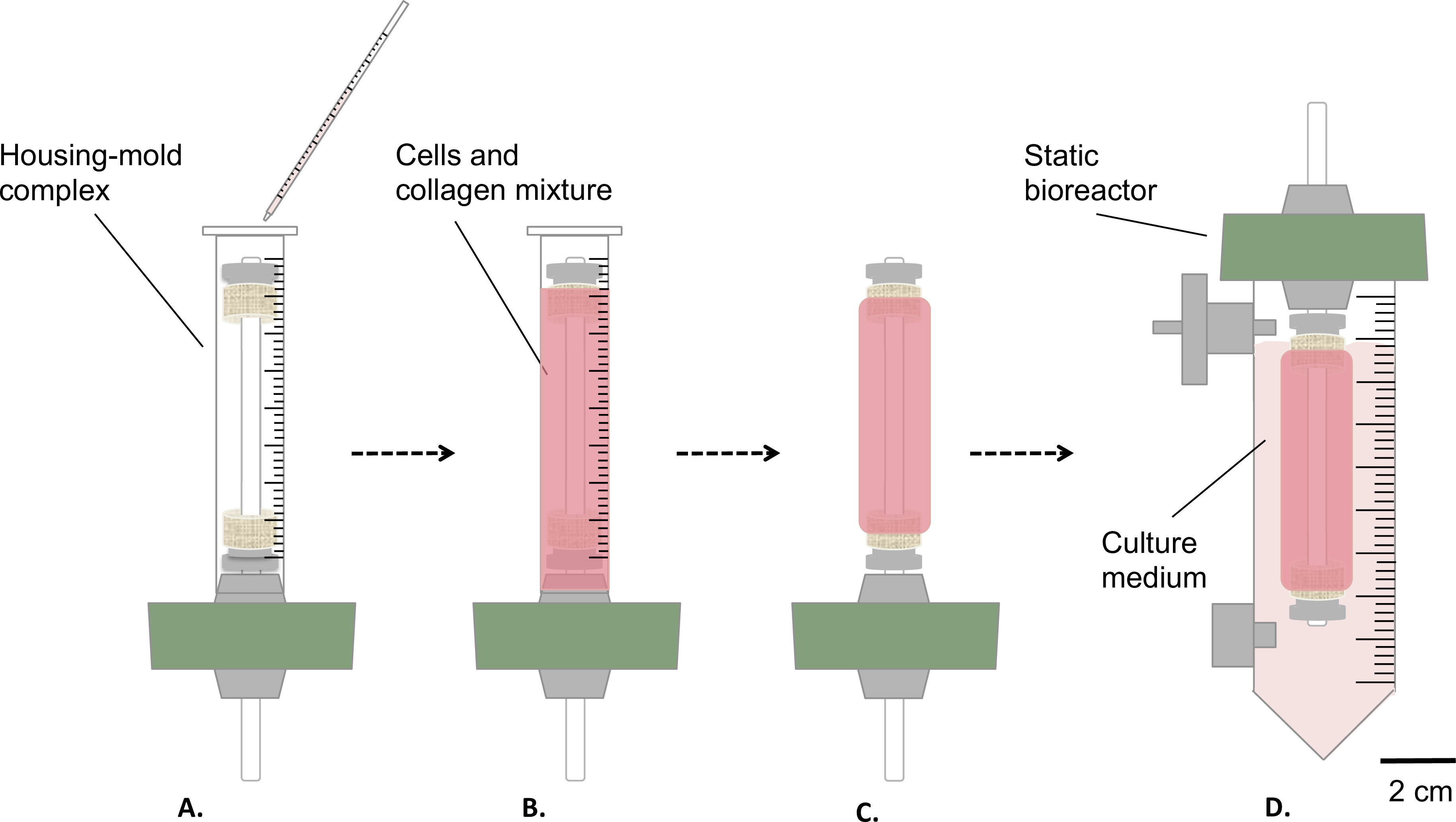
Fig. 3: Die Herstellung der Konstrukte unter sterilen Bedingungen die Zellen und Kollagen Mischung wurde in das Gehäuse-Form komplexen gegossen (A) und ließ Gel 1 h lang bei Raumtemperatur (B). Danach wurde die Form entfernt (C) wurde die statische Bioreaktors montiert (D) und in einen Vorratsbehälter für das statische Reifung des Konstrukts im Inkubator (T = 37 ° C, 5% CO 2, 100% Feuchtigkeit) überführt. Der Außendurchmesser des Dorns war 4,7 mm.

Fig. 4: Messung der Schichtdicke / Außendurchmesser der Konstrukte A Laser-Scanning-Interferometer verwendet, um die Messung der Außendurchmesser der Konstrukte auszuführen. Das Konstrukt wurde in den Weg des Laserstrahls angeordnet und erzeugt einen Schatten. Die Breite des Schattens entsprechend dem Außendurchmesser des zu konstruieren, wurde dann gemessen, und auf dem Bildschirm angezeigt.

Abb. 5: Die morphologische Erscheinungsbild der geernteten Konstrukt (A) Gleich nach dem Gelieren und (B), nachdem die Zellen getriebene Umbau während statische Reifung für 2 Wochen.

Abbildung 6: Versuchsaufbau zur mechanischen Charakterisierung Es bestand der mikromechanischen Testgerät mit 5 oder 10 N Lastzelle und einem Bad, das PBS bei 37 ° C, die Proben in Form von Pseudo-physiologischen Bedingungen zu halten ausgestattet..
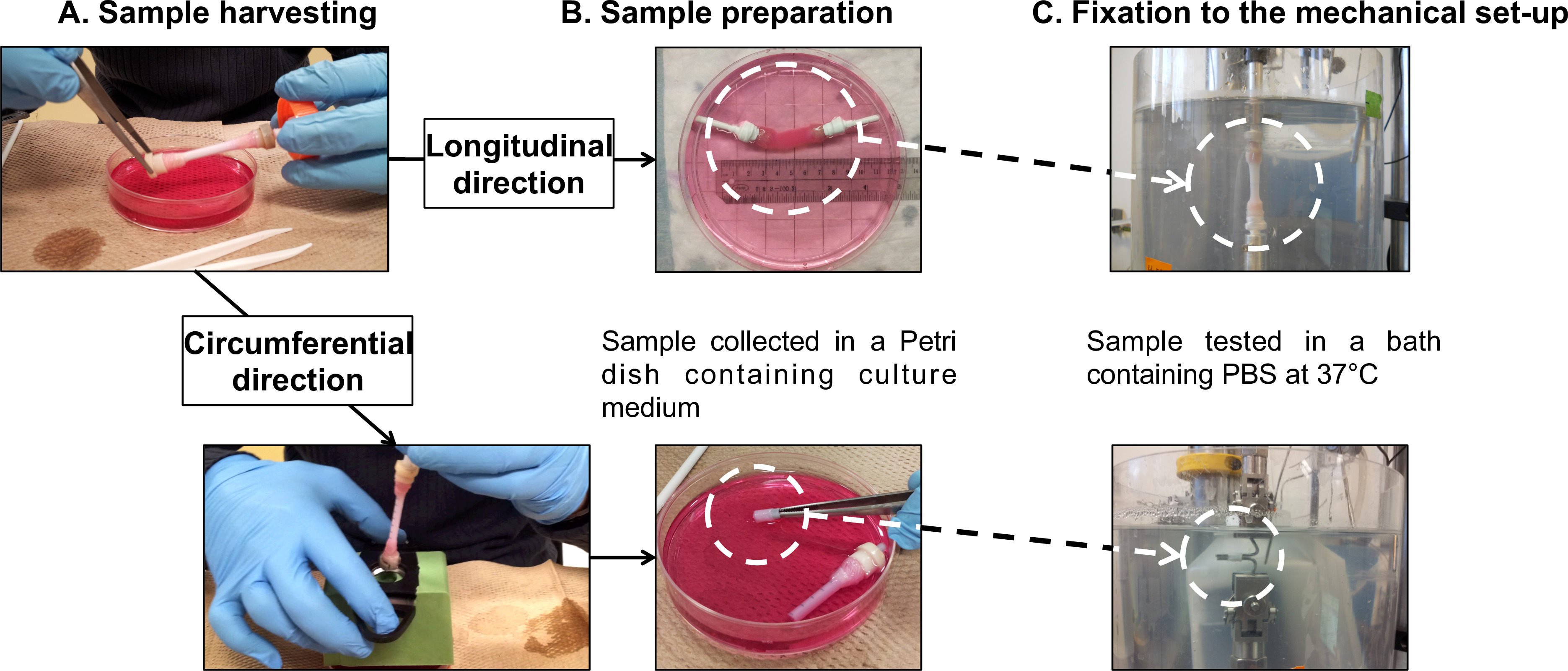
Abbildung 7: Probenvorbereitung f oder mechanische Charakterisierungen. Beispielsernte (A) und Präparat (B) Dauertests in Längsgeführt und Umfangsrichtungen (C). Der Außendurchmesser des Dorns war 4,7 mm.
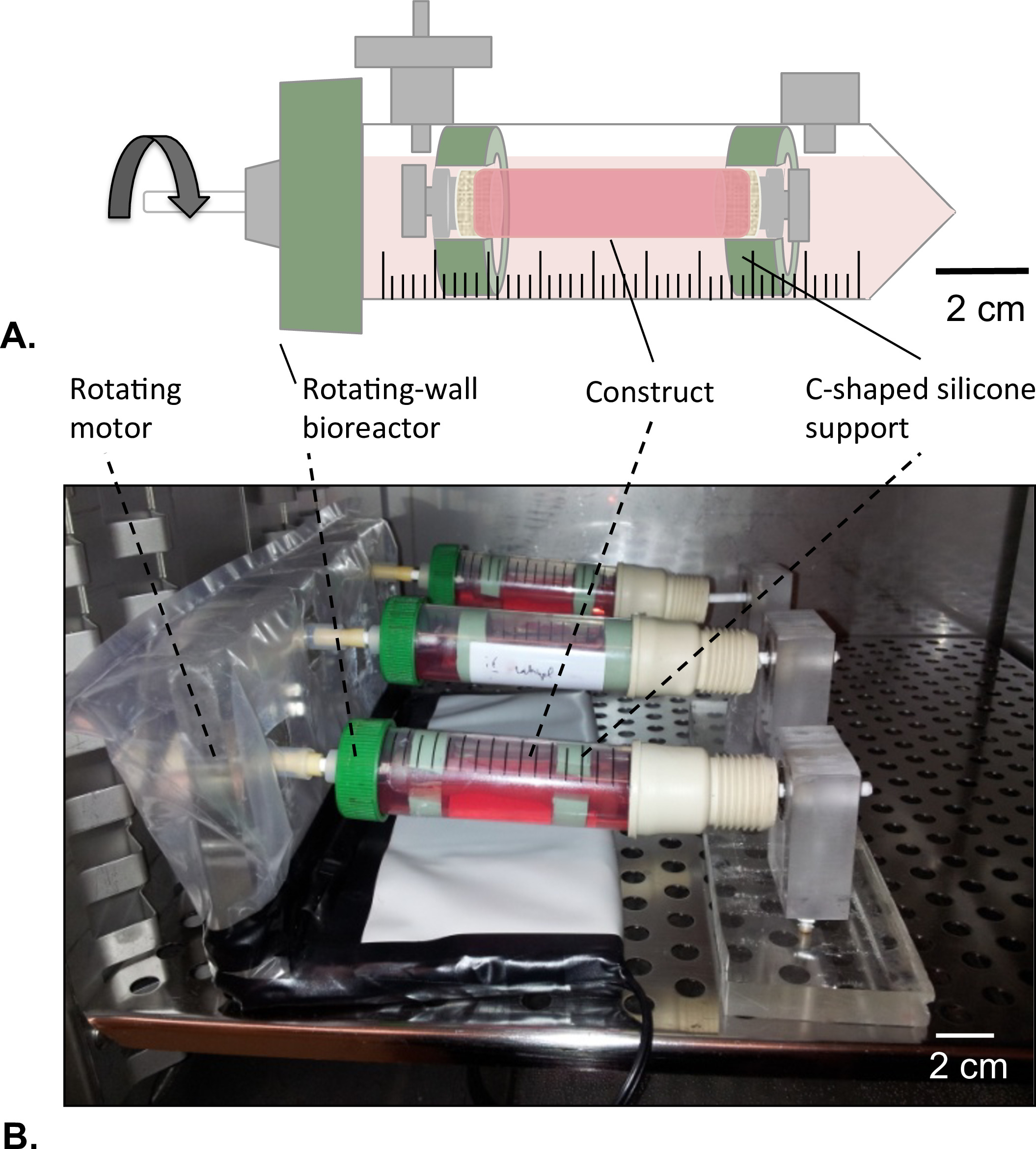
Abbildung 8: Drehwand Bioreaktor (A) Die rohrförmigen Konstrukte wurden in die Mitte des Behälters mit Hilfe der c-förmigen Silikon Träger aufgebaut.. Beide Enden des Konstrukts wurden geschlossen, um ein Austreten der Lösung zu vermeiden HUVECs. (B) Die Konstrukte wurden im Inkubator kultiviert (T = 37 ° C, 5% CO 2, 100% Feuchtigkeit) in Drehung bei 4,02 x 10 -5 g Kraft für 2 Tage.
2 / 52812fig9highres.jpg "width =" 700 "/>
Abbildung 9:.. Mechanische Charakterisierung Ergebnisse von Ermüdungsprüfungen an Konstrukten in Längsrichtung (A) durchgeführt und Umfangs (B) Richtungen nach Zellgetriebene Umbau Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
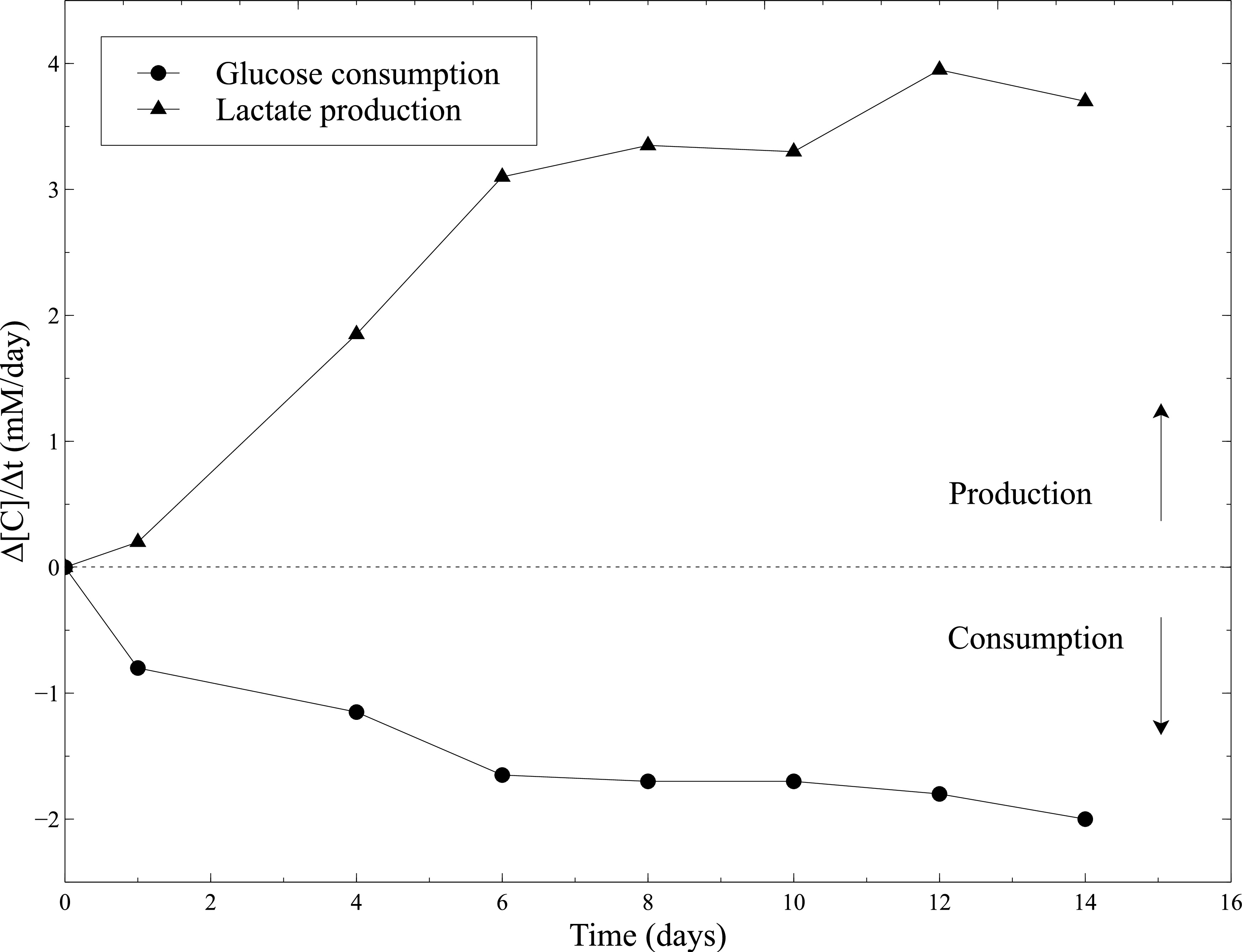
Abb. 10: Stoffwechselaktivität von SMCs in den Kollagengelen Messungen der Glukoseverbrauch Frequenz und Laktatproduktionsrate wurden mit der Blutgasanalysegerät alle 2 Tage durchgeführt, nachdem das Kulturmedium Wechsel. Frisches Kulturmedium wurde als Basisniveau für die Glukose und Laktat-Konzentrationen Messungen verwendet.
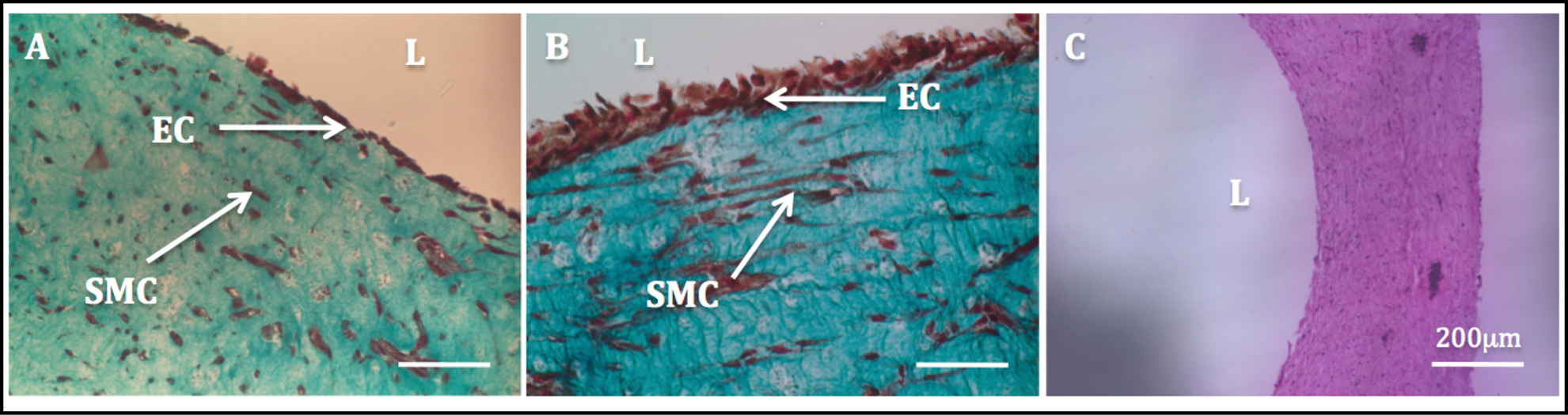
Abbildung 11: Lumen Endothelialisierung histologische Bilder der radialen Querschnitte der rohrförmigen Konstrukte.. Masson Trichome Färbung von Rohr Konstrukte kultiviert statisch für 1 Woche (A) und 2 Wochen (B). H & E-Färbung aus einem röhrenförmigen Konstrukt (C).
| Zeit | Dicke (mm) | Verdichtung (%) |
| 0 hr | 4.83 ± 0.02 | 0 ± 0 |
| 2 Stunden | 4.26 ± 0.02 | 12 ± 0 |
| 4 Stunden | 4.21 ± 0.03 | 13 ± 1 |
| 6 Stunden | 4,06 ± 0,10 | 16 ± 2 |
| 12 hr | 3,16 ± 0,07 | 35 ± 1 |
| 1 Tag | 2,08 ± 0,11 | 57 ± 2 |
| 1 Woche | 0,68 ± 0,07 | 86 ± 1 |
| 2 Wochen | 0,36 ± 0,00 | 93 ± 0 |
Tabelle 1: schnelle Verdichtung Konstrukt Messers während des statischen Reifung Wandstärke der Konstrukte und die Verdichtungsrate als eine Funktion der Zeit der statischen Kultur.. Verdichtung wurde durch Bestimmung der Außendurchmesser der rohrförmigen Konstrukte mit einem Abtast-Laser-Interferometer (Serie 183B, Lasermike 136) gemessen. Nach 24 Stunden verdichtet die Konstrukte auf 57% ± 2% ihrer Form Dimensionen. Daten sind ausgedrückt als Mittelwert ± SD (n = 3). Das Vorliegen und die Aktivität lebender Zellen der glatten Muskulatur war für solche wesentlichen Änderungen die nur verantwortlich.
Supplemental Video. 1: Ernten der nicht umgebaut Rohr Kollagengelen Bitte klicken Sie hier, um dieses Video anzusehen.
Supplemental Video 2:. Cells getriebenen Verdichtung des Rohr Kollagengelen Bitte klicken Sie hier, um dieses Video anzusehen.
Supplemental Video. 3: Manipulation der nicht umgebaut Rohr Kollagengelen Bitte klicken Sie hier, um dieses Video anzusehen.
Supplemental Video. 4: Manipulation der Zellen-Rohr umgebaut Kollagengelen Bitte klicken Sie hier, um zu sehen thVideo ist.
Supplemental Video. 5: Längsermüdungstest (bei 30%) auf Zellen-Rohr umgebaut Kollagengelen Bitte klicken Sie hier, um dieses Video anzusehen.
Supplemental Video. 6: Umlaufende Ermüdungstest (bei 30%) auf Zellen-Rohr umgebaut Kollagengelen Bitte klicken Sie hier, um dieses Video anzusehen.
Diskussion
In der Gemeinschaft der Gefäßgewebe Ingenieure, haben große Anstrengungen getan worden, um die für die mechanische Stabilität der Blutgefäße verantwortlich 16 Tunica media Schicht zu reproduzieren. Seit der Pionierarbeit von Weinberg und Bell 17, Kollagen wurde weithin als Gerüst für die Gefäßgewebezüchtung wegen ihrer Biokompatibilität, nicht-immunogene Eigenschaften und die Verfügbarkeit eingesetzt. Die Verwendung von Kollagen stellt aber eine große Herausforderung für die Forscher, da dieses Material nicht einfach zu handhaben, aufgrund der intrinsischen Mangel an mechanischer Steifigkeit. Manipulationen während der Gerüstvorbereitung können die Gerüste beschädigen, beeinträchtigen sie für die weitere Verwendung.
Die in dieser Arbeit beschriebenen Verfahren ermöglicht: i) cellularized Kollagengele in eine röhrenförmige Geometrie zu konstruieren, ii) um biologische Gewebe zu konstruieren stark genug, um nach einer kurzen statischen Reifezeit (1 oder 2 Wochen) behandelt werden, iii) alssess mechanischen und viskoelastischen Eigenschaften eines solchen rohrförmigen biologischen Geweben in 2 Richtungen. Die Zellen in dem Gel spielen eine Schlüsselrolle in der Kollagenmatrix Umbau. Während der Reifezeit, führte kontraktilen SMCs zur Verdichtung der Gele wodurch ein Konstrukt mit einer höheren mechanischen Stabilität, die in den Längs- und Umfangsrichtung beurteilt werden konnte. Danach ausgesät HUVECs in der luminalen Seite der Konstrukte erzeugt eine homogene und tragfähige Endothel und bewiesen damit die Eignung der Kollagengele für vaskuläre Gewebezüchtung.
Die in dieser Arbeit vorgestellten Bioreaktor wurde speziell entwickelt, um eine optimale Umgebung für das Zellwachstum während der statischen Reifung bereitzustellen. Darüber hinaus wurden die für die Charakterisierung der mechanischen und viskoelastischen Eigenschaften der Konstrukte entwickelt Vorrichtungen mit dem Ziel entwickelt, um jeden möglichen Schaden inhärent die Manipulation zu verringernwie empfindliche Materialien. Daher wurde die statische Bioreaktor ein 0,22 um Filter und einer Filtermembran auf der Kappe (Schritt 1.1.2 1A ausgestattet und B), die Gasaustausch zwischen Kulturmedium innerhalb des Behälters und dem Inkubator erlaubt, während eine sterile Kulturumgebung. Die Luer-Septum am Boden wurde als Hafen für Kulturmedium Probenahme und zum Ändern während statische Kultur. Einige wichtige Schritte müssen während Konstrukt Herstellung und Charakterisierung berücksichtigt werden. All die Manipulationen (im Schritt 2.1.1 und in den nachfolgenden Schritten durchgeführt wird), die die Sterilität des Systems nicht beeinträchtigen könnten, wurden in einer sterilen biologischen Abzug durchgeführt. Zellen und Kollagen-Gel Gemischaufbereitung wurde auf Eis, um das Gelieren verzögern behandelt (Schritte 2.1.4 bis 2.1.7). Bei Schritt 2.1.7, alle Luftblasen in der Mischung vor der Gelierung eingeschlossen sind potentielle Spannungskonzentration, die die Bereiche s gefährden könnenRentabilität der Konstrukte. Daher erfordert die Entfernung eines solchen Luftblasen leicht Schütteln der Montage oder Verwendung von Medizin Vakuum für 3 min zur Entgasung unter sterilen Bedingungen. Schließlich wurden die Griffe, die speziell für die Achse des Dorns zentral in der röhrenförmigen Form während der Gelierung zu erhalten und zu ermöglichen, dass empfindliche Manipulation der Konstrukte bei der Ernte (Entfernen des Dorns, Abschnitt 2.4) zur Endothelialisierung ausgebildet und zur Erleichterung der Montage an das mechanische System (Längs Tests).
Das vorliegende Protokoll schlägt eine Original einfach zu Prozess alternativer Ansatz der Verstärkung Kollagengelen Konstrukte auf Basis des natürlichen Eigenkontraktionspotential von SMCs. Übliche Techniken von Kollagenmatrices Verstärkung beinhalten die Verwendung von physikalischen und chemischen Vernetzungsmitteln, die schädliche Wirkungen auf die Zellen-Matrix-Interaktionen 18 aufweisen kann - 20. Die Herstellungstechnik in vorgediese Arbeit ermöglicht Leiten Sie diese Zellen getriebenen Umbauprozess, um ein Tissue-Engineering-Konstrukt mit gezielten mechanischen Eigenschaften ohne physikalische oder chemische Behandlung zu erhalten.
Charakterisierung von mechanischen und viskoelastischen Eigenschaften von hydrierten Kollagengelen ist eine große Herausforderung. In dieser Hinsicht ist die vorliegende Protokoll beschreibt eine ursprüngliche einfache und effiziente Methode zur Beurteilung der mechanischen Eigenschaften von Rohrweichteile. Diese Charakterisierung kann nicht nur in Umfangsrichtung, sondern auch in der Längsrichtung direkt auf die gesamte Rohrstruktur durchgeführt werden. Während mechanische Charakterisierung, Temperatur, wässrigen Umgebung, pH und Ionenstärke sind einige der Umweltfaktoren, die bekanntermaßen stark beeinflussen das mechanische Verhalten von biologischem Gewebe 21. Daher ist die vorliegende Arbeit schlägt eine originelle Einrichtung und Protokoll für die mechanische Charakterisierung von biologischen Geweben in einem hochreproduzierbare Pseudo physiologische Umgebung (Kochsalzlösung bei 37 ° C und pH 7,4). Um das Beste aus unserem Wissen, hat diese Art der Charakterisierung nie anderswo gemeldet.
Im Ergebnis ist die in dieser Arbeit vorgeschlagene Technik zeigt das hohe Potential der direkten Mischen der Zellen mit Kollagen für Gefäßgewebe-Engineering-Anwendungen. Diese Methode zusammen mit der mechanischen Charakterisierung und Endothelialisierung Prozess bilden Hoch polyvalenten Protokolle. Daher durch leichte Modifikationen der Set-ups und Protokolle, während die gleichen Gründe, Hauptanforderungen für Engineering Gefäßgewebeäquivalenten angegangen werden, wie eine schnelle und unkomplizierte Abwicklung, einschließlich Endothelialisierung, und die Möglichkeit, auf eine Vielzahl von weichen umgesetzt werden Geweben mit verschiedenen Längen und Durchmessern. Weiterhin verschiedenen adhärenten Zelltypen ECM Proteine und Formgeometrien können für eine Anzahl ausgewählter applicati sucht werdenons, wie Engineering Sehnen, Hauttransplantationen, Herz Patches, Nerven, unter anderem. Obwohl die mechanischen Eigenschaften der Konstrukte ermutigend sind, sind sie immer noch geringer als die von nativem Gewebe. In diesem Zusammenhang haben wir davon überzeugt, dass eine sehr kurze statische Reifezeit ist ein entscheidender Schritt in Richtung der dynamischen Anregung in einen Bioreaktor und damit zu einer höheren strukturellen Integrität und mechanische Stabilität führt. Allerdings ist die Möglichkeit, schnell zu produzieren Gewebezüchtung cellularized Kollagenbasis Konstrukte für die mechanische und histologische Analysen ermöglicht die hier beschriebene eine nützliche und vielversprechende Methode, um einen Einblick in das Zusammenspiel zwischen Zellen und ECM während des Wachstums und Umbau, oder sogar bereitzustellen statischen Bioreaktor als Modell für die Therapien und Wirkstoffabgabesysteme verwendet werden.
Offenlegungen
Keine Finanzierung wurde von Organisationen oder Einrichtungen mit potenziellen Interessenkonflikt erhalten.
Danksagungen
Diese Arbeit wurde von der Natural Science and Engineering Research Council of Canada, der kanadischen Institut für Gesundheitsforschung und der CHU de Québec Forschungszentrum finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
Referenzen
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten