Method Article
Ingegneria 3D Cellularized collagene Gel per Vascolare Rigenerazione Tissutale
In questo articolo
Riepilogo
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
Abstract
I materiali sintetici sono noti per avviare complicazioni cliniche come l'infiammazione, la stenosi, e le infezioni quando impiantati come sostituti vascolari. Il collagene è stato ampiamente utilizzato per una vasta gamma di applicazioni biomediche e viene considerata una valida alternativa ai materiali sintetici per la sua biocompatibilità intrinseca (cioè, bassa antigenicità, infiammazione, e risposte citotossiche). Tuttavia, le limitate proprietà meccaniche e la relativa mano bassa-capacità di gel di collagene hanno ostacolato il loro uso come materiali scaffold per l'ingegneria tissutale vascolare. Pertanto, la logica alla base di questo lavoro è stata la prima a progettare gel di collagene cellularized in una geometria a forma tubolare e in secondo luogo favorirne cellule muscolari lisce riorganizzazione guidato di matrice di collagene per ottenere tessuti abbastanza rigide da trattare.
La strategia qui descritta si basa sul montaggio diretto di collagene e cellule muscolari lisce (costruire) in un cyli 3Dgeometria ndrical con l'uso di una tecnica di stampaggio. Questo processo richiede un periodo di maturazione, durante il quale i costrutti sono coltivate in un bioreattore in condizioni statiche (senza applicati vincoli meccanici dinamiche esterne) per 1 o 2 settimane. Il "bioreattore statico" fornisce un ambiente sterile monitorati e controllati (pH, temperatura, scambio di gas, rifornimento dei nutrienti e rimozione dei rifiuti) per i costrutti. Durante il periodo di coltura, misure di spessore sono stati eseguiti per valutare l'cellule-driven rimodellamento della matrice di collagene, e consumo di glucosio e tassi di produzione di lattato sono stati misurati per monitorare le cellule attività metabolica. Infine, le proprietà meccaniche e viscoelastiche sono stati valutati per i risultanti costrutti tubolari. A tal fine, i protocolli specifici e un know-how concentrato (manipolazione, di presa, lavorando in ambiente idratato, e così via) sono stati sviluppati per caratterizzare i tessuti ingegnerizzati.
Introduzione
Ingegneria dei tessuti vascolari prevede diverse strategie mirate alla realizzazione di vasi ingegnerizzati, tra cui gli innesti a base di ponteggi sintetiche, vasi sanguigni tissutale basati strato di cellule (TEBVs) e matrice extracellulare (ECM) componenti basati TEBVs. Tra questi approcci, polimeri sintetici presentano buone proprietà meccaniche, ma condividono un inconveniente comune in quanto mancano bioattività 1. Il metodo basato su strato cellulare permette la produzione di sostituti vascolari artificiali, con elevate caratteristiche meccaniche, ma il tempo richiesto per produrre tali innesti è circa 28 settimane 2. Biopolimeri naturali della ECM, come il collagene, elastina, la fibrina 3 o una combinazione di questi, restano i materiali standard d'oro per ponteggi di ingegneria tissutale. Questo è principalmente per la ragione che questi materiali possiedono generalmente buona biocompatibilità pur essendo in grado di indurre risposte cellulari funzionali 4-5. Tra questi biopolimeros, collagene di tipo I è uno dei più abbondanti e predominante proteina portante della ECM in molti tessuti come la pelle, vasi sanguigni e tendini. Un'ampia attività è stata condotta sulle proprietà meccaniche del collagene 6 - 8, ma ci sono stati pochi studi sul rimodellamento cellulare del gel di collagene durante la maturazione statica. Rimodellamento cellulare si riferisce alle modifiche strutturali della matrice di collagene indotta da cellule che potrebbero alterare la stabilità della rete di fibrille di collagene 9. Come un ponteggio naturale, relativamente grandi quantità di collagene di tipo I possono essere isolate, sterilizzati e conservati da diverse fonti, come ratto-coda tendini 10. La comprensione interazioni cellulari con collagene e relativi comportamenti complessivi meccaniche degli scaffold di collagene cellularized (costrutti) è un passo essenziale per la costruzione di tessuti. TEBVs base di collagene possono essere elaborati miscelando direttamente le cellule con collagenedurante la preparazione del gel e ulteriormente modellato in forme particolari quali tubolare e planare 11. Cellule vascolari all'interno dei gel proliferano e tipo rimodellare collagene 12. Così, questo metodo ignora la necessità di macroporosità specifica che rappresenta uno dei problemi significativi nello sviluppo di scaffold per applicazioni di ingegneria tissutale. Tuttavia, i principali svantaggi di gel di collagene sono le loro scarse proprietà meccaniche rispetto ai materiali sintetici 13.
In questo studio, un tessuto vitale con distribuzione omogenea di cellule è stato progettato per miscelazione diretta di collagene con cellule in un unico passaggio. "bioreattori statici" sono stati utilizzati per le 1 o 2 settimane di maturazione statica dei gel di collagene cellularized (senza applicati vincoli meccanici dinamiche esterne). Durante la coltura, rimodellamento della matrice di collagene è verificato, fornendo così rinforzo strutturale per i costrutti. Inoltre, questi costrutti furono ready da trasferire ad un bioreattore rotante parete e un endotelio omogeneo è stato raggiunto. Inoltre, in questo lavoro viene proposto anche uno specifico protocollo di test meccanico per fornire un approccio adeguato nel caratterizzare le proprietà meccaniche dei tessuti molli tubolari.
In sintesi, questo lavoro presenta un metodo per la rapida realizzazione e maturazione dei tessuti vascolari che sono abbastanza forti da trattare non solo per caratterizzazioni biologiche e meccaniche, ma anche per un ulteriore condizionamento meccanico in un bioreattore dinamico, che è considerato un cruciale in vitro intervenire la rigenerazione dei tessuti.
Protocollo
1. Realizzazione e montaggio del Static bioreattore
- Realizzazione della Riserva
- Preparare 50 ml provette da centrifuga da serbatoio per mezzo di coltura del bioreattore.
- Fare due porte perforando due 5 mm Diametri fori a 20 mm dal fondo e la parte superiore del serbatoio, rispettivamente. Quindi inserire due raccordi luer in 5 millimetri tubi lunghezza di silicone. Press-Fit questi raccordi luer attraverso i fori, e sigillare tutte le connessioni con la colla silicone medicale.
- Inserire un filtro nell'attacco superiore del serbatoio (Figura 1A) 0,22 micron.
- Inserire un setto luer nell'attacco inferiore del serbatoio (Figura 1A).
- Assemblea Mandrino-cap
- Praticare un foro di diametro di 4,5 mm a centro del tappo ventilato del tubo serbatoio senza danneggiare la membrana del filtro che copre i fori di aerazione.
- Preparare una ancoretta (diametro = 4.5 mm, lunghezza = 100 mm) Come un mandrino per il costrutto.
- Preparare due tappi conici in silicone (lunghezza = 10 mm, con diametro medio foro = 4.5 mm).
- Assemblare il mandrino ed il tappo (complesso mandrino-cap) come descritto nella Figura 1B.
- Press-montare il mandrino nel foro. Inserire i 2 tappi sul mandrino in modo che il tappo è montato tra loro. Regolare la posizione del mandrino in modo che la sua lunghezza utile è di 78 mm.
- Applicare un primer e poi colla silicone di grado medico alle superfici che saranno in contatto prima di unirsi al tappo e tappi conici in silicone insieme. Rimuovere la colla in eccesso sul tappo.
- Lasciare asciugare a temperatura ambiente per 1-3 giorni.
- Realizzazione della garza-grip
- Preparare 3 tubi silicone (tubo 1: diametro interno = 6,4 millimetri, lunghezza = 5 millimetri; tubo 2: diametro = 6,4 millimetri, lunghezza 10 mm, e tubo 3: diametro = 3,1 millimetri, lunghezza = 12 mm).
- Assemblare i garza-grip come descrittod nella Figura 1C.
- Taglio tubo 1 longitudinalmente, e aprirlo su tubo 2. Bastone insieme con la colla siliconica.
- Tagliare garza sterile chirurgica al 5 cm x 7 cm foglio, e poi rotolare ermeticamente la garza sul tubo 3 lungo il lato più lungo della garza. Inserire il tubo complesso 1-tubo 2 sopra la garza.
- Aggiungere colla siliconica attaccare insieme la garza, il complesso tubo 1-tubo 2 e il tubo 3. Tagliare la garza ad una lunghezza di 8 mm.
- Assemblaggio e sterilizzazione
- Montare il complesso mandrino-cap e la garza-grip come descritto nella Figura 2.
- Rivestire il mandrino con grasso grado medico (Figura 2A). Posizionare la garza-grip sul mandrino (Figura 2B). Distanza le impugnature al valore fisso di 35 mm l'uno dall'altro.
- Preparare uno stampo tubolare rimuovendo la parte inferiore di una siringa da 10 ml usando una sega circolare (finale Lunghezza = 8 mm) ( Figura 2B).
- Inserire lo stampo sul gruppo mandrino-cap garza impugnature attrezzato (complesso residenziale-stampo), lo snap-montaggio lo stampo sul tappo in silicone (Figura 2C).
- Autoclave il serbatoio e il complesso residenziale-muffa.
Nota: Fare attenzione a tenere il tappo in silicone saldamente quando si inserisce lo stampo per evitare il suo distacco.
- Montare il complesso mandrino-cap e la garza-grip come descritto nella Figura 2.
2. Ingegneria muscolatura liscia cellule costrutti basati su gel di collagene e Static Maturazione
- Ingegneria costrutti
- Expand suina aortica cellule muscolari lisce (pSMCs) in 175 cm 2 fiasche di coltura riempito con 20 ml di mezzo di coltura completo composto da Dulbecco Modified Eagle Medium supplementato con 10% (v / v) di siero di suini (PS), 10% (v / v ) di siero fetale bovino (FBS), 1% (v / v) di penicillina-streptomicina (pen-strep).
- A ≈90% confluenza, staccare pSMCs (passaggio 2-4) rimuovendo il terreno di coltura dellapallone di pSMCs, aggiungendo 5 ml di soluzione di tripsina (1x in soluzione salina tamponata con fosfato, PBS), e incubando per 10 min (T = 37 ° C, 5% CO 2, 100% di umidità).
- Risospendere le pSMCs ad una concentrazione di 4 x 10 6 cellule / ml in mezzo di coltura completo.
- Preparare la soluzione di collagene come descritto in precedenza 10.
- Estrarre e raccogliere fasci di collagene da tendini coda di topo in una soluzione PBS.
- Trasferire le fibre di collagene successivamente in acetone (5 min), isopropanolo al 70% (v / v) (5 min) e acido acetico (0,02 N, 48 hr, 4 ° C) soluzioni.
- Miscela la soluzione viscosa e congelare a -20 ° C per 3 giorni.
- Lyophilize la soluzione congelata per ottenere spugne di collagene.
- Solubilizzare le spugne di collagene in soluzione di acido acetico (0,02 N) ad una concentrazione di 4 g / L e centrifugare a 29.581 g vigore per 45 min.
- Sterilizzare la soluzione di collagene attraverso il processo di dialisi contro successive solutions di acido acetico (0,02 N, 1 ora), cloroformio 1% (v / v, 1 ora) e acido acetico (0,02 N, soluzione sterile cambiata ogni 2 giorni per 1 settimana).
- Raccogliere la soluzione di collagene sterile (4 g / L) in una cappa sterile coltura cellulare.
- Preparare gel di collagene cellularized come mostrato in figura 3.
- Preparare 50 ml di soluzione tampone sterile miscelando 35 ml di DMEM (5x), 4 ml di HEPES (1 N), 3 ml di NaOH (1 N) in 8 ml di acqua deionizzata sterile.
- Preparare cellule e la miscela di gel di collagene in un contenitore posto in ghiaccio mescolando 50% (v / v) di soluzione di collagene sterile (4 g / L di acido acetico 0,02 N) con il 25% (v / v) di soluzione tampone e il 25% (v / v) della sospensione di pSMCs in mezzo di coltura completo.
- Misurare il pH della miscela e accertarsi che sia compreso tra 7,0 e 7,4.
- Versate delicatamente 9 ml di miscela di cellule-e-collagene nel complesso di cui sopra abitazioni / muffa (passo 1.4.3, figura 3A-B ).
- Lasciare gel a temperatura ambiente per 1 ora sotto il cofano coltura cellulare (Figura 3B).
- Maturazione in Static bioreattore
- Rimuovere lo stampo (Figura 3C) e trasferire accuratamente il costrutto nel serbatoio, contenente 35 ml di terreno di coltura (Figura 3D).
- Incubare il costrutto (T = 37 ° C, 5% CO 2, 100% di umidità) in posizione verticale per 1 o 2 settimane di maturazione statica.
- Installare una telecamera web (sigillato per garantire l'isolamento) all'interno dell'incubatrice davanti costrutto.
- Modificare il terreno di coltura ogni 2 giorni aspirando il vecchio mezzo dalla porta luer setto e ri-riempire il serbatoio con una quantità equivalente di terreno di coltura fresco.
- Misurazione dello spessore e metabolica attività di SMC-collagene Gel a base di costrutti Durante Cultura Static
- Posizionare l'interferometro laser a scansione nella cultu cellulareri cappuccio e capovolgere dalla verticale alla posizione orizzontale con una livella.
- Trasferire il bioreattore nella cappa coltura cellulare e rimuovere il costrutto dal serbatoio.
- Trasferire il costrutto (ancora montato sul mandrino) nel percorso del raggio laser, e posizionarlo strettamente ortogonalmente rispetto all'asse del fascio (come mostrato nella Figura 4).
- Leggere il valore visualizzato sullo schermo del laser interferometro scansione, corrispondente al diametro esterno del costrutto.
- Calcolare lo spessore della parete del costrutto base al suo diametro esterno ed interno (cioè il diametro del mandrino).
Nota: ripetere i passi 2.3.1 a 2.3.5 ogni ora per la prima 12 ore e poi ogni 24 ore. - Usare 1 ml del vecchio terreno di coltura (campionata quando si cambia il terreno di coltura, passo 2.2.4) per misurare le concentrazioni di lattato e glucosio con l'analizzatore di gas nel sangue.
- Usare 1 ml diterreno di coltura fresco come un livello base per le misure delle concentrazioni di glucosio e lattato 14.
Nota: ripetere i passi 2.3.6 e 2.3.7 ogni 2 giorni dopo terreno di coltura che cambia.
- Costruire raccolta per ulteriori Ccharacterizations meccanica e biologica
- Dopo 1 o 2 settimane di stagionatura statica, trasferire il bioreattore statica nel cofano coltura cellulare.
- Trasferire delicatamente il costrutto maturo dal suo mandrino (supplementare Video 1) ad una piastra di Petri da 100 mm contenenti 40 ml di terreno di coltura fresco (Figura 5 e Figura 7A).
3. Caratterizzazione meccanica dei costrutti del longitudinali e circolari arrivarci
- Installare il set-up sperimentale costituito dal tester micromeccanica dotato di una cella di 5 o 10 N carico ed un bagno contenente PBS a 37 ° C per mantenere i campioni at condizioni pseudo-fisiologico (Figura 6).
- Bilanciare la cella di carico e dell'estensimetro.
Nota: Balancing è una funzione integrata nel tester micromeccanica consiste nel ripristinare il valore di estensione visualizzato e il valore di carico visualizzato mentre nessun campione è montato sulla macchina. Questa funzione permette di definire il riferimento per entrambe le misure. - Montaggio dei costrutti tubolari sul dispositivo meccanico: direzione longitudinale.
Nota: eseguire prove di fatica longitudinali direttamente sull'intero costrutti tubolari. Uso interno incorporato dispositivi di presa per collegare le prese garza dei costrutti alla cella di carico e alla base della vasca PBS.- Montare il tubolare costruire sui dispositivi di presa (Figura 7B), seguendo la procedura di raccolta (punto 2.4).
- Avvolgere i dispositivi di presa e le impugnature garza insieme con nastro di teflon per evitare lo slittamento delle impugnature garza durante la prova.Montare il campione attraverso il tester micromeccanica (Figura 7C).
- Montaggio dei costrutti ad anello sul dispositivo meccanico: direzione circonferenziale.
Nota: eseguire prove di fatica circonferenziali su provini a forma di anello sezionati dai costrutti tubolari. Utilizzare due barre di acciaio inossidabile come grip per fissare i campioni.- Montare il tubolare costruire su un tubo di plastica come supporto contrassegnato con 5 lacune mm (Figura 7B), a seguito della raccolta (punto 2.4).
- Tagliare 10 millimetri anelli dal costrutto tubolare.
- Misurare la lunghezza del campione utilizzando un calibro a corsoio per le ulteriori analisi.
- Montare il campione a forma di anello sulle barre di acciaio inossidabile del tester micromeccanica (Figura 7C). Assicurarsi di posizionare il campione al centro delle barre.
Nota: Il tubo di plastica nel passo 3.4.1 e un sistema di taglio, come mostrato nella Figura 7B vengono utilizzati per evitare danni al costrutto durante il taglio.
- Prova di fatica sul costrutti in senso longitudinale o circonferenziale.
- Allungare il costrutto alla sua lunghezza calibro iniziale.
- Mantenere il costrutto in questa posizione per 10 min in un ambiente pseudo-fisiologico.
- Applicare il 10% di deformazione ciclica della lunghezza del calibro iniziale (30 cicli) per la costruzione di 5% / sec velocità di deformazione.
- Ripetere il punto 3.5.3 a passi incrementali di 10% di deformazione ciclica fino alla rottura del campione.
Nota: L'uso dell'ambiente pseudo-fisiologico richiede tenendo conto della galleggiabilità e l'inerzia del sistema di presa che influenzano la misura del carico applicato. - Registrare il fondo come segue:
- Spostare il telaio di carico per il tratto utile iniziale.
- Ripetere la procedura 3.5.3 e 3.5.4 senza montato qualsiasi campione, e mantenendo i dispositivi di presa collegati alla cella di carico (solo 1 ciclo è requirosso).
4. Luminal endotelizzazione di costrutti
Nota: Dopo aver seguito il protocollo di raccolta (punto 2.4), i costrutti resistono gestione per essere montato nel bioreattore rotante a parete per l'ulteriore endotelizzazione.
- Rotazione a parete Bioreattore design
- Praticare un foro di diametro di 4,5 mm a centro del tappo ventilato del tubo serbatoio senza danneggiare la membrana del filtro che copre i fori di aerazione.
- Press-montare un mandrino (diametro = 4.5 mm, lunghezza = 40 mm) nel foro e fissare il mandrino come descritto al punto 1.1.2.
- Preparare due supporto in silicone a forma di C per il diametro esterno costrutto = 14 millimetri; diametro interno = 8 mm).
- Posizionare un motore in rotazione in una estremità del bioreattore rotante parete e un cuscinetto sull'altra estremità (Figura 8B).
- Lumen endotelizzazione
- Espandere umbilic umanoal vena cellule endoteliali (HUVEC) in 25 cm 2 fiasche di coltura con 5 ml di mezzo di coltura M199 supplementato con 10% (v / v) PS, 10% (v / v) FBS, 1% (v / v) pen-strep in piastra di Petri all'interno di un incubatore (T = 37 ° C, 5% CO 2, 100% di umidità) fino al 90% di confluenza.
- Preparare 1,5 ml della soluzione di rivestimento proteine al costrutto richiesto per l'adesione cellulare ottimale diluendo la miscela di concentrato di proteine a 10,5 ng / ml in endoteliale mezzo privo di siero coltura cellulare.
- Misurare la lunghezza del costrutto utilizzando un calibro a corsoio.
- Calcolare il volume luminale V e l'area luminale A del costrutto come: V = D in 2 L / 4 e A = D a L, rispettivamente (dove D è il diametro interno corrispondente al diametro del mandrino, e L è la lunghezza del costrutto).
- Posizionare il costrutto al centro del serbatoio seguendo la procedura di raccolta (sezione 2.4).Utilizzare il supporto in silicone a forma di C per fissare il costrutto a entrambe le estremità per il serbatoio (Figura 8A).
- Riempire il serbatoio con 35 ml di terreno di coltura.
- Riempire il 75% del volume calcolato luminale del costrutto (V) con la soluzione di rivestimento proteico preparato al punto 4.2.2. Chiudere entrambe le estremità del costrutto di evitare qualsiasi fuoriuscita della soluzione di rivestimento proteico (Figura 8A).
- Montare il sistema di bioreattore rotante a parete all'interno della cappa di coltura cellulare.
- Posizionare il bioreattore a 37 ° C incubatore e avviare la rotazione del bioreattore a 4,02 x 10 -5 g forza per 1 ora per permettere il rivestimento luminale come mostrato in Figura 8B.
- Aprire l'estremità superiore del costrutto e aspirare la soluzione di rivestimento di proteine dal lume.
- Staccare HUVEC (passaggio 2-3) rimuovendo il terreno di coltura dal pallone di HUVEC e aggiungendo 3 ml della soluzione di tripsina (1x in PBS). IOncubate per 5 min (T = 37 ° C, 5% CO 2, 100% di umidità).
- Risospendere le HUVEC ad una concentrazione di 4 x 10 6 cellule / ml in mezzo di coltura M199 integrato.
- All'interno del cofano coltura cellulare, sementi HUVEC nel lume del costrutto con una densità di 1.000 cellule / cm 2 15. Chiudere le estremità superiori del costrutto di evitare qualsiasi dispersione di soluzione HUVEC.
- Incubare i costrutti (T = 37 ° C, 5% CO 2, 100% di umidità) ospitato nel bioreattore rotante parete (Figura 8B) e cultura per 2 giorni ad una rotazione costante di 4,02 x 10 -5 g forza.
- Raccolto il costrutto dopo 2 giorni di coltura in condizioni sterili e prepararlo per l'ulteriore caratterizzazione biologica come descritto nella sezione 2.4.
Risultati
Questo lavoro descrive la fabbricazione di costrutti a base di collagene tubolari ingegnerizzati contenenti cellule vascolari. Già dopo 1 ora di inizio di gelificazione, miscela cellule e collagene era direttamente assemblato in una geometria tubolare 3D, con il diametro esterno uguale al diametro dello stampo corrispondente (circa 14 mm). Lungo la maturazione statico, misurazioni hanno evidenziato la rapida riduzione del diametro esterno delle strutture cellularized tubolari, come mostrato in Tabella 1. Il diametro dei gel di collagene cellularized rimpiccioliti di circa il 60% del suo valore iniziale dopo 1 giorno di coltura statica, e di quasi il 85% entro 7 giorni (Supplemental Video 2). SMC all'interno dei costrutti sono responsabili della contrazione osservata e il rinforzo meccanico correlati, in quanto questo fenomeno non si verifica in scaffold di collagene non cellularized. Da notare che è stata applicata nessuna sfumatura di qualsiasi tipo (termici, biochimici, meccanici, o altro). Le cellule-driven compattazione portato in un materiale con una maggiore densità di collagene che può essere maneggiato e sottomesso alle sollecitazioni meccaniche (Video aggiuntive 3 e 4).
Per correlare il rimodellamento cellule-driven alle proprietà meccaniche e viscoelastiche generali, prove di fatica sono state eseguite su costrutti (video integrativi 5 e 6). Questi test consisteva nel ciclismo costrutti (30 volte) a diversi ceppi costanti (10%, 20% e 30% della lunghezza del calibro iniziale) e registrare lo stress come la risposta dei costrutti della sollecitazione meccanica nel tempo. I risultati rappresentativi per un costrutto sono mostrati in figura 9. Il costrutto resistito maggiori sollecitazioni nella direzione longitudinale (75 kPa) rispetto alla direzione circonferenziale (16 kPa) quando sono sottoposti alla stessa gamma ceppo (30% di deformazione). Nel frattempo, ad ogni ciclo, il valore di picco di stress raggiunto per la tadeformazione massima rgeted diminuito nel corso del tempo. Questo comportamento è tipico delle alte proprietà viscoelastiche presentati da questi costrutti base di collagene.
L'attività biologica dei costrutti cellularized stata valutata durante la maturazione statica. Quindi, l'attività metabolica delle SMC è stata valutata misurando il consumo di glucosio e la produzione di lattato durante la coltura statica. Il terreno di coltura è stata campionata ogni 2 giorni e glucosio e concentrazioni di lattato sono state misurate usando un analizzatore di gas ematici. La costante incremento del consumo di glucosio e la produzione di lattato combinati per l'importante contrazione dei costrutti, attestano l'attività SMCs lungo coltura statica (Figura 10).
La maggiore stabilità meccanica dovuta al rimodellamento cell-driven consentito la manipolazione dei costrutti e il successivo processo di endotelizzazione. Colorazione tricromica di Masson eseguita sui costrutti endotelizzazionemostrato un endotelio altamente omogenea. SMCs esibito una morfologia fusiforme-like e sembrava omogeneamente disperso attraverso la parete, mentre HUVEC apparso ben distribuito nel lato luminale (Figura 11).
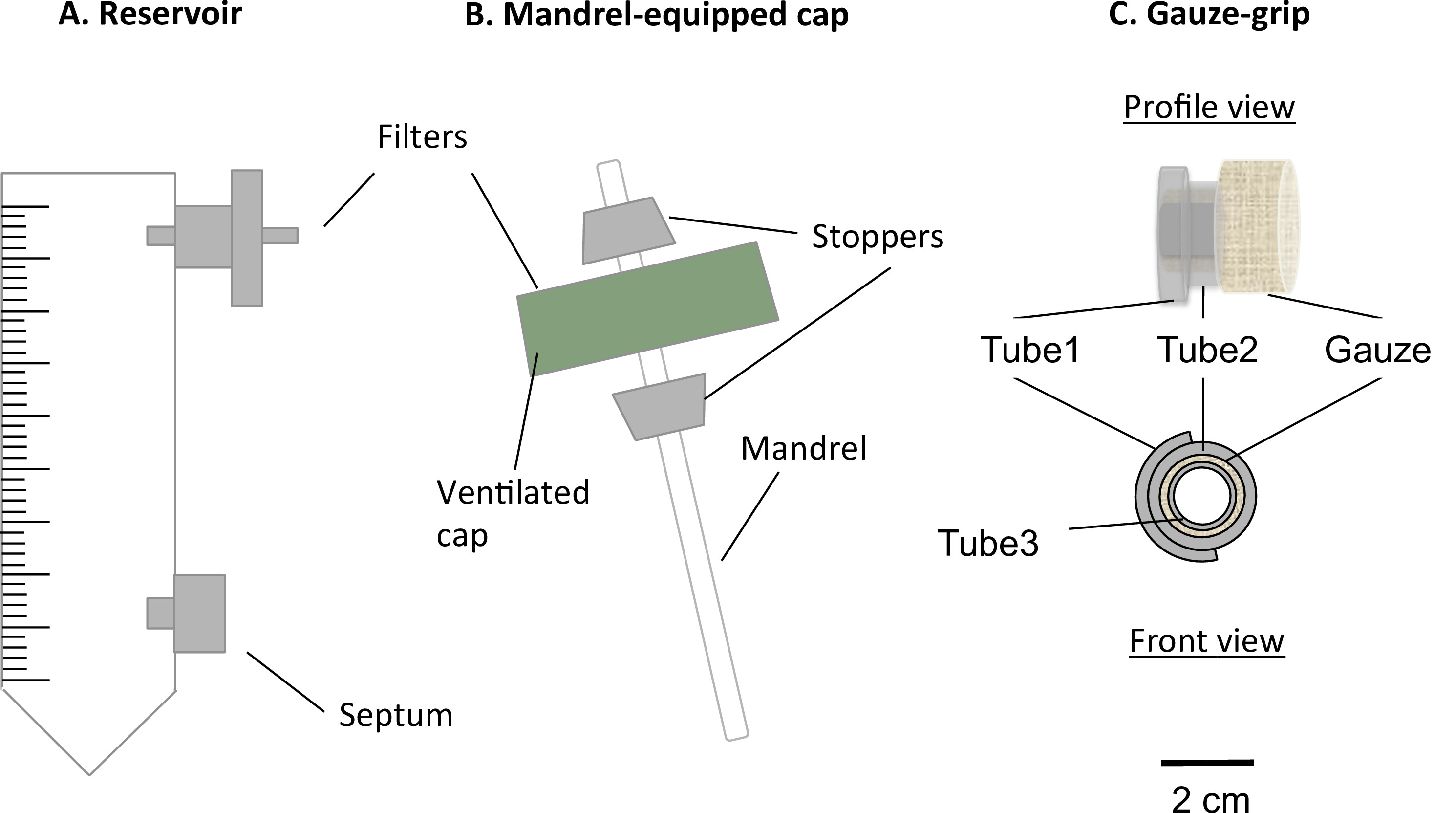
Figura 1:. Componenti del bioreattore statico Il bioreattore statica consisteva in un tubo da 50 ml modificata centrifuga (A) e un tappo mandrino attrezzato (B). Il tubo servito come mezzo serbatoio, ed era dotato di una porta per un filtro di 0,22 micron, per lo scambio di gas, e un setto, per il campionamento medio e cambiando. Un mandrino presente nel tappo ventilato permesso la realizzazione di costrutti in forma tubolare. La garza-impugnature (C) sono stati progettati e costruiti per supportare la gelificazione dei costrutti sul mandrino. Inoltre, questiimpugnature permesso ai costrutti da trattare dopo la maturazione statica e da fissare al apparato meccanico. Il diametro esterno del mandrino di 4,7 mm.
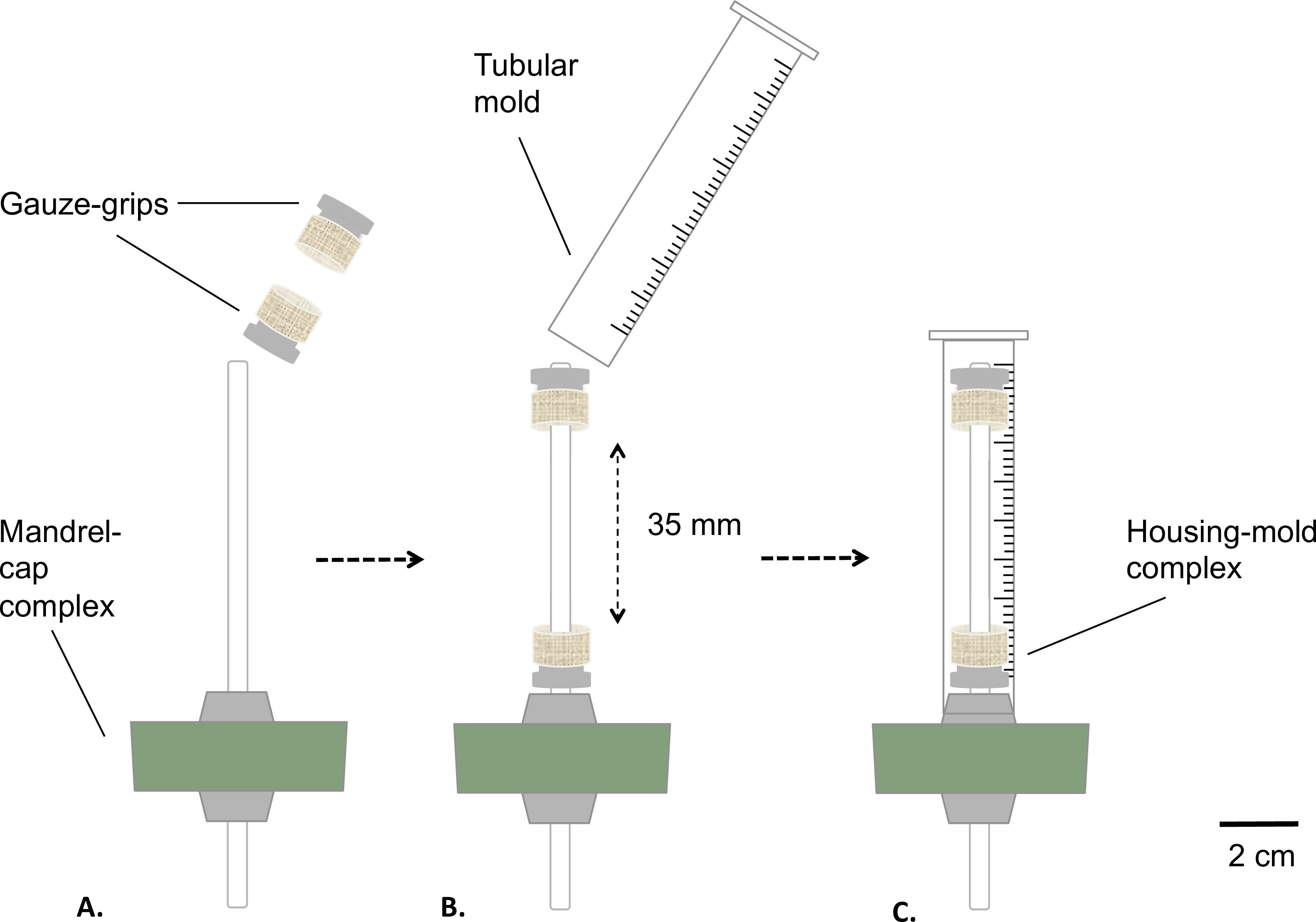
Figura 2: Assemblaggio del bioreattore statica fasi del bioreattore Assemblaggio prima della sterilizzazione.. La garza-impugnature sono stati montati sul mandrino (A) ad una distanza fissa. Uno stampo è stato inserito (B) e saldamente fissato al tappo in silicone (C). Il diametro esterno del mandrino di 4,7 mm.
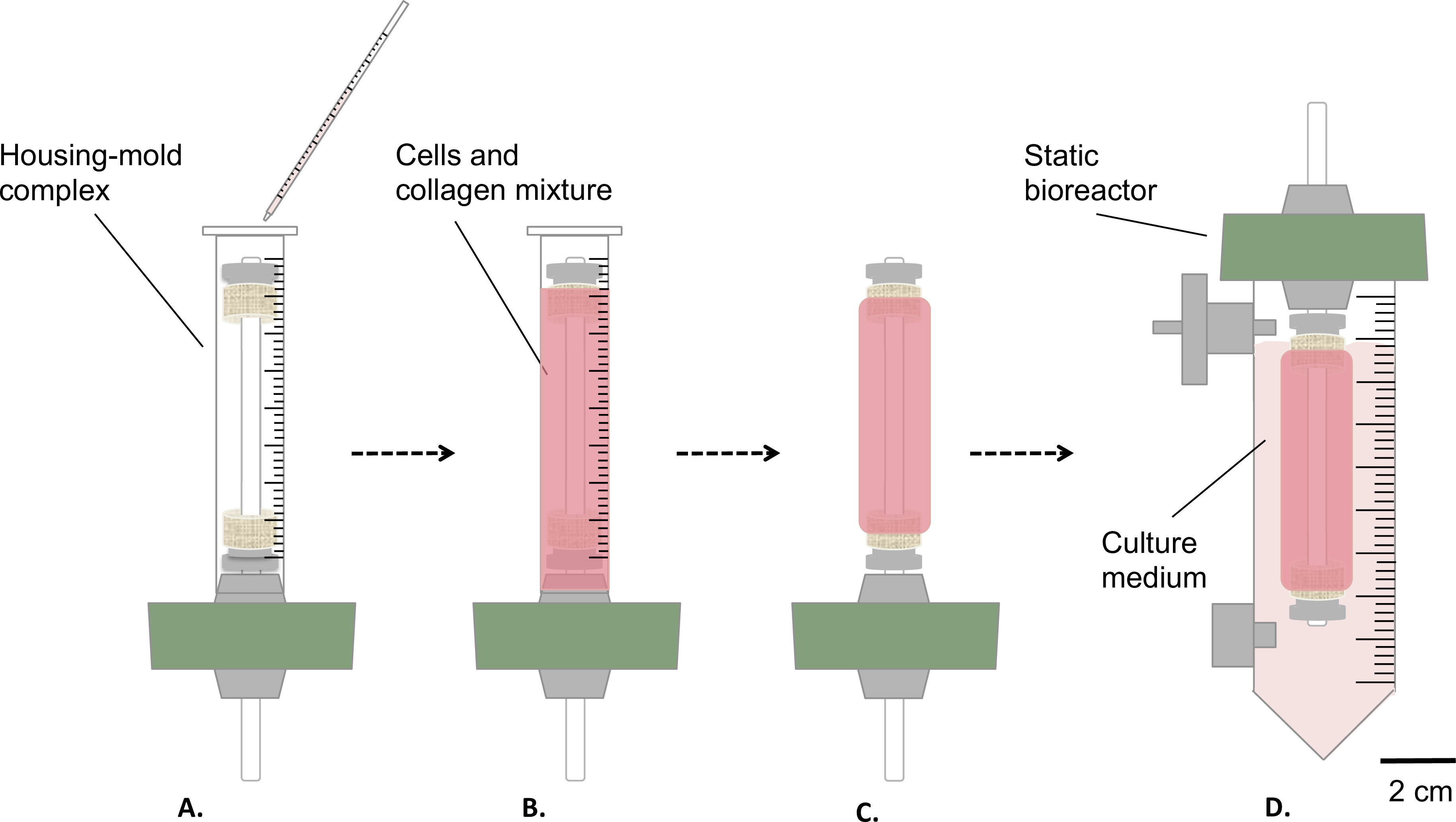
Figura 3:. Fabrication dei costrutti in condizioni sterili La miscela cellule e collagene è stato versato nel complesso di alloggiamento stampo (A), e lasciare il gel per 1 ora a temperatura ambiente (B). Successivamente, lo stampo è stato rimosso (C), il bioreattore statico è stato assemblato (D) e trasferito in un serbatoio per la maturazione statica del costrutto in incubatrice (T = 37 ° C, 5% CO 2, 100% di umidità). Il diametro esterno del mandrino di 4,7 mm.

Figura 4:. Misurazione dello spessore / diametro esterno dei costrutti Un interferometro a scansione laser è stato utilizzato per eseguire la misura dei diametri esterni dei costrutti. Il costrutto è stato inserito nel percorso del raggio laser e genera un'ombra. La larghezza dell'ombra, corrispondente al diametro esterno del costrutto, è stata poi misurata e visualizzata sullo schermo.

Figura 5:. Aspetto morfologico del costrutto raccolta (A) Subito dopo gelificazione e (B) dopo che le cellule-driven rimodellamento durante la maturazione statica per 2 settimane.

Figura 6: Experimental set-up per caratterizzazioni meccaniche Consisteva tester micromeccanica dotato di una cella di 5 o 10 N carico ed un bagno contenente PBS a 37 ° C per mantenere i campioni in condizioni pseudo-fisiologico..
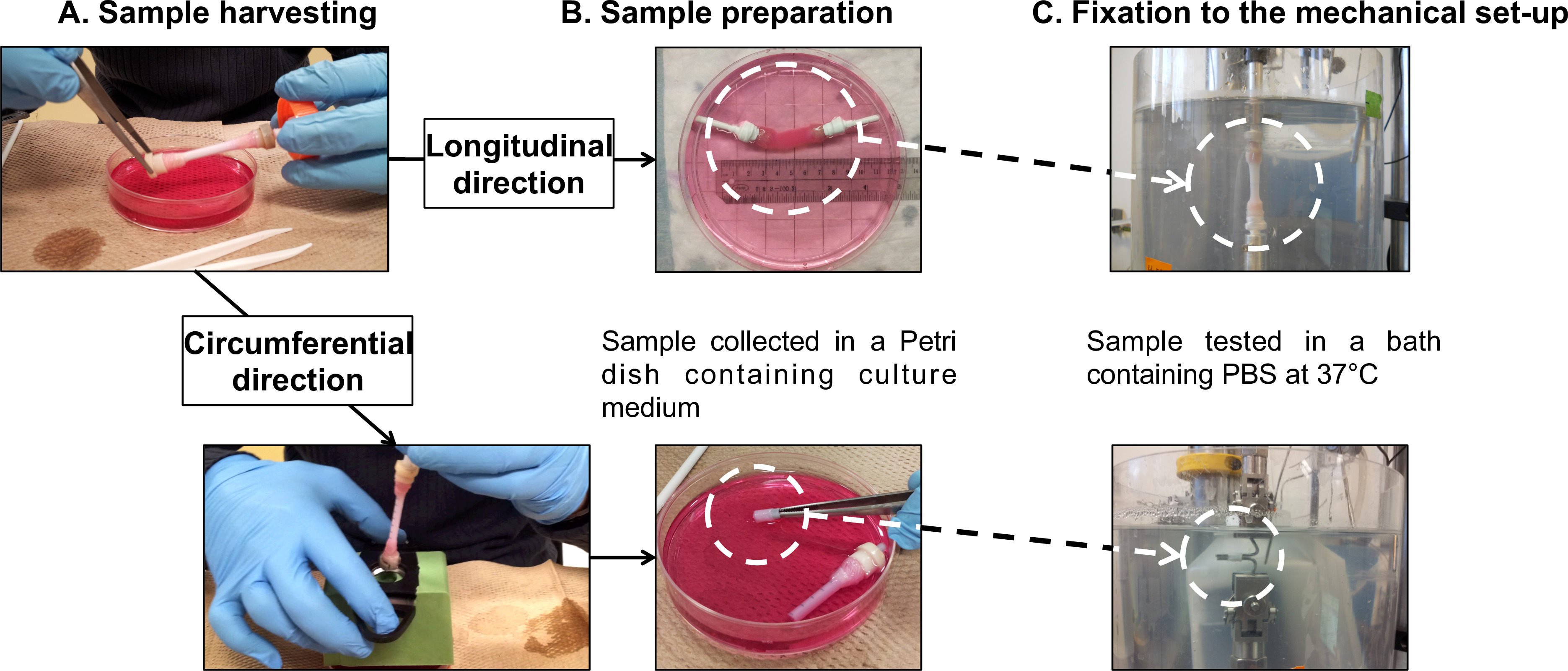
Figura 7: Preparazione del campione f o caratterizzazioni meccaniche. raccolta del campione (A) e preparazione (B) per prove di fatica eseguite in senso longitudinale e le direzioni circonferenziali (C). Il diametro esterno del mandrino di 4,7 mm.
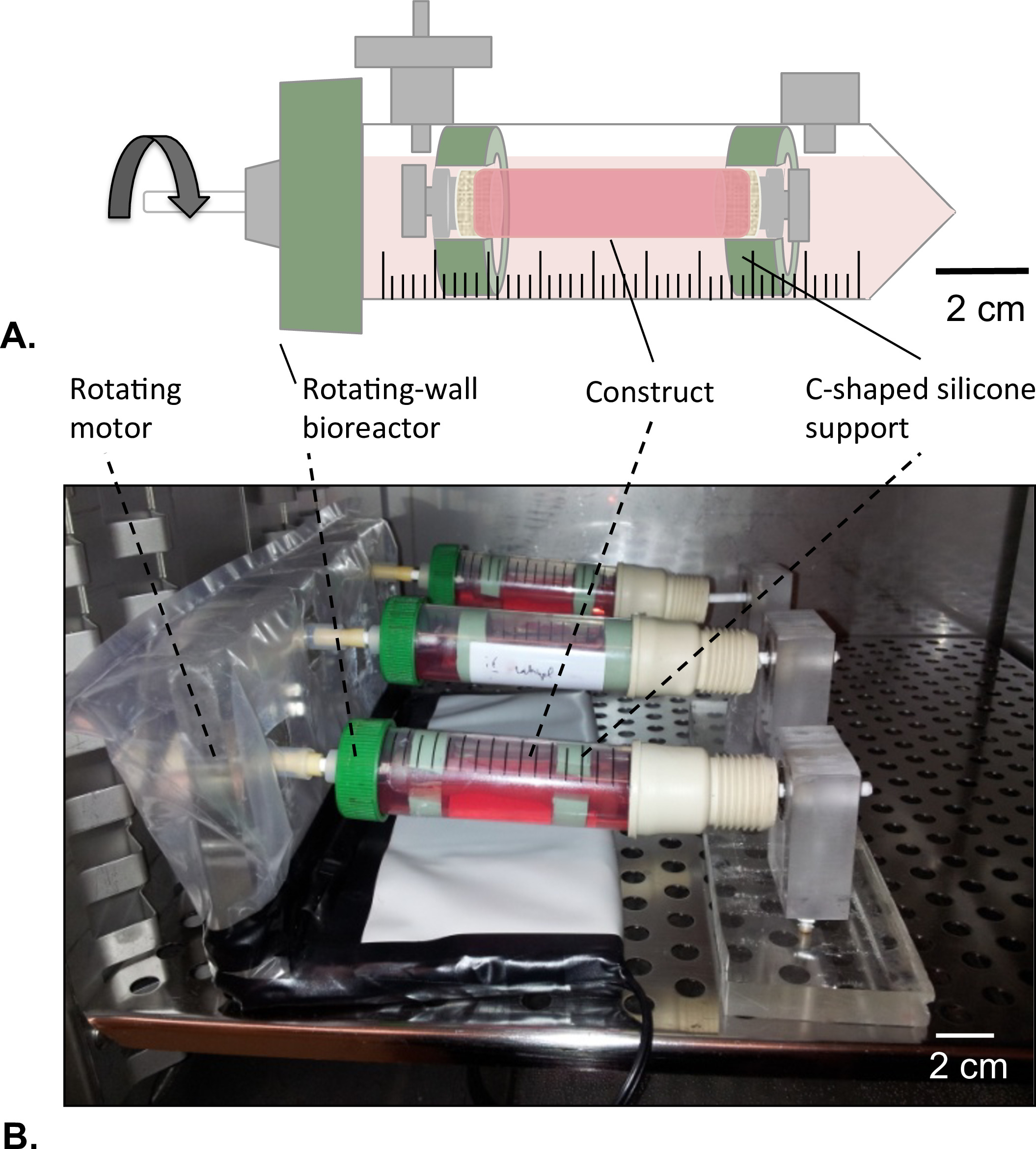
Figura 8: Rotazione parete bioreattore (A) I costrutti tubolari sono montati al centro del serbatoio con l'aiuto di supporto in silicone a forma di c.. Entrambe le estremità del costrutto sono stati chiusi per evitare qualsiasi dispersione di soluzione HUVEC. (B) I costrutti sono stati coltivati in incubatrice (T = 37 ° C, 5% CO 2, 100% di umidità) in rotazione a 4,02 x 10 -5 g forza per 2 giorni.
2 / 52812fig9highres.jpg "width =" 700 "/>
Figura 9:.. Caratterizzazioni meccaniche Risultati delle prove di fatica effettuati su costrutti a longitudinale (A) e (B) circonferenziali direzioni dopo rimodellamento delle cellule-driven Cliccate qui per vedere una versione più grande di questa figura.
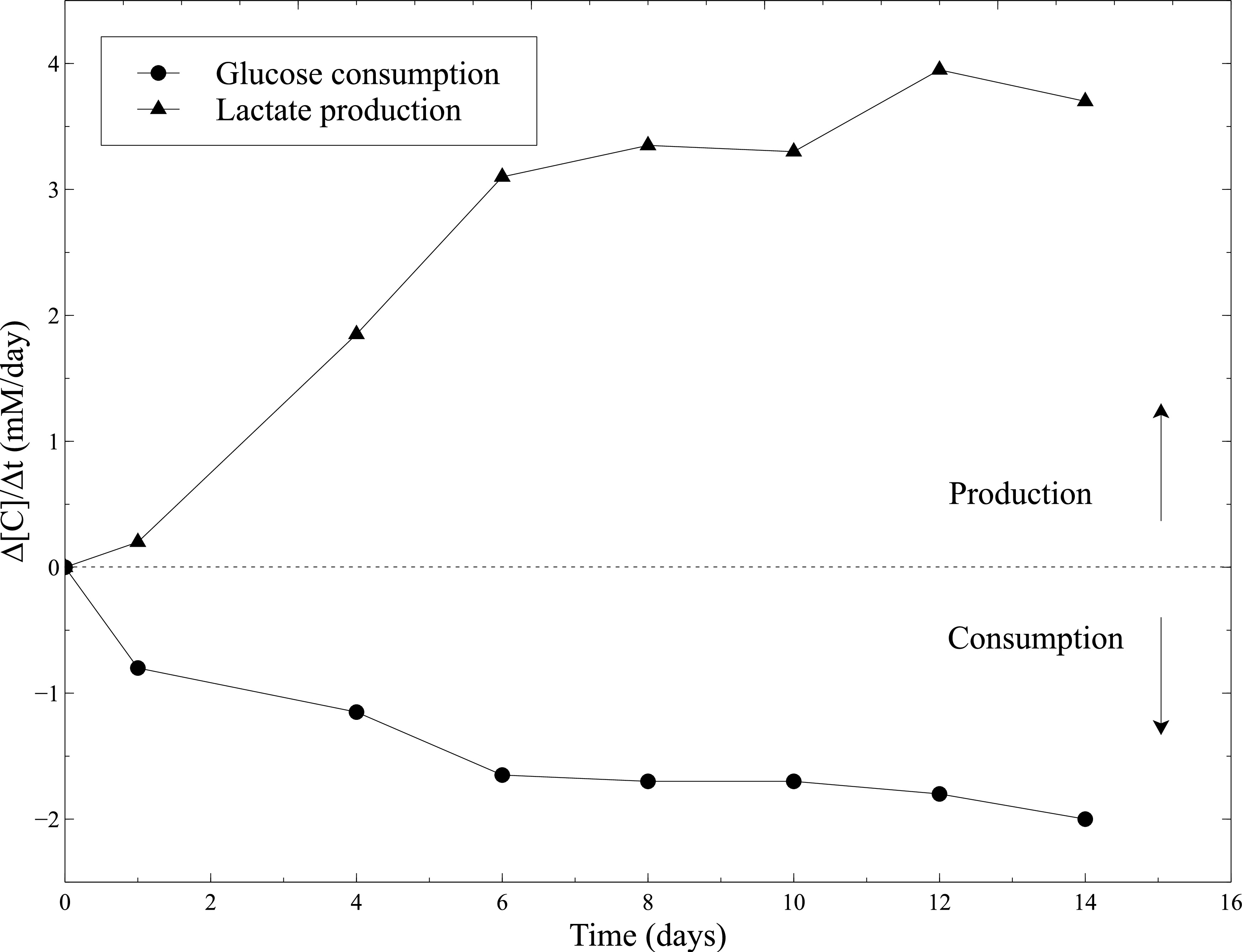
Figura 10:. Attività metabolica SMCs nei gel di collagene misurazioni del tasso di consumo di glucosio e tasso di produzione di lattato sono stati eseguiti con l'analizzatore di gas del sangue ogni 2 giorni, dopo il mezzo di coltura cambio. Mezzo di coltura fresco è stato usato come un livello base per le misurazioni del glucosio e concentrazioni di lattato.
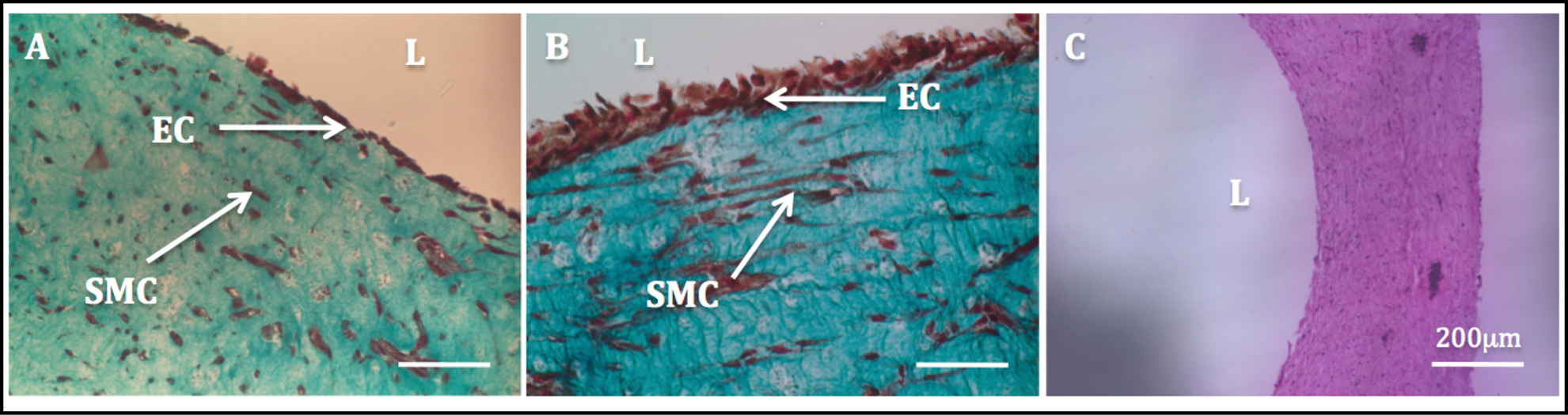
Figura 11: Lumen endothelialization immagini istologiche dei radiali sezioni di costrutti tubolari.. Di Masson Tricoma colorazione dei costrutti tubolari coltivate staticamente per 1 settimana (A) e 2 settimane (B). H & E colorazione di un costrutto tubolare (C).
| Tempo | Spessore (mm) | Compattazione (%) |
| 0 h | 4.83 ± 0.02 | 0 ± 0 |
| 2 ore | 4.26 ± 0.02 | 12 ± 0 |
| 4 ore | 4.21 ± 0.03 | 13 ± 1 |
| 6 ore | 4.06 ± 0.10 | 16 ± 2 |
| 12 hr | 3.16 ± 0.07 | 35 ± 1 |
| 1 giorno | 2.08 ± 0.11 | 57 ± 2 |
| 1 settimana | 0.68 ± 0.07 | 86 ± 1 |
| 2 settimane | 0.36 ± 0.00 | 93 ± 0 |
Tabella 1: Rapid compattazione del diametro costrutto durante la maturazione statica spessore della parete dei costrutti e il tasso di compattazione in funzione del tempo di coltura statica.. Compattazione è stata misurata determinando il diametro esterno dei costrutti tubolari con un interferometro laser a scansione (Serie 183B, LaserMike 136). Dopo 24 ore, i costrutti compattati al 57% ± 2% delle loro dimensioni stampati. I dati sono espressi come media ± deviazione standard (n = 3). La presenza e l'attività delle cellule viventi muscolari lisce era l'unico responsabile di tale rilievo.
Supplemental Video 1:. La raccolta dei gel non ristrutturato tubolare collagene Clicca qui per vedere il video.
Supplemento Video 2:. Le cellule-driven compattazione di gel tubolari collagene Clicca qui per vedere il video.
Supplemento Video 3:. La manipolazione dei gel non ristrutturato tubolare collagene Clicca qui per vedere il video.
Supplemento Video 4:. Manipolazione delle cellule rinnovate gel tubolare di collagene Cliccate qui per vedere thè il video.
Supplemento Video 5:. Prova di fatica longitudinale (al 30%) su cellule ristrutturato gel tubolare di collagene Cliccate qui per vedere il video.
Supplemento Video. 6: prova di fatica circonferenziale (al 30%) su cellule ristrutturato gel tubolare di collagene Cliccate qui per vedere il video.
Discussione
Tra la comunità di ingegneri dei tessuti vascolari, enormi sforzi sono stati fatti per riprodurre lo strato tunica media responsabili per la stabilità meccanica dei vasi sanguigni 16. Dal momento che il lavoro pionieristico di Weinberg e Bell 17, il collagene è stato ampiamente utilizzato come impalcatura per l'ingegneria tissutale vascolare a causa della sua biocompatibilità, le proprietà non immunogeniche e disponibilità. Tuttavia, l'uso di collagene rappresenta una sfida per i ricercatori, in quanto questo materiale non è facile da maneggiare, a causa della intrinseca mancanza di rigidità meccanica. Manipolazioni durante la preparazione patibolo possono danneggiare i ponteggi, li compromettendo per un ulteriore uso.
La tecnica descritta in questo lavoro permette di: i) ingegnere gel di collagene cellularized in una geometria a forma tubolare; ii) per ingegnerizzare tessuti biologici abbastanza forte per essere gestita dopo un breve periodo di maturazione statica (1 o 2 settimane); iii) comesess proprietà meccaniche e viscoelastiche tali tessuti biologici a forma tubolare in 2 direzioni. Le cellule in gel svolgono un ruolo chiave nel rimodellamento della matrice di collagene. Durante il periodo di maturazione, SMCs contrattili portato alla compattazione dei gel che producono un costrutto con maggiore stabilità meccanica valutabili nelle direzioni longitudinali e circolari. In seguito, HUVECs testa di serie nel lato luminale dei costrutti generato un endotelio omogeneo e vitale, dimostrando così l'idoneità dei gel di collagene per le applicazioni di ingegneria dei tessuti vascolari.
Il bioreattore presentata in questo lavoro è stato progettato specificamente per fornire un ambiente ottimale per la crescita cellulare durante la maturazione statica. Inoltre, i dispositivi sviluppati per la caratterizzazione delle proprietà meccaniche e viscoelastiche dei costrutti sono stati progettati con lo scopo di ridurre i danni potenziali inerenti alla manipolazione ditali materiali delicati. Quindi, il bioreattore statica era dotato di un filtro di 0,22 micron e una membrana filtrante sul tappo (passaggio 1.1.2, figura 1A e B) che ha permesso lo scambio di gas tra terreno di coltura all'interno del serbatoio e l'incubatore, mantenendo un ambiente coltura sterile. Il setto luer sul fondo è stato utilizzato come porta per mezzo di coltura campionamento e cambiando durante la coltura statica. Alcuni passaggi critici devono essere considerati durante costrutto fabbricazione e caratterizzazioni. Tutte le manipolazioni (effettuate nella fase 2.1.1 e nelle fasi successive) che potrebbero alterare la sterilità del sistema sono state eseguite in una cappa biologica sterile. Cellule e gel di collagene preparazione della miscela è stata gestita in ghiaccio, al fine di ritardare il processo di gelificazione (passi 2.1.4 a 2.1.7). Al passo 2.1.7, eventuali bolle d'aria intrappolate nella miscela prima della gelificazione sono potenziali zone di concentrazione delle tensioni che possono compromettere le sredditività dei costrutti. Pertanto, la rimozione di tali bolle d'aria richiede un po 'tremante il montaggio o usando il vuoto medico per 3 minuti per degasaggio in condizioni sterili. Infine, le impugnature sono stati specificamente progettati per mantenere l'asse del mandrino centrale nello stampo tubolare durante gelificazione e per consentire delicata manipolazione dei costrutti durante la raccolta (rimozione del mandrino, sezione 2.4), per endotelizzazione, e per facilitare il montaggio su il sistema meccanico (test longitudinali).
Il presente protocollo propone un approccio originale di facile procedimento alternativo di rinforzo di gel di collagene costrutti basato sul naturale potenziale contrattile intrinseca SMCs. Tecniche comuni di matrici di collagene rinforzo implicano l'uso di agenti fisici e chimici reticolanti che possono avere effetti deleteri sulle interazioni cellule-matrice 18 - 20. La tecnica di fabbricazione presentato inquesto lavoro permette di dirigere questo processo di rimodellamento cellule-driven per dare un costrutto tissutale con mirati proprietà meccaniche senza alcun trattamento fisico o chimico.
Caratterizzazione delle proprietà meccaniche e viscoelastiche del gel di collagene idratati è una grande sfida. In questa prospettiva, il presente protocollo descrive un metodo originale semplice ed efficiente per valutare le proprietà meccaniche dei tessuti molli tubolari. Questa caratterizzazione può essere eseguita non solo in direzione circonferenziale, ma anche in senso longitudinale, direttamente su tutta la struttura tubolare. Durante caratterizzazione meccanica, temperatura, ambiente acquoso, pH e forza ionica sono alcuni dei fattori ambientali che sono noti per influenzare drasticamente il comportamento meccanico di tessuti biologici 21. Pertanto, il presente lavoro suggerisce un set-up e protocollo originale per la caratterizzazione meccanica dei tessuti biologici in un altamenteriproducibile pseudo-fisiologica ambiente (soluzione salina a 37 ° C e pH 7,4). Per quanto a nostra conoscenza, questo tipo di caratterizzazione non è mai stata riportata altrove.
In conclusione, la tecnica proposta in questo lavoro dimostra l'elevato potenziale di miscelazione diretta di cellule con collagene per applicazioni di ingegneria tissutale vascolari. Questo metodo insieme al processo di caratterizzazione e endothelialization meccanica costituiscono alti protocolli polivalenti. Quindi, attraverso piccole modificazioni del set-up e protocolli mantenendo la stessa logica, requisiti principali per l'ingegneria dei tessuti vascolari equivalenti possono essere affrontati quali trattamento rapido e semplice, compresi endotelizzazione, e la possibilità di essere trasposta ad una vasta gamma di molle tessuti con diverse lunghezze e diametri. Inoltre, diversi tipi di cellule aderenti, proteine ECM e geometrie stampati possono essere indagati per una serie di appli mirations, come i tendini ingegneria, innesti cutanei, patch cardiaci, nervi, tra gli altri. Sebbene le proprietà meccaniche dei costrutti sono incoraggianti, sono ancora inferiori a quelli dei tessuti nativi. In questo contesto, crediamo fortemente che un brevissimo periodo di maturazione statico è un passo cruciale verso la stimolazione dinamica in un bioreattore, determinando in tal modo una maggiore integrità strutturale e la stabilità meccanica. Tuttavia, la possibilità di produrre rapidamente cellularized costrutti a base di collagene tissutale adatto per meccanica ed istologica analisi rende il bioreattore statica qui descritto uno strumento utile e promettente per fornire una conoscenza l'interazione tra cellule e ECM durante la crescita e il rimodellamento, o anche per essere utilizzato come modello per terapie e sistemi di drug delivery.
Divulgazioni
Nessun finanziamento è stato ricevuto da organizzazioni o agenzie con potenziale conflitto di interessi.
Riconoscimenti
Questa ricerca è stata finanziata dalla Scienze Naturali e ingegneria Research Council del Canada, Canadian Institute for Health Research e il Québec Research Center CHU de.
Materiali
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
Riferimenti
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon