Method Article
植物実験室で測定した表面への細菌の付着
要約
測定し、特に根や芽、植物に細菌の付着を特徴付けるのための簡単な方法は、この資料に記載されています。
要約
本稿では、光学顕微鏡では生菌を使用して無菌植物の表面に細菌の結合を測定する方法について説明します。使用される植物材料ではカット フルーツなど、根、芽、葉。説明する方法は安価な簡単に、そして小さなサンプル サイズに適しています。バインディングは実験室で測定、様々 なインキュベーション メディアや条件を使用できます。阻害薬の効果を判断できます。促進・抑制結合の状況も評価することができます。いくつかのケースで様々 な条件は植物や細菌に対する彼らの効果のために主にバインディングを変更するかどうかを区別することが可能です。
概要
植物表面に細菌の結合の測定は、3 つの異なる状況で重要になりました。最初の状況は、植物表面1,2,3の人間の病原体の感染の検査です。削除または、バインドされた細菌を殺す細菌を防ぐためには、ここでの目標とこの植物材料によって病気の伝達を減らすため。2 番目の状況は、植物の表面4の植物病原体結合の検討です。もう一度ここでの目標はようにバインディングを削除またはバインドされた細菌を殺すとこの病気を減らすために。3 番目の状況は、共生または植物成長促進菌5,6の結合の検討です。ここでの目標はバインドとこうして増加植物の健康および作物に細菌を促進するために得られます。
この資料に記載されている表面を植物に細菌のバインディングの測定方法は、安価、比較的実施しやすい。唯一の要件は、顕微鏡と細菌学の研究室で一般に見つけられる材料に。いくつかのテクニックお風呂超音波発生装置が便利です。説明する手法は、実験の結果, 比較的小さなサンプル サイズを使用してバインドするため設計されています。結合量の測定は、温室やフィールドでの使用のためのこれらのテクニックの一部を変更することがありますが、研究室で作られています。
これらのテクニックは、根、もやし、カット葉細菌バインディング、カット フルーツ、および研究室7,8,9,10、11でそのままチェリー トマトを測定に使用されています。 12,13,14,15。彼らは土壌で育つ植物の根を植民地化を測定または研究室16で砂にも使用されています。テクニックなどアグロバクテリウム、ダイズ法、大腸菌、サルモネラ、 緑膿菌の fluorescens細菌の多くの種に使用されています。(2012 年)17モートンとフュークワA. 根頭がんしゅ病菌の表面との相互作用を評価する方法の有用な説明を見つけることが。すべてのケースで関係のサンプル サイズが小さく、一般的に未満 25 50 植物。説明する手法は、実験中に含まれている保持する必要がある人間の病原体で使用に適しています。
プロトコル
1. 無菌植物材料の準備
- 水で育成した苗を準備します。
- 種子 (30 未満) の数が少ないが、30、50、100、または 150 mL ガラス製ビーカー、します。このプロトコルでは、トマト、アルファルファ、シロイヌナズナ、エンドウ豆、豆、タバコ、レタス、ニンジン種子を利用させていただきました。
注: どのように多くの種は、1 つの種から別に広がる汚染せず一緒に滅菌することが決定、1.1.2 の手順を参照してください。 - 80% エタノールで種子をカバーし、簡単に旋回します。1 分の浸漬種子ができます。
- エタノールを注ぐし、ボリューム商業漂白剤 (NaClO) 50%、0.1% 溶液で種子をカバー トリトン X-100 の水道水。20 分間浸漬種子ができます。
注: 場合は種子が大きく、種子など、必要があります完全に種の表面の菌を殺すために浸漬時間を長くします。 - 滅菌水で 3 回種子を洗浄し、漂白剤の混合物を注ぐ。1 分各洗浄のための水に浸漬種子ができます。
- 取得には、無菌苗は、少量の種子のサイズによって 5 つそして 25 の mL の滅菌水を追加します。種子の発芽用滅菌シャーレに種と水を注ぐ。
注: 水は皿の底をカバーがカバー種子根における根毛の形成を促進する必要があります。単一の生物種が存在するだけの文化を無菌に記述します。 - 苗間 1 cm と 10 cm (トマトとシロイヌナズナのため約 5 日間とアルファルファの 1 ~ 3 日) 目的のサイズに達するまでは、暗闇の中で孵化させなさい。種子の大きな箔で覆われてガラス皿など 100 mL 以上の容量を持つ屋根付き滅菌した容器を使用します。
- 種子 (30 未満) の数が少ないが、30、50、100、または 150 mL ガラス製ビーカー、します。このプロトコルでは、トマト、アルファルファ、シロイヌナズナ、エンドウ豆、豆、タバコ、レタス、ニンジン種子を利用させていただきました。
- 微生物の表面滅菌後または種子内で実行可能なままで特定の種の多くの汚染の頻度を決定します。
注: これは時折種子表面殺菌によって殺されることはできません種皮の下で微生物を運ぶので必要です。種子の多くの汚染された種の周波数を使用して、汚染細菌や真菌治療も存続と 1 つの種のための種のグループの高リスクなく一度に消毒するどのように多くの種子を決定します。- 1.1.1 1.1.3 からの手順を実行します。
- 寒天シャーレに種子を置きます。について各 10 30 種皿間隔をそれら彼らが個別に獲得することができます。お皿をテープやシールのフィルムをシールします。
- 種子からの微生物の目に見える突起の毎日を得点 25 ° C で 3-5 日間インキュベートします。
- 砂で育成した苗を準備します。育苗は細菌の付着実験用砂。
- 1.1.1 1.1.3 からの手順を実行します。
- オートクレーブで石英や海砂を殺菌します。これらの両方は、いくつかの有機材料を含まれています。これは実験に影響を与えます、解決し、液体を注ぐ砂その体積の 2 倍で 10 分間許可する 0.1 M 塩酸ミックスのでそれを覆うことによって砂を洗います。砂、水で 3 回、一度 80% エタノールは 0.1 M と同じプロトコルを使用して 2 つの追加の水すすぎが続く塩酸定置滅菌オートクレーブで洗った砂を洗い流してください。
- 滅菌コンテナー 5 分 50% の漂白剤でそれらを沈めると水没によって滅菌水で 5 回洗浄します。乾燥、フィルム シールの底をシールに許可します。メーカーから得られる映画は一般的に内部の微生物の無料側コンテナーの内側に直面して配置する必要があります。
- 滅菌砂十分でウェットに十分な滅菌水と砂の棒一緒に混ぜます。量は、どのように乾燥砂は異なります。通常砂の体積の 10-35% で十分です。根の長さの十分な深さにシュートの成長のための砂の上必要かつ十分なスペースを許可するコンテナーに濡れた砂を置きます。正確な距離は、種や使用されている植物の品種によって異なります。
- 植物の種子。
- ちょうど深い砂 (大体 1-5 mm) の表面の下のシードを配置する十分滅菌ガラス棒を使って砂の中には、浅い穴を作る。穴に種を配置します。砂の薄い層でそれをカバーします。水の損失、その他の微生物の入り口を防ぐためにフィルム シールでコンテナーの上部をシールします。
- 光の下でラボまたは適切な温度と日長種と、様々 な植物のための温室の植物を育てます。トマト、アルファルファ、またはシロイヌナズナの室温と 12 時間の明暗サイクルを使用します。
- 砂 (砂だらけ、ルートがない深さと直径 1-2 mm) で穴に苗を植えます。滅菌ガラス棒で穴をあけます。滅菌のステンレス鋼かぎ針編みのフックを必要とし、砂と穴の両側を埋める場合を使用して穴に慎重にルートをガイドします。
- MS の塩の塩の混合物を含む寒天培地、植物を axenically また、育てます。寒天で直接育つ無菌植物のシュートを使用します。寒天は植物の表面と細菌の両方に棒として寒天根を避けてください。これは細菌の付着の誤った印象を与える植物の表面にあります。
2. 他の植物材料の準備
- 先住民族の微生物の数を減らすために使用する前に水で温室で育つ植物材料を洗います。細菌や植物のカビがあります。原生動物は、土壌、根および葉の上に存在するでしょう。漂白剤やエタノールで洗浄植物の表面を変更され、お勧めできません。
- 微生物の重要な番号のまま、希薄液体石鹸が付いている植物を治療または希釈過酸化水素 (0.01%) を削除または微生物を殺すために水洗浄後の場合。これは一般的に少ない漂白剤やエタノールよりも植物にダメージを与えます。
- 地元の市場で購入の植物材料は染することは困難、長期保管の対象とされているに表示されない材料を選択します。茶色か破損しているに表示される材料の部分は避けてください。
- 水で洗って、カット サイトで蓄積してきたテスト細菌と細菌 (真核生物) との相互作用が興味のない限り、それを使用する前にカットした材料の両端に新鮮な切口を作る。彼らは植物の表面を変更が、漂白剤やエタノールで洗わないでください。
- 傷のサイトを扱います。傷のサイトはしばしば細菌植物材料18の内部へのアクセスを提供します。
- ブロックまたは、細菌の付着と傷や溶けたパラフィンで切り口を浸すことによってまたは小さなブラシを使用して溶融パラフィンとサイトを塗ることによって材料の準備で作成したカットのサイト内の移動を減らします。これはティッシュを傷つけることがあります、ヘラまたは任意の鋭い道具を使用しないでください。
- シールは、パラフィンとトマトなど果実に傷を幹します。いくつかの細菌は、パラフィンの下の領域に泳ぐが、番号は一般に小さい。
- 創への細菌侵入を興味、ソリューションに追加の染料の動きを観察することによって水流または拡散によって運ばれる細菌が移動できる距離の見積もりの場合は。それらに緑の蛍光蛋白質 (GFP) などの蛍光タンパク質をコードする遺伝子を導入することで運動性の細菌をマークし、それらをトレース手順 6.1.219に記載されている蛍光顕微鏡を用いたします。
3. 菌の準備
- 細菌を成長します。使用条件、細菌に最も近いメディア研究室の外の現実の世界で植物を発生する前にすぐにさらされている可能性があります。炭素・窒素イオンの存在だけでなく、ソースの特に二価陽イオン (Ca, Mg, Fe、Mn, Zn) とリン酸と培地の pH が重要。
- A. 根頭がんしゅ病菌とその他土壌細菌20最小 AB 媒体またはルリアスープを使用します。エシェリヒア属大腸菌、腸内で発することができるルリアスープを使用します。
- 中21根分泌物など誘導または soytone など商業植物エキス、ショ糖やキシロースなどの糖を追加します。誘導剤としてこれらの物質を使用している場合は、低濃度、例えば 0.01% を追加します。その場合に使用される炭素源は、高濃度、例えば 0.1% を追加します。
- 細菌接種材料を準備します。滅菌水または孵化が実施される植物材料に追加する媒体の細菌を希釈します。適切な希釈は、4.2 と 4.3 の手順で説明します。
- 成長媒体の細菌を使用する前に、削除する 2 分 10,000 x g で細菌懸濁液を遠心、上清を離れて注ぎ、ボルテックスによって細菌を再懸濁します植物材料との孵化に使用する同じ媒体でそれら。このメソッドは、削除または番号または細胞由来物質と細胞外多糖類、カプセル、flagellae、および線毛などの付属物の量を減らす可能性があります。これらの表面構造がそのまま残ることが重要な場合は、それらを接種する前に細菌を希釈手順 3.2.2 で説明した方法を使用して、または単に。
- 、成長培地を削除する別の方法としては、硝酸セルロースまたはポリカーボネート フィルター孔径 0.2 μ m 以下の細菌を収集します。培養培地で細菌を洗浄し、穏やかな揺れや培地の滅菌コンテナー内のフィルターのボルテックスによってそれらを再懸濁します。
4. 細菌の接種
- 細菌の付着を決定するために測定を参照して再接種されるべき細菌数と培養時間の長さを決定します。
- 顕微鏡的研究 1 日未満回インキュベーションを含む細菌の比較的大きい数を接種します。1 mL あたり 10 以上の6細菌の最終細菌濃度に到達する文化の量を追加します。長い培養時間のためには、菌のサイズを小さきます。
- 生菌、によって細菌の付着が測定する研究追加 10 の最終細菌濃度に到達する文化の量3 mL あたり 10 の6細菌。
- 彼らの新陳代謝が培養液の pH や酸素濃度を変更する非常に多くの細菌を追加しないでください。Ph 試験紙または電極を使用して pH を測定します。酸素電極を用いた酸素濃度を測定します。
- 砂で栽培植物の 3 つの可能な方法で接種します。
- 1 mL あたり約 10 の6細菌の水に懸濁液に 1 分の種子を浸漬によって植わる前に細菌種を接種します。
- 苗ルートが約 1 cm 長い浸漬してまたは mL の水に 1 分あたり 10 の6細菌の懸濁液で全体の苗を配置するときに、セクション 1 とを説明した、無菌苗の発芽によってルートを接種します。
- 1 mL あたり約 103細菌の最終的な集中を与えるに植栽する前に砂と細菌の混合または懸濁液 1 mL あたり 10 の6細菌の苗を植え付け後散水による砂を接種します。
5. 植物材料の細菌の培養
- 液体培地における孵化、孵化滅菌水やショ糖、ミネラル塩の植物素材と細菌や植物の組織培養培地 (、1:10 など MS 塩の希釈)22,23。
- 細菌の付着をしないコンテナーを使用します。植物の表面を維持しようと継続的に水没または穏やかな動揺によって覆われました。激しい撹拌が付着を防止または植物の表面から細菌をも除去。
- 孵化を停止し、測定を行うタイミングを決定する時間間隔を変化後、光学顕微鏡で植物材料を確認します。接着時間コースは、サンプルごとの 1 に 4 h または相互作用の速度に応じて毎日よく貴重なです。
- 砂でインキュベートするには、手順 5.1 で液体培地での培養について同様の考慮事項を適用します。
6. 顕微鏡を用いて密着性の測定
- 表面の細菌の見やすいノマルスキーまたは位相差光学顕微鏡測定を行います。ただし、20 倍以上の倍率に明視野顕微鏡を使用できます。
- 細菌は、ランダムに分散または特定のサイトにあるかどうかは、顕微鏡を使用します。また単独でまたはクラスターにバインドされているかどうかを確認します。細菌の増殖や接着後のわなに掛ける事を示唆している microcolonies の存在を探します。細菌表面にバイオ フィルムを形成するように見えるかどうかを確認します。
注: バイオ フィルムは細菌に結合して細胞外マトリックス23,24,25に囲まれた数が多いです。構造は滑らかで、均一なより複雑なアーキテクチャを持ちます。植物の表面に関連付けられているバイオ フィルムを研究するための方法は、記述されている17をされています。 - 蛍光マーカーが付いた細菌を使用します。他の細菌が存在し、興味の細菌、緑色蛍光タンパク質など蛍光タグで識別される、蛍光顕微鏡を使用して他の細菌の26のクラスターでタグ細菌の存在を判断します。GFP の 520 nm の発光と 490 nm 励起フィルターを使用します。
- その蛍光タグが悪影響を及ぼしていない細菌無菌体野生型細菌とノマルスキーと蛍光光学系を使用して同じ系統のタグの細菌の等量混合物への付着を観察することによって確認してください。蛍光と暗い細菌がランダムに混合と等しい数に存在する場合、タグはアッセイに干渉しません。
- 細菌は、ランダムに分散または特定のサイトにあるかどうかは、顕微鏡を使用します。また単独でまたはクラスターにバインドされているかどうかを確認します。細菌の増殖や接着後のわなに掛ける事を示唆している microcolonies の存在を探します。細菌表面にバイオ フィルムを形成するように見えるかどうかを確認します。
- 接続されている細菌の数を決定します。
注: 顕微鏡で接続されている細菌の数を決定する非常に困難です。バインディングが不規則な植物の表面、じゃ一般的に定量的な測定値を取得することが可能。走査電子顕微鏡観察 (この記事では説明しません) は、そのような測定に使用できます。- 細菌が毛根の毛など滑らかな表面にバインドされているときは、根毛 mm あたり毛根の毛の端にバインドされている細菌の数します。ほぼ同じサイズと測定値を比較することで形状の根毛を使用する注意してください。
- 顕微鏡内のオブジェクトのサイズを決定するには、それを測定マーキングと商業のスライドを使用します。観察し実験材料に使用したのと同じ設定でこのスライドを撮影し、顕微鏡写真内のオブジェクトのサイズを決定する結果の画像を使用します。
- 顕微鏡検査のためサンプルを準備します。
- サンプルを洗います。顕微鏡スライドの上水または潜伏中のドロップにサンプルを移動し、それを直接観察します。
注: があった場合細菌の増殖やが実際の細菌の死がないことそう多くの無料細菌の利点があります。ある可能性がありますというバクテリアの死または細菌のバインディングを孵化を行ったコンテナーに警告記号として無料の細菌の有無を取る。サンプルを洗浄の効果を図 1に示します。 - 液体の入った瓶にそれを置き、バイアルを軽く反転サンプルを水または培養培地で優しく洗ってください。観察のため新鮮な液体の顕微鏡スライドにサンプルを配置します。
- 普通のカバー スリップと顕微鏡のスライドを使用して液体のサンプルをマウントします。
- サンプルが厚い場合、カバー スリップの下の膨らみになるので、press-apply カバー スリップを使用します。これらのカバー スリップは、ゴムやプラスチック製カバー スリップの端のまわりのリングを持っています。カバー スリップの井戸で液体とサンプルを配置上部にスライドを配置し、優しく押し下げ、スライドにカバー スリップをシールに。反転し、確認します。
- また同様の方法でスライドし、カバー スリップをカウント、藻類を使用します。この深さとスライド メモは、20 倍以上の対物レンズで一般的に検査できません。
- サンプルを洗います。顕微鏡スライドの上水または潜伏中のドロップにサンプルを移動し、それを直接観察します。

図 1: バインドされた細菌の数を決定するためのサンプルの準備の手順を実行します。A. 根頭がんしゅ病菌のバインディング (A、B、および C) トマト根における根毛とナイロン スレッド (D、E、および F)。サンプルは無料細菌 (白い矢印) を見ることができるし、細菌 (黒矢印) をバインド両方を洗浄せずに水にマウントされている (A と D)。バインドされた細菌のまま洗濯が無料の細菌は、もはや後 (B および E) を提示します。超音波処理後バインドされた細菌は、(C と F) のサンプル面から削除されています。この図の拡大版を表示するのにはここをクリックしてください。
- 蛍光菌を使用した場合は、砂を削除した後顕微鏡でサンプルを確認します。砂で栽培植物の根は一般に顕微鏡に適した砂の粒子は、細菌の観察を妨げるです。
- ステップ 7 に従って成長コンテナーから工場を削除します。水の容器に根を置き、やさしく容器の底に解決する砂を削除するミックスします。
- 洗浄水から植物を外し、6.3.3 の手順とサンプルをマウントします。
7. 実行可能なセルを用いた付着度の測定カウントします。
- 超音波発生装置を使用して接続されている細菌の数を決定します。
- 非連結の細菌を削除します。十分な水、植物材料をカバーし、バイアルを数回反転バッファーまたは潜伏中にバイアルにサンプルを配置します。
- 最初の孵化に存在 mL あたり 10 以上の3無料細菌なら、それらのすべてを削除する連続洗浄を実行します。光学顕微鏡で確認 (手順 6.3 参照) 無料細菌の存在を確認します。
- 無料細菌数の大幅な削減があるまで洗浄しますが、無料細菌数がゼロに低下することがないので、連結および非連結の細菌間の平衡があることを覚えています。
- 洗浄液鉗子やヘラのバイアルからサンプルを削除します。
- 液体の植物の孵化でバインドされた菌の数を決定します。
- バイアルの洗浄のサンプルを中断し、水や培養液、洗浄液の測定量でそれをカバーします。十分な液体を使用して、サンプルをカバーします。お風呂超音波発生装置でバイアルを置き、1 つ分の超音波。
- サンプルを削除して、バインドされた細菌が植物から削除されているかどうかを決定する光を顕微鏡下で調べます。Sonication によってサンプルからの細菌の除去を図 1に示します。細菌の存在をまだバインドがある場合は、サンプルを試料表面にバインドされた細菌が残っていないことまで sonicating を続行します。バインドされた細菌を超音波によって除去できない場合 1 10 mg/mL 滅菌石英砂を追加、超音波処理して顕微鏡で検査を繰り返します。
- 超音波処理の手順ステップ 7.1.3.2 で最も効果的に表示される超音波処理に使用されるソリューションの液体培養から細菌を停止することによってに、細菌の生存率が低下しないことを決定する (それが必要だった場合、石英砂を追加)。一般生菌数を決定します。細菌を超音波照射し、再び生菌数を決定します。
注: 生菌数の減少がある場合は、液体や超音波処理時間まで治療は一般生菌数に影響を与えませんの組成を変更することによってプロシージャを変更します。 - 生菌に使用する希釈バッファーが異なる希釈バッファーおよび/または水を使用した生菌を比較することによって使用条件の下で培養されている細菌の生存率に影響を与えないことを決定します。
- 非連結の細菌を削除します。十分な水、植物材料をカバーし、バイアルを数回反転バッファーまたは潜伏中にバイアルにサンプルを配置します。
- 均質化を使用して接続されている細菌の数を決定します。
- 滅菌モルタル ミキサーまたは他の均質化デバイスにサンプルを配置します。滅菌水や培養液、洗浄バッファー27の測定量でそれをカバーします。サンプルをカバーするのに十分なボリュームを使用します。ミキサーは、100 mL を使用してください。
- それはよく均質になるまでサンプルを挽きます。均質化のことを確認その酸植物組織から解放が pH 7 以下の急激な低下を生じない後 pH をチェックします。PH が下がった場合、pH を維持するために均質化液中リン酸バッファーなどのバッファーを使用します。
- 一般生菌数を決定します。
- 付いている抗生の抵抗細菌を使用します。
- 細菌の 1 つ以上の型が存在する場合、抗生物質 (通常リファンピシンおよびナリジクス酸) に自発的な抵抗を用いた菌株をマークします。
- 使用する抗生物質のレベルを決定します。他の有機体の孵化に存在するはずの文化が利用可能な場合はプレート抗生物質植物と選択された濃度の範囲を含んでいる版の意図した培養条件下で栽培したこれらの文化です。いずれかのこれらの生物の成長を許可しない最低の濃度を確認します。これはテスト細菌耐性が必要があります抗生物質の最小濃度です。
- 自然の抗生物質耐性突然変異株を取得します。豊富な媒体の細菌の培養を後半のログまたは固定相に成長します。適切な濃度で適切な抗生物質を含んでいる皿に原液 0.1 mL をプレートします。7.3.1.1 の手順で説明されているように使用する濃度を決定します。維持し、成長と、抗生物質に耐性の細菌を浄化します。
- 親と抗生物質耐性菌の液体媒体の成長曲線により菌の増殖を減らさないこと抗生物質耐性を決定します。これが可能な場合、抗生物質耐性菌が無菌植物材料の親系統として植民地化の同じレベルを示すことを確認します。
- 細菌の 1 つ以上の型が存在する場合、抗生物質 (通常リファンピシンおよびナリジクス酸) に自発的な抵抗を用いた菌株をマークします。
- 砂で栽培植物にバインドされている細菌の数を決定します。
- コンテナーと砂から工場を削除します。植物をコンテナーから削除、上部と容器の底にシール材をまず削除します。滅菌紙の上のコンテナーを配置し、全体の砂や土と植物を 1 つの大きなテーパー シリンダーとして材料を緩和する面に対してコンテナーを優しくノックで優しく削除します。
- 必要な場合は、ヘラや棒を使用して周囲容器の底を通過材料を緩めます。
- 砂や植物を含む土のシリンダーは紙の上無料で、真ん中に植物の根を明らかにする分割されます。必要な場合は、コンテナーの端の近くだけでなく、ルートの近くから砂のサンプルを取る。これは細菌の広がり (と蓄積と成長) を決定する役に立つかもしれません。
- 根の長さを測定します。ルートをピックアップし、砂や水やバッファーの測定ボリュームのルートを浸漬、優しくそれを揺することによってルート (根素材) に緩く付着した細菌を削除します。ルリア寒天培地などの適した培地でのめっきによる結果の懸濁液中の細菌の生菌数を決定します。これはルートに緩く関連付けられている細菌の数を表します。
- コンテナーと砂から工場を削除します。植物をコンテナーから削除、上部と容器の底にシール材をまず削除します。滅菌紙の上のコンテナーを配置し、全体の砂や土と植物を 1 つの大きなテーパー シリンダーとして材料を緩和する面に対してコンテナーを優しくノックで優しく削除します。
- Sonication によって密接に結び付けられた細菌を削除し、手順 7.1 で説明するように、自分の番号を決定します。
- また、調べるに密接に結び付けられた細菌のルート上の場所はペトリ皿の寒天またはその他の適切な媒体を含む表面の根の洗浄を置きます。解剖顕微鏡または拡大鏡を使用して次の 3 日にわたってルートの細菌のコロニーの場所を確認します。
- 植物、cm2の表面積、cm 根長、または組織の新鮮な重量をグラムあたりの細菌数として結果を表現します。同じ日に複数のレプリケートを行うし、また異なる細菌文化、植物材料の異なった多くを使用して別の日にレプリケートを行います。
8. 接着に及ぼす培養条件が、細菌や植物の応答のためにかどうかを決定します。
- 死亡または死亡の植物材料を使用します。
- それを殺すために植物化学物質、定着剤、または熱など他の治療法の様々 な材料を対象します。これらの治療法のいずれかを使用した後、水と培養培地で徹底的に植物材料を洗います。その後、細菌を接種します。これが植物の表面を破壊しないが、ことが代謝的に不活性細菌に応答できないようにします。
- 手順 6 および 7 では、細菌の付着を測定します。また孵化および有毒な化学薬品が孵化の間に存在しないことを確保するため培養末に現在実行可能なセルの数の初めに植物材料と孵化に追加される実行可能なセルの数を決定します。
- 生気のない素材を使用します。
- 使用細菌付着細菌付着に関する植物素材に見られる効果を決定する無生物の材料には、植物や細菌に影響を及ぼすのためにです。細菌がバインド無生物材料を選択し、形状とサイズで学んだ植物材料に似ています。可能性がありますすべての種類 (セルロース、硝酸セルロース、ガラス繊維、ポリカーボネート、等)、スレッド(ナイロン、綿、ポリエステル、グラスウールなど)、ガラスまたはプラスチック coverslips、ステンレス鋼クーポンと透析フィルター ペーパー膜。
- 水と培地培養が実施され、それを使用する前に殺菌を徹底的に無生物の材料を洗います。8.2.1 の手順に記載されている材料のほとんどは、オートクレーブによる滅菌に安定しています。
- 希望の条件と手順 6 および 7 でスコアの下で無生物材料を孵化させなさい。A. 根頭がんしゅ病菌高カルシウム濃度で根毛の減らされた結合が原因であると判断するナイロン スレッドの使用の例 (少なくとも部分的に) 菌に及ぼすカルシウムの影響を図 428に示します。
結果
A. 根頭がんしゅ病菌の根面を定着します。セルロース合成を防ぐ細菌の突然変異の効果があったセルロースの細菌の生産は、ルートの植民地化の役割を果たしている、かどうかを決定するために16を検討しました。手順 1.3 および 7.1 技術が使用されました。トマトの種は表面滅菌し、滅菌水で発芽させた.根が約 2 cm 長い 1 mL あたり 10 の5菌懸濁液中に浸漬され、容器に殺菌土壌に植えられました。植物は、12 時間ライト/12 h 暗いサイクルに 25 ° C で 14 日間栽培しました。植物回示された後、コンテナーから削除されました。根は洗浄され、バインドされた細菌を除去する風呂超音波発生装置で超音波処理します。生菌を使用して細菌数を調べた。図 2は、トマトの根を植民地化する細菌の機能に 2 つの異なるセルロース マイナスの突然変異の効果を示します。いくつかの測定値の標準偏差が 0.9 ログ10 (測定のこのタイプの共通の問題) 高セルロース マイナス変異体の結合の減少は明らかであると結論付けることができます細菌の生産セルロースは、トマトの根の定着・増殖における細菌を支援します。
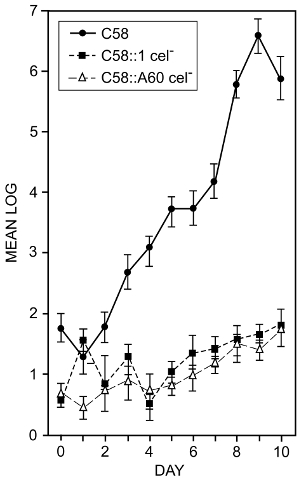
図 2: 野生型およびセルロース マイナス変異A. 根頭がんしゅ病菌による植民地化のルートします。ログ10トマトの根から回収 cm 根長当たりの細菌数を接種した野生型A. 根頭がんしゅ病菌系統 c58 形とセルロース マイナス変異体 C58:1 と C58:A60。内の数値は、最低 4 つの独立した実験から手段です。バーは、平均の標準偏差を表します。根は、mL の 1 分あたり 105菌懸濁液でそれらを浸すことを接種しました。コンテナーで栽培した、緩く付着性細菌がガラス瓶でバッファーを洗浄の根を洗浄することにより除去しました。しっかりと付着性細菌はお風呂超音波発生装置およびめっき生菌数16を決定する結果の懸濁液を使用して削除されました。この図は、タイトル後、プロボクサービクトリービッグスプロットアイズと McMahan から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
エシェリヒア属大腸菌およびアルファルファもやしに他の細菌の結合において細胞外多糖類の役割を検討しました。E. 大腸菌o157: h7 による下痢症のいくつかの発生は、汚染されたアルファルファもやしに追跡されています。野生型細菌と変異体の様々 な細胞外多糖類をすることができないのバインディングは、1.1、5.1、および 7.2 の手順で説明する方法を用いて測定しました。アルファルファもやしは表面殺菌し、暗闇の中 25 ° C で滅菌水で 1 日発芽しました。添付種皮を持つ 4 つの芽は、5 mL の水を含む滅菌プラスチック皿に置かれました。ルリアスープで増殖する細菌は、3 mL あたり約 5 x 10 の最終的な集中に追加されました。3 日間の暗闇の中 25 ° C で培養接種のもやし。もやしは積極的な逆解析によるバイアル 5 mL の滅菌水で 2 回洗浄され、モーター駆動のテフロン ガラス ホモジナイザーを使用してバッファーを洗浄で均質化されました。以前実験で細菌が表面の細菌は簡単にみに内面化された細菌を示さなかった GFP 遺伝子を運ぶプラスミッド付けられます。結果は表 1のとおりです。E. 大腸菌o157: h7 の 2 系統を調べた。両系統のポリ-β-1, 6-グルクロン ポリマーポリ グルタミン酸の生産は、植物表面に病原性大腸菌のバインディングに対して最大の貢献をするのに見えた。大腸酸結合に重要な役割を果たしました。セルロース マイナス変異体の結合の低減は重要なそれは他の 2 つの多糖類は、大きなでした。
| もやしと開いた種皮にバインドの E. 大腸菌 o157: h7 の体外生産遺伝子の突然変異の効果 | |||
| 菌株 | 突然変異または遺伝子型 (関連する表現型) | 10芽や種子コートごとに区切られる細菌数をログに記録します。 | |
| アルファルファもやしb | 開いている種皮 | ||
| 86 24 | どれも (野生型) | 4.7 ± 0.6 | 5.6 ± 0.2 |
| 8624N | yhjN(セルロース-マイナス) | 2.9 ± 0.7c | 3.5 ± 0.6c |
| 8624 C | wcaD(大腸酸マイナス) | 1.8 ± 0.7c | 2.4 ± 0.5c |
| 8624 P | pgaC(PGA マイナス) | < 1.0c | 1.0 ± 1.0c |
| DEC4A | どれも (野生型) | 5.6 ± 0.2 | 6.1 ± 0.3 |
| DEC4AN | yhjN(セルロース-マイナス) | 4.8 ± 0.8d | 4.1 ± 0.8d |
| DEC4AC | wcaD(大腸酸マイナス) | 3.9 ± 0.5c | 4.8 ± 0.8d |
| DEC4AP | pgaC(PGA マイナス) | < 1.0c | 1.2 ± 0.7c |
| 細菌の数 (ログ10) の 3 つの測定値の最小値の平均 ± 標準偏差は、3 日後にバインドされています。 | |||
| b もやしは、測定前に洗浄しました。 | |||
| 野生型と大きく異なる c: P < 0.01。 | |||
| 野生型と大きく異なる d: P < 0.05。 | |||
| このテーブルは、タイトル後、プロボクサービクトリービッグスプロットアイズ、マハラシュトラ、Mishra、トーレス10から変更されています。 | |||
表 1: 結合に対する体外生産遺伝子の突然変異の効果エシェリヒア属大腸菌 o157: h7 にもやし。メソッドを使用してさまざまな細胞外多糖類および病原性の結合のリポ多糖の役割を決定するためにアルファルファもやし、もやしとオープンの種皮には、突然変異体の一連のバインディングにエシェリヒア属大腸菌o157: h7 株を検討しました。手順 6 で説明します。結果、そのポリ-β-1, 6 -N-アセチル-D-グルコサミン (PGA) はもやしにバインドするために不可欠であるとし、セルロース、colanic 酸、エシェリヒア属大腸菌O157 の最大のバインディングが必要です。このテーブルは、タイトル後、プロボクサービクトリービッグスプロットアイズ、マハラシュトラ、Mishra、トーレス10から変更されています。
生産がないと思います 2 つの異なる細菌導入された PGA 生産は植物の表面、PGA に必要な遺伝子を符号化するクローンとして作られたオペロンを運ぶプラスミド (pMM11) に細菌の結合を引き起こすに十分なかどうかを決定するために通常トマト根10にバインドすることができます。A. 根頭がんしゅ病菌A1045 野生型株 1, 繰返し β-2 グルカンを作るが失敗し、また植物の表面29のバインドに失敗する c58 形のミュータントであります。ダイズ トリプトフアン1021 アルファルファの根粒を形成する非まめ科植物のバインドに失敗トマト12を含みます。1.1、5.1、7.1 6.3 の手順で説明する方法は、PGA を一般的にすることが根面細菌のバインディングを増加したかどうかを決定するために使用されました。トマトの種は表面滅菌し、滅菌水で発芽させた.根セグメント 1 cm の長さにカットされ、滅菌水に入れるし、細菌を接種しました。細菌のこれらの 2 つの種は、異なるレートで成長、バインディングは細菌の増殖のほぼ等しい量を可能にする異なる時に測定されました。プラスミド pMM11 の存在は、種 (表 2)10両の連結の細菌数のような大幅な増加を発生します。バインディングの大幅な増加はまた光学顕微鏡で見られたが、バインドされた (図 3) の 2 つの種の非常に異なる。A. 根頭がんしゅ病菌A1045 個々 の細菌として根面にバインドします。S. 法だけで細菌数直接ルートに接続しているし、細菌の大半は、他の細菌に取り付けられていた、大規模なクラスターでバインドします。この例では、顕微鏡観察を含めずにバインドされている細菌の数を解析するだけで実験の結果の誤った印象を与えることができます。両方の方法 (生菌と顕微鏡観察) 表示その pMM11 増加したトマトの根に細菌のバインディングが、PGA の生産による結合型 2 つの細菌種は、10の異なるだった
| トマトの根にはバクテリアのバインドにプラスミド pMM11 の効果 | ||
| 菌株 | プラスミド | Mm ルートごとに区切られる細菌の数 |
| A. 根頭がんしゅ病菌 A1045、 | どれも | 103 ± 0.25 x 103 x 0.25 |
| pBBR1mcs (ベクトル) | 103 ± 0.25 x 103 x 0.25 | |
| pMM11 (PGA 合成) | 10 x 103 ± 0.25 x 103 | |
| S. 法 1021b | どれも | 検出なし |
| pBBR1mcs (ベクトル) | 検出なし | |
| pMM11 (PGA 合成) | 50 x 103 ± 5 × 103 | |
| 2 時間後に測定した細菌のバインディング | ||
| b 細菌は 18 時間後測定 | ||
| このテーブルは、タイトル後、プロボクサービクトリービッグスプロットアイズ、マハラシュトラ、Mishra、トーレス10から変更されています。 | ||
表 2: のバインドで PGA の合成のための遺伝子を運ぶプラスミッドの効果A. 根頭がんしゅ病菌 A1045 と s. トリプトフアントマト ルート セグメントに 1021。ポリ-β-1, 6 - の能力を調査するためにN-アセチル-D-グルコサミン (PGA) 植物に細菌の結合を促進するために根をプラント関連細菌の 2 つの系統のバインディングの PGA (pMM11) を作成する機能を付与プラスミドの効果トマトの根を調べた。細菌のどちらのひずみは、PGA 合成 (pBBR1mcs) をコードしている遺伝子なしプラスミッドまたはプラスミッドの存在下での不在でトマトの根に重要な結合を示した。PGA 合成遺伝子を運ぶプラスミッドの添加は、両タイプの細菌による結合を増加しました。A. 根頭がんしゅ病菌はS. 法の測定A. 根頭がんしゅ病菌の培養の 2 h と 18 h の後米トリプトフアンバインディングよりも速く育ちます。使用方法は、手順 7 で記述されていません。このテーブルは、タイトル後、プロボクサービクトリービッグスプロットアイズ、マハラシュトラ、Mishra、トーレス10から変更されています。
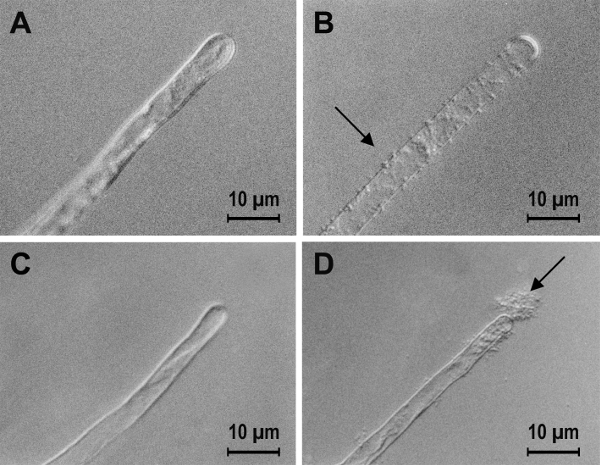
図 3: A. 根頭がんしゅ病菌A1045 のS. 法1021 トマト根における根毛にバインディングの PGA 生合成遺伝子を運ぶプラスミド pMM11 の効果です。A のトマト根における根毛にバインド) A. 根頭がんしゅ病菌A1045、B) A. 根頭がんしゅ病菌A1045 pMM11、C) S. 法1021 と D) S. 法1021 pMM11。2 つの菌種の結合の増加はほぼ同じような光学顕微鏡で見られるようにバインドの詳細はかなり異なっています。使用方法は、手順 6 で記述されていません。この図は、タイトル後、プロボクサービクトリービッグスプロットアイズ、マハラシュトラ、Mishra、トーレス10から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
細菌の特定の相互作用の植物の貢献を区別することを支援する非生物学的表面へのバインドを使用することができることがあります。A. 根頭がんしゅ病菌の単極の polysaccharide(UPP) は、両方の生物と非生物の表面の30のさまざまな細菌の結合を仲介することができるように示されています。カルシウムは、植物表面 UPP28によって仲介するA. 根頭がんしゅ病菌の結合を阻害する観察されました。植物の表面に細菌のバインディングのカルシウム イオンによる阻害がを細菌や植物の表面効果のためかどうかを決定するためにナイロン スレッドへの細菌のバインディングを検討しました。ステップでのテクニック 8.2 が使用されました。トマトの種は表面殺菌し、手順 1 で説明した水で発芽させた.細菌がスクロース最小培地で栽培され、手順 5.1 で説明したトマトの根または約 105/mL の最終的な集中でナイロン スレッドに追加します。トマトの根とナイロン スレッドに細菌の結合に及ぼす追加 CaCl2を顕微鏡で調べた。図 4はカルシウムか表面ことを示唆するカルシウムの効果は、主に細菌の10を使用してバインドのような抑制を示しています。

図 4: トマト根における根毛とナイロン スレッドA. 根頭がんしゅ病菌の結合に及ぼすカルシウム。A. 根頭がんしゅ病菌は培養トマトの根 (A と B) と 24 h のナイロン スレッド (C と D)、1:10 MS の塩と、1:20 の希釈 AB 最小媒体、0.4% ショ糖 (A、C) または、1:10 の希釈 MS 塩と 1:20 の希釈 AB 最小培地の希釈、0.4% ショ糖を含む 60 mM CaCl2 (B、D) の31。追加 CaCl2根とナイロン スレッド抑制は主に植物の表面ではなく、細菌に影響を与えるのためであったことを示唆している両方に細菌を抑制しました。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
実験中に細菌が付着することが表面のすべてを認識することが重要です。生菌が行われる場合、ガラスにバインドすることができる細菌が過小評価される従ってガラス管、ピペットを使用します。寒天培地または土壌と寒天のいくつかの植物は育つ土壌が植物に残っている場合、細菌は植物ではなく、付着した材料にバインドできます。その一方で、根、特に植物の表面を洗浄取り外せます自然表面コーティングなど粘膜付着テストの結果をこのように変更と。
特定の細菌培養混合物に追加が実験中に生きているままにすることが重要です。こうして無料として接続されている細菌の生菌は日常的に行われなければなりません。いくつかの治療法や細菌の突然変異は細菌の増殖率を減らすまたは実際に細菌の人口のごく一部の死を引き起こす可能性があります。特別な汚れを使用しない限り、ライブとデッド細菌を顕微鏡で区別できない場合があります。生きている細菌から染料の排除によって決まるライブ/デッド細菌の有用な染色キットです。しかし、菌種の混合された人口が存在する場合、関心の種の生菌数は孵化がバクテリアの死で起因したかどうかを決定する最も簡単な方法をする可能性があります。
培地成分は細菌の生存と成長に影響を及ぼします。傷から解放され、サイトをカットの根滲出液等ささやかな細菌の成長をサポートするための基板を提供します。リン酸・窒素・鉄は、これらの条件で制限される傾向にあります。カルシウムやマグネシウムなどの 2価陽イオン接着に影響を与える可能性があります。いくつかのケースで密着性に影響を及ぼす炭素源。pH も重要であります。一般に根圏 pH は 5.5 と 6.5 の間です。
付いている抗生の抵抗細菌を使用して注意が必要です。最も頻繁に使用される抗生物質リファンピシン ・ ナリジクス酸であります。これらの抗生物質への抵抗は一般に染色体の遺伝子の突然変異 (RNA ポリメラーゼとジャイレース、それぞれ) 従って、簡単に別の負担に孵化の間に転送することはできません。また抵抗のこのタイプは劣化や抗生物質の変更されません。他の細菌にプラスミドを転送できない場合を除き、プラスミド由来の遺伝子マーカーを持つ細菌をマーキングはお勧めしません。抗生物質感受性菌は耐性菌に近いある場合抗生物質プレートに成長することはできなくなりますので、抗生剤の劣化や化学修飾による抗生の抵抗にはなりません。
このペーパーで説明する方法は、サンプルが (たとえば、実験人間の病原体を含む) に格納する必要があります小さなサンプル サイズや実験に適しています。(100 g の材料または 50 以上の植物) の上の大きいサンプルの大きさのため他の方法またはこれらの方法の抜本的な変更になります必要な10,19,32,19,33,34,35,36. 多数研究されている種以外の微生物の存在も重大問題が発生することができます。可能な解決策には手順 6.1.2 および 7.3 蛍光タンパク質や抗生物質耐性付いて細菌の使用が含まれます。しかし、関心の菌は他の微生物の大規模な人口で稀な個人これらのマーカーは研究されている細菌の数の明確な評価を許可するように適切なできません。
すべてのここで説明した方法は実験室ベースの方法です。マイナーな修正温室効果研究のため必要になります。大きな変更は、原生動物、昆虫および他の動物の捕食と気候の変化が実験のための定義された条件の規定を複雑にフィールド調査に必要可能性があります。将来的にこれらのメソッドは、植物の表面に 2 つ以上の微生物の相互作用を含むように拡張可能性があります。
開示事項
著者は、競合する金融興味も持っていないこと彼女を宣言します。
謝辞
著者は、実験のいくつかの援助のための数字は、カミーユ ・ マルタンとヒラリー ・ Samagaio の準備のためのスーザン ホイット フィールドを感謝します。
資料
| Name | Company | Catalog Number | Comments |
| light microscope | any | N/A | phase contrast or Nomarski optics are helpful, for studies using fluorescent markers a fluorescence microscope is required. |
| seeds | any | N/A | make a note of the seed lot number and the cultivar |
| bleach | any | N/A | |
| bath sonicator | any scientific supply company | N/A | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| nutrient agar | Difco | 001-01-8 | |
| soytone | Difco | 24360 | |
| Sand | sea sand Fisher Scientific | S25 | |
| sand | Sigma-Aldrich | S9887 | |
| conetainers | Stuewe & Sons, Inc. | Ray-Leach cone-tainers | many different sizes are available to suit the type of plant you wish to grow |
| parafilm | any scientific supply company | N/A | |
| MS salts | Sigma-Aldrich | M5524 | |
| parrafin | any | N/A | |
| centrigfuge | any scientific company | N/A | to pellet most bacteri only a small centrifuge with a max force of 10,000 XG is needed |
| vortex mixer | any scientific company | ||
| micrometer | ACCU-SCOPE Accessories | A3145 | |
| Sedgwick-rafter counting cell | Hauser Scientific | HS3800 | |
| probe-clip press-seal incubatin chamber | Sigma-Aldrich | Z359483 | |
| rifampicin | Sigma-Aldrich | R3501 | |
| naladixic acid | Sigma-Aldrich | n8878 | |
| Live/dead stain | In Vitrogen Molecular Bioprobes | L7007 |
参考文献
- Heaton, J. C., Jones, K. Microbial contamination of fruit and vegetables and the behaviour of enteropathogens in the phyllosphere: a review. J. Appl. Microbiol. 104, 613-626 (2008).
- Beuchat, L. R. Ecological factors influencing survival and growth of human pathogens on raw fruit and vegetables. Microbes Infect. 4, 413-423 (2002).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Lugtenberg, B. J., Chin, A. W. T., Bloemberg, G. V. Microbe-plant interactions: principles and mechanisms. Antonie Van Leeuwenhoek. 81, 373-383 (2002).
- Preston, G. M., Haubold, B., Rainey, P. B. Bacterial genomics and adaptation to life on plants: implications for the evolution of pathogenicity and symbiosis. Curr. Opin. Microbiol. 1, 589-597 (1998).
- Compant, S., Duffy, B., Nowak, J., Clement, C., Barka, E. A. Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects. Appl. Environ. Microbiol. 71, 4951-4959 (2005).
- Mathews, S. L., Smith, R. B., Matthysse, A. G. A comparison of the retention of pathogenic Escherichia coli. O157 by sprouts, leaves and fruits. Microb. Biotechnol. 7, 570-579 (2014).
- Fuqua, C., Matthysse, A. G. Methods for studying bacterial biofilms associated with plants. Methods Enzymol. 337, 3-18 (2001).
- Torres, A. G., Jeter, C., Langley, W., Matthysse, A. G. Differential binding of Escherchia coli.O157:H7 to alfalfa, human epithelial cells, and plastic is mediated by a variety of surface structures. Appl. Environ. Microbiol. 71, 8008-8015 (2005).
- Matthysse, A. G., Deora, R., Mishra, M., Torres, A. G. Polysaccharides cellulose, poly-beta-1,6-n-acetyl-D-glucosamine, and colanic acid are required for optimal binding of Escherichia coli O157:H7 strains to alfalfa sprouts and K-12 strains to plastic but not for binding to epithelial cells. Appl. Environ. Microbiol. 74, 2384-2390 (2008).
- Matthysse, A. G., et al. The effect of cellulose overproduction on binding and biofilm formation on roots by Agrobacterium tumefaciens. Mol. Plant Microbe Interact. 18, 1002-1010 (2005).
- Matthysse, A. G., Kijne, J. W., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. Attachment of Rhizobiaceae to plant cells. The Rhizobiaceae. , 235-249 (1998).
- Matthysse, A. G. Conditioned medium promotes the attachment of Agrobacterium tumefaciens.strain NT1 to carrot cells. Protoplasma. 183, 131-136 (1994).
- Matthysse, A. G., McMahan, S. The effect of the Agrobacterium tumefaciens. attR mutation on attachment and root colonization differs between legumes and other dicots. Appl. Environ. Microbiol. 67, 1070-1075 (2001).
- Jeter, C., Matthysse, A. G. Characterization of the binding of diarrheagenic strains of E. coli.to plant surfaces and the role of curli in the interaction of the bacteria with alfalfa sprouts. Mol. Plant Microbe Interact. 18, 1235-1242 (2005).
- Matthysse, A. G., McMahan, S. Root colonization by Agrobacterium tumefaciens is reduced in cel, attB, attD, and attR mutants. Appl. Environ. Microbiol. 64, 2341-2345 (1998).
- Morton, E. R., Fuqua, C. Phenotypic analyses of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Brandl, M. T. Plant lesions promote the rapid multiplication of Escherichia coli O157:H7 on postharvest lettuce. Appl. Environ. Microbiol. 74, 5285-5289 (2008).
- Franz, E., et al. Quantification of contamination of lettuce by GFP-expressing Escherichia coli O157:H7 and Salmonella enterica serovar Typhimurium. Food Microbiol. 24, 106-112 (2007).
- Morton, E. R., Fuqua, C. Laboratory maintenance of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Lugtenberg, B. J., Kravchenko, L. V., Simons, M. Tomato seed and root exudate sugars: composition, utilization by Pseudomonas biocontrol strains and role in rhizosphere colonization. Environ. Microbiol. 1, 439-446 (1999).
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum. 15, 473-497 (1962).
- Danhorn, T., Fuqua, C. Biofilm formation by plant-associated bacteria. Annu. Rev. Microbiol. 61, 401-422 (2007).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Charkowski, A. O., Barak, J. D., Sarreal, C. Z., Mandrell, R. E. Differences in growth of Salmonella enterica and Escherichia coli O157:H7 on alfalfa sprouts. Appl. Environ. Microbiol. 68, 3114-3120 (2002).
- Loper, J., Suslow, T., Schroth, M. Lognormal distribution of bacterial populations in the rhizosphere. Phytopathology. 74, 1454-1460 (1984).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, 252 (2014).
- Douglas, C. J., Halperin, W., Nester, E. W. Agrobacterium tumefaciens mutants affected in attachment to plant cells. J. Bacteriol. 152, 1265-1275 (1982).
- Tomlinson, A. D., Fuqua, C. Mechanisms and regulation of polar surface attachment in Agrobacterium tumefaciens. Curr. Opin. Microbiol. 12, 708-714 (2009).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, (2014).
- Wright, K. M., et al. The endophytic lifestyle of Escherichia coli O157:H7: quantification and internal localization in roots. Phytopathology. 103, 333-340 (2013).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Erickson, M. C., et al. Internalization and Fate of Escherichia coli O157:H7 in Leafy Green Phyllosphere Tissue Using Various Spray Conditions. J. Food Prot. 77, 713-721 (2014).
- McKellar, R. C., et al. Evaluation of different approaches for modeling Escherichia coli O157:H7 survival on field lettuce. Int. J. Food Microbiol. 184, 75-85 (2014).
- Wu, F. M., et al. Factors influencing the detection and enumeration of Escherichia coli O157:H7 on alfalfa seeds. Int. J. Food Microbiol. 71, 93-99 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved