Method Article
공장 실험실에서 측정 하는 표면에 박테리아의 부착
요약
측정 및 식물, 특히 뿌리와 콩나물, 세균성 접착을 위한 쉬운 방법이이 문서에 설명 되어 있습니다.
초록
이 원고는 가벼운 현미경에 사용 가능한 셀 카운트 axenic 식물 표면에 세균성 바인딩을 측정 하는 방법을 설명 합니다. 사용 되는 식물 재료 뿌리, 콩나물, 잎를 포함 하 고 과일을 잘라. 설명 하는 메서드는 저렴, 쉽게, 그리고 작은 샘플 크기에 적합. 바인딩 실험실에서 측정 되 고 부 화 미디어의 다양 한 사용할 수 있습니다. 억제제의 효과 확인할 수 있습니다. 상황을 홍보 하 고 바인딩에 억제 평가 수 있습니다. 경우에 따라 다양 한 조건 변경 바인딩 주로 박테리아 나 식물에 그들의 효과 때문 인지 구별 가능 하다.
서문
식물의 표면에 세균성 바인딩의 측정 3 개의 서로 다른 상황에서 중요 한 되고있다. 첫 번째 상황은 식물 표면1,2,3에 인간 병원 체의 전송의 시험. 목표는 여기 세균성 바인딩 방지 제거 또는 바운드 박테리아를 죽 일 하는 것입니다 따라서 공장 설비 재료에 의해 질병의 전송을 줄이기 위해. 두 번째 상황은 표면4공장 식물 병원 체의 바인딩의 시험입니다. 다시 한번 목표 여기 바인딩 방지 제거 또는 바운드 박테리아를 죽 일 하는 것입니다 따라서 질병을 줄이기 위해. 세 번째 공생 또는 식물 성장을 승진 시키는 박테리아5,6의 바인딩의 시험 이다. 목표는 여기 세균성 바인딩 및 따라서 증가 식물 건강 및 작물을 홍보 하는 수익률.
이 문서에서 설명 하는 서피스 공장 세균성 바인딩 측정 기술을 저렴 하 고 비교적 수행 하기 쉬운 있습니다. 유일한 요구 사항은 현미경 및 세균 학 실험실에서 일반적으로 자료입니다. 몇 가지 기법에 대 한 목욕 sonicator 유용합니다. 설명 된 기술은 바인딩 상대적으로 작은 샘플 크기를 사용 하 여 실시 하는 실험을 위해 설계 되었습니다. 바인딩의 측정 분야 또는 온실에서 사용 하기 위해 이러한 기술 중 일부를 수정할 수 수 있지만, 실험실에서 만들어집니다.
이 기술은 세균성 바인딩 뿌리, 콩나물, 절단된 잎, 컷 과일과는 실험실7,,89,10,11, 체리 토마토를 그대로 측정 하 사용 되었습니다. 12,13,,1415. 그들은 또한 토양에서 성장 하는 식물의 뿌리 식민지를 측정 하거나 실험실16모래 사용 되었습니다. 기술은 많은 세균성 종 등 Agrobacterium tumefaciens, Sinorhizobium meliloti, 대장균, 살 모 넬 라 enterica, 슈 도모 나 스 fluorescens와 함께 사용 되었습니다. A. tumefaciens 의 표면 상호 작용을 평가 하기 위한 방법 중 유용한 설명 (2012 년)17모 튼 및 Fuqua에 찾을 수 있습니다. 모든 경우에 포함 된 샘플 크기 작은, 더 적은 일반적으로 25-50 식물 보다 했다. 설명 포함 된 실험 기간 동안 유지 될 필요가 있는 인간의 병원 체와 함께 사용을 위해 적당 하다.
프로토콜
1입니다. Axenic 식물 재료의 준비
- 준비 물에서 자란 묘 목.
- 30, 50, 100, 또는 150 mL 유리 비 커에 씨앗 (30 미만)의 작은 수를 배치 합니다. 토마토, 알 팔 파, 애기 thaliana, 완두콩, 콩, 담배, 상 추, 및 당근 씨앗이이 프로토콜을 사용 했습니다.
주: 얼마나 많은 씨를 함께 다른 하나의 씨앗에서 확산 하는 오염 없이 소독 수를 확인 하려면 단계 1.1.2를 참조 하십시오. - 80% 에탄올과 씨앗을 커버 하 고 짧게 소용돌이. 씨앗 1 분 동안 담가 보자.
- 에탄올을 부 어 하 고 커버 솔루션 볼륨 상업적인 표 백제 (NaClO) 50%와 0.1%의 씨앗 수돗물에 트라이 톤 X-100. 씨앗 20 분 동안 담가 보자.
참고: 씨 콩 씨앗 같은 큰 경우, 그것은 필요할 수 있습니다 완전히 씨앗 표면에 곰 팡이 죽 일 몸을 담글 시간이 길게 하. - 표 백제 혼합물을 부 어와 3 번 살 균 물으로 씨앗을 씻어. 각 세척에 대 일 분 동안 물에 담가 씨를 보자.
- axenic 모 종 씨앗의 크기에 따라서 5와 25 mL 사이 살 균 물 작은 금액을 추가 합니다. 씨앗 발 아에 대 한 멸 균 페 트리 접시에 씨앗과 물을 붓으십시오.
참고: 물 접시의 바닥을 커버 해야 하지만 루트 머리카락의 형성을 장려 하기 위해 씨앗을 커버 하지. Axenic 단일 종의 유기 체는 존재만 있는 문화를 설명 합니다. - 묘 목 1 cm, 10 cm (약 5 일 토마토, A. thaliana 와 알 팔 파에 대 한 1 ~ 3 일) 사이 원하는 크기에 도달할 때까지 어둠 속에서 품 어. 큰 씨에 대 한 호 일로 덮여 유리 접시 같은 이상의 100 mL의 용량으로 덮여 살 균 컨테이너를 사용 합니다.
- 30, 50, 100, 또는 150 mL 유리 비 커에 씨앗 (30 미만)의 작은 수를 배치 합니다. 토마토, 알 팔 파, 애기 thaliana, 완두콩, 콩, 담배, 상 추, 및 당근 씨앗이이 프로토콜을 사용 했습니다.
- 표면 살 균 후에 또는 씨앗 내에서 가능한 남아 있는 미생물과 특정 씨 많이 오염 빈도 결정 합니다.
참고:이 작업이 필요 가끔 씨앗 표면 살 균에 의해 살해 수 없는 씨 외 투에서 미생물을 나르기 때문 에입니다. 시드 많은 오염 된 씨앗의 주파수를 사용 하 여 소독 박테리아 또는 곰 팡이 치료를 살아 나는 한 씨로 인해 오염 되 고 씨앗의 그룹의 높은 위험 없이 한 번에 얼마나 많은 씨앗 결정.- 1.1.3 통해 1.1.1 단계를 실시 합니다.
- 영양 한 천 배양 접시에 씨앗을 놓습니다. 약 10-30 씨앗 각 접시 그들은 개별적으로 득점 될 수 있도록 그들을 밖으로 간격. 봉인 테이프 또는 씰링 필름으로 요리.
- 씨앗에서 미생물의 표시 파생물에 대 한 매일을 득점 하는 25 ° C에서 3-5 일에 품 어.
- 모래에서 자란 묘 목 준비. 묘 세균성 접착 실험에 사용 하기 위해 모래에 성장 될 수 있다.
- 1.1.3 통해 1.1.1 단계를 실시 합니다.
- 석 영 또는 바다 모래는 오토 클레이 브에서 소독. 이 것 둘 다 몇 가지 유기 물질을 포함 되어 있습니다. 이 실험에 영향을 미칠 것입니다, 그것의 양의 0.1 M HCl. 믹스 10 분 허용에 대 한 두 번으로 정착 하 고 있는 액체를 부 어 모래 그것을 취재 하 여 모래를 세척 한다. 3 회 물으로 하 고 일단 80% 에탄올 다음 0.1 m M에 관해서는 동일한 프로토콜을 사용 하 여 두 개의 추가 물 린스 HCl. Sterilize는 압력솥에 씻어 모래 모래를 씻어.
- 5 분 동안 표 백제 50%에에서 그들을 잠수 하 여 용기를 소독 하 고 그들에 게 살 균 물과 함께 5 번을 씻어 침수에 의해. 그들이 건조 하 고 밀봉 영화와 하단 인감 수 있습니다. 으로 제조 업체에서이 영화는 일반적으로 내부에 미생물의 무료 사이드 컨테이너의 내부를 직면 하 고 배치 한다.
- 믹스 메 마른 모래 충분히 젖은 충분히 살 균 물과 모래 막대기 함께. 양을 어떻게 건조 모래가에 따라 달라 집니다. 일반적으로 10 ~ 35%의 모래의 볼륨은 충분 합니다. 충분 한 깊이 뿌리의 길이 대 한 촬영의 성장 위한 모래 위에 필요 하 고 충분 한 공간을 허용 하는 컨테이너에 있는 젖은 모래를 놓습니다. 정확한 거리는 종 및 다양 한 사용 되 고 식물에 따라 달라 집니다.
- 식물 씨앗입니다.
- 그냥 깊은 만큼 (약 1-5 m m) 모래의 표면 아래 씨를 멸 균 유리 막대와 모래에 얕은 구멍을 확인 합니다. 구멍에 씨앗을 배치 합니다. 모래의 얇은 층으로 커버. 물 손실 및 추가 미생물의 입구를 방지 하기 위하여 필름을 밀봉 된 컨테이너의 상단을 봉인.
- 빛 아래 실험실에서 또는 하루 길이 종 및 다양 한 식물에 대 한 적절 한 온도에 온실에 있는 식물을 성장 한다. 토마토, 알 팔 파, 또는 애기 thaliana 실내 온도 12 h 명암 주기를 사용 합니다.
- 모래 (직경 및 루트 모래로 덮여 있을 것입니다 충분히 깊은 곳에서 1-2 m m)에 구멍에 묘 종 식물. 멸 균 유리 봉으로 구멍을 확인 합니다. 메 마른 스테인리스 바늘 필요 하 고 모래 구멍의 측을 작성 하는 경우를 사용 하 여 구멍에 신중 하 게 루트를 안내.
- 또는 MS 소금 같은 소금 혼합물을 포함 한 천 axenically 식물 성장 또는. 한 천에서 직접 재배 하는 axenic 식물의 싹을 사용 합니다. Agar agar 박테리아와 식물 표면에 막대기로 성장 하는 뿌리를 하지 마십시오. 이 식물 표면에 세균성 접착의 잘못 된 인상을 발생할 수 있습니다.
2입니다. 다른 공장 설비 재료의 준비
- 토착 미생물의 수를 줄이기 위해 사용 하기 전에 물으로 온실에서 재배 하는 식물 재료를 씻어. 박테리아와 균 류는 식물에 있을 것입니다. 원생 동물, 뿌리 및 잎에는 토양에 있을 것입니다. 표 백제 또는 에탄올으로 세척 공장 표면 변경 하 고 권장 하지 않습니다.
- 후 물 세척 세균의 중요 한 숫자 남아, 희석된 액체 손 비누 식물 치료 또는 희석 과산화 수소 (0.01%)를 제거 하거나 미생물을 죽 일 경우. 이것은 일반적으로 더 적은 보다 표 백제 또는 에탄올 공장에 손상.
- 공장 설비 재료는 현지 시장에서 구입은 오염을 제거 하기 어려운, 보관 대상이 되었다고 표시 되지 않는 재료를 선택 합니다. 갈색 또는 손상 된 표시 재료의 부분을 하지 마십시오.
- 물으로 세척 하 고 신선한 삭감 이전 잘라 왔다, 그것을 사용 하기 전에 컷된 사이트에 축적해와 박테리아 (진핵생물) 테스트 박테리아의 상호 작용의 관심 하지 않는 자료의 끝에. 그들은 식물 표면 변경으로 표 백제 또는 에탄올 씻지 않습니다.
- 상처 사이트를 처리 합니다. 상처 사이트 종종 박테리아 식물 소재18의 내부에 대 한 액세스를 제공합니다.
- 차단 또는 상처 또는 녹 인된 파라핀에 잘라 가장자리를 찍기 사이트 작은 브러시를 사용 하 여 녹 인된 파라핀으로 그림 재료 준비에서 만든 컷된 사이트 통해 운동과, 세균성 부착을 감소 시킨다. 이 조직 손상 될 수 있습니다으로 주걱 또는 어떤 날카로운 구현을 사용 하지 마십시오.
- 인감 줄기 파라핀와 토마토와 같은 과일에 흉터. 일부 박테리아는 파라핀 아래 지역에 수영 것입니다 하지만 그들의 숫자는 일반적으로 작은.
- 만약 상처 사이트에 세균성 항목 관심, 견적 솔루션에 추가 하는 염료의 움직임을 관찰 하 여 물 스트림 또는 보급에 의해 실시 하는 박테리아는 이동할 수 있는 거리입니다. 녹색 형광 단백질 (GFP) 등 형광 단백질 그들로 인코딩 하는 유전자를 도입 하 여 운동 박테리아를 표시 하 고 그들을 추적 단계 6.1.219에서 설명 하는 형광 현미경을 사용 하 여.
3입니다. 박테리아의 준비
- 박테리아를 성장. 사용 조건 박테리아에 가장 가깝게 근접 하는 매체 실험실 외부 현실 세계에서 식물 발생 직전에 노출 되었을 가능성이 있다. 탄소와 질소 이온의 존재 뿐만 아니라 특히 divalent 양이온 (Ca, Mg, Fe, Mn, 및 Zn)과 인산 염, 그리고 매체의 pH는 중요 한 소스입니다.
- A. tumefaciens 및 다른 토양 박테리아20에 대 한 최소한의 AB 매체 또는 Luria 국물을 사용 합니다. 대장균, 있는 용기에, Luria 국물을 사용 하 여 수 있습니다.
- 21중간 루트 exudates 같은 inducers 또는 soytone 같은 상용 식물 추출 물, 자당 등 xylose 설탕을 추가 합니다. 이러한 물질 inducers로 사용 하는 경우 낮은 농도 0.01% 예를 추가 합니다. 만약 그들이 사용된 탄소 소스, 높은 농도, 예를 들어 0.1% 추가.
- 세균성 inoculum을 준비 합니다. 희석 박테리아 살 균 물 또는 매체는 보육 실시 됩니다 및 공장 설비 재료에 추가 합니다. 적절 한 희석 단계 4.2와 4.3에에서 설명 되어 있습니다.
- 박테리아를 사용 하기 전에 성장 매체를 제거 하려면 10000 x g 2 분에 세균 현 탁 액을 원심, 부는 상쾌한 어 하 고 vortexing에 의해 박테리아를 resuspend 공장 설비 재료를 가진 외피에 사용 될 것입니다 동일한 매체에 그들. 이 방법은 수 있습니다 제거 하거나 수 또는 세포 외 물질 및 exopolysaccharides, 캡슐, flagellae, 피리 등 부속을 감소 합니다. 이러한 표면 구조 그대로 유지 중요 한 경우 단순히 박테리아 그들을 접종 전에 희석 하 하거나 단계 3.2.2에서에서 설명 하는 대체 방법을 사용 합니다.
- 성장 매체를 제거 하는 다른 방법으로 기 공 크기가 0.2 µ m 이하의 니트로 또는 폴 리 카보 네이트 필터에 박테리아를 수집 합니다. 인큐베이션 매체와 박테리아를 세척 하 고 부드러운 떨고 또는 매체의 멸 균 용기에 필터의 vortexing resuspend.
4입니다. 박테리아의 접종
- 세균성 접착을 결정 하는 데 사용할 측정에 관하여 주사 하는 박테리아의 수 및 보육 시간의 길이 결정 합니다.
- 1 일 미만의 시간 보육 관련 된 현미경 연구에 대 한 박테리아의 비교적 큰 숫자를 예방. ML 당 10 이상6 박테리아의 최종 세균 농도 도달 하는 문화에의 한 금액을 추가 합니다. 더 이상 보육 시간에 대 한 세균 inoculum 크기를 줄입니다.
- 연구는 세균성 접착 가능한 셀 수에 의해 측정 됩니다 추가 문화 10의 최종 세균 농도 도달 하는 양의3 mL 당 106 박테리아.
- 많은 박테리아는 그들의 물질 대사 변경 인큐베이션 매체의 pH 또는 산소 농도 추가 하지 마십시오. PH 전극 또는 pH 종이 사용 하 여 측정 합니다. 산소 농도 산소 전극을 사용 하 여 측정 합니다.
- 모래에서 재배 하는 식물에 대 한 세 가지 가능한 방법으로 예방.
- ML 당 약 106 박테리아의 물에 서 스 펜 션에 1 분 동안 씨앗을 몸을 담글 하 여 심기 전에 박테리아와 씨앗을 예방.
- 설명 된 대로 제 1과 경종 루트 길이 약 1 m 그것을 찍기 또는 1 분 동안 물에 mL 당 106 박테리아의 정지에 전체 종묘를 배치 axenic 묘 출 아에 의해 루트를 예방.
- ML 당 106 박테리아의 서 스 펜 션 모 종 심기 후 급수 또는 mL 당 약 103 박테리아의 최종 농도 주고 심기 전에 모래와 박테리아를 혼합 하 여 모래를 예방.
5. 식물 재료와 박테리아의 외피
- 액체에 부 화, 대 한 살 균 물 또는 자당 및 무기물 소금에서 공장 설비 재료와 박테리아를 품 어 또는 식물 조직 배양 (1시 10분 등 MS 염의 희석)22,23.
- 사용 하 여 컨테이너를 박테리아를 준수 하지 않습니다. 식물 표면 유지 하려고 지속적으로 덮여 침수 또는 부드러운 동요. 활기찬 동요 접착을 방지 수 있습니다 하거나 심지어 식물 표면에서 박테리아를 제거 합니다.
- 변화는 부 화를 중지 하 고 측정을 결정 하는 시간 간격 후 가벼운 현미경에서 공장 설비 재료를 관찰 합니다. 접착의 시간 과정은 종종 모든 1 ~ 4 h 또는 상호 작용의 속도 따라 매일 찍은 샘플 귀중 한.
- 모래에서 품 어, 인큐베이션 단계 5.1에서에서 액체 매체에 대 한 설명 같은 고려 사항을 적용 합니다.
6입니다. 현미경을 사용 하 여 접착의 측정
- 표면에 박테리아의 쉬운 보기를 위한 Nomarski 또는 단계 대조 광학 현미경 측정을 확인 합니다. 그러나, 어떤 밝은 분야 현미경 20 배 이상 확대와 함께 사용할 수 있습니다.
- 현미경 관찰을 사용 하 여 박테리아는 무작위로 배포 또는 특정 사이트에 있는. 또한 단독으로 또는 클러스터에 바인딩되어 있는지 여부를 확인 합니다. 세균성 성장 또는 접착 후 함정을 제안 하는 microcolonies의 존재에 대 한 보세요. 박테리아는 표면에는 biofilm을 형성 것 여부를 확인 합니다.
참고: A biofilm 박테리아 표면에 고 기질23,,2425에 의해 포위의 큰 수입니다. 구조는 부드럽고 균일 한 수 또는 더 복잡 한 구조를가지고 있습니다. Biofilms 식물 표면와 관련 된 공부 방법 설명된17되었습니다. - 박테리아는 형광 표시와 함께 태그를 사용 합니다. 다른 박테리아는 존재 하는 경우 관심의 박테리아 같은 녹색 형광 성 단백질 형광 태그에 의해 식별 됩니다 형광 현미경 검사 법을 사용 하 여 다른 박테리아26의 클러스터 태그 박테리아의 존재를 확인. GFP, 490 nm 여기와 520 nm 방출 필터를 사용 합니다.
- 형광 태그는 없습니다 저하 박테리아 준수 야생 타입 박테리아와 Nomarski와 형광 광학을 사용 하 여 동일한 긴장의 태그 박테리아의 동등한 혼합물의 axenic 자료를 관찰 하 여 확인 하십시오. 형광과 어두운 박테리아가 임의로 혼합 하 고 동등한 숫자에 태그 분석 결과와 방해 하지 않았다.
- 현미경 관찰을 사용 하 여 박테리아는 무작위로 배포 또는 특정 사이트에 있는. 또한 단독으로 또는 클러스터에 바인딩되어 있는지 여부를 확인 합니다. 세균성 성장 또는 접착 후 함정을 제안 하는 microcolonies의 존재에 대 한 보세요. 박테리아는 표면에는 biofilm을 형성 것 여부를 확인 합니다.
- 연결 된 박테리아의 수를 결정 합니다.
참고: 현미경에 부착 된 박테리아의 수를 결정 하는 데 매우 어렵다입니다. 바인딩을 불규칙 한 식물 표면에 때, 그것 아니다 일반적으로 양적 측정을 얻을 수 없습니다. 이러한 측정 스캐닝 전자 현미경 검사 법 (이 문서에서 설명 하지)을 사용할 수 있습니다.- 박테리아는 루트 머리 같은 매끄러운 표면에 바인딩되면 mm 루트 머리 길이 당 루트 머리의 가장자리에 바인딩된 박테리아의 수를 계산. 대략 같은 크기와 모양에 비교 하는 측정의 루트 머리카락을 사용 하는 것을 주의.
- 현미경에 있는 개체의 크기를 결정 하려면 그것에 측정된 표시와 상업 슬라이드를 사용 합니다. 관찰 하 고 실험 자료에 대 한 사용으로 동일한 설정에서이 슬라이드 사진을 사용 하 여 결과 이미지는 photomicrographs에 개체의 크기를 결정.
- 현미경 검사 법에 대 한 샘플을 준비 합니다.
- 샘플을 씻으십시오. 현미경 슬라이드에 물 또는 인큐베이션 매체의 드롭 샘플을 이동 하 고 그것을 직접 관찰.
참고:이 장점이 있다면 세균 성장 또는 실제 세균 죽음 거기 없는지 많은 무료 박테리아가 될 가능성이 있습니다. 경고 표시는 되었을 수도 있습니다 세균 죽음 또는 세균성 바인딩 컨테이너는 외피 밖으로 실시 됐다에 무료 박테리아의 부재를 가져가 라. 샘플을 세척의 효과 그림 1에 표시 됩니다. - 워시 샘플 부드럽게 물 또는 인큐베이션 매체에서 액체의 유리병에 그것을 배치 하 고 부드럽게 유리병을 반전 하 여. 다음 관찰에 대 한 신선한 액체 현미경 슬라이드에 샘플을 놓습니다.
- 액체는 일반 커버 슬립과 현미경 슬라이드를 사용 하 여 샘플을 탑재 합니다.
- 샘플은 두꺼운와 커버 슬립 아래 돌출 할 것 이다 press-apply 커버 슬립을 사용 합니다. 이러한 덮개 미 끄 러 짐 반지 고무 또는 플라스틱 커버 슬립의 가장자리의 주위에의 있다. 액체와 샘플에 커버 슬립에 잘 고 슬라이드 상단에 배치 놓고 부드럽게 눌러 커버 슬립 슬라이드에 밀봉을 합니다. 반전 하 고 검사 하십시오.
- 또는 비슷한 방식으로 슬라이드와 커버 슬립을 계산 하는 조류를 사용 합니다. 이 깊이와 슬라이드는 일반적으로 20 배 확대 보다 큰 대물 렌즈와 검사 수 없습니다.
- 샘플을 씻으십시오. 현미경 슬라이드에 물 또는 인큐베이션 매체의 드롭 샘플을 이동 하 고 그것을 직접 관찰.

그림 1 : 바운드 박테리아의 수를 결정 하기 위한 샘플의 준비 단계. A. tumefaciens 바인딩 토마토 루트 머리카락 (A, B 및 C) 및 나일론 스레드 (D, E 및 F). 샘플 없이 박테리아 (검은 화살표) 고 무료 박테리아 (흰색 화살표)를 볼 수 있다 둘 다 세척 물에 탑재 (A와 D). 세척 후 바운드 박테리아 남지만 무료 박테리아가 더 이상 현재 (B와 E). 쥡니다 후 바운드 박테리아 (C와 F) 샘플 표면에서 제거 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 모래를 제거한 후 형광 박테리아를 사용 하는 경우는 현미경에 샘플을 검사 합니다. 모래에서 재배 하는 식물의 뿌리는 일반적으로 하지 적합 현미경 모래 입자는 박테리아의 관찰을 방해 합니다.
- 7 단계에 따라 성장 컨테이너에서 식물을 제거 합니다. 물 컨테이너에 뿌리를 놓고 부드럽게 컨테이너의 하단에 정착 됩니다 모래 제거를 혼합 합니다.
- 세척 물에서 식물을 제거 하 고 단계 6.3.3에서 샘플을 탑재.
7. 측정 가능한 셀을 사용 하 여 접착의 계산
- sonicator를 사용 하 여 가능한 연결 된 박테리아의 수를 결정 합니다.
- 언바운드 박테리아를 제거 합니다. 충분 한 물, 식물 재료를 커버 하 고 반전 유리병 여러 번 버퍼 또는 외피 중간 세척 한 유리병에 샘플을 놓습니다.
- 초기 보육에 mL 당 10 이상3 무료 박테리아 있었다면 그들 모두 제거 하려면 순차 빨 래를 수행 합니다. 가벼운 현미경에서 검사 (단계 6.3 참조) 무료 박테리아의 존재를 확인.
- 무료 박테리아의 수에 있는 상당한 감소 될 때까지 씻어 하지만 바운드 및 언바운드 박테리아 무료 박테리아의 수는 0에 결코 저하 될 수 있습니다 그래서 사이 균형은.
- 집게 또는 주걱 세척액의 유리병에서 샘플을 제거 합니다.
- 액체에 있는 식물의 외피에 바인딩된 박테리아의 수를 결정 합니다.
- 유리병에 세척된 샘플을 일시 중단 하 고 물, 인큐베이션 매체, 또는 세척 버퍼의 측정된 볼륨으로 커버. 충분 한 액체를 사용 하 여 샘플을 커버. 목욕 sonicator에 유리병을 놓고 1 분 동안 그것을 sonicate.
- 샘플을 제거 하 고 공장에서 바운드 박테리아 제거 되었습니다 여부를 결정 하 가벼운 현미경 검사. 쥡니다에 의해 샘플에서 박테리아의 제거는 그림 1에 표시 됩니다. 경우 여전히 바운드 박테리아 존재 같은 박테리아 없음 바인딩된 샘플 표면에 남아 있는 시간까지 샘플 sonicating 계속. 바운드 박테리아 쥡니다에 의해 제거할 수 없습니다, 1-10 mg/mL의 멸 균 석 영 모래를 추가 하 고 쥡니다 현미경 검사를 반복.
- 가장 효과적인 단계 7.1.3.2에서에서 나타나는 쥡니다 절차 쥡니다 사용할 솔루션에 액체 문화에서 박테리아를 일시 중단 하 여 박테리아의 생존 능력을 감소 하지 않습니다 확인 (석 영 모래, 그것은 필요한 경우 추가). 실행 가능한 세포 수를 결정 합니다. 박테리아를 sonicate 고 다시 실행 가능한 세포 수를 결정 합니다.
참고: 경우에 실행 가능한 세포 수 감소, 치료 가능한 세포 수에 영향을 주지 않습니다 때까지 액체 또는 쥡니다 시간 구성을 변경 하 여 절차를 수정 합니다. - 확인 가능한 셀 카운트에 사용 되는 희석 버퍼 다른 희석 버퍼 또는 물 사용 하 여 가능한 셀 개수를 비교 하 여 사용 하는 조건 하에서 incubated 박테리아의 생존에는 영향을 미치지 않습니다.
- 언바운드 박테리아를 제거 합니다. 충분 한 물, 식물 재료를 커버 하 고 반전 유리병 여러 번 버퍼 또는 외피 중간 세척 한 유리병에 샘플을 놓습니다.
- 균질을 사용 하 여 가능한 연결 된 박테리아의 수를 결정 합니다.
- 살 균 박격포 또는 믹서 기 또는 다른 균질 장치에서 샘플을 놓습니다. 메 마른 물, 인큐베이션 매체, 또는 버퍼27세척의 측정 볼륨 커버. 샘플을 커버 하기에 충분 한 볼륨을 사용 합니다. 믹서 기에 대 한 100 mL를 사용 합니다.
- 잘 무 균 때까지 샘플을 갈기. 균질 확실 하 게 그 산 식물 조직에서 발표 하지 pH 7에 날카로운 드롭이 발생 했습니다 후 pH를 확인 하십시오. PH는 감소 하는 경우 pH를 유지 하기 위해 균질 액체에서 인산 염 버퍼 같은 버퍼를 사용 합니다.
- 실행 가능한 세포 수를 결정 합니다.
- 박테리아 항 생 저항으로 표시를 사용 합니다.
- 하나 이상의 유형의 박테리아가 있는 상황에서 세균성 긴장 (일반적으로 리 팜 피신 및 nalidixic 산) 항생제에 자연 저항을 사용 하 여 표시 합니다.
- 사용 하는 항생제의 수준을 결정 합니다. 다른 유기 체는 외피에 있을 것으로 예상의 문화를 사용할 수 있는 경우 이러한 문화 항생제 선택의 농도 범위를 포함 하는 접시에 식물을 가진 의도 외피의 조건 하에서 성장 플레이트. 이러한 생물의 성장을 허용 하지 않는 최저 농도 결정 합니다. 이는 테스트 박테리아 필요가 있을 것 이다 저항 하는 항생제의 가장 낮은 농도 이다.
- 자연 항생제 내성 돌연변이 얻을. 늦은 로그 또는 고정 단계에 풍부한 매체에 박테리아의 문화를 성장. 플레이트는 적절 한 농도에서 원하는 항생제를 포함 하는 접시에 undiluted 0.1 mL. 7.3.1.1 단계에 설명 된 대로 사용 하 여 농도 결정 합니다. 유지 하 고 성장 하 고 따라서 항생제에 저항력이 있는 박테리아를 정화.
- 항생제 내성의 부모 및 항생제 내성 변종 액체 매체에서 성장 곡선을 수행 하 여 박테리아의 성장을 감소 하지 않습니다 확인 합니다. 확인이 가능 하다 면 항생제 내성 박테리아 부모 긴장으로 axenic 식물의 식민의 동일한 수준을 표시 합니다.
- 하나 이상의 유형의 박테리아가 있는 상황에서 세균성 긴장 (일반적으로 리 팜 피신 및 nalidixic 산) 항생제에 자연 저항을 사용 하 여 표시 합니다.
- 모래에서 성장 된 식물에 바인딩된 실행 가능한 박테리아의 수를 결정 합니다.
- 컨테이너와 모래에서 식물을 제거 합니다. 컨테이너에서 식물을 제거 하려면 먼저 컨테이너의 위아래에 씰링 재료를 제거 합니다. 메 마른 종이 위에 컨테이너를 놓고 부드럽게 제거 전체 모래 또는 토양 및 식물 하나의 큰 테이퍼 실린더 부드럽게 완화 소재 표면에 대 한 컨테이너를 노크 하 여.
- 필요한 경우, 컨테이너의 하단 겪고 가장자리 자료를 풀고 주걱 이나 막대를 사용 합니다.
- 모래 또는 토양 식물을 포함 하는 실린더는 종이에 무료 이면 공장 루트 공개 중간 아래로 분할. 원하는 경우, 루트 근처 뿐만 아니라 컨테이너의 가장자리 근처에서 모래의 샘플을 가져가 라. 이 확산 (및 축적 및 결정 성장) 박테리아의 유용할 수 있습니다.
- 루트의 길이 측정 합니다. 루트를 선택 하 고 모래와 물 또는 버퍼의 측정된 볼륨에 루트 찍기와 부드럽게 흔들어 루트 (rhizosphere 소재)에 느슨하게 고착 하는 박테리아를 제거. Luria agar와 같은 적합 한 매체에 도금 하 여 결과 현 탁 액에 있는 박테리아의 가능한 셀 수를 결정 합니다. 이 루트와 느슨하게 관련 된 박테리아의 수를 나타냅니다.
- 컨테이너와 모래에서 식물을 제거 합니다. 컨테이너에서 식물을 제거 하려면 먼저 컨테이너의 위아래에 씰링 재료를 제거 합니다. 메 마른 종이 위에 컨테이너를 놓고 부드럽게 제거 전체 모래 또는 토양 및 식물 하나의 큰 테이퍼 실린더 부드럽게 완화 소재 표면에 대 한 컨테이너를 노크 하 여.
- 쥡니다에 의해 엄격 하 게 바인딩된 박테리아를 제거 하 고 7.1 단계에 설명 된 대로 그들의 숫자를 결정 합니다.
- 또는, 결정을 엄격 하 게 바인딩된 박테리아의 루트에 위치 영양 한 천 또는 다른 적합 한 매체를 포함 하는 배양 접시의 표면에 씻어 루트를 놓습니다. 해 현미경 또는 확대경을 사용 하 여 앞으로 3 일 동안 루트에 세균성 식민지의 위치를 확인 합니다.
- 식물 당, c m2 의 면적, cm 루트 길이, 당 또는 조직의 그램 신선한 무게 박테리아의 수와 결과 표현 한다. 같은 날에 여러 복제 하 고 복제 다른 세균성 문화 및 다른 많은 식물 재료를 사용 하 여 다른 일에 할.
8. 박테리아 나 식물의 반응으로 인해 접착에 부 화 조건의 영향 인지 결정
- 죽 었 거 나 죽은 공장 설비 재료를 사용 합니다.
- 그것을 죽이기 위하여 다양 한 화학 물질, fixatives, 또는 다른 치료 열과 같은 소재 식물을 주제. 워시 공장 설비 재료 철저 하 게 물과 인큐베이션 매체에서 이러한 치료의 사용 후. 다음 박테리아를 예방. 이 식물 표면 파괴 하지 않습니다 하지만 그것은 만들 것입니다 그것은 metabolically 비활성 박테리아에 응답 하지 않을 수 있도록.
- 6 및 7 단계에서 설명한 대로 세균성 접착을 측정 합니다. 또한는 인큐베이션 및 실행 가능한 세포 독성 화학 제품 없이 인큐베이션 기간 동안 참석 했다 되도록 외피의 끝에 존재의 수의 시작 부분에 식물 소재 보육에 추가 가능한 셀의 수를 결정 합니다.
- 무생물 재료를 사용 합니다.
- 나무 재질에 세균성 부착에 본 효과 확인을 무생물 재료 사용 세균성 준수는 식물이 나 박테리아에 영향 때문 이다. 박테리아가 바인딩할 활기 소재를 선택 하 고 비슷한 모양과 크기에서 공부 하는 공장 설비 재료. 가능성 등의 모든 종류 (셀 루 로스, 니트로, 유리 섬유, 폴 리 카보 네이트, 등.), 스레드 (나일론, 면, 폴 리 에스테, 유리 솜, 등), 유리 또는 플라스틱 coverslips, 스테인리스 쿠폰 및 투 석 필터 종이 막입니다.
- 워시 물과 매체는 보육 실시 됩니다 및 사용 하기 전에 소독에 철저 하 게 무생물 물자. 8.2.1 단계에 나열 된 자료의 대부분은 압력가 마로 소독 하 여 살 균을 안정.
- 원하는 조건과 점수 6-7 단계에 설명 된 대로에서 무생물 물자를 품 어. 높은 칼슘 농도에서 루트 머리카락 A. tumefaciens 의 감소 된 바인딩 예정 이다 확인을 나일론 스레드 사용의 예 (적어도 부분) 박테리아에 칼슘의 영향을 그림 428에 표시 됩니다.
결과
A. tumefaciens colonizes 루트 표면. 셀 루 로스 종합을 방지 하는 세균성 돌연변이의 효과 했다 셀 루 로스의 세균 생산 루트 식민에 역할 여부를 결정 하기 위해16을 검사 합니다. 1.3과 7.1 단계에 설명 된 기술은 사용 했다. 토마토 종자 표면 소독 및 살 균 물에서 출 아 했다 했다. 뿌리 길이 약 2 m 때 그들은 mL 당 105 박테리아의 현 탁 액에 담근 고 용기에 저온 살 균된 토양에 심어. 식물 빛/12 h 12 h 어두운 사이클에 25 ° C에서 14 일 동안 성장 했다. 식물 번 표시 된 후 컨테이너에서 제거 되었습니다. 뿌리를 씻어 고 바인딩된 박테리아를 제거 하는 목욕 sonicator에서 sonicated. 세균 숫자는 가능한 셀 수를 사용 하 여 결정 했다. 그림 2 는 토마토 뿌리를 식민지 화 하는 박테리아의 기능에 두 개의 다른 셀 룰 로스-마이너스 돌연변이의 효과 보여준다. 일부 측정의 표준 편차는 0.9 로그10 (측정의이 유형의 일반적인 문제) 높은 셀 룰 로스-마이너스 돌연변이의 바인딩 감소 명확 하 게 분명 하 고 우리가 결론 지을 수의 세균 생산 셀 루 로스는 토마토 뿌리의 식민지에서 박테리아를 에이즈.
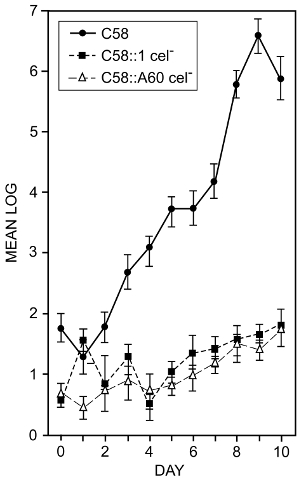
그림 2 : 야생 유형 및 A. tumefaciens의 셀 룰 로스-마이너스 돌연변이 의해 식민 뿌리. 로그10 cm 루트 길이 토마토 뿌리에서 발견 한 박테리아의 총 수는 야생 타입 A. tumefaciens 스트레인 C58와 셀 루 로스-마이너스 돌연변이 C58:1와 C58:A60 주사. 표시 된 숫자는 최소 4 개의 별도 실험에서에서 수단. 막대의 표준 편차를 나타냅니다. 뿌리는 한 분 mL 당 105 박테리아의 정지에서 그들을 담거 서 주사 했다. 용기에 식물 재배 하 고 느슨하게 부착 박테리아 세척 유리 유리병에 버퍼에서 뿌리를 세척 하 여 제거 되었습니다. 단단히 부착 박테리아 목욕 sonicator 가능한 셀 계산16결정 하 도금 결과 현 탁 액을 사용 하 여 제거 되었습니다. 이 그림은 Matthysse와 McMahan에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
알 팔 파 콩나물을 다른 박테리아와 대장균 의 바인딩에서 exopolysaccharides의 역할은 시험 되었다. 대장균 O157:H7에의 한 설사 질병의 몇몇 발발 오염 된 알 팔 파 콩나물을 추적 했습니다. 야생-타입 박테리아와 다양 한 exopolysaccharides를 만들 수 없습니다 돌연변이의 바인딩 1.1, 5.1, 7.2 단계에 설명 된 방법을 사용 하 여 측정 했다. 알 팔 파 콩나물 표면 소독 하 고 어둠 속에서 25 ° C에서 살 균 물에 하루 동안 출 아 했다 했다. 연결 된 씨 외 투를 가진 4 개의 콩나물 무 균 플라스틱 요리 물 5 mL에에서 배치 했다. Luria 국물에서 성장 하는 박테리아는3 mL 당 약 5 x 10의 최종 농도에 추가 되었습니다. 접종된 콩나물 3 일 동안 어둠 속에서 25 ° C에서 인 큐베이 팅 했다. 콩나물 활발 한 전도 된 유리병에 메 마른 물 5 mL에 두 번 씻어 고는 모터 구동 테 플 론 유리 균질 화기를 사용 하 여 버퍼를 세척에 무 균. 박테리아를 사용 하 여 이전 실험 표면 박테리아는 쉽게 관찰 되었다 비록 아무 내 면된 박테리아를 보여주었다 GFP 유전자를 운반 하는 플라스 미드로 표시. 결과 표 1에 표시 됩니다. E. 콜라이 O157:H7의 2 개의 긴장 시험 되었다. 모두 긴장에서 폴 리-β-1, 6-glucuronic acid(PGA)의 생산 표면 식물 병원 성 대장균 의 바인딩에 가장 큰 기여를 할 것 처럼 보였다. 장 산도 바인딩에서 중요 한 역할을 했다. 바인딩 셀 룰 로스-마이너스 돌연변이에 감소는 중요 한 하는 동안 다른 두 류 대는 큰 했다.
| 콩나물과 오픈 시드 코트에 바인딩의 E. 대장균 O157:H7에 Exopolysaccharide 생산 유전자에 있는 돌연변이의 효과 | |||
| 세균성 긴장 | 돌연변이 또는 유전자 (관련 형) | 박테리아의 로그10 수 새싹 또는 씨 외 투 바운드 | |
| 알 팔 파 콩나물b | 오픈 씨 코트 | ||
| 86-24 | 없음 (야생 타입) | 4.7 ± 0.6 | 5.6 ± 0.2 |
| 8624N | yhjN (셀 루 로스-빼기) | 2.9 ± 0.7c | 3.5 ± 0.6c |
| 8624 C | wcaD (저 승 산 마이너스) | 1.8 ± 0.7c | 2.4 ± 0.5c |
| 8624 P | pgaC (PGA-빼기) | < 1.0c | 1.0 ± 1.0c |
| DEC4A | 없음 (야생 타입) | 5.6 ± 0.2 | 6.1 ± 0.3 |
| DEC4AN | yhjN (셀 루 로스-빼기) | 4.8 ± 0.8d | 4.1 ± 0.8d |
| DEC4AC | wcaD (저 승 산 마이너스) | 3.9 ± 0.5c | 4.8 ± 0.8d |
| DEC4AP | pgaC (PGA-빼기) | < 1.0c | 1.2 ± 0.7c |
| 최소 3 일 후에 행 하는 박테리아의 수 (로그10)의 3 측정의 평균 ± 표준 편차입니다. | |||
| b 콩나물 측정 하기 전에 세척 했다. | |||
| 크게 다른 야생 타입 c: P < 0.01. | |||
| 크게 다른 야생 타입 d: P < 0.05. | |||
| 이 테이블은 Matthysse, Deora, Mishra, 그리고 토레스10에서 수정 되었습니다. | |||
표 1:의 바인딩에 exopolysaccharide 생산 유전자에 있는 돌연변이의 효과 대장균 을 O157:H7 콩나물. 다양 한 exopolysaccharides 및 병원 성의 바인딩에 lipopolysaccharide의 역할을 결정 하기 위하여 대장균 O157:H7 긴장을 알 팔 파 새싹, 콩나물과 오픈 시드 코트에 돌연변이의 세트의 바인딩 메서드를 사용 하 여 조사 되었다 6 단계에서 설명합니다. 결과 보여 그 폴 리-ß-1, 6-N-아 세 틸-D-글루코사민 (PGA) 콩나물에 대 한 바인딩을 위한 필수적인 것으로 나타나고 그 셀 룰 로스 및 colanic 산이 대장균 O157의 최대 바인딩 필요. 이 테이블은 Matthysse, Deora, Mishra, 그리고 토레스10에서 수정 되었습니다.
PGA의 생산 공장 표면, 인코딩 PGA에 필요한 유전자 복제 오 페론을 들고 플라스 미드 (pMM11) 세균성 바인딩 되도록 충분 한 지 확인 하기 위해 생산 하지 것이 두 개의 서로 다른 박테리아에 도입 되었다 일반적으로 토마토 뿌리10에 바인딩할 수 있습니다. A. tumefaciens A1045은 야생 타입 스트레인 C58 순환-β-1, 2 글 루 칸을 만드는 데 실패 하 고 또한 표면29공장에 바인딩할 실패의 돌연변이. Sinorhizobium meliloti 파에 뿌리 혹을 형성 하는 1021 비 콩에 바인딩하지 못합니다 토마토12를 포함 하 여. 1.1, 5.1, 6.3, 및 7.1 단계에 설명 된 기술은 일반적으로 PGA 하 루트 표면에 세균성 바인딩 증가 결정 하 사용 되었다. 토마토 종자 표면 소독 및 살 균 물에서 출 아 했다 했다. 뿌리 했다 세그먼트 길이 1cm로 잘라 하 고 메 마른 물에 박테리아를 주사 했다. 이 두 종의 박테리아를 서로 다른 속도로 성장, 바인딩 세균 성장의 대략 동일한 금액에 대 한 수 있도록 다른 시간에 측정 했다. 플라스 미드 pMM11의 존재는 두 종 (표 2)10의 바운드 박테리아의 수에서 비슷한 크게 증가 발생합니다. 바인딩 크게 증가 가벼운 현미경에 또한 보였다 하지만 바인딩 두 종 (그림 3)에 대 한 매우 달랐다. A. tumefaciens A1045 개별 박테리아 루트 표면에 바인딩됩니다. S. meliloti 박테리아의 몇 가지 루트에 직접 연결 된 박테리아의 대다수는 다른 박테리아에 연결 된만 있는 큰 클러스터에 바인딩된. 이 예제는 단순히 현미경 관측을 포함 하지 않고 행 하는 박테리아의 숫자를 분석 그 실험의 결과 대 한 잘못 된 인상을 줄 수를 보여 줍니다. 하지만 두 방법 (가능한 셀 개수와 현미경 관찰) 보여 그 pMM11 증가 토마토 뿌리에 세균성 바인딩, PGA의 생산에 의해 발생 하는 바인딩 형식을 달랐다 두 세균 종10.
| 토마토 뿌리에 바인딩의 박테리아에 플라스 미드 pMM11의 효과 | ||
| 세균성 긴장 | 플라스 미드 | 박테리아의 수 mm 루트 길이 당 바인딩 |
| A. tumefaciens A1045는는 | 없음 | 103 ± 0.25 x 103 x 0.25 |
| pBBR1mcs (벡터) | 103 ± 0.25 x 103 x 0.25 | |
| pMM11 (PGA 합성) | 10 x 103 ± 0.25 x 103 | |
| S. meliloti 1021b | 없음 | 감지 없음 |
| pBBR1mcs (벡터) | 감지 없음 | |
| pMM11 (PGA 합성) | 50 x 103 ± 5 x 103 | |
| 세균성 바인딩 2 시간 후에 측정 되었다 | ||
| b 세균성 바인딩 18 시간 후에 측정 했다 | ||
| 이 테이블은 Matthysse, Deora, Mishra, 그리고 토레스10에서 수정 되었습니다. | ||
표 2:의 바인딩을에 PGA의 합성에 대 한 유전자를 운반 하는 플라스 미드의 효과 A. tumefaciens A1045 및 S. meliloti 토마토 루트 세그먼트 1021. 폴 리-ß-1, 6-의 능력을 시험 하기 위하여N-아 세 틸-D-글루코사민 (PGA) 공장 박테리아의 바인딩을 촉진 뿌리, 식물 관련 된 박테리아의 2 개의 긴장의 바인딩에 PGA (pMM11)을 만들 수 있는 능력을 부여 하는 플라스 미드의 효과 토마토 뿌리는 시험 되었다. 어느 긴장 박테리아의 유전자 PGA 합성 (pBBR1mcs)을 인코딩 없이 플라스 미드 플라스 미드의 존재 또는 부재에 토마토 뿌리에 중요 한 바인딩을 보여주었다. PGA 합성 유전자를 운반 하는 플라스 미드의 추가 바인딩 두 가지 유형의 박테리아에 의해 증가 했다. 때문에 A. tumefaciens S. meliloti 바인딩 S. meliloti에 대 한 18 h 그리고 A. tumefaciens 에 대 한 보육의 2 시간 후 측정 되었다 보다는 빨리 성장 한다. 7 단계에서 사용 된 기술은 그 기술 된다. 이 테이블은 Matthysse, Deora, Mishra, 그리고 토레스10에서 수정 되었습니다.
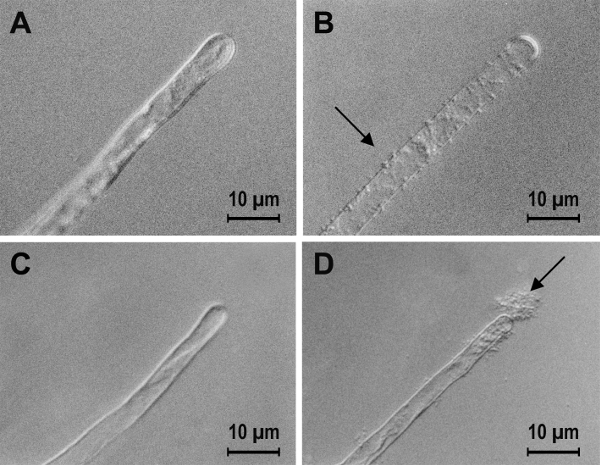
그림 3 : A. tumefaciens A1045 바인딩과 S. meliloti 1021 토마토 루트 머리카락에 PGA 생 합성 유전자를 운반 하는 플라스 미드 pMM11의 효과. A의 토마토 루트 머리카락 바인딩) A. tumefaciens A1045, B) A. tumefaciens A1045 pMM11, C) S. meliloti 1021, 및 D) S. meliloti 1021 pMM11. 비록 2 개의 세균성 종의 바인딩 증가 대략 비슷합니다 가벼운 현미경에서 보듯이 바인딩 세부 매우 다르다. 6 단계에서 사용 된 기술은 그 기술 된다. 이 그림은 Matthysse, Deora, Mishra, 그리고 토레스10에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
그것은 때로는 생물학적 인 표면에 바인딩을 사용 하 여 박테리아의 특정 상호 작용에 식물의 기여를 구별에 도움이 수 있습니다. A. tumefaciens 의 유 니 폴라 polysaccharide(UPP) 두 생물과 비 생물 표면30의 다양 한 세균성 바인딩 중재 수 표시 되었습니다. 칼슘은 식물 표면 UPP28에 의해 중재 A. tumefaciens 바인딩을 억제 하 관찰 되었다. 식물의 표면에 세균 바인딩의 칼슘 이온에 의해 저해 박테리아 나 식물 표면 효과 때문 인지를 파악 하기 위해 나일론 스레드를 박테리아의 바인딩 시험 되었다. 단계에서 설명 하는 기술을 8.2 사용 되었다. 토마토 종자 표면 소독 하 고 물 1 단계에 설명 된 대로에 출 아 했다 했다. 박테리아 자당과 최소한의 매체에서 성장 하 고 토마토 뿌리 또는 약 105/mL의 최종 농도에 나일론 스레드 5.1 단계에서 설명한 대로 추가 되었다. 에 세균에 바인딩 토마토 뿌리 및 나일론 스레드 추가 CaCl2 의 효과 현미경에서 시험 되었다. 그림 4 는 칼슘 중 표면 제안 칼슘의 효과 주로 박테리아10을 사용 하 여 바인딩의 유사한 금지를 보여준다.

그림 4 : 토마토 루트 머리카락과 나일론 스레드 A. tumefaciens 의 바인딩에 칼슘의 효과. 1시 10분에서 토마토 뿌리 (A와 B) 또는 24 h에 대 한 나일론 스레드 (C 및 D) A. tumefaciens 를 incubated MS 염과 1시 20분의 희석 AB 최소한의 매체, 0.4% 자당 (A와 C) 또는 1:10에서 희석 MS 염과 1시 20분의 희석 AB 최소 매체의 희석 포함 하는 60 m m CaCl2 (B와 D)310.4% 자당. 추가 CaCl2 뿌리와 나일론 스레드 억제 보다 식물 표면에 박테리아에 영향 때문에 주로 이었다 제안 모두에 세균성 바인딩을 저해. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
그것은 모든 실험 기간 동안 박테리아 고착 수 표면에 자각 하는 것이 중요입니다. 따라서 유리에 바인딩 할 수 있다 박테리아 수 있습니다 과소 평가 될 가능한 셀 계산 한다면 유리 튜브와 펫을 사용 하 여. 경우 고 일부는 agar agar 또는 토양 식물 재배 또는 토양 식물에 남아 다음 박테리아 수 있습니다 바인딩 접착 소재 보다는 식물. 다른 한편으로, 식물 표면, 특히 뿌리의 경우 세척을 제거할 수 있습니다 자연 표면 코팅과 같은 점 막 따라서 준수 테스트의 결과 변경.
그것은 외피 혼합물에 추가 하는 박테리아 실험 기간 동안 살아 남아 특정 해야 합니다. 따라서 자유로 연결 된 박테리아의 가능한 셀 카운트 정기적으로 해야 한다. 일부 치료 또는 세균성 돌연변이 세균 성장 속도 감소 또는 실제로 세균성 인구의 일부분의 죽음의 원인이 있습니다. 라이브 하 고 죽은 박테리아 특별 한 얼룩 사용 하지 않으면 현미경에 구별할 수 있습니다. 라이브/죽은 박테리아의 유용한 얼룩 키트 살아있는 박테리아에서 염료의 배제에 달려 있다. 그러나, 세균성 종의 혼합된 인구는 존재 하는 경우 다음의 종의 가능한 셀 수 것입니다는 인큐베이션 세균성 죽음 귀착되 여부를 결정 하는 가장 쉬운 방법.
중간 구성 세균성 생존 및 성장을 좌우할 것 이다. 루트 exudate 및 자료 상처에서 나왔고 사이트 잘라 겸손 세균성 성장을 지원 하기 위해 기판을 제공할 것입니다. 인산 염, 질소, 그리고 철이이 조건에 제한 되 경향이 있다. Divalent 양이온 칼슘, 마그네슘 등 접착에 영향을 미칠 수 있습니다. 어떤 경우에 접착에 영향을 미칠 수 있는 탄소 소스. pH도 중요 하다. 일반적으로 rhizosphere의 pH는 5.5 및 6.5 사이입니다.
그것은 박테리아 항 생 저항으로 표시를 사용 하 여 조심 해야 합니다. 가장 자주 사용 하는 항생제는 리 팜 피신 및 nalidixic 산. 이러한 항생제에 저항 염색체 유전자에 있는 돌연변이 때문에 일반적으로 (RNA 중 합 효소와 gyrase, 각각) 이며 따라서 쉽게 전송할 수 없습니다 다른 긴장에는 부 화 하는 동안. 저항의이 유형은 또한 되지는지 않습니다 저하 또는 항생제의 수정. 플라스 미드 부담 유전자 표시와 함께 표시 하는 박테리아 플라스 미드는 다른 박테리아를 전송할 수 없습니다 않는 한 권장 하지 않습니다. 민감한 박테리아 항생제 내성 박테리아에 인접해 있다면 항생제 접시에 성장 수 다음으로 항생제 내성 때문에 항생제의 저하 또는 화학 수정 되지 않아야 합니다.
이 문서에서 설명 하는 방법은 샘플 (예: 인간 병원 체를 포함 하는 실험) 포함 될 필요가 작은 샘플 크기 및 실험에 대 한 유용 합니다. (위 재료 또는 50 개 이상의 식물의 100 g) 큰 샘플 크기에 대 한 다른 방법 또는이 방법의 과감 한 수정 것입니다 필요10,19,32,,1933, 34 , 35 , 36. 공부 되 고 종 이외의 미생물의 많은 수의 존재는 중요 한 문제를 초래할 수도 있습니다. 가능한 솔루션에는 형광 단백질 또는 항생제 저항 6.1.2-7.3 단계에 설명 된 대로 표시 된 박테리아를 사용 하 여 포함 됩니다. 그러나, 관심의 박테리아는 다른 미생물의 큰 인구에서 드문 개인 때 이러한 마커 공부 되는 박테리아의 수의 명확한 평가 수 있도록 적절 한 않을 수 있습니다.
여기에 설명 된 방법 중 모두 실험실 기반 방법. 작은 수정 온실 연구 필요할 것 이다. 더 많은 주요 수정 원생 동물, 곤충과 다른 동물 포식, 기후 변화 실험에 대 한 정의 된 조건의 규정을 복잡 분야 연구에 필요한 될 가능성이 있습니다. 미래에 이러한 방법은 식물 표면에 두 개 이상의 미생물의 상호 작용을 포함 하도록 확장할 수 있습니다.
공개
저자는 그녀는 아무 경쟁 금융 관심사가 선언 합니다.
감사의 말
저자는 실험의 일부 지원에 대 한 수치와 카밀 마틴과 힐러리 Samagaio의 준비에 대 한 수잔 윗 필드를 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| light microscope | any | N/A | phase contrast or Nomarski optics are helpful, for studies using fluorescent markers a fluorescence microscope is required. |
| seeds | any | N/A | make a note of the seed lot number and the cultivar |
| bleach | any | N/A | |
| bath sonicator | any scientific supply company | N/A | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| nutrient agar | Difco | 001-01-8 | |
| soytone | Difco | 24360 | |
| Sand | sea sand Fisher Scientific | S25 | |
| sand | Sigma-Aldrich | S9887 | |
| conetainers | Stuewe & Sons, Inc. | Ray-Leach cone-tainers | many different sizes are available to suit the type of plant you wish to grow |
| parafilm | any scientific supply company | N/A | |
| MS salts | Sigma-Aldrich | M5524 | |
| parrafin | any | N/A | |
| centrigfuge | any scientific company | N/A | to pellet most bacteri only a small centrifuge with a max force of 10,000 XG is needed |
| vortex mixer | any scientific company | ||
| micrometer | ACCU-SCOPE Accessories | A3145 | |
| Sedgwick-rafter counting cell | Hauser Scientific | HS3800 | |
| probe-clip press-seal incubatin chamber | Sigma-Aldrich | Z359483 | |
| rifampicin | Sigma-Aldrich | R3501 | |
| naladixic acid | Sigma-Aldrich | n8878 | |
| Live/dead stain | In Vitrogen Molecular Bioprobes | L7007 |
참고문헌
- Heaton, J. C., Jones, K. Microbial contamination of fruit and vegetables and the behaviour of enteropathogens in the phyllosphere: a review. J. Appl. Microbiol. 104, 613-626 (2008).
- Beuchat, L. R. Ecological factors influencing survival and growth of human pathogens on raw fruit and vegetables. Microbes Infect. 4, 413-423 (2002).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Lugtenberg, B. J., Chin, A. W. T., Bloemberg, G. V. Microbe-plant interactions: principles and mechanisms. Antonie Van Leeuwenhoek. 81, 373-383 (2002).
- Preston, G. M., Haubold, B., Rainey, P. B. Bacterial genomics and adaptation to life on plants: implications for the evolution of pathogenicity and symbiosis. Curr. Opin. Microbiol. 1, 589-597 (1998).
- Compant, S., Duffy, B., Nowak, J., Clement, C., Barka, E. A. Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects. Appl. Environ. Microbiol. 71, 4951-4959 (2005).
- Mathews, S. L., Smith, R. B., Matthysse, A. G. A comparison of the retention of pathogenic Escherichia coli. O157 by sprouts, leaves and fruits. Microb. Biotechnol. 7, 570-579 (2014).
- Fuqua, C., Matthysse, A. G. Methods for studying bacterial biofilms associated with plants. Methods Enzymol. 337, 3-18 (2001).
- Torres, A. G., Jeter, C., Langley, W., Matthysse, A. G. Differential binding of Escherchia coli.O157:H7 to alfalfa, human epithelial cells, and plastic is mediated by a variety of surface structures. Appl. Environ. Microbiol. 71, 8008-8015 (2005).
- Matthysse, A. G., Deora, R., Mishra, M., Torres, A. G. Polysaccharides cellulose, poly-beta-1,6-n-acetyl-D-glucosamine, and colanic acid are required for optimal binding of Escherichia coli O157:H7 strains to alfalfa sprouts and K-12 strains to plastic but not for binding to epithelial cells. Appl. Environ. Microbiol. 74, 2384-2390 (2008).
- Matthysse, A. G., et al. The effect of cellulose overproduction on binding and biofilm formation on roots by Agrobacterium tumefaciens. Mol. Plant Microbe Interact. 18, 1002-1010 (2005).
- Matthysse, A. G., Kijne, J. W., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. Attachment of Rhizobiaceae to plant cells. The Rhizobiaceae. , 235-249 (1998).
- Matthysse, A. G. Conditioned medium promotes the attachment of Agrobacterium tumefaciens.strain NT1 to carrot cells. Protoplasma. 183, 131-136 (1994).
- Matthysse, A. G., McMahan, S. The effect of the Agrobacterium tumefaciens. attR mutation on attachment and root colonization differs between legumes and other dicots. Appl. Environ. Microbiol. 67, 1070-1075 (2001).
- Jeter, C., Matthysse, A. G. Characterization of the binding of diarrheagenic strains of E. coli.to plant surfaces and the role of curli in the interaction of the bacteria with alfalfa sprouts. Mol. Plant Microbe Interact. 18, 1235-1242 (2005).
- Matthysse, A. G., McMahan, S. Root colonization by Agrobacterium tumefaciens is reduced in cel, attB, attD, and attR mutants. Appl. Environ. Microbiol. 64, 2341-2345 (1998).
- Morton, E. R., Fuqua, C. Phenotypic analyses of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Brandl, M. T. Plant lesions promote the rapid multiplication of Escherichia coli O157:H7 on postharvest lettuce. Appl. Environ. Microbiol. 74, 5285-5289 (2008).
- Franz, E., et al. Quantification of contamination of lettuce by GFP-expressing Escherichia coli O157:H7 and Salmonella enterica serovar Typhimurium. Food Microbiol. 24, 106-112 (2007).
- Morton, E. R., Fuqua, C. Laboratory maintenance of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Lugtenberg, B. J., Kravchenko, L. V., Simons, M. Tomato seed and root exudate sugars: composition, utilization by Pseudomonas biocontrol strains and role in rhizosphere colonization. Environ. Microbiol. 1, 439-446 (1999).
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum. 15, 473-497 (1962).
- Danhorn, T., Fuqua, C. Biofilm formation by plant-associated bacteria. Annu. Rev. Microbiol. 61, 401-422 (2007).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Charkowski, A. O., Barak, J. D., Sarreal, C. Z., Mandrell, R. E. Differences in growth of Salmonella enterica and Escherichia coli O157:H7 on alfalfa sprouts. Appl. Environ. Microbiol. 68, 3114-3120 (2002).
- Loper, J., Suslow, T., Schroth, M. Lognormal distribution of bacterial populations in the rhizosphere. Phytopathology. 74, 1454-1460 (1984).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, 252 (2014).
- Douglas, C. J., Halperin, W., Nester, E. W. Agrobacterium tumefaciens mutants affected in attachment to plant cells. J. Bacteriol. 152, 1265-1275 (1982).
- Tomlinson, A. D., Fuqua, C. Mechanisms and regulation of polar surface attachment in Agrobacterium tumefaciens. Curr. Opin. Microbiol. 12, 708-714 (2009).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, (2014).
- Wright, K. M., et al. The endophytic lifestyle of Escherichia coli O157:H7: quantification and internal localization in roots. Phytopathology. 103, 333-340 (2013).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Erickson, M. C., et al. Internalization and Fate of Escherichia coli O157:H7 in Leafy Green Phyllosphere Tissue Using Various Spray Conditions. J. Food Prot. 77, 713-721 (2014).
- McKellar, R. C., et al. Evaluation of different approaches for modeling Escherichia coli O157:H7 survival on field lettuce. Int. J. Food Microbiol. 184, 75-85 (2014).
- Wu, F. M., et al. Factors influencing the detection and enumeration of Escherichia coli O157:H7 on alfalfa seeds. Int. J. Food Microbiol. 71, 93-99 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유