Method Article
Присоединение бактерий к заводе поверхности измеряется в лаборатории
В этой статье
Резюме
Простой метод для измерения и характеризующие бактериальной адгезии для растений, особенно корни и побеги, описанные в этой статье.
Аннотация
Эта рукопись описывает метод для измерения бактериальных привязки для стерильных завод поверхностей в световой микроскоп, а также путем применения жизнеспособных клеток. Завод материалов включают корни, побеги, листья и разрезать фрукты. Методы, описанные недорогой, легко и подходит для небольших выборок. Привязка измеряется в лаборатории и могут использоваться разнообразные инкубации средств массовой информации и условий. Эффект ингибиторов может быть определена. Можно также оценить ситуации, которые поощряют и подавляют привязки. В некоторых случаях это возможно отличить ли различные условия изменить привязки главным образом из-за их воздействия на заводе или на бактерии.
Введение
Измерения бактериальной привязки к заводе поверхности стало важным в трех различных ситуациях. Первая ситуация является изучение передачи человеческих патогенов растений поверхностей1,2,3. Цель здесь является для предотвращения бактериального привязки или для удаления или убить привязанных бактерий и тем самым по сокращению передачи заболевания от растительного материала. Вторая ситуация является изучение привязки патогенов растений к заводе поверхности4. Еще раз целью здесь является для предотвращения привязки или удалить или убить привязанных бактерий и тем самым уменьшить болезни. Третья ситуация является изучение привязки симбиотические или растений рост содействия бактерий5,6. Цель здесь заключается в содействии бактериальных обязательную силу и, таким образом, увеличение здоровья растений и культур урожайность.
Методы измерения бактериальных привязки к заводе поверхностей, описанные в этой статье, недорогой и сравнительно легко осуществить. Только требования являются микроскопом и материалы, обычно встречается в бактериологии лаборатории. Для некоторых методов sonicator Ванна является полезным. Методы, описанные предназначены для привязки экспериментов, проводимых с использованием относительно небольшие размеры выборки. Измерения привязки производятся в лаборатории, хотя это может быть возможность изменить некоторые из этих методов для использования в теплицах или в поле.
Эти методы были использованы для измерения бактериальных привязки корни, ростки, вырезать листья, фрукты и нетронутыми помидорами черри в лаборатории,78,9,10,11, 12,13,14,15. Они также используются для измерения корень колонизации растений, растущих в почве или песок в лаборатории16. С многих бактериальных видов, включая Agrobacterium tumefaciens, Sinorhizobium meliloti, кишечная палочка, Salmonella enterica и Pseudomonas fluorescensбыли использованы методы. Полезное описание методов для оценки взаимодействия A. tumefaciens с поверхности можно найти в Мортон и Фукуа (2012)17. Во всех случаях участие выборки были небольшими, обычно меньше чем растения 25-50. Описанные методы подходят для использования с патогенов человека, которые должны храниться содержащихся в ходе экспериментов.
протокол
1. Подготовка стерильных растительного материала
- Готовить саженцы, выращенные в воде.
- Поместите небольшое количество семян (менее 30) в 30, 50, 100 или 150 мл стеклянный стакан. Мы использовали помидор, люцерны, Arabidopsis thaliana, гороха, фасоли, табака, салат и морковь семян с настоящим Протоколом.
Примечание: Чтобы определить, сколько семян можно стерилизовать вместе без загрязнения распространяется из одного семени, смотрите шаг 1.1.2. - Обложка семена с 80% этанола и вихрем кратко. Пусть семена замочить на 1 мин.
- Слить этанола и охватывают семена с раствор 50% объема коммерческих отбеливатель (NaClO) и 0,1% тритон X-100 в водопроводной воде. Пусть семена замочить на 20 минут.
Примечание: Если семена большие, такие как семена фасоли, это может быть необходимо удлинить время замачивания полностью убить грибки на поверхности семян. - Слить отбеливатель смесь и мыть семена 3 раза с стерильной водой. Пусть семена замачивают в воде на 1 мин для каждой стирки.
- Для получения стерильных саженцы добавить небольшое количество стерильной воды между 5 и 25 мл в зависимости от размера семян. Налейте в стерильных Петри для прорастания семян семена и воды.
Примечание: Вода должна покрыть дно тарелки, но не охватывают семена поощрять формирование корневых волосков. Стерильных описывает культуру, в которой только одного вида организма присутствует. - Инкубируйте в темноте до тех пор, пока саженцы достичь желаемого размера между 1 и 10 см (около 5 дней для помидоров и A. thaliana и 1 до 3 дней для люцерны). Для крупных семян используют покрыты стерильный контейнер емкостью более 100 мл например стеклянную посуду, покрыты фольгой.
- Поместите небольшое количество семян (менее 30) в 30, 50, 100 или 150 мл стеклянный стакан. Мы использовали помидор, люцерны, Arabidopsis thaliana, гороха, фасоли, табака, салат и морковь семян с настоящим Протоколом.
- Определите частоту загрязнения много конкретной семян с микроорганизмами, которые остаются жизнеспособными на или внутри семена после поверхности стерилизации.
Примечание: Это необходимо, потому что иногда семена нести микроорганизмов под шубой семя, которое не может быть убит поверхности стерилизации. Используйте частоту зараженных семян в много семян для определения, сколько семян для стерилизации в одно время без высокого риска группы семян, становится загрязненных вследствие одно семя с бактериями или грибками, которые выживают лечения.- Выполните шаги 1.1.1 через 1.1.3.
- Поместите семена на питательный агар Петри. Положите около 10-30 семена в каждом блюдо интервалов их так что они могут быть индивидуально забил. Уплотнение блюда с ленты или запечатывания фильм.
- Инкубируйте 3-5 дней при температуре 25 ° C скоринга каждый день для видимых нарост микроорганизмов из семян.
- Готовить саженцы, выращенные в песок. Сеянцы можно выращивать в песок для использования в экспериментах бактериальной адгезии.
- Выполните шаги 1.1.1 через 1.1.3.
- Стерилизуйте кварц или морской песок в автоклаве. Оба из них содержат некоторые органического материала. Если это будет влиять на эксперимент, мыть песок, покрывая его дважды его объемом 0,1 М HCl. смесь для 10 мин разрешить песок урегулировать и слейте жидкость. Промывайте песок 3 раза с водой, и один раз с 80% этанола следуют два дополнительных воды полоскания, используя тот же протокол как 0,1 М HCl. Стерилизируй-отпусти промытого песка в автоклаве.
- Стерилизуйте контейнеры, погрузив их в отбеливатель 50% за 5 минут и промыть их 5 раз стерильной водой погружения. Позвольте им сохнуть и уплотнения дна с пленки для запайки. Фильм, полученные от производителя как правило бесплатно микроорганизмов на внутренней стороне, который должен быть размещен обращена внутрь контейнера.
- Смешайте стерильных песка достаточно стерильной водой для мокрой достаточно что песок палочки. Сумма будет зависеть от того, как сухой песок является. Обычно достаточно 10-35% от объема песка. Поместите влажный песок в контейнере, позволяя достаточную глубину для длина корней необходимого и достаточного пространства выше песка для роста побегов. Точное расстояние зависит от видов и разнообразие растений используется.
- Семена растений.
- Сделайте неглубокие отверстия в песок с стерильной стеклянной палочкой, достаточно глубоко, чтобы поместить семя ниже поверхности песка (примерно 1-5 мм). Поместите семена в отверстие. Покрывают тонким слоем песка. Печать в верхней части контейнера с уплотнительной фильм для предотвращения потери воды и вход дополнительного микробов.
- Растут растения в лаборатории под светом или в Теплице при соответствующей температуре и день длину для видов и разнообразие растений. Для томатов люцерны, или Arabidopsis thaliana использовать 12 h свет/темно циклов и комнатной температуре.
- Растение рассады в ямку в песке (1-2 мм в диаметре и достаточно глубоко, что корень будет покрыта песком). Сделайте отверстие с стерильной стеклянной палочкой. Руководство тщательно корень в отверстие с помощью стерильных нержавеющей стали крючком если необходимо и заполнить с песком стороны отверстия.
- Кроме того растут растения axenically, или в агар, содержащие смесь солей, таких как MS солей. Использование стреляет из стерильных растений, выращенных в агар непосредственно. Избегайте корни, выросло с агар как агар прилипает к поверхности растений и бактерий. Это может привести к ложное впечатление о бактериальной адгезии к поверхности растений.
2. подготовка другого растительного материала
- Вымойте растительного материала, выращенные в Теплице с водой перед использованием, чтобы уменьшить количество коренных микробов. Там будет бактерий и грибков на растения. Простейшие будет присутствовать в почве, на корни и, возможно, на листьях. Стирка с отбеливателем или этанола изменят поверхность растений и не рекомендуется.
- Если после промывки водой значительное количество микробов остаются, лечения растений с разбавленным жидкое мыло для рук или разбавлять перекись водорода (0,01%) удалить или убить микробы. Это как правило меньше повреждение к заводе чем отбеливатель или этанола.
- Как завод материал, приобретенных на местном рынке трудно деконтаминации, выбрать материал, который, как представляется, не были предметом длительного хранения. Избегайте частей материала, которые появляются коричневые или повреждены.
- Промойте его водой и сделать свежие порезы на концах материала, которые ранее были сокращены перед его использованием, если сократить взаимодействия тест бактерий с бактериями (и эукариот), которые будут накопили на сайты представляют интерес. Не мойте с отбеливателем или этанола, как они изменят поверхность растений.
- Лечить рану сайтов. Рану сайты часто предоставляют бактерий доступ к внутренней части растений материала18.
- Блокировать или уменьшить бактериальных привязанность к и движение через рану или вырезать сайтов, созданных при подготовке материала путем окунать среза в расплавленный парафин или живопись на сайт с расплавленным парафином, с помощью небольшой кисти. Не использовать шпателем или любого резкого реализации, как это может повредить ткани.
- Уплотнение штока шрамы на плоды томатов с парафином. Некоторые бактерии будут плавать в область под парафина, но их число обычно малы.
- Если бактериальный вступления в рану сайтов представляет интерес, смета, расстояние, что бактерии могут двигаться несла потоков воды или диффузии, наблюдая движение краска добавлены в решение. Марк подвижные бактерий путем введения кодирования флуоресцентных белков, таких как Зеленый флуоресцентный белок (ГПУП) в них ген и отслеживать их с помощью микроскопии флуоресцирования, описанные в шаге 6.1.219.
3. Подготовка бактерий
- Рост бактерий. Используйте средство, которое наиболее близко приближает условий бактерии, скорее всего, были подвержены непосредственно перед сталкивается с завода в реальном мире за пределами лаборатории. Углерода и азота источников, а также присутствие ионов, важны особенно двухвалентной катионов (Ca, Mg, Fe, Mn и Zn) и фосфатов и рН среды.
- Используйте минимальные AB среднего или бульоне Лурия A. tumefaciens и других бактерий почвы20. Для кишечной палочки, которая может возникать в кишечнике, используйте бульоне Лурия.
- Добавьте индукторов как корень экссудата или коммерческих растительных экстрактов, таких как soytone или сахара как сахароза или ксилоза средних21. Если эти вещества используются в качестве индукторов, добавьте низкой концентрации, например 0,01%. Если они используются углерода источников, добавьте более высокой концентрации, например 0.1%.
- Подготовьте бактериальных посевным материалом. Разбавьте бактерий в стерильной воде или в среде, в которой инкубации будет осуществляться и добавить их в растительного материала. В шаги 4.2 и 4.3 рассматривается соответствующим разбавлением.
- Чтобы удалить роста СМИ перед использованием бактерий, центрифуга бактериальных подвеска на 10000 x g за 2 мин, слить супернатант и Ресуспензируйте бактерий, vortexing их в той же среде, которая будет использоваться для инкубации с растительного материала. Этот метод может удалить или уменьшить число или количество внеклеточного материала и придатки как экзополисахаридов, капсулы, flagellae и пили. Если это важно, что эти поверхностные структуры остаются нетронутыми, затем развести бактерий до прививки их или использовать альтернативный метод, описанный в шаге 3.2.2.
- Как альтернативный метод для удаления среднего роста Соберите бактерии на нитроцеллюлозную или поликарбоната фильтр с размером пор 0,2 мкм или менее. Промойте бактерий с средство инкубации и Ресуспензируйте их мягкий сотрясение или vortexing фильтра в стерильный контейнер среды.
4. прививки бактерий
- Определите количество бактерий, чтобы быть прививанным со ссылкой на измерения, которые будут использоваться для определения бактериальной адгезии и длина время инкубации.
- Для микроскопического исследования с участием инкубации раз меньше, чем 1 день инокуляции относительно большое количество бактерий. Добавьте сумму культуры для достижения окончательного бактериальных концентратов более чем 106 бактерий / мл. Для больше инкубации раз уменьшить размер бактериальной посевным материалом.
- Для исследования, в которых бактериальной адгезии будет измеряться жизнеспособных клеток, добавить количество культуры для достижения окончательного бактериальные концентрация 103 до 106 бактерий / мл.
- Избегайте добавления так много бактерий, что их метаболизм изменения рН или кислорода концентрация в средстве для инкубации. Измерение pH с помощью РН бумаги или электрода. Измерение концентрации кислорода, с использованием кислорода электрода.
- Для растений, выращиваемых в песок прививать в три возможных пути.
- Инокуляции семян с бактерий до посадки путем замачивания семян за 1 мин в взвеси в воде около 106 бактерий / мл.
- Прививать корня путем прорастать стерильных саженцы, как описано в разделе 1, и когда Рассада корень длиной около 1 см окунать его или поместив весь рассада во взвешенном состоянии 106 бактерий / мл в воде в течение 1 мин.
- Прививать песок, смешивая бактерии с песком до посадки, чтобы дать окончательное концентрации около 103 бактерий / мл или полив рассады с подвеской 106 бактерий / мл после посадки.
5. инкубации бактерий с материалом завод
- Для инкубации в жидких средах, инкубировать бактерий с материалом завод в стерильной воде или сахароза и минеральные соли или растительных тканей питательной среды (например, 1:10 растворения солей MS)22,23.
- Используйте контейнер, к которому бактерии не придерживаются. Попытайтесь держать растение поверхности покрыты непрерывно либо путем погружения нежный агитации. Активной агитации могут предотвратить прилипание или даже удалить бактерии от поверхности растений.
- Наблюдать растительный материал в световой микроскоп после различные интервалы времени, чтобы определить, когда следует остановить инкубации и производить измерения. Время курса адгезии часто ценные с проб каждые 1-4 h или каждый день в зависимости от скорости взаимодействия.
- Для инкубации в песок, применяются те же самые соображения, описанной для инкубации в жидкой среде на шаге 5.1.
6. Измерение адгезии, с помощью микроскопии
- Сделайте микроскопических измерения бактерий на поверхности с Номарски или фазово контрастной Оптика для удобного просмотра. Однако может использоваться любой ярко поле микроскоп с увеличением 20 X или выше.
- Используйте микроскопические наблюдения для определения если бактерии случайным образом распределены или расположенных в определенных сайтов. Также проверите, связаны ли они отдельно или в кластерах. Посмотрите на присутствие microcolonies, предлагая рост бактерий или захвата после сцепления. Проверьте ли, как представляется, бактерии образуют биопленки на поверхности.
Примечание: Биопленки является большое количество бактерий привязан к поверхности и окруженный внеклеточного матрикса23,24,25. Структура может быть гладкой и единообразной или иметь более сложную архитектуру. Методы для изучения биопленки, связанные с поверхности растений были описаны17. - Использование бактерий, отмеченных флуоресцентных маркеров. Если присутствуют другие бактерии и бактерии интерес идентифицируются флуоресцентные метки например Зеленый флуоресцирующий белок, используйте микроскопии флуоресцирования для определения присутствия тегами бактерий в кластерах других бактерий26. Для GFP используйте фильтр с 490 Нм возбуждения и 520 Нм выбросов.
- Проверьте, что флуоресцентные тег не является неблагоприятное воздействие на бактерии, наблюдая за присоединение к стерильных материалов равной смеси дикого типа бактерий и тегами бактерий штамма же, используя Номарски и флуоресценции оптика. Если бактерии флуоресцентные и темные случайно смешанных и присутствует в равных количествах затем тег не вмешивались с assay.
- Используйте микроскопические наблюдения для определения если бактерии случайным образом распределены или расположенных в определенных сайтов. Также проверите, связаны ли они отдельно или в кластерах. Посмотрите на присутствие microcolonies, предлагая рост бактерий или захвата после сцепления. Проверьте ли, как представляется, бактерии образуют биопленки на поверхности.
- Определите количество вложенных бактерий.
Примечание: Это очень трудно определить количество вложенных бактерий в микроскопе. Когда привязка осуществляется к поверхности нерегулярных завод, это вообще не возможно получить количественные измерения. Чтобы сделать такие измерения может использоваться растровая электронная микроскопия (не рассматривается в этой статье).- Когда бактерии привязаны к гладкой поверхности, такие как корневого волоска, подсчитать количество бактерий, привязан к краю корневого волоска на корень волос мм длины. Позаботьтесь, чтобы использовать корневые волоски примерно такого же размера и формы в сравнении измерения.
- Чтобы определить размер объектов в Микроскоп, используйте коммерческие слайд с измеренной маркировки на нем. Наблюдать и фотографировать этот слайд в те же параметры, как используемый для экспериментального материала и использовать полученные изображения, чтобы определить размер объектов в микрофотографиями.
- Подготовка образца для микроскопии.
- Помойте образец. Переместите образец капли воды или инкубации среды на микроскопа и непосредственно наблюдать.
Примечание: Это имеет то преимущество, что, если там был не рост бактерий или фактической бактериальных смерти там вряд ли будет много свободного бактерий. Возьмите отсутствие свободного бактерий как предупреждающий знак, что там были бактериальных смерти или бактериальной привязки к контейнеру, в котором была проведена инкубации. Эффект стирки в образце показано на рисунке 1. - Мыть нежно образца в воду или инкубации среднего, поместив его в пробирку жидкости и переворачивать флакон осторожно. Затем поместите образец на микроскопа в свежей жидкости для наблюдения.
- Установите образец в жидкости, используя обычные крышки выскальзования и микроскопа.
- Если образец толстые и так бы выпуклость под крышку выскальзования, используйте press-apply покрытие скольжения. Эти скользит крышка имеют кольца резиновые или пластиковые вокруг края крышки выскальзования. Поместите жидкость и образец в колодец в крышку выскальзования место слайда на вершине и осторожно надавите, чтобы уплотнение крышки выскальзования к слайду. Инвертировать и изучить.
- В качестве альтернативы используйте водорослей, подсчета слайдов и крышка выскальзования аналогичным образом. Обратите внимание, что слайды с этой глубиной не может рассматриваться как правило с более чем 20 X увеличением объектива.
- Помойте образец. Переместите образец капли воды или инкубации среды на микроскопа и непосредственно наблюдать.

Рисунок 1 : Шаги в подготовке образца для определения количества привязанных бактерий. A. tumefaciens привязки томатный корневые волоски (A, B и C) и нитки капроновые (D, E и F). В образцах монтируется в воде без мытья оба связаны бактерий (черные стрелки) и бесплатные бактерий (белые стрелки) можно увидеть (A и D). После мытья остаются привязанных бактерий, но бесплатный бактерии есть не больше (B и E). После sonication привязанных бактерий были удалены от поверхности образца (C и F). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Если были использованы люминесцентные бактерий, рассмотрим пример в микроскопе после удаления песка. Корни растений, выращенных в песок, как правило, не подходит для микроскопии как частицы песка вмешиваться с замечанием бактерий.
- Удалите растение из контейнера роста в соответствии с шага 7. Корни в емкость с водой и осторожно смешать для удаления песка, который будет располагаться в нижней части контейнера.
- Удалить из воды Стиральная завод и смонтировать образец как шаг 6.3.3.
7. Измерение сцепления с помощью жизнеспособных клеток графов
- Определите количество жизнеспособных прилагаемый бактерий с помощью sonicator.
- Удаление несвязанных бактерий. Поместите образец в пробирку с достаточным количеством воды, мытье буфер или инкубации среднего для покрытия растительного материала и переверните флакон несколько раз.
- Если там были более чем 103 бесплатно бактерий / мл в первоначальном инкубации, выполните последовательный смывки для удаления всех из них. Проверьте в световой микроскоп (см. шаг 6.3) чтобы определить наличие свободного бактерий.
- Мыть до тех пор, пока существует значительное сокращение количества свободного бактерий, но помните, что существует равновесие между присоединенным и свободным бактерий, поэтому количество свободного бактерий никогда не может уменьшаться до нуля.
- Удалите образец из флакона промывочной жидкости с помощью щипцов или шпателя.
- Определите количество привязанных бактерий в инкубаций растений в жидкости.
- Приостановить промывают образца в пробирку и накрыть измеренного объема воды, средний инкубационный или Отмывающий буфер. Используйте достаточное количество жидкости для покрытия образца. Флакон в ванной sonicator и sonicate за 1 мин.
- Удаление образца и рассмотреть его под микроскопом света для определения ли связанный бактерии были удалены от завода. Удаление бактерий из выборки, sonication показано на рисунке 1. Если есть еще связаны бактерии продолжают sonicating образец до тех пор не привязанных бактерий остаются на поверхности образца. Если связанный бактерии не могут быть удалены sonication, добавления 1-10 мг/мл стерильного кварцевый песок и повторите sonication и микроскопическое исследование.
- Определить, что процедура sonication, которая представляется наиболее эффективным в шаге 7.1.3.2 не уменьшить жизнеспособность бактерий, приостановив бактерий из жидкого культуры в решении использоваться для sonication (добавить кварцевый песок, если это необходимо). Определите количество жизнеспособных клеток. Sonicate бактерии и определить количество жизнеспособных клеток снова.
Примечание: Если есть сокращение числа жизнеспособных клеток, измените процедуру, изменяя состав жидкости и/или sonication время до тех пор, пока лечение не влияет на количество жизнеспособных клеток. - Определите, что разведение буфер, используемый для жизнеспособных клеток не влияет на жизнеспособность бактерий, которые были инкубировали в условиях используются, сравнивая жизнеспособных клеток с использованием различных разрежения буферов и/или воды.
- Удаление несвязанных бактерий. Поместите образец в пробирку с достаточным количеством воды, мытье буфер или инкубации среднего для покрытия растительного материала и переверните флакон несколько раз.
- Определите количество жизнеспособных прилагаемый бактерий с помощью гомогенизации.
- Поместите образец в стерильный раствор или блендер или другое устройство гомогенизации. Обложка с измеренной объемом стерильной водой, средний инкубационный или мытья буфера27. Использование тома, достаточной для покрытия образца. Блендер используйте 100 мл.
- Измельчить образец до тех пор, пока она хорошо гомогенизации. Проверьте рН после гомогенизации быть уверенным, что кислоты освобожден из тканей растений не вызвало резкое снижение рН ниже 7. Если pH упала используйте буфер как фосфатного буфера в гомогенизации жидкости для поддержания рН.
- Определите количество жизнеспособных клеток.
- Используйте с устойчивостью к антибиотикам бактерий.
- В ситуациях, в которых присутствует более чем один тип бактерии Марк бактериальных штаммов, используя спонтанное устойчивость к антибиотикам (обычно рифампицин и налидиксовая кислота).
- Определите уровень антибиотик для использования. Если доступны культур других организмов, как ожидается, будет присутствовать в инкубации, тарелка этих культур, выращенных в условиях предполагаемой инкубации с растениями на тарелках, содержащий диапазон концентраций выбрали антибиотиков. Определите низкие концентрации, которая не допускает рост какого-либо из этих организмов. Это самая низкая концентрация антибиотика, какой тест бактерии должны быть устойчивы.
- Получения спонтанного антибиотикам мутантов. Растут культуры бактерий в богатой среде до конца журнала или неподвижной фазой. Пластины 0,1 мл, неразбавленный на тарелку, содержащий требуемый антибиотик в соответствующей концентрации. Определение концентрации, как описано в шаге 7.3.1.1. Сохранить и очистить бактерий, которые растут и, таким образом, устойчивы к антибиотикам.
- Определите, что антибиотикорезистентности не уменьшить рост бактерий, делая кривую роста в жидкой среде родителя и устойчивых к антибиотикам штаммов. Определите, устойчивых к антибиотикам бактерий показать тот же уровень колонизации стерильных растительного материала как родитель деформации, если это возможно.
- В ситуациях, в которых присутствует более чем один тип бактерии Марк бактериальных штаммов, используя спонтанное устойчивость к антибиотикам (обычно рифампицин и налидиксовая кислота).
- Определите количество жизнеспособных бактерий, обязан растений, выращенных в песок.
- Удалите растение из контейнера и песка. Чтобы удалить растений из контейнеров, сначала удалите заделывающий материал на верхней и нижней части контейнера. Поместите контейнер кусок стерильной бумаги и аккуратно удалить весь песок или почвы и растений как один большой конический цилиндр, нежно сбивая контейнера по поверхности, чтобы ослабить материала.
- При необходимости, используйте шпатель или стержня ослабить материала по краям, переживает нижней части контейнера.
- Когда цилиндр песка или почвы, содержащие завод бесплатно на бумаге, разбить его вниз с середины раскрыть корень растения. При желании, взять образцы песка от на краю контейнера, а также вблизи корня. Это может быть полезным для определения распространения (и накопления и роста) бактерий.
- Измерьте длину корня. Выбрать вверх корня и удалить песок и бактерий, слабо придерживаясь корень (ризосфере материал), окуная корень измеренного объема воды или буфера и слегка покачивая его. Определите количество жизнеспособных клеток бактерий в результате приостановления путем покрытия на подходящую среду например Лурия агар. Это представляет количество бактерий, слабо связанные с корнем.
- Удалите растение из контейнера и песка. Чтобы удалить растений из контейнеров, сначала удалите заделывающий материал на верхней и нижней части контейнера. Поместите контейнер кусок стерильной бумаги и аккуратно удалить весь песок или почвы и растений как один большой конический цилиндр, нежно сбивая контейнера по поверхности, чтобы ослабить материала.
- Удалите тесно привязанных бактерий, sonication и определить их число, как описано в пункте 7.1.
- Кроме того чтобы определить местоположение на корень тесно привязанных бактерий место промывают корень на поверхности чашку Петри, содержащих питательный агар или других подходящих средств. Наблюдать расположение бактериальных колоний на корень в ближайшие 3 дней, с использованием рассечения Микроскоп или увеличительное стекло.
- Экспресс результаты как количество бактерий на растении, см2 площади поверхности, на см длины корня или за грамм свежей массы ткани. Сделать несколько реплицирует в тот же день, а также делать реплицирует в разные дни, с использованием различных бактериальных культур и различных много растительного материала.
8. определения, является ли влияние условий инкубации на сцепление благодаря реакции бактерий или завод
- Используйте убитых или мертвого растительного материала.
- Тема материала для различных химических веществ, фиксаторы или других процедур, таких как жара завод для того, чтобы убить его. Тщательно мойте растительный материал в воде и инкубации среде после использования любого из этих методов лечения. Затем инокуляции бактерий. Это не будет уничтожать поверхности растений, но он будет делать это метаболически неактивны, так что он не может отвечать на бактерии.
- Мера бактериальной адгезии, как описано в шагах 6 и 7. Также определите количество жизнеспособных клеток, добавлены к инкубации с растительный материал в начале инкубации и количество жизнеспособных клеток в конце инкубации обеспечить, что никаких токсичных химических веществ были представлены во время инкубации.
- Использование неживой материал.
- Использование бактериальных соблюдение неживой материал для определения если эффект проявляется на бактериальных придерживании к заводе материал является из-за воздействия на растение или бактерии. Выберите неживой материал, к которому бактерии связывают и который подобен по форме и размеру изучал растительный материал. Возможности включают фильтр документов всех типов (целлюлоза, нитроцеллюлоза, стекловолокно, поликарбоната, и т.д.), потоки (нейлон, хлопок, полиэстер, стекловаты, и т.д.), стеклянных или пластиковых coverslips, купоны из нержавеющей стали и диализа мембраны.
- Промойте неодушевленные материал тщательно в воде и среднего, в котором будет осуществляться инкубации и стерилизовать его перед использованием. Большинство материалов, перечисленных в действии 8.2.1 устойчивы к стерилизации в автоклавах.
- Инкубируйте неживой материал под желаемых условий и оценка, как описано в шагах 6 и 7. Пример использования Нейлоновая нить, чтобы определить, что объясняется сокращение привязки A. tumefaciens для корневых волосков на концентрации кальция (по крайней мере частично) эффект кальция на бактерии показан на рисунке 428.
Результаты
A. tumefaciens колонизирует поверхности корней. Для того чтобы определить ли бактериального производства целлюлозы играет роль в колонизации корень, эффекты бактериальных мутаций, которые предотвращают синтез целлюлозы были рассмотрены16. Были использованы методы, описанные в шаге 1.3 и 7.1. Семена томатов были поверхности стерилизовать и проросшие в стерильной воде. Когда корни были примерно 2 см в длину они были погружается в приостановлении 105 бактерий / мл и посадили в пастеризованных почвы в контейнерах. Растения выращивались на 14 дней при температуре 25 ° C на 12 ч света/12 h темные цикла. После указанного времени растения были удалены из контейнеров. Корни были вымыты и sonicated в sonicator ванна для удаления привязанных бактерий. Бактериальные цифры были определены с помощью жизнеспособных клеток. Рисунок 2 показывает эффект двух различных мутаций целлюлозы минус на способности бактерий колонизировать томатный корни. Хотя стандартные отклонения некоторых измерений были так высоко, как 0,9 войти10 (общая проблема с этим типом измерения) сокращение привязки целлюлозы минус мутантов совершенно очевидно, и мы можем заключить, что бактериальные производство целлюлозы СПИДа бактерий в колонизации томатный корней.
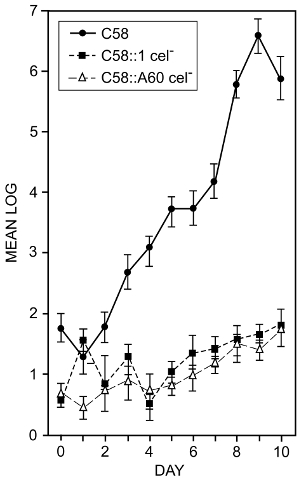
Рисунок 2 : Корень колонизация дикого типа и целлюлоза минус мутантов A. tumefaciens. Журнал10 общее количество бактерий на см Длина корневого оправились от помидор корни засеян с дикого типа A. tumefaciens штамм C58 и целлюлоза минус мутантов C58:1 и C58:A60. Номера, указанные являются средством от минимум четыре отдельных экспериментов. Полоски указывают на стандартные отклонения средств. Корни были привиты, опуская их во взвешенном состоянии 105 бактерий / мл на 1 мин. Растения выращивались в контейнерах и слабо адэрентных бактерии были удалены путем промывания корни в отмывающего буфера в стеклянный флакон. Плотно адэрентных бактерии были удалены с помощью sonicator ванна и результирующая подвеска, покрытие для определения жизнеспособных клеток насчитывает16. Эта цифра была изменена от Матиссе и МакМахан. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Была рассмотрена роль экзополисахаридов в привязке E. coli и других бактерий, чтобы ростки люцерны. Некоторые вспышек диарейных заболеваний из-за кишечной палочки O157: H7 был проложен в загрязненных люцерны ростки. Связывание одичал тип бактерий и мутанты не в состоянии сделать различные экзополисахаридов была измерена с помощью методов, описанных в шагах 1.1, 5.1 и 7.2. Ростки люцерны были поверхности стерилизовать и проросшие на один день в стерильной воде при 25 ° C в темноте. Четыре побеги с прилагаемой семян пальто были помещены в стерильных пластиковых блюда, содержащие 5 мл воды. Бактерии, выращенных в бульоне Лурия были добавлены в конечной концентрации примерно 5 х 103 мл. Привитых ростки инкубировали при 25 ° C в темноте в течение 3 дней. Побеги были омывается энергичные инверсии дважды в стерильной воде 5 мл в флаконе и гомогенизации в отмывающего буфера с помощью механического гомогенизатор стекла тефлон. Предыдущие эксперименты с использованием бактерий, отмеченные плазмида, перевозящих показали внутреннюю бактерий нет, хотя поверхности бактерии легко наблюдались гена GFP. Результаты приведены в таблице 1. Были рассмотрены два штаммов кишечной палочки O157: H7. В обоих штаммов производства поли β-1,6-глюкуроновой acid(PGA) появился вносить наибольший вклад в привязку патогенной кишечной палочки к заводе поверхностей. Толстой кислоты также сыграл значительную роль в привязке. Хотя сокращение привязки в мутантов целлюлозы минус был значительным было не так велика, как для двух других полисахаридов.
| Влияние мутаций в генах Exopolysaccharide производства на привязки E. палочки O157: H7 ростки и открытые семян пальто | |||
| Бактериальный штамм | Мутации или генотипа (соответствующие фенотип) | Журнал10 количество бактерий связана в Росток или семян пальто | |
| Ростки люцерныb | Открытый Семена пальто | ||
| 86-24 | Нет (дикий) | 4.7 ± 0,6 | 5.6 ± 0,2 |
| 8624N | yhjN (целлюлоза минус) | 2,9 ± 0,7c | 3.5 ± 0,6c |
| 8624C | закона (толстой кислоты минус) | 1,8 ± 0,7c | 2.4 ± 0.5c |
| 8624P | pgaC (PGA-минус) | < 1.0c | 1,0 ± 1.0c |
| DEC4A | Нет (дикий) | 5.6 ± 0,2 | 6.1 ± 0,3 |
| DEC4AN | yhjN (целлюлоза минус) | 4,8 ± 0,8d | 4.1 ± 0,8d |
| DEC4AC | закона (толстой кислоты минус) | 3,9 ± 0.5c | 4,8 ± 0,8d |
| DEC4AP | pgaC (PGA-минус) | < 1.0c | 1,2 ± 0,7c |
| Среднее ± стандартное отклонение минимум трех измерений (журнал10) количество бактерий, привязанны после 3 дней. | |||
| b ростки были смыты перед измерением. | |||
| c значительно отличается от дикого типа: P < 0.01. | |||
| d значительно отличается от дикого типа: P < 0,05. | |||
| Эта таблица была изменена Матиссе, Деора, Мишра и Торрес10. | |||
Таблица 1: влияние мутаций в генах exopolysaccharide производства на привязку Кишечной палочки O157: H7 для рассады. Для того чтобы определить роль различных экзополисахаридов и липополисахарида в привязку патогенных штаммов кишечной палочки O157: H7 ростки люцерны, Связывание набора мутантов ростки и открытые семян пальто был рассмотрен с помощью методов описано в шаге 6. Результаты показали, что поли ß-1, 6 -N-ацетил-D-глюкозамина (PGA), как представляется, существенно важное значение для привязки к ростки и что целлюлозы и colanic кислоты, необходимые для максимальной привязки кишечной палочки O157. Эта таблица была изменена Матиссе, Деора, Мишра и Торрес10.
Для того, чтобы определить, является ли производство PGA достаточно, чтобы вызвать бактериальных привязки посадить поверхностей, плазмида (pMM11), перевозящих клонированных Оперон кодирование генов, необходимых для PGA производства была введена в двух различных бактерий, которые бы не обычно быть в состоянии связать томатный корни10. A. tumefaciens A1045 — мутант дикого типа штамма C58, который не в состоянии сделать глюкан циклических β-1,2 и также не удается выполнить привязку к заводе поверхности29. Sinorhizobium meliloti 1021, который образует корневого узелки на люцерны, привязать не удается к не бобовые включая томатный12. Методы, описанные в шагах 1.1, 5.1, 6,3 и 7.1 были использованы для определения, если способность сделать PGA обычно увеличивается бактериальных привязки к поверхности корней. Семена томатов были поверхности стерилизовать и проросшие в стерильной воде. Корни были нарезать сегменты 1 см в длину и помещают в стерильную воду и бактерии были привиты. Поскольку эти два вида бактерий растут с разной скоростью, привязки была измерена в разное время для примерно равное количество бактериального роста. Присутствие плазмид pMM11 вызвало аналогичные значительное увеличение количества привязанных бактерий обоих видов (Таблица 2)10. Значительное увеличение в привязке также видели в световой микроскоп, но привязка была весьма различны для двух видов (рис. 3). A. tumefaciens A1045 связаны как отдельных бактерий на поверхности корня. S. meliloti связаны в больших кластерах, в котором только некоторые бактерии были напрямую подключены к корню, и большинство бактерий были прикреплены к другие бактерии. Этот пример показывает, что просто Анализируя количество бактерий, связаны не включая микроскопические наблюдения может дать ложное впечатление о результатах эксперимента. Хотя оба метода (жизнеспособных клеток и микроскопические наблюдения) показывают, что pMM11 более бактериальных привязки к корням помидор, тип привязки, вызванные производством PGA был различны для двух видов бактериальных10.
| Влияние плазмида pMM11 на привязки бактерий к корням помидор | ||
| Бактериальный штамм | Плазмиды | Количество бактерий, связаны в корень длина мм |
| A. tumefaciens A1045 | нет | 0.25 x 103 ± 0,25 x 103 |
| pBBR1mcs (вектор) | 0.25 x 103 ± 0,25 x 103 | |
| pMM11 (PGA синтез) | 10 x 103 ± 0,25 x 103 | |
| S. meliloti 1021b | нет | не обнаружено |
| pBBR1mcs (вектор) | не обнаружено | |
| pMM11 (PGA синтез) | 50 x 103 ± 5 x 103 | |
| Бактериальные привязка была измерена после 2 часов | ||
| b бактериальных привязки является мерой, после 18 часов | ||
| Эта таблица была изменена Матиссе, Деора, Мишра и Торрес10. | ||
Таблица 2: эффект плазмида, перевозящих генов для синтеза PGA на привязку A. tumefaciens A1045 и S. meliloti 1021 томатный корень сегментов. Для того, чтобы изучить способность поли ß-1, 6 -N-ацетил-D-глюкозамина (PGA) содействовать привязке бактерий к заводе корни, эффект плазмида, возлагающего на связывание двух штаммов бактерий, связанных растений, чтобы способность сделать PGA (pMM11) было рассмотрено томатный корни. Ни штамм бактерий показала значительные привязки к корням помидор в отсутствие плазмида или присутствии плазмида без генов, кодирующих синтез PGA (pBBR1mcs). Добавление плазмида PGA синтеза гены увеличилась связывания обоих типов бактерий. Потому что A. tumefaciens растет быстрее, чем привязка S. meliloti была измерена после 2 ч инкубации для A. tumefaciens и 18 h для S. meliloti. Методы, используемые описаны те на шаге 7. Эта таблица была изменена Матиссе, Деора, Мишра и Торрес10.
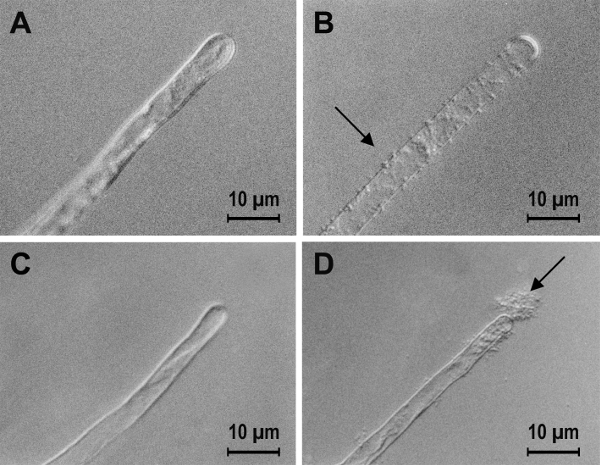
Рисунок 3 : Эффект плазмида pMM11, перевозящих генов биосинтеза PGA в привязке A. tumefaciens A1045 и S. meliloti 1021 до помидор корневые волоски. Привязка к томатный корневые волоски A) A. tumefaciens A1045, B) A. tumefaciens A1045 pMM11, C) S. meliloti 1021 и D) S. meliloti 1021 pMM11. Хотя увеличение привязки двух видов бактериальных примерно аналогичные подробности привязки, как показано в световой микроскоп являются весьма различными. Методы, используемые описаны те на шаге 6. Этот показатель был изменен с10Матиссе, Деора, Мишра и Торрес. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Иногда можно использовать привязку к небиологических поверхностей для помощи в разграничении вклад бактерий и растений в специфическое взаимодействие. Однополярный polysaccharide(UPP) A. tumefaciens было показано, быть в состоянии выступить посредником бактериальных привязки к различным обоих биологических и небиологических поверхности30. Было отмечено, что кальция подавляют привязки A. tumefaciens посадить поверхностей при посредничестве UPP28. Для того, чтобы определить, является ли торможение ионами кальция бактериальной привязки к заводе поверхности вследствие эффекта на бактерии или на поверхности растений, был рассмотрен привязки бактерий до нитки капроновые. В шаге описывает методы были использованы 8.2. Семена томатов были поверхности стерилизовать и проросшие в воде, как описано в шаге 1. Бактерии были выращены в минимальный средний с сахарозой и добавляется томат корни или нитки капроновые в конечной концентрации примерно 105/мл, как описано в шаге 5.1. Микроскоп был рассмотрен эффект добавлен CaCl2 на бактериальных привязки к корням помидор и нитки капроновые. Рисунок 4 показывает аналогичные ингибирование привязки, кальция, с использованием либо поверхности предполагая, что кальция применяется главным образом на бактерии10.

Рисунок 4 : Влияние кальция на привязку A. tumefaciens томатный корневые волоски и нитки капроновые. A. tumefaciens был инкубировали с томатным корни (A и B) или нитки капроновые (C и D) за 24 ч в 1:10 разрежения MS соли и 1:20 разрежения AB минимальный средний, 0,4%-ая сахароза (A и C) или в 1:10 разрежения MS соли и 1:20 разрежения AB минимальный средний , 0,4%-ая сахароза, содержащие 60 мм CaCl2 (B и D)31. Добавлено CaCl2 ингибирует бактериальные привязки корни и нитки капроновые, предполагая, что ингибирование был обусловлен эффектом на бактерии, а не на поверхности растений. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Важно быть в курсе всех поверхностей, которые бактерии могут придерживаться в ходе эксперимента. Таким образом могут недооценивать бактерий, которые способны привязки к стеклу, если сделали жизнеспособных клеток с использованием стеклянных трубок и пипетки. Если растения выращиваются в агар или почвы и некоторые из агар или почвы остается на растения, бактерии могут связывать приставшего материала, а не к растениям. С другой стороны, мытье поверхности растений, особенно в случае корни, могут удалить природных поверхностных покрытий таких, как слизистые и таким образом изменить результаты испытаний присоединения.
Важно быть уверенным, что бактерии добавляется в смесь инкубации живы во время эксперимента. Таким образом следует регулярно жизнеспособных клеток бактерий, как бесплатные, так и вложенные. Некоторые лечения или бактерий мутации могут снизить темпы роста бактерий или на самом деле причиной смерти часть населения бактериальных. Живые и Мертвые бактерии не могут быть различимы в микроскопе, если используются специальные пятна. Есть полезные пятно комплект для жить/Мертвые бактерии, которая зависит исключение красители из живых бактерий. Однако если присутствует смешанное население бактериальных видов жизнеспособных клеток видов интерес может быть простой способ, чтобы определить ли инкубации привело к бактериальной смерти.
Средний состав будет влиять бактериальных выживания и роста. Корень экссудатом и материалы освобожден от раны и вырезать сайтов предоставит субстрат для поддержки скромный рост бактерий. Фосфат, азота и железа, как правило, ограничения в этих условиях. Двухвалентной катионов кальция и магния могут влиять адгезии. В некоторых случаях источник углерода могут влиять адгезии. также имеет значение pH. В целом pH ризосфере находится между 5.5 и 6.5.
Необходимо быть осторожным при использовании бактерий, отмеченные антибиотикорезистентности. Наиболее часто используемых антибиотиков, рифампицин и налидиксовой кислотой. Сопротивление этих антибиотиков является как правило из-за мутации в генах, хромосомная (РНК-полимераза и гиразы, соответственно) и таким образом не могут легко быть переданы другой штамм во время инкубации. Также этот вид сопротивления не привести к деградации или модификации антибиотика. Маркировка бактерий с маркером плазмида нести ген не рекомендуется, если плазмида не могут быть переданы любой другой бактерии. Антибиотикам не должны быть из-за деградации или химическая модификация антибиотика как антибиотик чувствительных бактерий затем сможет расти на антибиотик пластины, если они расположены недалеко от резистентных бактерий.
Методы, описанные в этом документе являются полезными для небольшой выборки и/или экспериментов, где образцы должны содержаться (например, эксперименты с патогенов человека). Для больших выборок (выше 100 г материала или более чем 50 растений) другие методы или резкого изменения этих методов будет необходимо10,,1932,19,33, 34 , 35 , 36. присутствие большого числа микроорганизмов за исключением видов изучается также может представлять серьезные проблемы. Возможные решения включают в себя использование бактерий, отмеченные флуоресцентный белок или резистентность к антибиотикам, как описано в шагах 6.1.2 и 7.3. Однако когда бактерии интерес редких особей в большой популяции других микроорганизмов эти маркеры не может быть достаточным для однозначной оценки числа бактерий изучается.
Все описанные здесь методы, на основе лабораторных методов. Для исследования парниковых потребуются незначительные изменения. Более крупные изменения, вероятно, будет требоваться для полевых исследований, где простейшие, насекомых и других животных хищничество и климатических вариаций осложнить предоставление определенных условий для экспериментов. В будущем эти методы может быть расширена для включения взаимодействия двух или более микроорганизмов на поверхности растений.
Раскрытие информации
Автор заявляет, что она не имеет никаких финансовых интересов.
Благодарности
Автор благодарит Сьюзан Уитфилд для приготовления цифры и Камилла Мартин и Хиллари Samagaio для помощи с некоторыми из экспериментов.
Материалы
| Name | Company | Catalog Number | Comments |
| light microscope | any | N/A | phase contrast or Nomarski optics are helpful, for studies using fluorescent markers a fluorescence microscope is required. |
| seeds | any | N/A | make a note of the seed lot number and the cultivar |
| bleach | any | N/A | |
| bath sonicator | any scientific supply company | N/A | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| nutrient agar | Difco | 001-01-8 | |
| soytone | Difco | 24360 | |
| Sand | sea sand Fisher Scientific | S25 | |
| sand | Sigma-Aldrich | S9887 | |
| conetainers | Stuewe & Sons, Inc. | Ray-Leach cone-tainers | many different sizes are available to suit the type of plant you wish to grow |
| parafilm | any scientific supply company | N/A | |
| MS salts | Sigma-Aldrich | M5524 | |
| parrafin | any | N/A | |
| centrigfuge | any scientific company | N/A | to pellet most bacteri only a small centrifuge with a max force of 10,000 XG is needed |
| vortex mixer | any scientific company | ||
| micrometer | ACCU-SCOPE Accessories | A3145 | |
| Sedgwick-rafter counting cell | Hauser Scientific | HS3800 | |
| probe-clip press-seal incubatin chamber | Sigma-Aldrich | Z359483 | |
| rifampicin | Sigma-Aldrich | R3501 | |
| naladixic acid | Sigma-Aldrich | n8878 | |
| Live/dead stain | In Vitrogen Molecular Bioprobes | L7007 |
Ссылки
- Heaton, J. C., Jones, K. Microbial contamination of fruit and vegetables and the behaviour of enteropathogens in the phyllosphere: a review. J. Appl. Microbiol. 104, 613-626 (2008).
- Beuchat, L. R. Ecological factors influencing survival and growth of human pathogens on raw fruit and vegetables. Microbes Infect. 4, 413-423 (2002).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Lugtenberg, B. J., Chin, A. W. T., Bloemberg, G. V. Microbe-plant interactions: principles and mechanisms. Antonie Van Leeuwenhoek. 81, 373-383 (2002).
- Preston, G. M., Haubold, B., Rainey, P. B. Bacterial genomics and adaptation to life on plants: implications for the evolution of pathogenicity and symbiosis. Curr. Opin. Microbiol. 1, 589-597 (1998).
- Compant, S., Duffy, B., Nowak, J., Clement, C., Barka, E. A. Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects. Appl. Environ. Microbiol. 71, 4951-4959 (2005).
- Mathews, S. L., Smith, R. B., Matthysse, A. G. A comparison of the retention of pathogenic Escherichia coli. O157 by sprouts, leaves and fruits. Microb. Biotechnol. 7, 570-579 (2014).
- Fuqua, C., Matthysse, A. G. Methods for studying bacterial biofilms associated with plants. Methods Enzymol. 337, 3-18 (2001).
- Torres, A. G., Jeter, C., Langley, W., Matthysse, A. G. Differential binding of Escherchia coli.O157:H7 to alfalfa, human epithelial cells, and plastic is mediated by a variety of surface structures. Appl. Environ. Microbiol. 71, 8008-8015 (2005).
- Matthysse, A. G., Deora, R., Mishra, M., Torres, A. G. Polysaccharides cellulose, poly-beta-1,6-n-acetyl-D-glucosamine, and colanic acid are required for optimal binding of Escherichia coli O157:H7 strains to alfalfa sprouts and K-12 strains to plastic but not for binding to epithelial cells. Appl. Environ. Microbiol. 74, 2384-2390 (2008).
- Matthysse, A. G., et al. The effect of cellulose overproduction on binding and biofilm formation on roots by Agrobacterium tumefaciens. Mol. Plant Microbe Interact. 18, 1002-1010 (2005).
- Matthysse, A. G., Kijne, J. W., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. Attachment of Rhizobiaceae to plant cells. The Rhizobiaceae. , 235-249 (1998).
- Matthysse, A. G. Conditioned medium promotes the attachment of Agrobacterium tumefaciens.strain NT1 to carrot cells. Protoplasma. 183, 131-136 (1994).
- Matthysse, A. G., McMahan, S. The effect of the Agrobacterium tumefaciens. attR mutation on attachment and root colonization differs between legumes and other dicots. Appl. Environ. Microbiol. 67, 1070-1075 (2001).
- Jeter, C., Matthysse, A. G. Characterization of the binding of diarrheagenic strains of E. coli.to plant surfaces and the role of curli in the interaction of the bacteria with alfalfa sprouts. Mol. Plant Microbe Interact. 18, 1235-1242 (2005).
- Matthysse, A. G., McMahan, S. Root colonization by Agrobacterium tumefaciens is reduced in cel, attB, attD, and attR mutants. Appl. Environ. Microbiol. 64, 2341-2345 (1998).
- Morton, E. R., Fuqua, C. Phenotypic analyses of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Brandl, M. T. Plant lesions promote the rapid multiplication of Escherichia coli O157:H7 on postharvest lettuce. Appl. Environ. Microbiol. 74, 5285-5289 (2008).
- Franz, E., et al. Quantification of contamination of lettuce by GFP-expressing Escherichia coli O157:H7 and Salmonella enterica serovar Typhimurium. Food Microbiol. 24, 106-112 (2007).
- Morton, E. R., Fuqua, C. Laboratory maintenance of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Lugtenberg, B. J., Kravchenko, L. V., Simons, M. Tomato seed and root exudate sugars: composition, utilization by Pseudomonas biocontrol strains and role in rhizosphere colonization. Environ. Microbiol. 1, 439-446 (1999).
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum. 15, 473-497 (1962).
- Danhorn, T., Fuqua, C. Biofilm formation by plant-associated bacteria. Annu. Rev. Microbiol. 61, 401-422 (2007).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Charkowski, A. O., Barak, J. D., Sarreal, C. Z., Mandrell, R. E. Differences in growth of Salmonella enterica and Escherichia coli O157:H7 on alfalfa sprouts. Appl. Environ. Microbiol. 68, 3114-3120 (2002).
- Loper, J., Suslow, T., Schroth, M. Lognormal distribution of bacterial populations in the rhizosphere. Phytopathology. 74, 1454-1460 (1984).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, 252 (2014).
- Douglas, C. J., Halperin, W., Nester, E. W. Agrobacterium tumefaciens mutants affected in attachment to plant cells. J. Bacteriol. 152, 1265-1275 (1982).
- Tomlinson, A. D., Fuqua, C. Mechanisms and regulation of polar surface attachment in Agrobacterium tumefaciens. Curr. Opin. Microbiol. 12, 708-714 (2009).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, (2014).
- Wright, K. M., et al. The endophytic lifestyle of Escherichia coli O157:H7: quantification and internal localization in roots. Phytopathology. 103, 333-340 (2013).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Erickson, M. C., et al. Internalization and Fate of Escherichia coli O157:H7 in Leafy Green Phyllosphere Tissue Using Various Spray Conditions. J. Food Prot. 77, 713-721 (2014).
- McKellar, R. C., et al. Evaluation of different approaches for modeling Escherichia coli O157:H7 survival on field lettuce. Int. J. Food Microbiol. 184, 75-85 (2014).
- Wu, F. M., et al. Factors influencing the detection and enumeration of Escherichia coli O157:H7 on alfalfa seeds. Int. J. Food Microbiol. 71, 93-99 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены