Method Article
ローカライズされたカルシウム イオン勾配に対応した膜小胞の膜を改造
要約
ローカライズされたカルシウム イオン勾配を使用して小胞の非接触マイクロマニピュレーション用手法を提案します。巨大な脂質ベシクルの近くのカルシウム イオン溶液のマイクロインジェクションを利用して膜管状の突起の生産の結果、脂質膜を改造します。
要約
基礎的な細胞プロセス、膜の売買およびアポトーシスなどの多種多様な細胞膜形状遷移は局地的カルシウム イオン濃度の変化と並行して発生します。これらのプロセスに関連する主要な分子コンポーネントが特定されています。生物の細胞の複雑な性質のために主に、しかし、カルシウム イオン勾配および細胞膜内脂質間の特定の相互作用ははるかに少ない知られて、観察方法の困難。このギャップを埋める、合成法は細胞膜模倣に対するカルシウム イオンのローカライズされた効果を明らかにすることを実装しました。セル内条件に似ていると模倣を確立され、磨かれ問題であります。まず、適切な寸法と膜組成を有する適切な生体模倣モデルは、細胞の物理的特性をキャプチャに必要です。第二に、マイクロマニピュレーション セットアップが特定の膜の位置に少量のカルシウム イオンを提供する必要です。最後に、観測方式は検出し、脂質膜の外部刺激に対する反応を記録する必要があります。この記事は、多重小胞 (MLV) に接続されている巨大な単層ベシクル (GUV) から成る脂質ベシクル システムがローカライズされたカルシウムにさらされているカルシウム イオン膜の相互作用の詳細な生体模倣アプローチを提供していますグラデーションは、インジェクション システムを使用して形成されます。イオン膜に及ぼす動力学は蛍光顕微鏡を用いて観察され、ビデオ フレーム レートでの記録。膜刺激の結果として膜管状突起 (MTPs) GUV、配向膜から内に形成されて非常に湾曲します。記述されているアプローチは、完全非接触と制御された方法で脂質膜と MTP 生産の改造を誘導します。このアプローチは、細胞膜の形状を変える機構を研究する新しい手段を提供するカルシウム イオン膜の相互作用の詳細について説明するための手段を紹介します。
概要
生物学的プロセス、シグナル伝達、細胞分裂、膜融合に関与特に内カルシウム イオンの役割は、多くの解明1の焦点です。細胞内の細胞質内のカルシウム イオン濃度は 100 nM, 中の小胞体、分泌小胞、ミトコンドリアなどの細胞小器官の中のカルシウム濃度の millimolars の最大数十レベルに到達します。これは細胞内の膜2,3,4,5,6,7,8 の間で急なカルシウム イオン濃度勾配桁違いを作成します ,9。細胞外のカルシウム イオン濃度が約 2 mM としたがって、カルシウム イオン濃度の変化は、細胞外と細胞内の両方のレベルで発生します。さらに、最近の研究はイベントをシグナル伝達、細胞内カルシウム イオンの証拠を提供する神経活動の重要性を示す、細胞外のカルシウム イオン濃度の局所的なゆらぎの条件下で発生する可能性が同期内と細胞外のカルシウム イオンのバリエーション10。
カルシウム イオンと生体膜、ネイティブの細胞膜、脂質二分子膜ベシクルに置き換えられます合成アプローチ間の相互作用を理解することを目指しては正常に実装されています。脂質頭部群と炭化水素鎖のパッキング、増加膜張力と小胞凝集として脂質膜相転移11,12 の分離の変更につながるカルシウム イオン溶液に小胞を公開 ,13,14,,1516。カルシウム イオンへの露出に脂質膜の性質は、x 線、 1H 核磁気共鳴分光学的あるいは熱力学的研究11,16,とこのような実験的テクニックを使用して行った17,18. これらの研究で膜組成がよくネイティブの細胞膜のように調整されて、ホスファチジルコリン (PC)、ホスファチジルエタノールアミン (PE)、ホスファチジルセリン (PS) とそのような生理学的な脂質が含まれています。PS 細胞内膜輸送、分泌、アポトーシス19,20など多くの細胞プロセスに不可欠なコンポーネントであるために、人工小胞準備のために特に重要です。
合成脂質ベシクルのサイズよくナノメートルから数 μ の範囲します。いくつか異なる小胞準備、巨大リポソーム (Guv) の間で、数十 μ m の直径は比較的サイズが大きいため、密接に類似している特に重要な個々 の寸法細胞21,22,23.、Guv の使用可能な表面領域を有効に、ローカル化学勾配特性に及ぼす膜生物物理勉強します。外部からの刺激を細胞膜表面の一部のみを公開すると、膜の原動力をより密接に調べることができます。たとえば、膜の表面に化学的または pH 勾配のローカライズされたアプリケーションが一括露光24,25では見られなかった管状の突起の形成につながることが示されています。膜挙動の観測の違いは細胞膜リモデリングのメカニズムにいくつかの洞察力を得るために単一胞尋問方式の発展方法に求めます。
建物のマイクロインジェクションと早い 1900 年代26,27、2000 年代23,28から単一胞操作方式のより最近の進歩に関連してからマイクロマニピュレーションの方法、本稿は膜カルシウム イオンのローカル アプリケーションに対する応答で改造と旦那膜膜管状突起 (MTPs) の形成を生成します。 アプローチ。
我々 のアプローチは、生体膜モデル系 (図 1 a) として多重小胞 (MLV) に接続されている旦那から成る複雑な小胞を利用しています。MLV がカルシウム イオン勾配への露出の間に、GUV 脂質材料を供給する複雑な脂質貯蔵所として必要です。この接続では、誘導改造中膜張力の増加を補うため、GUV 膜の遷移形状と MTP 成長のため脂質を提供複雑なことができます。さらに、MLV 表面固定化が容易、質量が大きいため、GUV のそれと比較します。GUV MLV の複合体、固体基板上に固定したときはカーボンナノ チューブ小胞ネットワークを生産、高分子膜の相互作用の勉強、エキソサイトーシス29,30の後期段階を模倣に以前使用されていた 31,32,33。
以前のプロトコルには、大豆極性脂質抽出物 GUV MLV 錯体28を準備する (SPE) が利用されています。SPE は、ホスファチジン酸 (PA、6.9%)、および他の脂質 (6.9%) の混合物は、PC (45.7%)、PE (22.1%)、ホスファチジルイノシトール (PI、18.4%)、リン脂質の混合物から構成されます。本プロトコルで SPE の混合物は 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (ナトリウム塩) の 20% をドープした (DOP) がセル血しょう膜の内部のリーフレットを模倣します。さらに 1% の ATTO 488-1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (ATTO488 ドープ) は、蛍光顕微鏡を用いた膜リモデリングの監視を有効にする脂質二分子膜を染色する使用されます。膜は 2 層の間で対称の脂質組成を有しローカル塩化カルシウム (CaCl2) の 5 mM の濃度にさらされています。高カルシウム イオン濃度では、このような実験条件も PS 分子が表現された34をアポトーシス細胞の外膜リーフレットを模倣します。GUV MLV 複合体の形成には、最初クリアドとケラー35によって開発された変更された水分補給乾燥法が必要です。小胞の準備のプロトコルには使用して、ソリューションの小さい小胞を形成する乾燥脂質層の形成が含まれています。このソリューションは、脱水し、最終の GUV MLV 錯体を形成するために復元されました。図 2A-Dは、典型的な GUV MLV の複合体の準備のための主な手順を示しています。
小胞の準備が完了し、複雑な小胞はガラス基板に固定化した、マイクロインジェクション法を使用して、開く先端ガラス マイクロ ピペットを旦那のリーフレットには外側に少量のカルシウム イオンを提供します。先端からカルシウム溶液の流れは膜を改造と Mtp の世代につながる GUV 膜表面でローカライズされたカルシウム イオン勾配を生成します。Mtp はカルシウム イオン源から離れる方向、GUV の中育ちます。この MTP 形成は、蛍光顕微鏡を用いた直接監視することができ、デジタル カメラを使用して記録されます。図 3は、生成膜の改造に使用される実験のセットアップを示しています。このプロトコルでは Mtp (図 2 eおよび図 4) の形成は、一括ボリューム状態のカルシウム イオン暴露実験に対照的な結果を示しています。一括の条件下で、膜破裂し、ガラス表面25に準拠する観察することができます膜パッチを形成します。
カルシウム イオンのマイクロインジェクションを実行する手順と同様に、GUV MLV 錯体の形成に関する詳細は、この資料で説明します。プロトコルは主としてカルシウム イオン マイクロインジェクション; に焦点を当ててください。ただし、この方法は、他のイオンやタンパク質に局所曝露による膜反応の勉強に使用する簡単に変更できます。さらに、膜を改造中脂質のコンポーネントの役割を分離する膜小胞の組成を調整できます。提案するプロトコルは、GUV MLV 錯体を生成する任意の高度な機器を必要としないし、再現性の高度特徴付けられます。
プロトコル
1. 小さな脂質ベシクルの準備
- 79/20/1.The クロロホルムの脂質の濃度が 1 mg/mL、最終的な質量を 0.6 mg (通常より 1 mg) 最終の混合比質量を持つ脂質 SPE/DOPS/ATTO488 ドープ クロロホルム溶液を準備します。(下部のガラス管、10 × 75 mm) 丸底ガラスバイアル ラウンド使い捨て前洗浄ステップなし脂質ソリューションを準備するときに使用します。
- 記入し、使用前に少なくとも 5 回クロロホルムとガラス注射器 (25 μ L) をすすいでください。記入し、リンスのガラス製注射器に少なくとも 5 回、3-4 mL のクロロホルムで十分です。
注意: ガラス注射器を使用、クロロホルムを処理および適切な手袋を着用しながらヒューム フードのすべての手順を実行し、すべての回で保護メガネ。クロロホルムを処理するときプラスチック フラスコや注射器、ピペットを使わない。
- 記入し、使用前に少なくとも 5 回クロロホルムとガラス注射器 (25 μ L) をすすいでください。記入し、リンスのガラス製注射器に少なくとも 5 回、3-4 mL のクロロホルムで十分です。
- 周囲の光から内容を保護し、到達 80 rpm で 7 kPa の真空圧をクロロホルムを削除する 3 時間ロータリーエバポレーターで溶剤を蒸発金属箔と脂質の混合物を含むガラスの瓶をラップします。ガラス瓶の下部に乾燥脂質被膜を形成して、蒸発 (図 2 a) 後。
注: スケール数回アップして脂質量クロロホルムの完全除去を確実に回転蒸発時間を必要があります。 - ゆっくりとリン酸の 600 μ L 乾燥脂質膜上に生理食塩水 (PBS) 緩衝液 (pH 7.8、希釈せず) をバッファーを追加します。次のバッファーの追加により、優しく GUV MLV 形成手順 (1 wt % のグリセロールの最終的な集中を達成する)36の間に完全な脱水からサンプルを保護するためにグリセリンの 6 μ L を追加します。金属箔でパラフィルムとカバーを使用して周囲の光から守るためにガラスの瓶を密封してください。一晩 4 ° C で冷蔵庫に保存します。
PBS 緩衝液は Trizma ベースの 0.151 g、K3PO4の 1.592 g、KH2PO4の 1.021 g、MgSO4 ·7H2O、0.062 g と 250 mL の精製水に EDTA 0.0465 g で構成されています。4 ° C でソリューションを格納し、使用する前に室温に戻します。10 mM HEPES 緩衝の相当額は、PBS ソリューションの代わりに使用できます。HEPES 緩衝液は、精製水で 1 M HEPES 原液を希釈することによって準備されます。 - 次の日、室温で超音波風呂を使用して 1 分のためのソリューションを含むガラスの瓶を超音波照射します。パラフィルムを削除し、小さな脂質ベシクルの視覚的に統一されたソリューションが形成されるまでのピペット (図 2 b)。個々 の 0.5 mL プラスチック チューブに得られる小さな脂質ベシクル溶液の分注 30 μ L。最長 6 ヶ月間-18 ° C でこれらの株式の因数を維持します。
注: 視覚的に小さな脂質ベシクルのソリューションがない場合制服、渦 4 回最大速度で渦のミキサーを使用して 1 〜 2 秒のためのソリューション。
2. の GUV MLV 錯体の合成
- 部屋の温度に小さな脂質ベシクルの冷凍懸濁液の因数が含まれているプラスチック製のチューブを解凍します。渦管 4 回最大速度で渦のミキサーを使用して 1-2 秒。
- 小さなを形成するガラス製カバー スリップ (24 × 60 mm) の表面に小さな脂質ベシクル サスペンションのプレイス 5 μ L は、液滴をラウンドします。前洗浄手順を踏まなくてもガラス製カバー スリップを使用します。
- 真空デシケータのガラス製カバー スリップを配置 (< 100 kPa の真空) 20 分。
- 4 分間、室温で乾燥させた脂質膜を保存し、ゆっくりと水分補給のため乾燥脂質膜上に 10 mM HEPES バッファーの 50 μ L をピペットします。事前 GUV MLV 錯体 (図 2) を形成する 5 分を待ちます。
- 顕微鏡ステージのガラス製カバー スリップを中心し、それを HEPES バッファーの 300 μ L をピペット (図 3 b) 目的上の液滴の中心します。
- HEPES ソリューション (300 μ L) に前もって形成された GUV MLV ソリューションの 50 μ L を転送します。(図 2 D) ガラス製カバー スリップの表面にしっかりと付着するまばらに形成された GUV MLV 錯体を許可する 25 分を待ちます。
注: 場合によっては、GUV MLV 錯体を形成しないガラス製カバー スリップ上、脂質パッチや Mlv だけを観察する代わりに。これは偶発的な揺れのサンプルの手順の中に小さな小胞懸濁液の 2.4 か 2.6、または多数の凍結融解サイクルによって説明できます。手順 2.1 2.6 か GUV MLV 錯体を取得する新鮮な脂質貯蔵液 (ステップ 1.1) を使用します。
3. マイクロ ピペット作製とマイクロインジェクション
- 毛細血管をそっと置くことによってホウケイ酸ガラス管のエッジのラウンドをマイクロ ピペット ピペット ホルダーに追加中壊れているを防ぐためにろうそくの炎に終了します。
- プログラムのセットを使用して自動レーザー引き手を使用して少なくとも 3 のガラス管を引く: 熱 = 400、Fil = 4、ヴェル = 50、デル 225、プルを = =;熱 = 400、Fil = 4、ヴェル 60、デル = 150、プルを = = 120。プログラム セット Pul 空白の最初の値を入力してください。管内径 (内径) のホウケイ酸ガラス管を使用して 1.00 mm と外径 (外径) 0.78 mm 直径約 0.3 μ m の先端開口を有するマイクロ ピペット。
- 埋戻し 5 mM HEPES バッファー (10 mM)、microloader を使用しての CaCl2ソリューションの 8 μ L を各マイクロ ピペット。0.2 0.5 を使用して CaCl2ソリューションをフィルター μ m シリンジ フィルター ピペット チップの目詰まりを避けるために使用する前に。
注: は、CaCl2が手順 2.4 から 2.6 にも使用される HEPES 緩衝液に溶解して完全にいるを確認します。 - マイクロマニピュレーターにマイクロ ピペット ホルダーを接続します。しっかりと、ピペット ホルダーにマイクロ ピペットをマウントします。噴射ポンプ、供給管を用いたキャピラリーのホルダーを接続します。
- 噴射ポンプを起動します。20 hPa (射出圧力) の噴射ポンプの設定を調整し、5 hPa 補正圧力を自動モードに設定します。マイクロ ピペット、マイクロインジェクションの準備が整うまでに、噴射ポンプを一時停止します。
- 顕微鏡を明視野観察モードに設定します。差動干渉の対照 (DIC) 用に構成します。63 X または 100 X 高 NA (1.3) 目標を最適な膜エッジの解像度を達成するために使用します。
- 粗動マニピュレーターを使用して、上記の GUV MLV 錯体を含む液滴マイクロ ピペットを配置します。上記の目的ピペットの先端を探します。
- GUV MLV 複合体の中間点の顕微鏡の焦点し、再び GUV の上約 50 μ m 焦点を当てます。焦点にマイクロ ピペットをゆっくりさせるマニピュレーターの粗モードを使用します。
- マニピュレーターを fine モードに切り替えます。ゆっくりとダウン マイクロ ピペット チップを翻訳、フォーカスの先端を維持し、ながら旦那の表面に焦点を合わせます。GUV 表面からピペット先端約 20 μ m を位置します。マイクロ ピペット チップ、ガラス製カバー スリップ (図 5 bの例) との偶発的な接触のために壊れて、バルク試料に不要なカルシウム イオン放出を避けるためにすぐにそれを交換してください。
4. 形成とカルシウム イオン源を用いた Mtp の翻訳
- 顕微鏡は、蛍光モードに設定します。488 でエキサイトする dichroics を設定 nm と 505 550 nm の発光を検出します。
- 噴射ポンプに切り替え、カルシウム イオン注入を開始します。マイクロマニピュレーター等の細かいモードを使用し、マイクロ ピペット チップで旦那にゆっくりと近づきます。フォーム (図 4) を Mtp を許可するマイクロ ピペットから CaCl2ソリューションを注入しながら、膜面から 3 μ m の距離でマイクロ ピペット チップを置きます。
- 旦那の表面に沿って Mtp を翻訳するためゆっくりと移動ピペット チップ (0.1 0.3 の速度と μ m/s)、GUV の周り表面微動マイクロマニピュレーター (図 6) を使用します。カルシウム イオン注入を継続しながら旦那とマイクロ ピペット チップの約同じ距離 (3 μ m) を維持します。
注: マイクロ ピペット チップ (0.7 μ m/s) 上の高い翻訳レートで Mtp が移行されません、ピペットと同期。代わりに、彼らは散布し、短縮、新しい Mtp にマイクロ ピペット チップ (図 7) の新しい場所で形成される間。 - 停止する、マイクロインジェクション噴射ポンプをオフにし、GUV 表面かマイクロ ピペットを移動します。
結果
この作品は、GUV MLV の複合体および細胞膜の動態に及ぼすカルシウム イオン勾配を解明するための使用方法の作成を示す.GUV MLV 錯体の表面接続はマイクロインジェクションによるイオン勾配を確立している間固定細胞サイズリポソームの模倣を可能にするこれらの実験に必要です。旦那の膜は、Mtp カルシウム イオン源から監督の形成によってローカライズされたカルシウム濃度に応答します。また、Mtp は、膜表面をマイクロ ピペット チップを移動することによってのプロセス非接触方法で旦那の周り翻訳できます。
GUV MLV の準備手順の模式図、図 2に示します。提示プロトコルで 2.4 (図 2) の段階は GUV MLV 錯体が前もって形作られた既によう、まばらに形成された GUV MLV 錯体ができますバッファー (プロトコルの手順 2.6) の別の 300 μ L 液滴への小胞のソリューションの転送ガラス基板に十分に従います。この方法でマイクロマニピュレーションのマイクロインジェクション適した複合体が確立される (図 2 D)。時折、膜は、MTP 形成に影響しない図 4 aに示すように、1 つまたは複数の内包された脂質ベシクルを含まれています。これらの膜生成 Mtp;ただし、内包された小胞が大きい場合、イメージングが妨げられる可能性があります。準備の Guv の大半 (75% まで) 半球表示、図 1 aに示すように、Mlv にアタッチされます。これらの小胞はこのプロトコルの主な焦点、マイクロインジェクション プロシージャに適したです。残りの Guv の約 25% が起伏のある表示されます (図 1 b)、低い膜緊張体制を示すものであります。これらの起伏のある小胞も管状の突起の形成を可能にします。しかし、彼らはこのプロトコル25の範囲を超えている形成された Mtp の異なる形態と異なる反応を示します。準備された小胞の典型的な直径は異なります、Mlv の 2 に 15 μ m および 2 に 40 μ m、膜の間です。カルシウム イオンへの曝露が 5 μ m のサイズ以上の最適な旦那。
マイクロ ピペットは、単一セル尋問方式もいくつか数十年37,38合成膜の操作を必要とする手順同様にで使用されています。これらのアプリケーションの大部分には、ピペットと細胞や小胞の表面との間の直接物理的な接触が関与しています。パッチ ・ クランプの技術またはカーボンナノ チューブ小胞ネットワーク23,28,39を構築できるほか、GUV 膜から膜綱を引きがあります。最近では、マイクロ ピペットは、イオンと異種細胞微小24,25を再構築する膜中の分子のローカライズされたグラデーションを生成する使用されています。正常マイクロ ピペット (図 5 a) は、提示されたプロトコル内に含まれるソリューションをリリースして旦那の表面にカルシウム イオン勾配を確立するための重要な要因です。適切な GUV 表面にマイクロ ピペットの位置と脂質膜との接触を回避するマイクロインジェクション成功に不可欠です。マイクロ ピペットのチップは、細胞膜近くカルシウムのバリエーションを真似しながら Mtp を生成するための最適な距離は、GUV の表面から約 3 μ m の距離で開催されます。マイクロ ピペット チップが誤って壊れた (図 5 b) の場合は、交換が必要です。MTP の形成を可能に、マイクロ ピペットの中以前にテストした濃度範囲の CaCl2は 2 と 5 mM25、細胞外カルシウム濃度に相当します。CaCl2濃度、すなわち1 mM、Mtp は認められなかった。
露出 (図 4 b) のサイトで Mtp に育つ小さな膜陥入の形成とカルシウムのマイクロインジェクションに Mtp の形成を開始します。Mtp はカルシウム イオンにさらされる旦那膜残っている限り成長し続けます。彼らは変動して (図 4、附則ムービー 1) カルシウム イオン源から遠ざかります。カルシウム イオンの供給を終了すると、Mtp ままか最終的に消えるかどうかを判断し難い GUV 表面に Mtp が散布図です。
Mtp の形成を説明できるは直接関連付けられているローカライズされたカルシウム イオン GUV 膜の露出外側リーフレットへのバインドおよび自発曲率 (m) をトリガーの自発的な形成張力σ = 2κm2 (Κは曲げ剛性)、膜の曲げと内側の Mtp の形成を誘発します。以前のレポートは、結露による説明および/または負荷電脂質膜にカルシウム イオンが結合する負の自発曲率40の結果のクラスタ リング、膜の変形ができることを実証しています。また、Ca2 +負荷電膜の表面に強力な結合は、露出した脂質二分子膜リーフレット表面電荷密度を中和します。これは二分子膜・膜25を曲げるのに十分な以外の自発曲率の結果の間で電荷密度の差につながります。
観測された Mtp におけるカルシウム イオンに対する脂質膜の感度を示します膜管状構造を作成する新しい非接触アプローチを提供しています。膜形状の様々 な細胞の機能や細胞を作り直す時に移行のダイナミクスを理解するために重要であること、細胞内の脂質の構成に洞察力を得るために有用することができますこの膜するの起源を解明膜。
観測された Mtp はカルシウム イオンの露出を経る膜上のサイトに常に生成されます。したがって、マイクロ ピペット チップの場所を選択すると、GUV 表面突起成長のための領域を定義することが可能です。次に、マイクロ ピペットはゆっくりと (0.1 0.3 μ m/s) GUV 表面膜からの距離を維持しながら移動 Mtp はマイクロ ピペットとタンデムで変換されます。図 6および対応する補助映画 2 GUV 表面の周り Mtp のような移行を示します。このプロセスは連続的なカルシウム イオン注入25時に新しい Mtp の形成を伴うことに可能性があります。高い翻訳レート (0.7 μ m/s) 以上で、Mtp はマイクロ ピペット チップに従うことは。代わりに、マイクロ ピペット チップ (図 7) の新しい場所で新しい突起が形成されます。
観測された非接触型カルシウム イオン ガイドの翻訳 MTPs さらに運転の我々 の理解力の細胞内膜管状構造物のダイナミクス GUV 表面ができます周り。さらに、このアプローチは、化学勾配を用いたソフトマター系における物質の輸送を制御するための新しい非接触モードを提供しています。

図 1: ガラス製カバー スリップの表面に固定化した GUV MLV 錯体の代表的な蛍光顕微鏡画像。(A). 球状 GUV の例。旦那は、MLV に接続されている半球の形で表示されます。(B). 起伏のある旦那の例。黒い矢印は、膜の変形領域を示します。画像が強化され、蛍光に分類された旦那膜の可視化を改善するために反転します。スケール バーを表す 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。
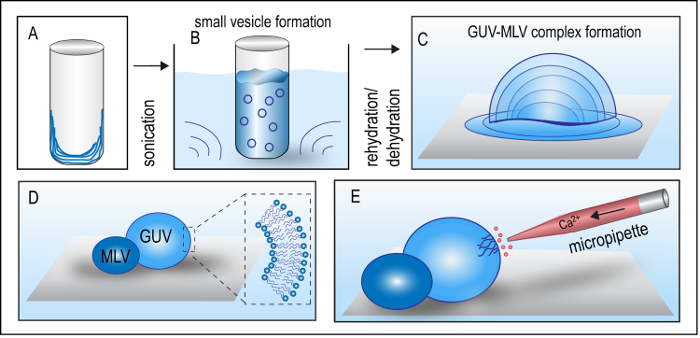
図 2: GUV MLV 準備とインジェクション方式の模式図.(A). 乾燥脂質層が脂質ソリューションからクロロホルムの回転蒸発によりガラス瓶の下部に形成されます。(B). 水分を補給された脂質層は、超音波処理し、脂質膜小胞が形成されます。(C). 小胞液 (5 μ L) の小さな液滴のガラス製カバー スリップの表面に置かれ、脂質ソリューションを脱水し、(このステップは表示されません) 乾燥脂質膜を形成する 20 分間乾燥器に転送します。緩衝液 50 μ L で乾燥の脂質膜を復元すること前もって形成された GUV MLV 錯体を生成します。(D). まばらで区切られた GUV Mlv の形成により、バッファーの大きいボリュームに前もって形成された複合体の転送は、ガラス製カバー スリップの面に取り付け。(E). 旦那の表面近くマイクロ ピペットを位置決めとカルシウム イオンを放出 Mtp の形成をトリガーします。イラストないスケール。この図の拡大版を表示するのにはここをクリックしてください。

図 3: カルシウム イオンのマイクロインジェクションの実験のセットアップ。(A).、Guv の Mtp を生成に必要な実験のセットアップのコンポーネントです。(B). マイクロインジェクション セットアップの詳細。GUV MLV 錯体の溶液でのガラス基板は、顕微鏡ステージ上に配置。マイクロ ピペットとガラス製カバー スリップの表面間の角度は 30 ° (白でマークです)。この図の拡大版を表示するのにはここをクリックしてください。
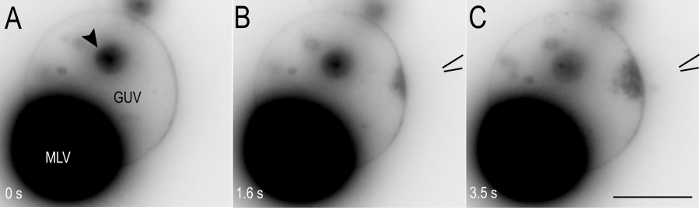
図 4: 旦那の表面にカルシウム イオンのマイクロインジェクションに Mtp の形成します。(A). カルシウム イオン勾配への暴露の前に、GUV MLV コンプレックス。矢印の GUV、内部に陥れた脂質小胞と Mtp。 (B) の観測を妨げないです。小さな Mtp は、カルシウム イオン (CaCl2マイクロ ピペットでの濃度 5 mM) のマイクロインジェクションに形成されます。(C). カルシウム イオンへの連続的な露出に Mtp の成長。蛍光イメージが強化され可視化目的のため反転します。スケール バーを表す 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 5: ガラスのカルシウム イオンのインジェクション用マイクロ ピペット。(A). 正常マイクロ ピペットの例。(B). (被災地は黒の矢印で示されます) 壊れた先端マイクロ ピペットの例。両方のイメージが強化されより良い視覚化のため反転します。スケール バーを表す 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。
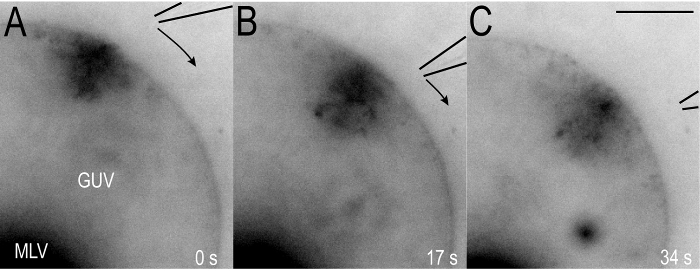
図 6: カルシウム イオン誘導翻訳 MTPs、GUV の表面のまわりの。(A).「Mtp で 5 mM CaCl2ソリューションのマイクロインジェクションに GUV 表面形成されます。(B ・ C)。マイクロ ピペット チップの翻訳 (0.2 0.3 μ m/s) 膜の周り表面はカルシウム イオン源の方向に Mtp の動きをトリガーします。黒い矢印は、ピペットの動きの方向を強調表示します。画像が強化され、膜の可視化を改善するために反転します。スケール バーを表す 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。
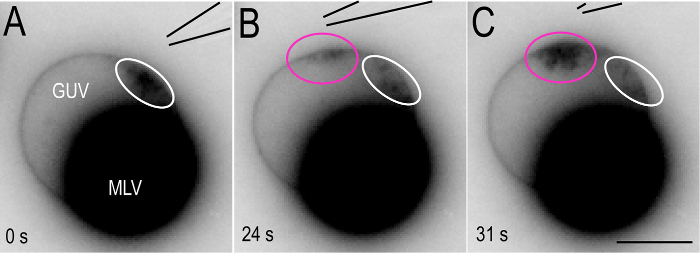
図 7: マイクロ ピペット チップの高い翻訳レートで Mtp 。(A).「Mtp で 5 mM CaCl2ソリューション (白い線) のマイクロインジェクションに GUV 表面形成されます。(B ・ C)。マイクロ ピペット GUV 表面 (1 μ m/s) の周りの高い翻訳率以前に形成された Mtp (白い線) の散乱、マイクロ ピペット チップ (マゼンタの線) の新しい場所で新しい Mtp の形成で起因します。この図の拡大版を表示するのにはここをクリックしてください。
附則ムービー 1:Ca に局所曝露時に旦那の Mtp の形成2 +グラデーションします。この映画をダウンロードするここをクリックしてください。
附則ムービー 2:GUV 表面カルシウム イオン誘導 MTP 移行します。 この映画をダウンロードするここをクリックしてください。
ディスカッション
生体細胞イオン、タンパク質やナノ粒子などの外部刺激を浴びる膜挙動に関する研究を可能にします。Guv、このようなモデルであることが多く管状構造と陥入24,41,42,43 の形成は、その形状を調整することによって化学環境の変化に対応できます。.
この記事では、GUV 表面におけるカルシウム イオンのローカライズされた注入 GUV 表面の改造による非接触方法で Mtp を生成する方法を提供しています。プロトコルは、フォーム Mtp に旦那に近いイオン勾配表面のカルシウムを生成するためのマイクロインジェクション技術を採用する方法とセル血しょう膜、同様の模倣の GUV MLV の複合体の準備を記述します。カルシウム イオン膜相互作用に対処前の実験的研究の大半は、カルシウム イオン濃度14,17を一括する脂質ベシクルを公開しました。実験条件によってこのような一括露光のない管状の突起形成25の異なる膜応答可能性があります。
GUV MLV 複合体の形成は、むしろ単純でのみ標準実験装置、ロータリーエバポレーター、超音波風呂、真空デシケータなどが必要です。それでも、小胞準備中に考慮すべきいくつかの重要なステップがあります。小胞の脱水が完了すると (プロトコルの手順 2.3) の中に、ガラス製カバー スリップの表面に少量の塩の結晶のみを含む乾燥循環脂質膜が形成されることを確認することが重要です。実験では、慎重な取り扱いの小胞性の成功の GUV MLV 錯体の合成に不可欠な新鮮な脂質クロロホルムとして新鮮な HEPES 緩衝液、原液を使用してです。さらに、ガラス カバー スリップ表面 GUV MLV 複合体のセキュリティで保護された添付ファイルは、マイクロマニピュレーション、マイクロインジェクションにとって重要です。GUV MLV の十分な密着性を確認するため、複雑な注入流れ) を除いたマイクロ ピペット使用できます GUV 表面に対して優しくプッシュします。しっかりと付着小胞と直接物理的な接触に表面に沿ってスライドされます。実験はいくつかの時間のために問い合わせることができますの開いているバッファー液滴で実行されるので、蒸発が考慮する必要があります。バッファー液滴からの蒸発量に影響を与えることができると、小胞を不安定にする浸透圧条件が変更されます。浸透圧条件を復元元のボリュームを復元するためにサンプル純粋な水の定期的な添加は恒常性するシステムを返します。
脂質膜の組成を変更するとき、MLV 膜再編中に旦那に脂質素材を転送することができますので、小胞が GUV MLV の複合体の形で生産されている重要です。以前の研究では、純粋な脂質は、SPE の混合物のコンポーネントの交換や、コレステロールの 5-30% の追加も GUV MLV 複合体形成28,44できますを示しています。準備の Guv の大半は、リポソーム45です。
さらに、他の 2価陽イオン、マグネシウム イオンなどのテスト Mtp の形成は大きく脂質混合物に負荷電 DOPS の存在に依存します。ドプス、なし、Mtp はこのプロトコルで記述されている小胞では形成しません。また、カリウムやナトリウムなどのカチオンは DOPS を含む小胞25でも、Mtp の形成されません。
準備と、Guv の操作に関して重要な手順、に加えてマイクロインジェクション処理中に考慮すべきいくつかの重要な要因があります。カルシウム イオンの成功のインジェクションが正しく機能に大きく依存していますガラス マイクロ ピペットは、実験の日に準備されます。誤動作するマイクロ ピペットを引き起こす可能性のあるいくつかの要因があります。一般的な理由は、詰まっている先端開口です。小胞準備の副産物である、小さな脂質粒子は溶液中に分散しているし、目詰まりを発生するマイクロ ピペット チップに付着する傾向があります。ピペットの先端を清掃最高、ベシクル溶液から持ち上げて、GUV 表面近くに戻ってそれを置くことによってされます。一括ソリューションへのカルシウム イオンの大規模な注入を得られるので、インジェクション ポンプのブローアウト関数の使用を避けなければなりません。さらに、マイクロ ピペット内に陥れた小さな気泡を防ぐ適切なマイクロインジェクション、マイクロ ピペットの場合、新しいものに置き換えてくださいします。先端の破損とは、大幅には先端の振動を抑える制振テーブルに実験装置を置くことによって最小化します。
さらに、ケアは、最高の時間分解画像を取得しながら退色を最小限に抑えるための観測パターンを選択するときに実行する必要があります。客観的限られたプローブの深さで比較的高い画像集録レートできるため、広視野レーザ誘起蛍光顕微鏡はこのプロトコルで利用されました。さらに、倒立顕微鏡の使用法は同時マイクロインジェクション ・脂質ベシクルの Mtp 観測ことができます。
本手法の主な制限の 1 つは、膨大な手作業とマイクロマニピュレーションの十分なスキルの要件です。自発的な膨潤過程を経て複合体が形成される、ので、Guv と Mlv のサイズを制御できません。さらに、このプロトコルは膜リモデリングに関する追加の詳細情報を収集する必要があります準備の GUV MLV 錯体膜張力の制御することはできません。膜は、のみ、膜から膜を利用した達成するために可能になる程度に Mtp の相当な成長のための後者の供給脂質材料と Mlv に接続されます。Mlv は、GUV MLV 複雑な44、マイクロ ピペット吸引を使用して小胞の張力を制御する試みを複雑になるサブファミリ任意側面の表面張力を下げることにも貢献します。この GUV ベース MLV のモデルより良い膜ひだや陥入46などの膜溜に接続された細胞膜構造物の張力体制を模倣した低緊張を提供しています。同時に、単一 Guv の膜の張力を制御するマイクロ ピペット吸引法を正常に適用できます。たとえば、グラバーらによって仕事カルシウム イオンが結合する単一 Guv の膜管状に陥入の形成に、詳細、様々 な緊張体制40から一括条件で膜を提供します。最後に、カルシウムにローカルおよび一括露光で膜性状の比較は、このプロトコルの範囲を超えている表面に皮膜密着性の改善された制御を必要とします。
要約すると、提案手法は非接触膜リモデリングとカルシウム イオンの刺激によるローカライズされた Mtp の形成についてことができます。セル鉱物など、ネイティブの生体膜に小胞の合成システムから変換でこのメソッド センターの将来のアプリケーション。提案手法をパッチ ・ クランプまたは電極の電流などの他の単一セルの尋問スキームで組み込むかと組み合わせることができますローカライズ戦略31,47,48を加熱します。他のイオンや分子の効果を検査は簡単で、単に興味の分子とカルシウム イオンを置き換える必要があります。さらに、複雑な合成脂質膜小胞は膜貫通タンパク質は、ローカルのセンシングに関連付けられている細胞の再編と細胞膜のダイナミクスの生物物理学の私達の理解を拡大することで膜を高機能化を通して作り出すことができます。化学のグラデーション。最後にではなく、少なくとも、脂質膜の非接触刺激を新規の非接触操作プラットフォームのための基礎を提供する高分子ソフトマター システムに訳すことも可能します。
資料
| Name | Company | Catalog Number | Comments |
| Soy bean polar lipid extract | Avanti Polar Lipids, Inc. (Alabaster, USA) | 541602C | 100 mg |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt) DOPS | Avanti Polar Lipids, Inc. (Alabaster, USA) | 840035C | 1x25 mg |
| ATTO 488- 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) | ATTO-TEC (Germany) | AD 488-31 | 1 mg |
| Hamilton syringe, 700 series, fixed needle, 702N, volume 25 μL, needle size 22s ga (bevel tip), needle L 51 mm (2 in.) | Sigma Aldrich (Missouri, USA) | 20735 SIGMA-ALDRICH | |
| Pyrex Tube, culture, disposable, rimless, 10x75 mm, Borosilicate glass 250/pack | Corning Incorporated (Corning, NY 14831) | 99445-10 | |
| Chloroform CHROMASOLV Plus, for HPLC, ≥99.9%, contains amylenes as stabilizer | Sigma Aldrich (Missouri, USA) | 650498-1L-D | |
| Rotary evaporator | Büchi Rotavapor R-144 Switzerland | ||
| Kalciumklorid purum torkad minimum 95% medelkornig 5-10 mm | KEBO lab (Sweden) | MA00360500 | |
| Magnesium chloride hexahydrate reagent grade ACS, ISO | Sharlau Chemie S.A. (Spain) | P9333-500G | |
| Potassium chloride, SigmaUltra, minimum 99.0% | Sigma Aldrich (Missouri, USA) | S7653-1KG | |
| Sodium chloride, SigmaUltra, minimum 99.5% | Sigma Aldrich (Missouri, USA) | G5516-1L | |
| Glycerol, for molecular biology, minimum 99% | Sigma Aldrich (Missouri, USA) | T-1503 2050 g | |
| Trizma base | Sigma Aldrich (Missouri, USA) | P5629-500G | |
| Potassium phosphate tribasic (K3PO4) | Sigma Aldrich (Missouri, USA) | P5655 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma Aldrich (Missouri, USA) | 5886 | |
| MgSO4 | Merck (USA) | 34549-100 g | |
| EDTA | Sigma Aldrich (Missouri, USA) | H0887 Sigma | |
| HEPES solution 1 M, pH 7.0-7.6, sterile-filtered, BioReagent, suitable for cell culture | Sigma Aldrich (Missouri, USA) | Z260282-1PAK | 24x60 mm |
| Acrodisc syringe filters, PVDF membrane, diam. 13 mm, pore size 0.2 μm | Sigma Aldrich (Missouri, USA) | 631-1339 | |
| Menzel Gläzer #1, glass cover slip | VWR (USA) | ||
| Diaphragm vacuum pump for the desiccator | Vacuubrand (Germany) | ||
| Ultrasonicate bath | Bandelin Sonolex (Germany) | ||
| VX-100 Lab vortexer vortex mixer | Labnet International (USA) | ||
| 488 nm laser line | Cobolt MLD-488 nm (Solna, Sweden) | ||
| Leica Microsystems immersion oil for microscopes | Leica (Germany) | 12847995 | |
| Inverted fluorescence microscopy system | Leica DM IRB (Wetzlar, Germany) | ||
| Camera (Prosilica Ex 1920, Allied Vision) | Technologies GmbH (Thuringia, Germany) | 300038 | |
| PatchStar Micromanipulator | Scientifica (Uckfield, UK) | 612-7933 | |
| Borosilicate glass capillaries, GC100TF-10, 1.00mm O.D. X 0.78mm I.D. | Harvard Apparatus U.K | ||
| Eppendorf microloader (pipette tips) | VWR (USA) | ||
| P-2000 CO2 laser-puller | Sutter Instruments (Novato, USA) | ||
| Femtoliter automatic injection pump, Eppendorf Femtojet | Eppendorf (Germany) |
参考文献
- Monteith, G. R., McAndrew, D., Faddy, H. M., Roberts-Thomson, S. J. Calcium and cancer: Targeting Ca2+ transport. Nature Reviews Cancer. 7 (7), 519-530 (2007).
- Meldolesi, J., Pozzan, T. The endoplasmic reticulum Ca2+ store: A view from the lumen. Trends in Biochemical Science. 23 (1), 10-14 (1998).
- Bygrave, F. L., Benedetti, A. What is the concentration of calcium ions in the endoplasmic reticulum?. Cell Calcium. 19 (6), 547-551 (1996).
- Mogami, H., Tepikin, A. V., Petersen, O. H. Termination of cytosolic Ca2+ signals: Ca2+ reuptake into intracellular stores is regulated by the free Ca2+ concentration in the store lumen. The EMBO Journal. 17 (2), 435-442 (1998).
- SantoDomingo, J., et al. Calcium dynamics in bovine adrenal medulla chromaffin cell secretory granules. European Journal of Neuroscience. 28 (7), 1265-1274 (2008).
- Moreno, A., et al. Calcium dynamics in catecholamine-containing secretory vesicles. Cell Calcium. 37 (6), 555-564 (2005).
- Bulenda, D., Gratzl, M. Matrix free Ca2+ in isolated chromaffin vesicles. Biochemistry. 24 (26), 7760-7765 (1985).
- Montero, M., et al. Chromaffin-cell stimulation triggers fast millimolar mitochondrial Ca2+ transients that modulate secretion. Nature Cell Biology. 2 (2), 57-61 (2000).
- Villalobos, C., et al. Redistribution of Ca2+ among cytosol and organella during stimulation of bovine chromaffin cells. The FASEB Journal. 16 (3), 343-353 (2002).
- Brown, E. M., Hofer, A. M. Extracellular calcium sensing and signalling. Nature Reviews Molecular Cell Biology. 4 (7), 530-538 (2003).
- Tarafdar, P. K., Chakraborty, H., Dennison, S. M., Lentz, B. R. Phosphatidylserine inhibits and calcium promotes model membrane fusion. Biophysical Journal. 103 (9), 1880-1889 (2012).
- Boettcher, J. M., et al. Atomic view of calcium-induced clustering of phosphatidylserine in mixed lipid bilayers. Biochemistry. 50, 2264-2273 (2011).
- Binder, H., Zschörnig, O. The effect of metal cations on the phase behavior and hydration characteristics of phospholipid membranes. Chemistry and Physics of Lipids. 115, 39-61 (2002).
- Sinn, C. G., Antonietti, M., Dimova, R. Binding of calcium to phosphatidylcholine-phosphatidylserine membranes. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 282-283, 410-419 (2006).
- Pedersen, U. R., Leidy, C., Westh, P., Peters, G. N. H. The effect of calcium on the properties of charged phospholipid bilayers. Biochimica et Biophysica Acta. , 573-582 (2006).
- Melcrova, A., et al. The complex nature of calcium cation interactions with phospholipid bilayers. Scientific Reports. 6, 38035 (2016).
- Roux, M., Bloom, M. Ca2+, Mg2+, Li+, Na+, and K+ distributions in the headgroup region of binary membranes of phosphatidylcholine and phosphatidylserine as seen by deuterium NMR. Biochemistry. 29 (30), 7077-7089 (1990).
- Waldbillig, R. C., Robertson, J. D., McIntosh, T. J. Images of divalent cations in unstained symmetric and asymmetric lipid bilayers. Biochimica et Biophysica Act. 448 (1), 1-14 (1976).
- Kay, J. G., Koivusalo, M., Ma, X., Wohland, T., Grinstein, S. Phosphatidylserine dynamics in cellular membranes. Molecular Biology of the Cell. 23, 2198-2212 (2012).
- Vernier, P. T., et al. Nanopore formation and phosphatidylserine externalization in a phospholipid bilayer at high transmembrane potential. Journal of the American Chemical Society. 128, 6288-6289 (2006).
- Moscho, A., Orwar, O., Chiu, D. T., Modi, B. P., Zare, R. N. Rapid Preparation of Giant Unilamellar Vesicles. Proceedings of the National Academy of Sciences of the United States of America. 93 (21), 11443-11447 (1996).
- Walde, P., Cosentino, K., Engel, H., Stano, P. Giant Vesicles: Preparations and Applications. ChemBioChem. 11 (7), 848-865 (2010).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. S. Reconstitution of a Transmembrane Protein, the Voltage-gated Ion Channel, KvAP, into Giant Unilamellar Vesicles for Microscopy and Patch Clamp Studies. Journal of Visualized Experiments. (95), e52281 (2015).
- Khalifat, N., Puff, N., Bonneau, S., Fournier, J. B., Angelova, M. I. Membrane deformation under local pH gradient: mimicking mitochondrial cristae dynamics. Biophysical Journal. 95, 4924-4933 (2008).
- Ali Doosti, B., et al. Membrane Tubulation in Lipid Vesicles Triggered by the Local Application of Calcium Ions. Langmuir. 33 (41), 11010-11017 (2017).
- Barber, M. A. A Technic for the Inoculation of Bacteria and Other Substances into Living Cells. The Journal of Infectious Diseases. 8 (3), 348-360 (1911).
- Taylor, C. V. An accurately controllable micropipette. Science. 1329, 617-618 (1920).
- Jesorka, A., et al. Generation of phospholipid vesicle-nanotube networks and transport of molecules therein. Nature Protocols. 6 (6), 791-805 (2011).
- Lobovkina, T., et al. Mechanical tweezer action by self-tightening knots in surfactant nanotubes. Proceedings of the National Academy of Sciences of the United States of America. 101, 7949-7953 (2004).
- Karlsson, A., et al. Networks of nanotubes and containers. Nature. 409 (6817), 150 (2001).
- Wegrzyn, I., et al. Membrane protrusion coarsening and nanotubulation within giant unilamellar vesicles. Journal of the American Chemical Society. 133, 18046-18049 (2011).
- Mellander, L. J., et al. Two modes of exocytosis in an artificial cell. Scientific Reports. 4, (2014).
- Cans, A. S., et al. Artificial Cells: Unique Insights into Exocytosis Using Liposomes and Lipid Nanotubes. Proceedings of the National Academy of Sciences of the United States of America. 100 (2), 400-404 (2003).
- Hampton, M. B., Vanags, D. M., Isabella Pörn-Ares, M., Orrenius, S. Involvement of extracellular calcium in phosphatidylserine exposure during apoptosis. FEBS Letters. 399 (3), 277-282 (1996).
- Criado, M., Keller, B. U. A membrane fusion strategy for single-channel recordings of membranes usually non-accessible to patch-clamp pipette electrodes. FEBS Letters. 224, 172-176 (1987).
- Duzgunes, N. Methods in Enzymology. Liposomes Part F. Elsevier Science. , (2009).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv European Journal of Physiology. 391 (2), 85-100 (1981).
- Orwar, O., et al. Patch-Clamp Detection of Neurotransmitters in Capillary Electrophoresis. Science. 272 (5269), 1779-1782 (1996).
- Pevost, C., Tsai, F. C., Bassereau, P., Simunovic, M. Pulling Membrane Nanotubes from Giant Unilamellar Vesicles. Journal of Visualized Experiments. (130), e56086 (2017).
- Graber, Z. T., Shi, Z., Baumgart, T. Cations induce shape remodeling of negatively charged phospholipid membranes. Physical Chemistry Chemical Physics. 19 (23), 15285-15295 (2017).
- Pezeshkian, W., et al. Mechanism of Shiga Toxin Clustering on Membranes. ACS Nano. 11 (1), 314-324 (2017).
- Angelova, M. I., Tsoneva, I. Interactions of DNA with giant liposomes. Chemistry and Physics of Lipids. 101 (1), 123-137 (1999).
- Liu, Y. G., Agudo-Canalejo, J., Grafmuller, A., Dimova, R., Lipowsky, R. Patterns of Flexible Nanotubes Formed by Liquid-Ordered and Liquid-Disordered Membranes. ACS Nano. 10 (1), 463-474 (2016).
- Stepanyants, N., Jeffries, G. D. M., Orwar, O., Jesorka, A. Radial Sizing of Lipid Nanotubes Using Membrane Displacement Analysis. Nano Letters. 12 (3), 1372-1378 (2012).
- Billerit, C., et al. Heat-induced formation of single giant unilamellar vesicles. Soft Matter. (20), (2011).
- Gauthier, N. C., Fardin, M. A., Roca-Cusachs, P., Sheetz, M. P. Temporary increase in plasma membrane tension coordinates the activation of exocytosis and contraction during cell spreading. Proceedings of the National Academy of Sciences of the United States of America. 108 (35), 14467-14472 (2011).
- Garten, M., et al. Whole-GUV patch-clamping. Proceedings of the National Academy of Sciences of the United States of America. 114 (2), 328-333 (2017).
- Messina, P., et al. Monitoring and Quantifying the Passive Transport of Molecules Through Patch-Clamp Suspended Real and Model Cell Membranes. Angewandte Chemie International Edition. 126 (12), 3256 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved