このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
大人のゼブラフィッシュの経口挿管: 生理活性化合物の腸管吸収の評価モデル
要約
プロトコルは、生物学的製剤; とラリンジアルマスクエアウェイ アダルト ゼブラフィッシュを記述します。解剖し、フローサイトメトリー、共焦点顕微鏡と qPCR の腸を準備します。このメソッドは、腸内の吸収と局所の免疫刺激誘発を監視する生理活性物質を管理できます。口腔予防薬の腸内ダイナミクスのテストに適用されます。
要約
ほとんどの病原体は侵入、粘膜を通して生物です。これは、微生物が豊富な水環境にさらされ続ける魚で特に。ワクチンは、感染症に対する免疫システムをアクティブ化、または生理の口頭配達の効果的な手法の開発は非常に望ましいです。予防ツールを工夫すること、彼らのパフォーマンスをテストする良い実験モデルが必要です。ここでは、大人のゼブラフィッシュの経口挿管法とを細かく分析し、フローサイトメトリー、共焦点顕微鏡と量的なポリメラーゼの連鎖反応 (qPCR) 分析のための腸の準備の手順のセットを示します。このプロトコルでは、我々 は正確に魚の動物を傷つけることがなく簡単かつ迅速に、約 1 g の重さを 50 μ L までボリュームを管理できます。このメソッドでは、挿管後腸の粘膜とローカル ・ サイトでこのような生物学的製剤の免疫調節能力によって蛍光標識化合物の生体内で直接取り込みを探索することが出来ます。Cytometry 流れ、組織学、qPCR 腸組織の共焦点顕微鏡など下流の方法を組み合わせることによって我々 は生理やワクチンが腸の粘膜の障壁を交差、粘膜を通過することができる方法を理解できると腸管の粘膜免疫系に効果を発揮、筋肉に到達します。モデルは、候補者口腔予防薬と配信システムまたは任意の経口投与の生物活性化合物の局所効果をテストする使用できます。
概要
この記事の目標は、深さで関連付けられている下流の有用な手順と共に、ゼブラフィッシュの経口挿管に簡単なメソッドを記述することです。ゼブラフィッシュを用いた経口気管挿管における感染症の動態、経口ワクチン/免疫賦活剤、薬/ナノ粒子の吸収・効果、腸管粘膜免疫の実用的なモデルとなっています。たとえば、ゼブラフィッシュ経口挿管は、 marinum 結核菌や結核菌 peregrinum感染1の研究で使用されています。Lovmoら正常に大人ゼブラフィッシュ2の消化管をナノ粒子やM. marinum提供するのにこのモデルを使用します。さらに、陳らは、ナノ粒子、薬がカプセル化をゼブラフィッシュ経口挿管を使用とき投与による消化管血頭脳障壁3間で運ばれました。これらの著者実行コリモアらによって記述されている gauvage メソッドに基づいて、挿管4いくつかの変更。しかし、彼らは、経口挿管の手順を記述する非常に詳細なプロトコルを提供しませんでした。ここでは、建物コリモアら大人のゼブラフィッシュの経口挿管法を提案します。4フローサイトメトリー、共焦点顕微鏡、qPCR による関連する下流解析のため腸の準備を更に含んで。
腸、特にその粘膜は感染に対する防御の最初の行と養分吸収5主のサイトです。上皮細胞と抗原提示細胞粘膜障壁内では、危険信号を感知、即時の自然免疫応答がトリガーされます。次に、非常に特定の適応免疫応答は、T および B リンパ球6,7で確立されます。経口ワクチンの開発は、ワクチン学に現在フォーカス エリアです。このようなワクチンは粘膜関連リンパ組織 (モルト)8,9の免疫細胞の特定の応答のための露出サイトで有機体を保護するために効果的なツールになります。養殖業、粘膜ワクチン注射ワクチンと比較して明らかな利点があります。集団予防接種は、比較的手間のかからないための実用的、魚、ストレスの少ない、若い魚に投与することができます。それにもかかわらず、粘膜ワクチン候補口腔内環境に変性されることがなく腸の 2 番目のセグメントに到達する必要があります。彼らはまた抗原提示細胞 (APCs) ローカルおよび全身の応答10を誘発するへのアクセスを得るために粘膜の障壁を越える必要があります。したがって、候補の経口抗原およびその配信システムにより粘膜吸収のテスト、誘発、免疫反応だけでなく、不可欠である経口ワクチンの開発に
生体においては、経口挿管の関心の高まりの後、化合物の生物学的効果をテストするモデルを開発します。腸の解剖学的および生理学的機能の多くは哺乳類、硬骨魚類11、左右相称性系統間保存されます。下流の分析に接続されているこの経口挿管モデルは、生物学的製剤の試験場と同様、人間の生物学への洞察力を提供するためのツールをすることができます。 または他の化合物の生体内で。
経口気管挿管プロトコルは、1 つの演算子、例えば、魚の重さの 1 g は、生存率の高いタンパク質ナノ粒子懸濁液の最大 50 μ L を正常に管理実行できます。手順はセットアップするシンプルで簡単です。30 魚は 1 h で挿管することができます。腸の準備のためのプロトコルは、その後の分析のため品質の細胞・組織のサンプルを提供する鍵です。下流の結果の例の腸管吸収に関連するデータを取得、qPCR の質 RNA を隔離するプロトコルの有用性を示すとおりです。これら腸内口腔予防薬のダイナミクスや他の化合物をテストするための適切なモデルを必要とする偉大な使用のプロトコルになります。
Access restricted. Please log in or start a trial to view this content.
プロトコル
ゼブラフィッシュ (動脈分布) を含むすべての実験手順は、Autònoma · デ · バルセロナ (CEEH 番号 1582) 研究を含む動物 (国際指導原則に一致しての倫理委員会によって承認されました。EU 2010/63)。26-28 ° C で生きたゼブラフィッシュで実験を行った
1. 経口挿管装置の準備
- 針の先端をカバーする 31 G ルアー ロック針に高級シリコン チューブを約 1 cm を配置します。
- カット 10 μ L 滅菌フィルター ピペット チップ (約 2 cm)、細かい端を取るやシースとしてシリコン チューブの上に置きます。ピペットを超える動物が負傷を避けるために針の先端を確認します。
- 100、μ L ルアーロック注射器に針を取り付けます。
注: は常にエタノールで洗い、その後、リン酸緩衝生理食塩水 (PBS、資料をご覧ください) 治療の間に徹底的に。
2. ソリューション
- (麻酔) のための 150 mg/L または 300 mg/L (安楽死) エチル 3-アミノ安息香酸メタンスルホン酸 (MS-222) 液の水族館、ゼブラフィッシュの保管場所からの水の準備をします。麻酔液の 1 L と小型タンクを記入し、通気しておきます。
- 魚の回復のため MS 222 なし水槽の水 1 L を別の小さい水槽を記入し、通気しておきます。
- 50 mL の 1x PBS 滅菌原液 x の 10 からを確認します。
- フローサイトメトリー解析/腸の細胞の隔離、魚在庫ソリューション、またはダルベッコ変法イーグル培地 (DMEM) で粉からあたり 1 mL の 1 %v/v ペニシリンとストレプトマイシン (材料を参照) と十分な新鮮な 0.15% コラゲナーゼ IV 型ソリューションを準備します。2 mL の遠心管に 1 mL の因数 (魚ごとの 1) を作る。解剖手順の前に 30 分まで 4 ° c を維持します。
- 共焦点顕微鏡/サンプル固定用 PBS で新鮮な 4% パラホルムアルデヒド (PFA) ソリューションの 50 mL を準備または発煙のフード-20 ° C のフリーザーから原液を解凍します。
注意: PFA は有毒です。使用前に製品安全データシートをお読みください。手袋と保護メガネ着用すべきし、ヒューム フード内のソリューションを常に残します。
3. 蛍光ナノ粒子懸濁液の準備
- Atto 488 NHS エステルとタンパク質ナノ粒子のラベル (材料の表を参照してください) または製造元の指示に従って適切な蛍光染料。
- 0.1 M 炭酸水素ナトリウム 2 mg/mL の濃度バッファーでナノ粒子を再懸濁します。
- アミン無料ジメチルスルホキシド (DMSO) で 2 mg/mL の Atto 488 NHS エステルを溶解します。ラベリング効率 (ステップ 3.7 3.8) をチェックする 10 μ L の因数を維持します。
- 暗闇の中で攪拌によるナノ粒子と (蛋白質: 色素) を 1:2 のモル比で Atto 488 NHS エステルを混ぜます。
- 室温で 10 分間 8,000 × gで遠心分離によってラベル付けされたナノ粒子のスピンダウン、上澄みを除去し、標識効率 (ステップ 3.7 3.8) をチェックしてください。
- ボルテックスと上下にピペットで 1 mL の 0.1 M 炭酸水素ナトリウム バッファーの再ラベル付けされたナノ粒子を洗い。その後、室温で 10 分間 8,000 × gで遠心分離して上澄みを廃棄します。5 倍の 3.6 のステップを繰り返します。
- 15 mL 遠心管中の 0.1 M 炭酸水素ナトリウム緩衝の 5 mL にペレットを再懸濁します、1.5 mL 遠沈管 (30 因数) 蛍光ナノ粒子の因数を作る。室温で 10 分間 8,000 x gでスピンダウン、上澄みを廃棄し、光から保護-80 ° C で保存します。
-
微量分光光度計を使用してラベル付けの効率を測定します。
- ステップ 3.3 から続けた元の Atto 488 ソリューションの 1 μ L を取り、さらに DMSO (例えば、1:20 容積比によると) で希釈しています。これは手順 3.4 でタンパク質ナノ粒子と Atto 488 ミックスのモル比を得るに使用するボリュームです。
- 3.5 の手順でラベリングの反応から保存した上清の 1 μ L を取る。吸光度 (abs) = 501 nm。ラベルの割合です。
(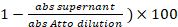
- 実験の前に 1 x PBS 溶液を使用して望ましい集中ナノ粒子懸濁液を準備します。
4. ゼブラフィッシュ Anesthetization と経口挿管
- 魚を高速 (> 0.5 g) 腸を空にする実験の前に少なくとも 48 時間。
- 魚 (12 魚) 実験的戦車 (6 L) 順化12を許可する実験の前に 1 つの夜に移動します。
- 渦もナノ粒子溶液 (例えば、 2,500 rpm と 30 s)、保護された針に接続されている注射器にナノ粒子懸濁液 (例えば20 – 50 μ L) の音量を描きます。
- 曝気 150 mg/L の MS で、魚をプレイス-222 ソリューション (セクション 2 を参照) まではタンクの底に沈むし、垂直尾翼のピンチ; に応答しません。このプロセスは、5 分未満かかります。
- すぐにネットで麻酔をかけられた魚をぬれたプラスチック製のトレイに転送、針に直面し、すぐに経口挿管に水平方向に動物をオリエンテーションします。
- 慎重に 1 つの手で魚をサポートし、保護された針を使用して片方の手で口を開きます。そっと口の入り口から約 1 cm に食道を押し針を挿入します。
注: オペレーターは、ピペット先端末鰓に合格したときわずかな抵抗を感じることがあります。鰓を穿孔することがありますあまりにも多く、針の刺入角度に注意してください。 - 魚にナノ粒子懸濁液をゆっくりと注入します。懸濁液はエラや口から外側はフローしないことを確認します。
- そっと針を除去し、回収タンク (セクション 2 を参照) に魚を置きます。回復は通常 1 分以内になります。
- 異常を慎重に魚をチェック (例えば鰓で出血、穿孔の徴候)。
- 魚が回復すると、一度実験タンクに戻します。
5. ゼブラフィッシュ腸解剖
- 挿管の記事の時間の指定された期間の後 (例えば、 5 h や 24 h)、300 mg/L MS に網を使って魚を置きます-222 向け安楽死 (セクション 2 を参照)。蓋を移動停止尾ピンチ反射がないことを確認します。5 分で通常十分です。
- ネットで euthanized の動物をピックアップし、フィルター ペーパーの上に置きます。
メモ: フィルター ペーパーは腸に沿って接着組織を除去するのに便利です。 - 鋭い解剖はさみを使って、作る、蓋に肛門から半円形切開と微細ピンセットを使用して開いて切開。腸管の両端をカット、すべての内臓を取り出してろ紙の上に置きます。
注意: は、細胞の代謝や死を減らすためにすぐに動作します。
注: は、PBS で、氷の上または、接着組織を削除します。 - (前方後部腸管) の方向を維持し、それを伸ばすようにして内臓から腸を区切ります。通常、腸の眼は後方のセグメントよりも広いです。切り裂く場合腸のすべてを取得する注意してください。
注: 後端は非常に微細で小魚に壊れやすいと動物の特に離れる可能性があります < 0.7 g。 - 腸をピンセットで腸から接着組織を切断するためにフィルター紙の上をロールします。
- 腸を備える様々 な下流解析 (セクション 6、7 および 8) に進んでください。
6. フローサイトメトリーの腸細胞を準備
- 0.15% コラゲナーゼ溶液 (セクション 2.4 を参照) の因数を事前に準備します。
注: 因数は、進む前に室温でする必要があります。 - (省略可能) 手順 5.5 から継続し、腸を縦切り開いてし、1x PBS で洗浄します。
- ピンセットを使用すると、満ちている 0.15% コラゲナーゼ溶液 2 mL の遠心管に腸管を配置します。
- 暗闇の中で部屋の温度で 1 時間垂直研究室回転子にチューブを置きます。
- 50 mL の遠心管にサポートされている 100 μ m セル ストレーナーに腸を配置します。50 mL の遠心管にサンプル内の流れを収集 1 × PBS 洗浄 3 回 5 mL シリンジのプランジャーと腸を破る。
- 400 × g 10 分間、4 ° C で 50 mL 遠心チューブを遠心分離します。
- 慎重にいくつかの粘液に関連しているかもしれない細胞を維持しながら上澄みのほとんどをピペット。
- 500 μ L の 1x PBS で遠心管の底に小腸細胞を再懸濁します、フローサイトメトリー解析まで氷の上を保つ
- 5 mL に 30 μ m セル フィルターを介してフィルター サンプルはラウンド フローサイトメトリーの下部チューブです。
- Cytometer 機器のパラメーター (例えば分析用セルの数、興味、電圧および補償の地域があり、検出器の選択) を設定 (マテリアルを参照してください)。
- Cytometer で使用13の手順を次のセルをすぐに分析します。
7. 共焦点の顕微鏡検査のため腸の凍結切片の準備
- プラスチック金型をご記入 (材料表参照) 最適な切削温度 (O.C.T.) 化合物とボリュームも半分に。
- プラスチック金型で腸を配置手順 5.5 から、解体直後後に継続し、慎重に。腸は O.C.T. 化合物に完全に埋め込まれていることを確認します。必要に応じて、プラスチック金型に複数 O.C.T. 化合物を追加します。
注: 簡単にその自然な方向に従う化合物 O.C.T. の"Z"の形をした腸を配置することをお勧めします。 - それが不透明な (1 分未満) までドライアイスにプラスチック金型を配置します。
- 長期的な使用またはすぐに次の手順を使用して、プロセスの-80 ° C でプラスチック金型を格納します。
注: プロトコルはここで一時停止することができます。 - 冷凍の腸を 10 μ m のセクションまたは-20 ° C でクライオスタットを用いた適切な厚さにスライスします。
- スライドに細かいブラシで腸のセクションを収集します。
- 4% のスライドを浸し室温で 15 分間のサンプルを修正する PFA。
注意: PFA は有毒です。使用前に製品安全データシートをお読みください。手袋と保護メガネ着用すべきし、ヒューム フード内のソリューションを常に残します。 - 1x PBS、10 分で 3 回スライドを洗います。
- メディアをマウントのドロップを追加し、標本を観察を配置します。
注: プロトコルはここで一時停止することができます。 - 適切な倍率で共焦点顕微鏡下で試料を観察します。
8. qPCR リアルタイム (RT qPCR) の腸を準備
- ステップ 5.5 から継続し、極低温バイアルで腸を入れて、使用するまで液体窒素、-80 ° c 店で腸を急速に凍結します。
注: プロトコルはここで一時停止することができます。 - 均質化、200 μ L 2% (v/v) の冷蔵 1 チオグリセ/均質化ソリューションを追加 (材料の表を参照してください) または腸のサンプルの均質化の代替ソリューションです。
- すぐに働き、氷上腸サンプルを均質の断片が残ってないの目に見える組織まで高速 (25-30,000 rpm に設定) で研究室ホモジナイザーを用いた。3 回の 5 s は通常は十分です。
- 商業を使用して RNA を分離 (材料の表を参照) をキット製造元の指示14または適切な代替方法によると。必要に応じて、長期使用のため-80 ° C で RNA を保存します。
注: プロトコルはここで一時停止することができます。 - 分光光度計15を使用して RNA 濃度を定量化し、RNA アナライザー16を使用して品質を評価します。
- 1 μ g または製造元の指示に従って cDNA 合成キットを使用して cDNA の適切な量を準備します。
注: プロトコルはここで一時停止することができます。QPCR 解析、MIQE のガイドライン17に従ってください。 - 興味の遺伝子/s の適切なプライマーを設計します。
- 適切な参照の遺伝子を選択し、RT qPCR 法による各遺伝子の発現を分析商業を用いたシステム キット (マテリアルを参照してください)。
注: たとえば、qPCR プレートの各ウェルに 10 μ L の最終巻で SYBR グリーン スーパーミックスの 5 μ L、0.5 μ M プライマー、希釈 cDNA の 2.5 μ L、1.5 μ L の水を追加します。
Access restricted. Please log in or start a trial to view this content.
結果
ゼブラフィッシュ (平均重量: 1.03 ± 0.16 g) 混合性が正常に異なる組換えタンパク質ナノ粒子 (細菌封入体)、自家製経口気管挿管デバイス (図 1) を使用して挿管します。正常に経口挿管を行い平均割合が低い死亡率 (6.8%) を達成(表 1)。ゼブラフィッシュは 30 μ L とナノ粒子懸濁液を 50 μ l 添加いずれか挿管され 24 時間ポスト挿管内死?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このプロトコルは前述コリモアらによる経口気管挿管法の改善4私達のプロトコルは経口挿管法の詳細に説明し、下流解析のため腸の準備が含まれています。本手法は、演算子間の変動があまりなく、急速に全体のプロトコルを実行する人を許可する魚操作速度を向上します。以前のものと弊社のプロトコルの主な違いは、幸福のための動物の観察によってだけでなく...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、競合する利益がないことを宣言します。
謝辞
この作品は、欧州委員会と AGAUR 資金 NR (AGL2015-65129-R MINECO/フェダー、2014SGR-345 AGAUR) スペイン語科学省からの補助金によって支えられました。RT は、AGAUR (スペイン)、JJ から博士奨学金に支えられ中国公費 (中国) から博士課程フェローシップと NR は Ramón y カハール プログラム (RYC-2010-06210、2010 年、MINECO) によってサポートされているを保持します。タンパク質の生産、「Servei ・ デ ・ ミクロスコピア」から (名) バルバで専門家の助言ありがとう博士トレアルバと博士 m ・ コスタ、Autònoma · デ · バルセロナの役に立つのテクニカル サポートの「Servei ・ デ ・ Citometria」から。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
参考文献
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85(2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542(2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054(2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190(2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved