Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yetişkin zebra balığı sözlü entübasyon: bağırsak alımını biyoaktif bileşiklerin değerlendirmek için bir Model
Bu Makalede
Özet
Protokol entübasyonda yetişkin zebra balığı ile bir biyolojik açıklar; daha sonra Diseksiyon ve bağırsak sitometresi, confocal mikroskobu ve qPCR için hazırlanıyor. Bu yöntem yönetime biyoaktif bileşiklerin bağırsak alımı ve uyarılmış yerel bağışıklık uyarıcı izlemek için izin verir. Sözlü prezervatiflerinin bağırsak dinamiklerini test etmek için uygundur.
Özet
Çoğu patojen organizmalar onların mukoza yoluyla istila. Onlar sürekli bir mikrobiyal zengin su ortamına maruz kalır gibi bu özellikle balık doğrudur. İmmunostimulants veya bulaşıcı hastalıklara karşı bağışıklık sistemi harekete geçirmek, aşı oral teslim etmek için etkili yöntemler geliştirmek son derece arzu edilir. Profilaktik araçlar oluşturulması, iyi modeller onların performansını test etmek için ihtiyaç vardır. İşte, Yetişkin zebra balığı sözlü entübasyon için bir yöntem ve incelemek ve bağırsak sitometresi, confocal mikroskobu ve nicel polimeraz zincir reaksiyonu (qPCR) analizi için hazırlamak için yordamlar kümesi göstermektedir. Bu iletişim kuralı ile tam 50 µL hayvanlara zarar vermeden basit ve hızlı, yaklaşık 1 g ağırlığında Balık ye yönetebilirsiniz. Bu yöntem fluorescently etiketli bileşikler doğrudan vivo içinde alımını entübasyon sonra bağırsak mukoza ve yerel sitesinde böyle destekte immunomodulatory kapasitesini keşfetmek için bize izin verir. Akış Sitometresi, histoloji, qPCR ve bağırsak dokusu confocal mikroskobu gibi aşağı akım yöntemleri birleştirerek, biz nasıl immunostimulants veya aşı intestinal mukozal engelleri çapraz, lamina propria geçmek edebiliyoruz anlayabiliyorum ve barsak mukozal bağışıklık sistem üzerinde bir etkisi uygulamakla kas ulaşmak. Model aday sözlü donlarını ve dağıtım sistemleri veya herhangi bir sözlü olarak yönetilen biyoaktif bileşik yerel etkisini test etmek için kullanılabilir.
Giriş
Bu makalenin amacı ile birlikte yararlı ilişkili karşıdan akış yordamları zebra balığı sözlü entübasyon için basit bir yöntem derinlemesine tarif etmektir. Zebra balığı kullanarak sözlü entübasyon bulaşıcı hastalığı dinamikleri, sözlü aşı/immunostimulant, uyuşturucu/nanopartikül alımı ve etkinlik ve intestinal mukozal bağışıklık çalışmanın pratik bir model haline gelmiştir. Örneğin, zebra balığı sözlü entübasyon Mycobacterium marinum ve Mycobacterium peregrinum enfeksiyon1çalışmada kullanılmıştır. Lovmo vd. aynı zamanda başarılı bir şekilde bu model nano tanecikleri ve M. marinum yetişkin zebra balığı2mide-bağırsak sistemi için teslim etmek için kullanılan. Buna ek olarak, Chen ve ark. zebra balığı sözlü entübasyon ilaçlar nano tanecikleri tarafından Kapsüllü göstermek için kullanılan ne zaman yönetilen yolu ile belgili tanımlık mide-bağırsak arazi taşınan arasında kan beyin bariyerini3. Bu yazarlar Collymore vd tarafından açıklanan gauvage yöntemine dayalı entübasyon yapılır 4 bazı değişikliklerle. Ancak, sözlü entübasyon işlemi açıklayan bir çok detaylı protokol sağlamadı. Burada, Collymore ve ark. üzerinde bina yetişkin zebra balığı sözlü entübasyon için bir yöntem mevcut 4 biz daha fazla bağırsak hazırlanması için ilgili karşıdan akış analiz sitometresi, confocal mikroskobu ve qPCR içermektedir.
Bağırsak ve özellikle onun mukoza enfeksiyona karşı savunma ilk satırı ve besin alımını5birincil site olduğunu. Epitel hücreleri ve antijen sunan hücreler mukozal engelleri içinde tehlike sinyalleri algıladıkları zaman hemen doğuştan gelen bağışıklık yanıt tetiklenir. Ardından, son derece belirli edinilmiş bağışıklık yanıtı T ve B lenfositler6,7tarafından kuruldu. Sözlü aşıların geliştirilmesi vaccinology geçerli bir odak alanıdır. Böyle aşılar mukoza ilişkili lenfoid doku (MALT)8,9bağışıklık hücreleri belirli tepki nedeniyle maruz sitelerdeki organizma korumak için etkili bir araç olurdu. Su ürünleri yetiştiriciliği, mukozal aşı enjekte edilebilir aşılar için karşılaştırıldığında belirgin avantajları var. Onlar için kitle aşı, daha az emek yoğun pratik, balık için daha az stresli ve genç balık yönetilemez duruma gelir. Yine de, mukozal aşı adaylar sözlü ortamda denatüre olmadan ikinci gut segment ulaşmalıdır. Onlar da hücreleri (ZPT) yerel ve/veya sistemik yanıt-e doğru10ikna etmek için sunulması antijen erişim kazanmak için mukozal engelleri aşıyorlar. Dolayısıyla, aday sözlü antijenleri ve onların teslim sistemleri tarafından elde mukozal alım testi, uyarılmış, immün yanıt yanı sıra sözlü aşıların geliştirilmesi esastır.
Biyomedikal bir bağlamda sonra sözlü entübasyon büyüyen ilgi bileşiklerin biyolojik etkileri test etmek için bir model geliştirilmesi. Bağırsak anatomik ve fizyolojik özelliklerin çoğu memeliler ve kemikli balıklar11ile bilaterian soy arasında korunmuş. Aşağı akım analizi için bağlı bu sözlü entübasyon model insan biyolojisi, hem de bir deneme alanı içine anlayışlar için destekte sağlamak için bir araç olabilir veya diğer vivomaddeler ve birleşimler.
Örneğin, bir yüksek sağkalım oranı ile tartı 1 g balık protein nanopartikül süspansiyon 50 µL başarıyla yöneten bir operatör tarafından sözlü entübasyon Protokolü gerçekleştirilebilir. Kurmak basit ve hızlı bir yöntemdir; 30 balık 1 h entübe. Kalite hücre ve doku örnekleri daha sonraki analiz için sunmak için anahtar bağırsak hazırlık için kuralıdır. Akış aşağı sonuçları örnekleri için bağırsak alımı ile ilgili veri alma ve kalite RNA qPCR için izole protokol 's kullanışlılığı show verilir. Protokol bu sözlü prezervatiflerinin dinamiği veya diğer bileşikler bağırsaklarda test etmek için uygun bir model ihtiyacı için büyük yararı olur.
Access restricted. Please log in or start a trial to view this content.
Protokol
Zebra balığı (Danio rerio) içeren tüm deneysel yordamlar araştırma içeren hayvanlar () için uluslararası yol gösterici ilkeleri ile anlaşma Universitat Autònoma de Barcelona (CEEH numarası 1582) Etik Komitesi tarafından yetkili EU 2010/63). 26-28 ° C'de canlı zebra balığı ile tüm deneyler yapıldı
1. Cihazın sözlü entübasyon için hazırlanması
- İyi silikon tüp yaklaşık 1 cm iğne ucu kapsayacak şekilde 31 G radarı kilit iğne yerleştirin.
- 10 µL steril Filtre Pipet (yaklaşık 2 cm) uç, ince ucundan tut ve bir kılıf olarak silikon tüp üzerine yerleştirin kesik. Pipet hayvan zarar önlemek için iğne ucu uzanan emin olun.
- İğne 100 µL radarı kilit şırıngaya takın.
Not: Her zaman etanol ile durulayın ve serum fosfat tamponlu (PBS, malzemelerigörmek) iyice tedaviler arasında.
2. gerekli çözümler
- 150 mg/L (anestezi için) veya 300 mg/L etil 3-aminobenzoate methanesulfonate (MS-222) çözüm nerede zebra balığı sürdürülür akvaryum su ile (için ötenazi) hazırlayın. 1 litre anestezik çözüm ile küçük bir tank doldurmak ve gazlı tutun.
- Başka bir küçük tank balık kurtarma için MS-222 olmadan akvaryum su 1 litre ile doldurun ve gazlı tutun.
- 1 x PBS üzerinden 10 steril hisse senedi çözüm x 50 mL olun.
- Sitometresi Analizi/bağırsak hücre izolasyon için yeterli taze % 0.15 collagenase tip IV çözüm balık stok bir çözüm veya toz Dulbecco'nın değiştirilmiş kartal Orta (DMEM) başına 1 mL % 1 v/v penisilin ve streptomisin ile (malzemeleri görmek) hazırlamak. Aliquots (1 balık başına) 1 ml 2 mL santrifüj tüplerde olun. 4 ° C'de 30 dk önce diseksiyon adım kadar devam et.
- Confocal mikroskobu/örnek fiksasyon, 50 mL PBS taze %4 paraformaldehyde (PFA) çözeltisi hazırlamak veya duman kukuIeta dondurucuda-20 ° C hisse senedi bir çözümden çözülme.
Dikkat: PFA zehirlidir. Malzeme güvenlik bilgi formu ile çalışmaya başlamadan önce okuyun. Eldiven ve koruyucu gözlük takılmalıdır ve her zaman bir duman başlık içinde çözümleri bırakın.
3. floresan nanopartikül süspansiyon hazırlama
- Protein nanopartikül Atto-488 NHS ester ile etiket ( Tablo malzemelerigörmek) veya üreticinin yönergelerine göre uygun bir floresan boya.
- Nano tanecikleri 0.1 M sodyum bikarbonat tampon 2 mg/mL konsantrasyonu, resuspend.
- Dimetil Amin-Alerjik sülfoksit (DMSO) 2 mg/mL, sınav 488 NHS ester geçiyoruz. 10 µL etiketleme verimliliği (adım 3.7 – 3,8) kontrol etmek için bir aliquot tutmak.
- Nano tanecikleri ve sınav 488 NHS ester molar oranı 1:2 (protein: boya) adlı tarafından karanlıkta karıştırma karıştırın.
- Santrifüjü 8.000 x g oda sıcaklığında 10 dakika için de tarafından etiketli nano tanecikleri spin, süpernatant kaldırmak ve etiketleme verimliliği (adım 3.7 – 3,8) kontrol etmek için saklayın.
- Etiketli nano tanecikleri vortexing ve yukarı ve aşağı pipetting 1 mL 0.1 M sodyum bikarbonat arabellek resuspending yıkayın. O zaman süpernatant Santrifüjü 8.000 x g oda sıcaklığında 10 dakika için de tarafından atmak. Adım 3.6 için 5 kez tekrarlayın.
- 5 ml 0.1 M sodyum bikarbonat arabellekte bir 15 mL santrifüj tüpü Pelet resuspend ve floresan nanopartikül aliquots 1,5 mL santrifüj tüpleri (30 aliquots) olun. Spin aşağı 8.000 x g oda sıcaklığında 10 dakika için de, süpernatant atmak ve ışıktan korunan-80 ° C'de depolayın.
-
Microvolume spektrofotometre kullanarak etiketleme verimliliği ölçmek.
- 3.3 adımından tutulur orijinal Atto 488 çözüm 1 µL alın ve daha fazla (Örneğin, 1:20 hacim oranı göre) DMSO içinde sulandırmak. Bu adımda 3.4 protein nanopartikül ve sınav 488 mix molar oranı elde etmek için kullanılan birimdir.
- 1 µL kaydedilmiş süpernatant etiketleme reaksiyon gelen, adım 3.5 at. Soğurma (abs) ölçmek, 501 = nm. Etiketleme yüzdesidir:
(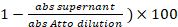
- Deneme önce 1 x PBS çözüm kullanarak istenen konsantrasyon nanopartikül süspansiyon hazırlamak.
4. zebra balığı Anesthetization ve Oral entübasyon
- Balık hızlı (> 0,5 g) en az 48 saat önce bağırsak boşaltmak için deneme.
- Balık (12) deneysel tankları (6 L) iklimlendirme12izin vermek için deneme önce bir gece hareket.
- Girdap nanopartikül çözüm iyi (Örneğin, 2500 devir/dakika ve 30 s) ve korumalı iğneye bağlı şırınga içine nanopartikül süspansiyon (Örneğin, 20-50 µL) istenen sesini çizin.
- Balık gazlı 150 mg/L MS koyun-222 çözüm (bakınız Bölüm 2) kadar lavabo tankın altına ve değil yanıt vermek için bir kuyruk yüzgeci çimdik; Bu işlem az 5 dk sürer.
- Hızlı bir şekilde bir net imzalat balıkla ıslak bir plastik tepsiye aktarın, yatay olarak iğne yüz ve hemen sözlü entübasyon başlatmak için hayvan yönlendirmek.
- Dikkatle tek elle balık desteklemek ve korumalı iğne kullanarak diğer eliyle ağzını aç. Yavaşça iğneyi özofagus aşağı yaklaşık 1 cm için açılış ağız yerleştirin.
Not: pipet ucu sonu gill geçti zaman operatör hafif bir direnç hissedebilirsiniz. Çok fazla gill sorgulamaktı iğne girişi açısı değil için dikkat ediniz. - Yavaş yavaş nanopartikül süspansiyon balık için enjekte et. Solungaçları veya ağız dışa süspansiyon akışı değil emin olun.
- Yavaşça iğneyi çıkarın ve balık kurtarma tank (bakınız Bölüm 2) içine yerleştirin. Kurtarma genellikle 1 dk içinde alır.
- Balık herhangi bir anormallik için dikkatli bir şekilde kontrol (solungaçları kanamaÖrneğin, delikli bir işareti is).
- Bir kez balık iyileşti, deneysel tankları için iade.
5. zebra balığı bağırsak diseksiyon
- Belirtilen bir süre sonra entübasyon sonrası (Örneğin, 5 h ve/veya 24 s), yer bir net 300 mg/L MS kullanarak balık-222 çözüm için ötenazi (bakınız Bölüm 2). Operculum hareket etmeyi durdurana ve hiçbir Kuyruk tutam refleks olduğundan emin olun. Normalde yeterli beş dakika var.
- Bir net euthanized hayvanla almak ve bir filtre kağıdı yerleştirin.
Not: Filtre kağıdı yapışkanlı doku bağırsak boyunca kaldırmak için çok yararlı olur. - Keskin diseksiyon makası kullanarak, anüs operculum için gelen yarı dairesel bir kesi ve açık kesi iyi Cımbız kullanarak olun. Her iki ucunda da bağırsak kesmek, tüm iç organları alıp filtre kağıdı yerleştirebilirsiniz.
Dikkat: hızlı hücre metabolizması ve ölüm azaltmaya çalışın.
Not: Alternatif olarak, PBS ve buz üzerinde yapışkan doku çıkarın. - Bağırsak iç organları yönünü (anterior posterior bağırsak segment) tutmak ve o streç emin ayırmak. Genellikle, bağırsak ön segment posterior bölütten daha geniştir. Tüm bağırsak dissekan zaman elde etmek için dikkat ediniz.
Not: Arka uç oldukça ince ve kırılgan küçük balık ve, özellikle hayvanlarda koparmak < 0.7 g. - Bağırsak bağırsak yapışkanlı dokusundan ayırmak için cımbız ile filtre kağıdına rulo.
- Bağırsak çeşitli aşağı akım analizleri (Bölüm 6, 7 ve 8) için hazırlamak için devam edin.
6. bağırsak hücreleri sitometresi için hazırlanması
- Önceden aliquots % 0.15 collagenase çözüm (bakınız Bölüm 2.4) hazırlamak.
Not: Aliquots devam etmeden önce oda sıcaklığında olmalıdır. - İsteğe bağlı: 5.5 adımından devam etmeden, bağırsak boyuna açık yarık ve 1 x PBS ile yıkayın.
- Cımbız kullanarak, bağırsak %0,15 collagenase çözüm ile dolu 2 mL santrifüj tüpü yerleştirin.
- Tüpler içinde belgili tanımlık karanlık oda sıcaklığında 1 h için dikey laboratuvar rotator yerleştirin.
- Bağırsak 50 mL santrifüj tüpü üzerinde desteklenen bir 100 µm hücre süzgeç yerleştirin. 1 x PBS, 50 mL santrifüj tüpü örnekte aracılığıyla akış toplama ile 3 kez yıkama bir 5 mL şırınga pistonu ile bağırsak bölün.
- 50 mL santrifüj tüpü vasıl 400 x g 4 ° C'de 10 dakika santrifüj kapasitesi
- Dikkatle süpernatant çoğunu pipet biraz-in hangi-ebilmek var olmak için mukus ilişkili hücrelere, hikâyesinin değil.
- 1 x PBS 500 µL santrifüj tüpü dibinde bağırsak hücreleri resuspend ve buza Sitometresi Analizi kadar devam et.
- Filtre örnekleri 5 mL içine 30 µm hücre filtre aracılığıyla alt tüpler sitometresi için yuvarlak.
- Sitometresi ekipman üzerinde küme parametreleri (Örneğin, analiz için hücre sayısı, faiz, gerilim ve tazminat bölgesi, dedektörleri yelpazesi) (malzemeleri görmek).
- Hemen kullanım13talimatları bir sitometresi hücrelerdeyse analiz.
7. Confocal Mikroskopi için bağırsak Cryosections hazırlanması
- Plastik kalıp doldurmak ( Tablo malzemelerigörmek) yarım birime optimum kesim sıcaklık (O.C.T.) bileşik ile.
- Adım 5.5 ve hemen sonra diseksiyon devam, dikkatle bağırsak plastik kalıp içinde yer. Bağırsak O.C.T. bileşim içinde tamamen gömülü olduğundan emin olun. Gerekirse, daha fazla O.C.T. bileşik plastik kalıp ekleyin.
Not: Bağırsak "Z" şeklinde O.C.T. içinde kolayca doğal yönünü takip için bileşik yerleştirmek için önerilir. - (Biraz daha az) opak gidene plastik kalıp kuru buza koyun.
- Plastik kalıp uzun süreli kullanımı veya hemen aşağıdaki yordamı kullanarak işlem için-80 ° C'de depolayın.
Not: Protokol burada duraklatılmış. - Donmuş bağırsak 10 µm bölümleri veya uygun kalınlıkta bir cryostat-20 ° C'de kullanma dilim
- Barsak bölümüne bir slayt üzerine ince bir fırça ile toplamak.
- % 4 slayt bırakın örnek düzeltmek için İngiltere'de yılın 15 dakika oda sıcaklığında.
Dikkat: PFA zehirlidir. Malzeme güvenlik bilgi formu ile çalışmaya başlamadan önce okuyun. Eldiven ve koruyucu gözlük takılmalıdır ve her zaman bir duman başlık içinde çözümleri bırakın. - Slayt 3 kez 1 x PBS, 10 dk ile yıkayın.
- Ve bir coverslip numune üzerinde yer montaj orta bir damla ekleyin.
Not: Protokol burada duraklatılmış. - Örnek uygun büyütmede confocal mikroskop altında gözlemlemek.
8. gerçek zamanlı qPCR (RT-qPCR) bağırsak hazırlanması
- 5.5 adımından sürekli, bağırsak kriyojenik bir şişede koymak ve hızla bağırsak sıvı azot ve mağaza-80 ° c kadar kullanmak dondurmak.
Not: Protokol burada duraklatılmış. - Homojenizasyon için 200 soğutulmuş µL % 2 (v/v) 1-Thioglycerol/homojenizasyon çözüm ekleyin ( Tablo malzemelerigörmek) veya alternatif homojenizasyon çözüm bağırsak örnek için.
- Hızlı çalışın, buz üzerinde bağırsak örnek homojenize bir laboratuvar homogenizer (25-30.000 rpm'de ayarla) yüksek hızda kadar hiçbir görünür doku parçaları kalır. 5 için 3 kez s genellikle yeterlidir.
- Bir ticari kullanarak RNA izole ( Tablo malzemelerigörmek) kit üreticinin yönergeleri14 ya da uygun bir alternatif yöntem göre. Gerektiğinde, RNA uzun vadeli kullanım için-80 ° C'de depolayın.
Not: Protokol burada duraklatılmış. - Spektrofotometre15 kullanarak RNA konsantrasyon ölçmek ve RNA analyzer16kullanarak kalitesini değerlendirmek.
- 1 µg veya üreticinin yönergelerine göre cDNA sentez kit kullanarak cDNA uygun bir miktarda hazırlayın.
Not: Protokol burada duraklatılmış. QPCR analiz için lütfen17MIQE yönergeleri izleyin. - Gen/s için uygun astar çiftlerini faiz tasarlayın.
- Uygun başvuru gen seçin ve her Gen ifadesinin bir RT-qPCR tespitinde tarafından çözümlemek bir ticari kullanarak sistem kiti (malzemeleri görmek).
Not: Örneğin, SYBR yeşil supermix 5 µL, 0.5 µM astar, seyreltilmiş cDNA 2.5 µL ve su 1,5 µL her şey qPCR plaka için 10 µL son hacmi ekleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Zebra balığı (Ortalama ağırlık: 1.03 ± 0,16 g) karışık seks başarıyla bizim ev yapımı oral entübasyon aygıt (Şekil 1) kullanarak farklı Rekombinant protein nano tanecikleri ile (bakteriyel dahil organları) entübe. Biz başarıyla gerçekleştirilen sözlü entübasyon ve düşük ortalama yüzde mortalite (%6,8) elde (Tablo 1). Zebra balığı ya 30 µL veya nanopartikül süspansiyonlar 50 µL ile tüp ve ölüm 24 saat m...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu iletişim kuralı bir Collymore vd tarafından sözlü entübasyon için yukarıda açıklanan teknik gelişmedir 4 bizim protokol sözlü entübasyon yöntemi ayrıntılı olarak açıklar ve aşağı akım analizleri için bağırsak hazırlanması içerir. Bizim yöntem tüm iletişim kuralı hızla, operatörler arasında çok varyasyon olmadan yerine getirmek için bir kişi izin balık işleme hızını artırır. Biz sadece hayvan refahı için gözlem tarafından sözlü entüb...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar hiçbir rakip çıkarları var olduğunu bildirin.
Teşekkürler
Bu eser bilim, İspanyolca Bakanlığı gelen hibe AGAUR fonlar için NR (AGL2015-65129-R MINECO/FEDER ve 2014SGR-345 AGAUR) ve Avrupa Komisyonu tarafından desteklenmiştir. RT AGAUR (İspanya), JJ bir önceden Doktora Bursu Doktora Bursu Çin burs Konseyi (Çin) tarafından desteklenen ve NR Ramon y Cajal programı (RYC-2010-06210, 2010, MINECO) tarafından desteklenen tutar. Biz Dr Torrealba protein üretim, "Servei de Microscopia" dan i. Barba uzman önerileri için teşekkür ederiz ve Dr. M. Costa Universitat Autònoma de Barcelona yararlı teknik destek için "Servei de Citometria" dan.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
Referanslar
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85(2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542(2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054(2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190(2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır